固相萃取/高效液相色譜法測定水中痕量硝磺草酮
王小梅,譚培功 ,曹正梅,郎印海*
(1.中國海洋大學 環境科學與工程學院,山東 青島 266100;2.中國海洋大學 海洋環境與生態教育部重點實驗室,山東 青島 266100;3.青島市環境監測中心站,山東 青島 266100)
固相萃取/高效液相色譜法測定水中痕量硝磺草酮
王小梅1,2,譚培功3,曹正梅3,郎印海1,2*
(1.中國海洋大學 環境科學與工程學院,山東 青島 266100;2.中國海洋大學 海洋環境與生態教育部重點實驗室,山東 青島 266100;3.青島市環境監測中心站,山東 青島 266100)
建立了一種固相萃取/高效液相色譜(SPE/HPLC)測定水中痕量硝磺草酮的方法。水樣用磷酸調至pH 3.0~4.0,經C18固相萃取柱富集、乙腈-水(1∶1)洗脫后,用HPLC/紫外檢測器測定。測定條件為:流動相為乙腈-磷酸水溶液(45∶55,pH 3.0),流速0.5 mL/min,色譜柱為Thermo Hypersil-C18柱(250 mm×4.6 mm,5 μm),柱溫30 ℃,檢測波長233 nm。結果表明:在0.4~20 μg·L-1范圍內,硝磺草酮的線性良好,方法檢出限為0.039 μg·L-1。加標濃度為1,5,10 μg·L-1時,硝磺草酮的回收率為90.3%~94.7%,相對標準偏差為3.5%~4.6%。應用該方法測得實際水樣中硝磺草酮的加標回收率為89.9%~93.2%。該方法具有快速、簡便、靈敏等優點,可用于水樣中痕量硝磺草酮的測定。
硝磺草酮;固相萃取;高效液相色譜;乙腈;水
硝磺草酮(Mesotrione),化學名為2-(4-甲磺酰基-2-硝基苯甲酰基)環己烷-1,3-二酮,商品名為米斯通,是一種近年來廣泛使用的新三酮類除草劑[1]。硝磺草酮具有較高的起始活性、殘留活性,較強的水溶性和致癌性等特點,極易對地表水和地下水造成污染[2]。硝磺草酮在遷移和轉化過程中能通過光解、水解、揮發等途徑減少環境中的殘留量,但仍有可能通過遠距離遷移進入水體,并通過食物鏈作用最終對生物和人體健康產生影響[3-4]。EPA于2007年報道了在1961~1990年間某一地區以硝磺草酮作為除草劑施用于農作物,使得該區域水中硝磺草酮的含量為0.1~3 μg·L-1[5]。目前,我國尚未規定水中硝磺草酮含量的限值。
水中硝磺草酮的提取方法通常采用液液萃取和固相萃取。液液萃取[6-7]方法的操作過程較繁瑣,且需要消耗大量有機試劑。固相萃取的操作簡便、環境污染小[8],且能有效去除樣品中的雜質從而提高檢測靈敏度[9],近年來被廣泛用于水中有機污染物的提取。常用的硝磺草酮測定方法主要有HPLC/熒光檢測法[10]、HPLC/紫外檢測法[11-12]、HPLC-核磁共振[13]和 HPLC-質譜法(MS)[14]。HPLC-核磁共振和HPLC-MS可提高定量分析的選擇性和靈敏度,但也會增加分析檢測的成本和運行費用。Alferness等[10]采用C18柱萃取玉米、土壤和水中的硝磺草酮及其代謝物,經衍生化后利用HPLC/熒光檢測器進行定量測定。Gervais等[15]利用Water Oasis HLB柱萃取水中的硝磺草酮,乙腈-二氯甲烷(1∶1)洗脫后,利用超高效液相色譜-質譜法(UPLC-MS)進行測定。 盡管國外學者開展了環境中硝磺草酮的固相萃取和測定研究[16-17],但主要集中于探討多種污染物的固相萃取以及采用HPLC-MS測定,對于不同萃取柱、不同洗脫溶劑和洗脫體積的研究較少,國內也未見相關報道。本文探討了不同萃取柱、不同洗脫劑、洗脫體積、上樣速度和洗脫速度對萃取效率的影響,建立了C18固相萃取水中痕量硝磺草酮的方法;通過比較分析檢測波長和流動相比例對分離度的影響,優化了HPLC測定條件,從而確定了水中痕量硝磺草酮測定的固相萃取/高效液相色譜方法。
1 實驗部分
1.1 儀器與試劑
LC-10ATvp高效液相色譜儀(日本島津公司);Thermo Hypersil C18柱(250 mm × 4.6 mm,5 μm,美國熱電公司);Agilent Zorbax SB-C18柱(250 mm × 4.6 mm,5 μm,北京金歐亞科技發展有限公司);KQ3200B型超聲波清洗器(昆山市超聲儀器有限公司);ASE-24固相萃取儀(天津奧特賽恩斯儀器有限公司);玻璃纖維濾膜(0.45 μm,Whatman公司);HLB固相萃取柱(500 mg,6 mL,美國Waters公司);C18固相萃取柱(1 000 mg,6 mL,天津博納艾杰爾科技有限公司);Multi 3430便攜式多參數水質分析儀(德國WTW公司)。
乙腈(色譜純,德國Merck公司);磷酸(分析純,南京化學試劑有限公司);甲醇(色譜純,瑞典Oceanpak 公司);二氯甲烷(色譜純,天津市科密歐化學試劑有限公司);丙酮(色譜純,北京邁瑞達科技有限公司);硝磺草酮標準品(純度≥99.0%,德國Dr.Ehrenstorfer公司);實驗用水為超純水。
1.2 標準溶液的配制
標準品儲備液:精密稱取硝磺草酮標準品適量,用少量乙腈溶解后,再用水準確定容,配成濃度為100 mg·L-1的標準品儲備液,于4 ℃下保存備用。標準品系列溶液:分別準確移取適量標準品儲備液于容量瓶中,加水稀釋,配成所需濃度的標準品系列溶液。
1.3 實際水樣的采集與預處理
采集青島某地表水樣和農藥廠廢水置于棕色玻璃瓶中,用磷酸調至pH 3.0~4.0,于4 ℃下保存備用。水樣經0.45 μm玻璃纖維濾膜過濾后,直接進行固相萃取。
1.4 固相萃取步驟
C18固相萃取柱使用前依次經10 mL乙腈-水(1∶1)和10 mL水活化,在活化過程中保持柱體濕潤。取1 000 mL水樣通過活化后的C18固相萃取柱,保持水樣流速為3 mL/min,待水樣全部過柱后,抽真空干燥3 min。再用10 mL乙腈-水(1∶1)為洗脫劑洗脫,洗脫速度為3 mL/min,洗脫后抽真空干燥3 min,收集洗脫液并用洗脫劑定容至10 mL,待測。
1.5 色譜條件
Thermo Hypersil C18柱(250 mm×4.6 mm,5 μm);高效液相色譜的檢測波長為233 nm,柱溫30 ℃,流動相為乙腈-磷酸水溶液(45∶55,pH 3.0),進樣量為20 μL,流速為0.5 mL/min。
2 結果與討論
2.1 固相萃取方法的優化
2.1.1 固相萃取柱的選擇 考察了C18和Water Oasis HLB兩種固相萃取柱對硝磺草酮的分離效果。由于硝磺草酮呈弱酸性(pKa=3.2),因此在過萃取柱前將硝磺草酮pH值調至3.0~4.0,使硝磺草酮能以分子形式與填料相結合,從而被保留在固相萃取柱中。實驗結果表明,兩種固相萃取柱對硝磺草酮的分離效果相似,平均回收率均大于 89.7%。考慮價格因素的差異,最終確定固相萃取柱為C18柱。
2.1.2 洗脫劑的選擇 不同洗脫劑對回收率具有一定影響,為實現最佳的洗脫效率,本文分別比較了甲醇、甲醇-乙腈(1∶1)、甲醇-水(1∶1)、乙腈-水(1∶1)、二氯甲烷和丙酮6種常用溶劑對硝磺草酮的洗脫效果,洗脫體積均為10 mL。結果表明,丙酮和甲醇-水(1∶1)不能將硝磺草酮洗脫出來;經二氯甲烷洗脫后,硝磺草酮的回收率為34%;其余洗脫劑所得到的回收率均達到89.7%以上。考慮到高效液相色譜的流動相為乙腈-磷酸水溶液,為保持一致性,選擇乙腈-水(1∶1)為洗脫劑。
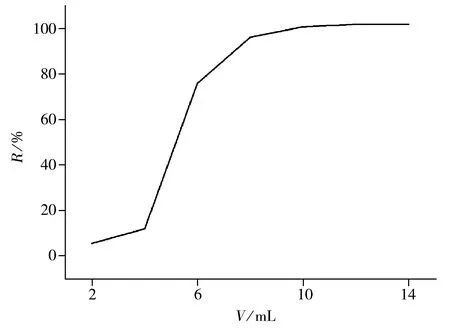
圖1 洗脫劑體積對回收率的影響
2.1.3 洗脫劑的用量 在1 000 mL空白水樣中加入一定濃度的硝磺草酮標準品,以乙腈-水(1∶1)為洗脫劑,分7次洗脫,每次2 mL,分段收集洗脫液并定容至10 mL,測定其回收率(見圖1)。結果發現,第5次洗脫后的回收率為100.8%,且已基本穩定,因此選擇洗脫劑的最佳用量為10 mL。
2.1.4 上樣速度 根據文獻[18-19]報道,對于大體積水樣,一般選擇5 mL/min和7 mL/min的上樣速度。本實驗在此基礎上分別研究了在3,5,7 mL/min的上樣速度下硝磺草酮的回收率。結果表明,在3種上樣速度下,硝磺草酮的回收率均在84%以上,其中上樣速度為3 mL/min時,硝磺草酮的回收率最高(93%)。因此,實驗選擇最佳上樣速度為3 mL/min。
2.1.5 洗脫速度 選擇適宜的洗脫速度,既能使目標化合物最大限度地洗脫干凈,又能節省時間。本實驗分別研究了1,3,5 mL/min的洗脫速度對硝磺草酮回收率的影響。結果表明,3種洗脫速度下,硝磺草酮的回收率均在88%以上,其中洗脫速度為3 mL/min時,硝磺草酮的回收率最高(93%)。因此,實驗選擇最佳洗脫速度為3 mL/min。
2.2 高效液相色譜條件的優化
2.2.1 檢測波長的選擇 為確定最佳測定波長,使用二極管陣列檢測器,分別對空白及硝磺草酮進行光譜掃描,掃描范圍為190 ~800 nm。結果表明,硝磺草酮的最大吸收依次出現在220,268,233 nm。在波長220 nm處,干擾過多;波長為268 nm處,方法靈敏度不高。因此確定233 nm作為紫外檢測器波長。
2.2.2 色譜柱的選擇 采用乙腈-磷酸水溶液(45∶55,pH 3.0)為流動相,流速為0.5 mL/min,對比Agilent Zorbax SB-C18柱(250 mm×4.6 mm,5 μm)和Thermo Hypersil C18柱(250 mm×4.6 mm,5 μm)對硝磺草酮分離性能的影響。實驗結果表明:在上述測定條件下,Agilent Zorbax SB-C18柱和Thermo Hypersil C18柱的分離度分別為6.48與7.24,均能較好分離硝磺草酮。因此使用Thermo Hypersil C18柱可滿足分析要求。
2.2.3 流動相的選擇 根據國內外學者的研究,用高效液相色譜法測定硝磺草酮的流動相種類主要為甲醇-磷酸溶液[1,6]和乙腈-磷酸溶液[3,12,20-21]。本文分別比較了這兩種溶液為流動相時硝磺草酮的分離情況。結果表明,以乙腈-磷酸溶液為流動相時,硝磺草酮的出峰時間為11.875 min,峰形良好,分離度為7.24。以甲醇-磷酸溶液為流動相時,硝磺草酮的出峰時間為27.5 min,出峰時間過長,峰形不佳。因此,實驗選擇乙腈-磷酸溶液為流動相對硝磺草酮進行分離。由于硝磺草酮為弱酸性農藥(pKa=3.2),流動相的pH值對分離具有一定影響。本文比較了流動相在不同pH值(6.0,5.0,4.0和3.0) 時對硝磺草酮分離度的影響。結果表明,當pH值在4.0~6.0范圍時,硝磺草酮的出峰時間早,不能與溶劑峰較明顯的分離,分離效果較差。當pH值為3.0時,硝磺草酮的峰形良好、分離效果較好,分離度為7.24,因此確定乙腈-磷酸水溶液流動相的pH值為3.0。進一步分析了乙腈-磷酸溶液流動相在不同比例(30∶70,35∶65,40∶60,45∶55)時硝磺草酮的分離情況。結果表明,當乙腈-磷酸溶液比例為30∶70和35∶65時,硝磺草酮的分離度分別為9.93和14.66,但色譜峰的保留時間過長。流動相比例為40∶60和45∶55時,硝磺草酮的分離度分別為 8.17和7.24,但后者對硝磺草酮的響應值更高。故確定最佳流動相為乙腈-磷酸(45∶55,pH 3.0)。在優化條件下,1 000 μg·L-1硝磺草酮標準溶液的色譜圖見圖2,其峰形對稱,分離效果好。

圖2 1 000 μg·L-1硝磺草酮標準溶液的色譜圖
2.2.4 標準曲線與方法檢出限 分別配制濃度為0.4,1,5,10,20 μg·L-1的硝磺草酮系列標準溶液,按照優化色譜條件進行測定,以濃度(x,μg/L)為橫坐標,對應峰面積(y)為縱坐標繪制標準曲線。結果表明,硝磺草酮濃度在0.4~20 μg·L-1范圍內線性關系良好,相關系數為0.999 7。利用MDL=3.143×δ(δ為7次測定值的標準偏差)計算方法檢出限。取硝磺草酮質量濃度為0.4 μg·L-1的水樣,平行測定7次,當固相萃取1 000 mL水樣時,方法的檢出限為0.039 μg·L-1。
2.2.5 回收率與精密度 分別在空白水樣中添加硝磺草酮標準品,使水樣中硝磺草酮的濃度分別為1,5,10 μg·L-1,按上述前處理方法和色譜條件進行測定,每個濃度平行測6次。結果顯示,3個加標水平下的回收率分別為90.3%,91.7%,94.7%,相對標準偏差(RSD) 分別為3.5%,3.5%,4.6%,方法顯示了較好的回收率與精密度。
2.3 實際水樣的測定
按照上述方法對地表水樣和農藥廠廢水進行硝磺草酮含量的測定。為進一步考察該方法用于實際水樣測定時的準確度,加入標準溶液進行加標實驗。結果表明,地表水中未檢出硝磺草酮,農藥廠廢水中檢出硝磺草酮的濃度為1.31 μg·L-1。向地表水和農藥廠廢水樣品中分別加入5,10 μg·L-1硝磺草酮標準溶液,連續測定6次,平均加標回收率及相對標準偏差見表1。結果表明,硝磺草酮的平均加標回收率為89.9%~93.2%,相對標準偏差(RSD)為3.6%~5.8%。實際水樣中硝磺草酮的加標回收率良好,該方法可用于實際水樣的檢測。

表1 實際水樣中硝磺草酮的加標回收率與相對標準偏差(n=6)
3 結 論
本實驗采用固相萃取/高效液相色譜法測定水中痕量硝磺草酮,樣品用C18固相萃取柱分離富集,以乙腈-水(1∶1)為洗脫劑,采用Thermo Hypersil-C18柱(250 mm×4.6 mm,5 μm)分離,乙腈-磷酸溶液(45∶55,pH 3.0)為流動相。該方法的檢出限為0.039 μg·L-1,對實際水樣的加標回收率為89.9%~93.2%。該方法具有快速、簡便、靈敏度高等優點,可用于水中痕量硝磺草酮的測定。
[1] Sun Y B,Xu Y M,Sun Y,Qin X,Wang Q,Gao Y.Environ.Chem.(孫約兵,徐應明,孫揚,秦旭,王倩,高陽.環境化學),2013,32(1):144-149.
[2] Zhang D H,Teng G S,Li Z Q,Li A J,Kang M Q,Mou J.Chin.J.Anal.Chem.( 張代輝,騰國生,李正強,李愛軍,康明芹,牟峻.分析化學),2012,40(5):811-812.
[3] Duan Y L,Tang B H,Huang X,Li Y,Huang C T,Cai L M.Agrochemicals(段亞玲,湯保華,黃鑫,李瑩,黃成田,蔡磊明.農藥),2013,52(8):582-584.
[4] Li A J,Qi B,Li F L,Mou J,Wang M T,Zhang D H,Fu R.Phys.Test.Chem.Anal.:Chem.Anal.( 李愛軍,齊犇,李鳳蘭,牟峻,王明泰,張代輝,符蓉.理化檢驗:化學分冊),2011,47(5):586-589.
[5] United States Environmental Protection Agency.Section 3 Registration for New Use of Mesotrione on Asparagus,Grass Grown for Seed,Oats,Okra,Rhubarb,Sugarcane and Sorghum.Washington DC:Office of Prevention,Pesticides and Toxic Substances,2007.
[6] Wang M,Duan J S,Sun M N,Zhang Y,Gao T C.Mod.Agrochem.(王梅,段勁生,孫明娜,張勇,高同春.現代農藥),2011,10(1):38-40.
[7] Kong D Y,Shi L L,Shan Z J,Wu X W,Wang F,Gao S X.ChinaEnviron.Sci.( 孔德洋,石利利,單正軍,吳星衛,王菲,高士祥.中國環境科學),2008,28(8):753-757.
[8] Zhang X,Liu Z H,Yang G Y,Yang L,Duan Y X,Liu C B,Chen Y K,Miao M M.J.Instrum.Anal.(張霞,劉志華,楊光宇,楊柳,段沅杏,劉春波,陳永寬,繆明明.分析測試學報),2014,33(5):545-550.
[9] Zhou C Y,Tang B B,Xi C X,Chen D D,Zhang L,Peng T,Wang G M,Chen Z Q.J.Instrum.Anal.(周春燕,唐柏彬,郗存顯,陳冬東,張雷,彭濤,王國民,陳志瓊.分析測試學報),2013,32(10):1212-1216.
[10] Alferness P,Wiebe L.J.Agric.FoodChem.,2002,50(14):3926-3934.
[11] Wu Y F,Xu J J,Li Z G,Zhang X C,Yin Y J,Zhang S H,Lin Y Y,Yu W J.Agrochemicals(吳艷芳,徐家俊,李治國,張新昌,尹云吉,張淑紅,林妍妍,禹文靜.農藥),2009,48(3):183-184.
[12] Pang M H,Liu S,Zhang L H,Kang Z H,Tao B,Wu L Q,Liu Y C.J.Agric.Univ.Hebei(龐民好,劉順,張利輝,康占海,陶晡,吳立強,劉穎超.河北農業大學學報),2007,30(5):75-78.
[13] Durand S,Sancelme M,Besse-Hoggan P,Combourieu B .Chemosphere,2010,81(3):372-380.
[14] Stoob K,Singer H P,Goetz C W,Ruff M,Mueller S R.J.Chromatogr.A,2005,1097(1):138-147.
[15] Gervais G,Brosillon S,Laplanche A,Helen C.J.Chromatogr.A,2008,1202(2):163 -172.
[16] Freitas L G,G?tz C W,Ruff M,Singer H P,Müller S R.J.Chromatogr.A,2004,1028(2):277-286.
[17] Barchanska H,Rusek M,Szatkowska A.Environ.Monit.Assess.,2012,184(1):321-334.
[18] Yan F L,Ma J P,Tan P G,Lu X,Jiang L H.J.Instrum.Anal.(閆鳳麗,馬繼平,譚培功,盧曦,姜蓮華.分析測試學報),2013,32(11):1328-1332.
[19] Yang Q H,Cheng X Y,Yang P,Qian S,Dan D Z.Chin.J.Anal.Chem.(楊秋紅,程小艷,楊坪,錢蜀,但德忠.分析化學),2011,39(8):1208-1212.
[20] Alekseeva T,Kolyagin Y,Sancelme M,Besse-Hoggan P.Chemosphere,2014,111:177-183.
[21] Pinna M V,Roggero P P,Seddaiu G,Pusino A.Chemosphere,2014,111:372-378.
Determination of Trace Amounts of Mesotrione in Water by Solid Phase Extraction and High Performance Liquid Chromatography
WANG Xiao-mei1,2,TAN Pei-gong3,CAO Zheng-mei3,LANG Yin-hai1,2*
(1.College of Environmental Science and Engineering,Ocean University of China,Qingdao 266100,China;2.Key Laboratory of Marine Environment and Ecology,Ministry of Education,Ocean University of China,Qingdao 266100,China;3.Qingdao Environmental Monitoring Centre,Qingdao 266100,China)
A solid phase extraction coupled with high performance liquid chromatographic(HPLC) method was developed for the determination of trace amounts of mesotrione in water.The pH values of the samples were initially adjusted to 3.0-4.0 with phosphoric acid,and then enriched and purified with a C18solid-phase extraction column.The mesotrione fraction was eluted with acetonitrile-water(1∶1) and then concentrated to 10 mL.Mesotrione was determined by HPLC equipped with a Thermo Hypersil-C18column(250 mm×4.6 mm,5 μm),by using a mixture of acetonitrile-phosphoric acid solution(45∶55,pH 3.0) as mobile phase at a constant flow of 0.5 mL/min.The column temperature was set at 30 ℃ and the wavelength of ultraviolet(UV) detection was set at 233 nm.The experimental results showed that a good linear relationship(r>0.999 7) between peak area and mesotrione concentration was obtained in the range of 0.4-20 μg·L-1.The method detection limit for mesotrione was 0.039 μg·L-1.The average recoveries were in the range of 90.3%-94.7% at spiked levels of 1,5,10 μg·L-1with relative standard deviations of 3.5%-4.6%.The method was applied in the determination of trace amounts of mesotrione in surface water and wastewater with recoveries of 89.9%-93.2% at spiked amounts of 5 μg·L-1and 10 μg·L-1.The method showed the advantages of simplicity, rapidness and sensitivity,and was suitable for the determination of trace amounts of mesotrione in water.
mesotrione;solid phase extraction;high performance liquid chromatography(HPLC);acetonitrile;water
2014-10-11;
2014-10-25
國家環境保護標準制修訂項目(2012-44)
10.3969/j.issn.1004-4957.2015.02.016
O657.72;S482.4
A
1004-4957(2015)02-0216-05
*通訊作者:郎印海,博士,教授,研究方向:污染控制與生態修復,Tel:0532-66786308,E-mail:yhlang@ouc.edu.cn

