響應面法優化超聲輔助提取佛手瓜總黃酮的工藝研究
陳建福 , 林 洵 , 陳美慧 , 周媚媚
(1.漳州職業技術學院食品與生物工程系,福建 漳州 363000;2.閩南師范大學生物科學與技術學院,福建 漳州 363000;3.農產品深加工及安全福建省高校應用技術工程中心,福建 漳州 363000)
佛手瓜[Sechium edule(Jacq.)Swartz]又名安南瓜、隼人瓜等,是葫蘆科佛手瓜屬珍稀瓜類蔬菜(Ordo?eza 等,2006)。黃酮類化合物是一類廣泛存在于植物體中的多酚類物質,具有抗炎、抗腫瘤、抗氧化、降血壓、降血脂、延緩衰老等作用(Escriche 等,2014;Nakabayashi等,2014)。 本試驗對影響超聲波輔助提取佛手瓜總黃酮的工藝條件進行了研究,并利用響應面法對提取工藝進行了優化,得到了最佳的工藝條件,為佛手瓜資源的進一步開發利用提供理論依據。
1 材料與方法
1.1 試劑與儀器 佛手瓜,購于漳州西洋坪菜市場。乙醇,分析純,使用時,配制成不同濃度(體積分數)的乙醇溶液;蘆丁,標準品;硝酸鋁,分析純;亞硝酸鈉,分析純;氫氧化鈉,分析純。
SCQ-3201E超聲波清洗機,上海聲彥超聲波有限公司;LGJ10-C冷凍干燥機,北京四環科學儀器廠;Q-250B高速多功能粉碎機,上海冰都電器有限公司;UV-1800PC-DS2紫外可見分光光度計,上海美譜達儀器有限公司;BSA124S電子天平,賽多利斯科學儀器有限公司;GZX-9070MBE數顯鼓風干燥箱,上海博訊實業有限公司醫療設備廠。
1.2 試驗方法
1.2.1 佛手瓜總黃酮的測定 利用硝酸鋁-亞硝酸鈉比色法,以蘆丁為標準品,測定在波長為510 nm時的吸光度,繪制標準曲線,得到吸光度與濃度的回歸方程(陳建福和施偉梅,2014)。
利用上述方法測定佛手瓜提取液的吸光度,代入回歸方程,得到總黃酮濃度,利用下式換算得到總黃酮提取率。

式中:m為佛手瓜的質量,g;b為回歸方程計算的總黃酮質量濃度,mg/L;V為提取液體積,L。
1.2.2 超聲波輔助提取佛手瓜總黃酮 將佛手瓜洗凈切成條狀,并泡于蒸餾水中0.5 h,撈起自然晾干后,冰凍,并于冷凍干燥機中進行干燥,粉碎,過80目篩備用。在裝有冷凝管的250 mL三口燒瓶中,裝入一定量的佛手瓜粉末,置于超聲波反應器中,按照試驗工藝條件對佛手瓜總黃酮進行提取,結束后,濃縮,定容,按1.2.1中的方法對總黃酮提取率進行計算。
1.3 單因素試驗 固定其他條件不變,分別選取乙醇濃度(60%、65%、70%、75%、80%、85%)、超聲溫度 (60、65、70、75、80、85 ℃)、 液料比(15、20、25、30、35、40 mL/g)、超聲時間(15、20、25、30、35、40 min)等進行單因素試驗,以總黃酮提取率為指標,研究各因素對佛手瓜總黃酮提取率的影響。
1.4 響應面試驗設計 在單因素試驗基礎上,以總黃酮提取率為響應值,選擇乙醇濃度(A)、超聲溫度(B)、液料比(C)、超聲時間(D)為工藝參數,運用Design Expert 8.05b軟件,采用Box-Behnken中心組合原理設計試驗,進行4因素3水平的響應面優化試驗,建立響應值與因素間的預測模型,以確定最佳的工藝條件,響應面試驗因素與水平見表1。
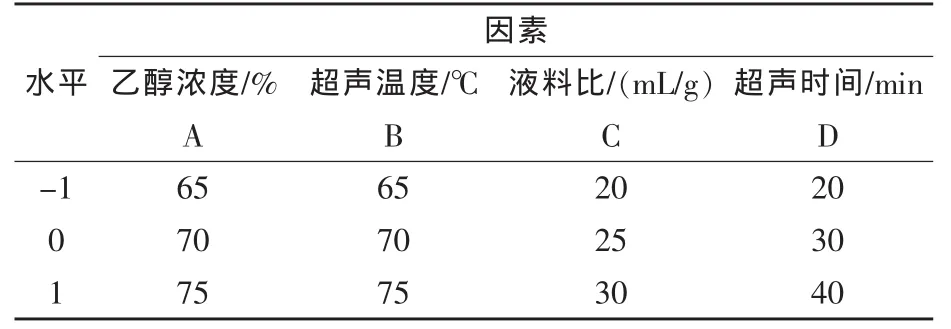
表1 響應面試驗因素與水平
2 結果與分析
2.1 單因素試驗對佛手瓜總黃酮提取率的影響
2.1.1 乙醇濃度對佛手瓜總黃酮提取率的影響從表2可以看出,總黃酮提取率隨著乙醇濃度的增加而增大,當乙醇濃度為70%時,總黃酮的提取率最大,當乙醇濃度超過70%時,提取率反而又下降,這是因為黃酮類物質具有一定的醇溶性,隨著乙醇濃度的增加,黃酮類物質在溶劑中的溶解能力增強,因此總黃酮提取率提高。當乙醇濃度超過70%后,溶劑的極性變弱,部分強極性的黃酮溶出阻力增加,使得黃酮類物質提取率的下降(Zhang等,2011)。因此最佳的乙醇濃度選擇為70%。

表2 提取條件對總黃酮提取率的影響
2.1.2 超聲溫度對佛手瓜總黃酮提取率的影響從表2可以看出,總黃酮提取率隨著超聲溫度的升高而增大,當超聲溫度為70℃時,總黃酮提取率最大,當超聲溫度超過70℃時,提取率反而下降,這是因為隨著超聲溫度的升高,提取體系的分子熱運動增強,促進了總黃酮與溶劑之間的擴散與交換(Xie等,2014),從而使得總黃酮提取率增大,但當超聲溫度超過70℃時,高溫會使黃酮類物質破壞與分解,從而導致總黃酮提取率的下降。因此最佳的超聲溫度選擇為70℃。
2.1.3 液料比對佛手瓜總黃酮提取率的影響 從表2可以看出,總黃酮提取率隨著液料比的增加而增大,當液料比為25 mL/g時,總黃酮提取率最大,當液料比超過25 mL/g時,提取率反而下降,這是因為隨著液料比的增大,佛手瓜顆粒內外的濃度差增大,使得傳質推動力增加,促進了黃酮從顆粒內部溶出,而使得總黃酮提取率增大,當液料比超過25 mL/g后,溶劑量過大,溶劑會增加超聲能量的損耗且會增加后序濃縮中黃酮的損失(A-boshora等,2015),而使得總黃酮提取率下降。因此,最佳的液料比選擇為25 mL/g。
2.1.4 超聲時間對佛手瓜總黃酮提取率的影響從表2可以看出,總黃酮提取率隨著超聲時間的延長而增大,當超聲時間為30 min時,總黃酮提取率最大,當超聲時間超過30 min時,提取率反而下降。這是因為隨著超聲時間的延長,佛手瓜顆粒中的黃酮類物質逐漸溶出,使得總黃酮提取率增大,但超聲時間過長,超聲會產生局部的高溫而造成部分黃酮類物質的分解 (Teh和 Birch,2014),而導致總黃酮提取率的下降。因此最佳的的超聲時間選擇為30 min。
2.2 響應面法優化超聲輔助提取佛手瓜總黃酮的工藝
2.2.1 響應面試驗設計與結果 利用Design Expert 8.05b軟件對表3的試驗結果進行響應面分析,根據Box-Behnken中心組合試驗設計,得到了佛手瓜總黃酮提取率對乙醇濃度、超聲溫度、液料比和超聲時間的二次多項式回歸方程:
Y=3.35-0.12A+0.34B+0.13C+0.14D+0.18AB-0.047AC-0.13AD+0.05BC-0.017BD+0.002CD-0.3A2-0.61B2-0.57C2-0.48D2。
回歸模型的方差分析如表4所示。由表4可以看出,該回歸模型F=19.81,P<0.0001,說明該模型極顯著,與試驗擬合較好。失擬項P=0.3113>0.05,差異不顯著,表明未知因素對本試驗的干擾較小,殘差是由隨機誤差引起的。相關系數R2=0.9519,表明該模型有超過95%的試驗值可用預測值來代替,說明預測值與實際值之間的相關性較好。從回歸方程的F值及P值可看出,一次項B、D,二次項 A2、B2、C2、D2對試驗結果影響極顯著(P < 0.01),一次項 A、C,交互項AB 對試驗結果影響顯著(P < 0.05),交互項 AC、AD、BD、CD 對試驗結果影響不顯著(P>0.05),說明各因素與佛手瓜總黃酮提取率之間不是簡單的一次線性關系,而是呈二次關系,影響因子的主效應主次順序為:超聲溫度>超聲時間>液料比>乙醇濃度。綜上所述,利用響應面法建立的回歸模型擬合度高,可較好地描述各因素與響應值之間的真實關系,因此可以用該模型預測和分析超聲輔助提取佛手瓜總黃酮的工藝條件。
2.2.2 響應面分析 根據表3的結果作出的響應面分析圖及等高線圖如圖1所示。從圖1可以看出,超聲溫度和超聲時間的曲線較陡,說明超聲溫度和超聲時間對總黃酮提取率的影響最為顯著;而液料比和乙醇濃度的曲線均較平緩,響應值變化較小,說明液料比和乙醇濃度對總黃酮提取率的影響較小。分析可知,主次因素順序為超聲溫度>超聲時間>液料比>乙醇濃度。

表3 響應面設計方案及試驗結果
2.2.3 提取工藝優化及結果驗證 在所選取的各因素條件范圍內,通過Design Expert 8.05b軟件對二次回歸模型進行數據分析,得到超聲波輔助提取佛手瓜總黃酮的最佳工藝條件為:乙醇濃度69.15%、超聲溫度71.27℃、液料比25.66 mL/g、超聲時間31.64 min,在此條件下,佛手瓜總黃酮提取率的最大理論值為3.420%。為了驗證響應面法的可靠性,并考慮到實際操作條件的便利性,將工藝條件修正為:乙醇濃度69%、超聲溫度71℃、液料比25 mL/g、超聲時間31 min。以此為條件進行三次平行驗證試驗,測得佛手瓜總黃酮平均提取率為3.402%,與理論預測值3.420%相差較小,相對誤差為0.526%,說明通過響應面法優化得到的佛手瓜總黃酮的回歸模型擬合度高,具有實際的生產價值。該工藝與楊海濤(2008)報道的傳統的熱浸提法(乙醇濃度70%、料液比1∶20,溫度80℃,提取時間2 h)相比,提取率提高了12.69%,該工藝大大縮短了操作時間,且操作溫度低,具有明顯的成本優勢,是一種高效快速提取佛手瓜總黃酮的方法。

表4 回歸模型方差分析
3 結論
試驗利用BoX-behnken Design設計方案,運用Design Expert 8.05b軟件對工藝參數進行了優化,得到了佛手瓜總黃酮提取率與各因素間的四元二次回歸方程。根據回歸模型確定了超聲輔助提取佛手瓜總黃酮的最佳工藝參數為:乙醇濃度69%、超聲溫度71℃、液料比25 mL/g、超聲時間31 min。在該工藝條件下進行驗證試驗,測得佛手瓜總黃酮平均提取率為3.402%,與理論預測值(3.420%)相差較小,相對誤差為0.526%,說明通過響應面法優化得到的佛手瓜總黃酮提取的工藝參數準確可靠。

圖1 兩因素交互作用對總黃酮提取率影響的響應面圖
[1]陳建福,施偉梅.響應面法優化纖維素酶輔助提取西蘭花總黃酮[J].四川農業大學學報,2014,32(3):298 ~ 304.
[2]Aboshora W,Lianfu Z,Dahir M,et al.Effect of Extraction Method and Solvent Power on Polyphenol and Flavonoid Levels in Hyphaene Thebaica L Mart(Arecaceae)(Doum)Fruit,and its Antioxidant and Antibacterial Activities[J].Trop J Pharm Res,2015,13:2057 ~ 2063.
[3]Escriche I,Kadar M,Juan-Borrás M,et al.Suitability of antioxidant capacity,flavonoids and phenolic acids for floral authentication of honey.Impact of industrial thermal treatment[J].Food Chem,2014,142:135 ~ 143.
[4]Nakabayashi R,Yonekura-Sakakibara K,Urano K,et al.Enhancement of oxidative and drought tolerance in Arabidopsis by overaccumulation of antioxidant flavonoids[J].Plant J,2014,77:367 ~ 379.
[5]Ordonez A A L,Gomez J D,Vattuone M A.Antioxidant activities of Sechium edule(Jacq.)Swartz extracts[J].Food Chem,2006,97:452 ~ 458.
[6]Teh S S,Birch E J.Effect of ultrasonic treatment on the polyphenol content and antioxidant capacity of extract from defatted hemp,flax and canola seed cakes[J].Ultrason Sonochem,2014,21:346 ~ 353.
[7]Xie Z,Sun Y,Lam S,et al.Extraction and isolation of flavonoid glycosides from Flos Sophorae Immaturus using ultrasonic-assisted extraction followed by high-speed countercurrent chromatography[J].J Sep Sci,2014,37:957 ~ 965.
[8]Zhang G,He L,Hu M.Optimized ultrasonic-assisted extraction of flavonoids from Prunella vulgaris L.and evaluation of antioxidant activities in vitro[J].Innov Food Sci Emerg,2011,12:18 ~ 25.

