中和反應與“可計量”計算融合的中考命題策略
摘要:以2012~2014年蘇州市中考化學卷“中和反應”試題為案例,從化學計量角度闡述了以化學實驗有效數(shù)據(jù)與計算的有機融合,考查初中學生“可計量的單一化學反應的簡單計算”的核心能力等的命題策略。從初中化學計算教學層面貫徹落實課程標準出發(fā),讓學生從不可計量的、憑空臆想的、情景虛假的、脫離科研實驗和生產(chǎn)實際的無謂的“題海”中解放出來,以期達到“減負”目的。
關鍵詞:中和反應;“可計量”計算;化學計量學;中考化學;命題策略
文章編號:1005–6629(2015)2–0077–04 中圖分類號:G633.8 文獻標識碼:B
1 問題的提出
2011年9月我國義務教育化學課程標準(以下簡稱“新版課標”)頒布并開始實施。自2012年9月起,在認真貫徹新版課程標準里的8個“基礎學生實驗[1]”過程中,為切實減輕初中學生在化學計算上的課業(yè)負擔,蘇州市初中化學教學研究的主題定為“可計量”化學計算,即開展化學實驗與化學計算在“可計量”基礎上有機融合的教學實踐研究[2]。
“計量”從詞源意義上被解釋為:“①把一個暫時未知的量與一個已知的量做比較,如用尺量布,用體溫計量體溫;②計算。[3]”顯然“計量”離不開相應的量測工具;“計量”與計算又密不可分。“計量”還要科學選擇計量單位和科學控制影響計量的各種外界因素[4]。
再從化學計量學的角度來看“計量”與化學的關系。“化學計量學是化學中所有數(shù)學計算的基礎”。而化學計量學與初中階段化學有密切關系的應用通常包含下列內(nèi)容:(1)化合物組成的計算;(2)化學反應的計量關系的計算;(3)溶液中各組分的濃度和數(shù)量的計算[5]。又“化學計量學運用數(shù)學、統(tǒng)計學、計算機科學以及其他相關學科的理論和方法,優(yōu)化化學量測過程,并從化學量測數(shù)據(jù)中最大限度地獲取有用的化學信息,是一門化學量測的基礎理論與方法學”[6]。它現(xiàn)已被歐盟分析化學專業(yè)委員會列為分析化學的四大支柱學科之一[7]。
從初中化學教學角度,何謂“可計量”?筆者以為從“可計量實驗”的儀器角度,有托盤天平(精度0.1g或0.2g不等)、電子天平(精度0.1g或0.01g或0.001g不等),各種規(guī)格和精度不同的量筒、滴管、溫度計、廣泛pH試紙、數(shù)字化傳感儀等。科學家通過大量精密的量測實驗得出的可查閱的數(shù)據(jù),如相對原子質(zhì)量、溶解度等。再從“可計量計算”的角度,就是教師按照初中化學現(xiàn)有的實驗器材以及教材提供的可查閱的數(shù)據(jù),設計情景真實的量測實驗,并合理有效地引導學生進行有關元素質(zhì)量分數(shù)、混合物中某一純凈物純度、溶液中某溶質(zhì)質(zhì)量分數(shù)和單一化學反應的簡單計算。或者說,初中階段化學計算題中提供的數(shù)據(jù)必須真實可信、有據(jù)可查,具有“可計量”性和可操作性。
中和反應是復分解反應的典型,又是離子反應中可靠的、真實的“可恰好完全反應”的典型,且是高中化學中和滴定實驗及其定量計算的基礎[8],是大學分析化學中使用計算機編程技術實現(xiàn)中和反應滴定曲線復現(xiàn)的經(jīng)典案例。怎樣在義務教育階段夯實中和反應及其計算的基礎是初、高中化學教學銜接的重要課題之一。蘇州市中考化學命題組近三年連續(xù)圍繞“中和反應”這一核心知識,考查了學生對于“可計量的單一化學反應的簡單計算”的核心能力。
以下筆者以近三年蘇州市中考化學中和反應的化學方程式計算為案例,闡述“可計量”化學計算的命題策略。
2 由指示劑的變色到溶質(zhì)質(zhì)量計算
2.1 2012年題例
試題以指示劑的概念和作用為背景,從洗氣裝置吸收和半定量分析的角度考查物質(zhì)檢驗和檢測的關系,再根據(jù)指示劑在中和反應中用于判斷“滴定終點”的依據(jù),引出根據(jù)化學方程式計算反應物的質(zhì)量,進而考查反應后生成物作為溶質(zhì)的量以及配制飽和溶液的實驗操作與對應的計算。
第36題(7分) 為判斷某物質(zhì)的存在或某物質(zhì)恰好完全反應,通常以特定物質(zhì)的顯色達到目的,能顯色的物質(zhì)就稱“指示劑”。如:用藍色的石蕊試紙變紅判斷待測液顯酸性;用淀粉溶液變藍判斷單質(zhì)碘(I2)的存在。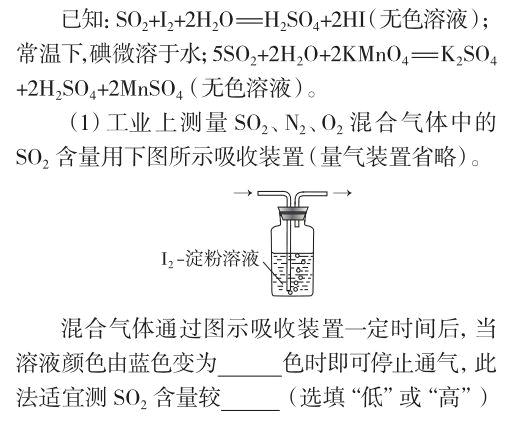

②試列式計算說明將該反應后的溶液轉化為20℃時飽和溶液的一種簡單方法(計算結果精確到0.1g)。已知:20℃時氯化鈉的溶解度為36.0g。
[參考答案和評分建議](1)①無(1分),低(1分)。②高錳酸鉀或KMnO4(1分),高錳酸鉀溶液吸收一定量的SO2可由紫紅色變?yōu)闊o色(1分)。(2)①7.3%(1分)。②中和反應得到氯化鈉2.34g(1分);再加入氯化鈉9.8g,溶液達到飽和(1分)。
2.2 回避量器計量因素,反思蒸發(fā)與添加固體準確稱量的可行性
簡短的題干給出“藍色的石蕊試紙變紅判斷待測液顯酸性,用淀粉溶液變藍判斷單質(zhì)碘(I2)的存在”,即指示劑的簡單定性作用。隨后列出3個“已知”信息,說明二氧化硫和單質(zhì)碘的某些性質(zhì)及相應的化學方程式,為定量化測定作準備。接下來試題給出的第一個應用案例就是“工業(yè)上測量某混合氣體中的二氧化硫含量”,這里并未要求考生進行準確的定量計算,也不要求氧化還原反應方程式的配平,只要求半定量地回答指示劑的變色情況和在二氧化硫含量大小不同情況下選擇恰當指示劑的原因,并為中和反應滴定選用指示劑做好鋪墊。在此案例中省略量氣裝置是符合初中化學課程標準要求的,因為有關量氣裝置的知識要求太高,因此題干僅僅給了一個簡單的洗氣裝置。
第二個應用的案例是酚酞作為中和反應的指示劑。當酚酞試液變色的瞬間,“可認為恰好完全反應”,即可精確定量計算。因為對于鹽酸或氫氧化鈉溶液來說,其中鈉離子、氯離子、氫離子和氫氧根離子均以自由移動的離子形式存在,酚酞試液的變色可以顯示后兩種離子間完全反應的關系,因此第①空是比較容易計算出正確結果的。但是第②空,有些學生不從實驗操作角度考慮,僅從純理論計算角度以為“蒸發(fā)一定量的水即能成為飽和溶液”而失分。因為蒸發(fā)水的操作其實比較繁瑣:選擇的儀器比只稱量氯化鈉多,至少多了酒精燈、燒杯、固定支架等;還有蒸發(fā)時需監(jiān)控水的蒸發(fā)量,每稱量一次就得冷卻至室溫,再加熱蒸發(fā)……如此循環(huán)操作很費時費力,萬一水蒸發(fā)過量了還得補加一定量的水……由此可知理論計算出蒸發(fā)水的質(zhì)量與初中階段量測的可操作性是脫節(jié)的。因此一次性地加入一定質(zhì)量的氯化鈉固體,是配制中和反應后飽和鹽水的更為簡單的操作方法。
這就是本題給予我們的啟示:化學計算教學要考慮怎樣做到“真實的實驗情景與化學計算”的有機融合?怎樣把握計算數(shù)據(jù)的合理性、真實性?如何回避初中生尚未掌握和了解的量器測量?在初中階段理應讓學生扎實掌握天平的稱量方法,以及對蒸發(fā)溶劑與添加固體對準確計量可行性的理解與把握,達到使實驗操作與化學計算融合的目的。
3 由滴定終點判斷到溶液濃度計算
3.1 2013年題例
為了進一步檢驗2012年中考第36題的導向作用,2013年仍以中和反應為背景,用加入溶質(zhì)的方法由不飽和溶液配制飽和溶液,并且考查用托盤天平稱取所需質(zhì)量固體的操作,最后求出“當時”室溫條件下硝酸鉀的溶解度。
第35題(5分) 用膠頭滴管向盛有20.0g稀硝酸的燒杯中滴加2滴酚酞試液,再向其中緩緩加入20.0g 5.6%的氫氧化鉀溶液;邊滴加邊用玻璃棒攪拌,待滴入最后1滴堿液時,混合液剛好由無色變?yōu)榉奂t色,且30s內(nèi)顏色不變,即可認為恰好完全反應。
(1)請列式計算反應后溶液中溶質(zhì)的質(zhì)量分數(shù)。
(2)將反應后的溶液冷卻到室溫,若要配制室溫時的飽和溶液,還需向其中加入10.0g硝酸鉀固體。按規(guī)范操作用托盤天平稱取10.0g硝酸鉀時,若指針略向左偏轉,要使指針居中的恰當操作是:____________。
(3)根據(jù)上述情境,列式計算此時硝酸鉀的溶解度(計算結果保留小數(shù)點后一位)。
[參考答案和評分建議](1)5%(2分)。(2)用藥匙從左盤取下少許硝酸鉀固體(1分)。(3)31.6g(2分)。
3.2 詳細描述中和滴定終點過程,考查添劑稱量的準確性操作
本題題干情景本身就是初中化學利用膠頭滴管進行的不算十分精確的中和反應滴定過程(較為精確的中和滴定應該用滴定管,但初中不作要求)。題干所給數(shù)據(jù)既考慮了3位有效數(shù)字,又考慮了托盤天平的0.1g精度。
第35(1)題就是根據(jù)中和反應計算產(chǎn)物硝酸鉀質(zhì)量;第35(2)題是考查加入10.0g硝酸鉀的規(guī)范稱量操作,多數(shù)考生用籠統(tǒng)地“減少固體”來代替減量操作的規(guī)范化解答;第35(3)題再根據(jù)常溫時剛加入的10.0g硝酸鉀使溶液達到飽和,計算常溫時的硝酸鉀溶解度。以此印證了2012年試題中將溶液轉化為飽和的最簡單的方法就是加入固體溶質(zhì),而不是費時、費力又不易計量的蒸發(fā)水分的方法。但是從學生解答本題的統(tǒng)計數(shù)據(jù)來看,整道題的得分率僅為0.304;前2小題的得分率為0.327,最后1小題的得分率只有0.27。因此這道題是整卷中相對最難的一道題。
由此可知,盡管依據(jù)化學方程式的計算,只是完全反應的一步計算,涉及的溶解度計算也僅僅是單一情形的,但是由于數(shù)據(jù)運算時不可整除,仍然有相當一部分考生計算失誤或不知如何運算。再由第一年考查了蒸發(fā)與添劑的實驗操作哪一種更為準確的反思,到來年緊接著考查如何準確稱量已知質(zhì)量固體的具體操作方法,得分率卻較低,說明這樣遞進式即“追問式”的命題策略還是有效的。
4 由中和后的“返滴”現(xiàn)象到微量計算
4.1 2014年題例
為了繼續(xù)跟蹤分析平時“中和反應”教學的情況,又因為我市中考化學已經(jīng)連續(xù)兩年與中和反應的計算和溶解度關聯(lián),所以第三次與中和反應計算有關的內(nèi)容將溶解度計算剝離并置前,這次采用教材上“活動與探究”里中和反應后的“返滴”實驗,再設計計算情景來說明返滴現(xiàn)象與原溶液濃度的關系。
第36題(5分) 現(xiàn)有兩種稀溶液:標記為A的0.0400%的氫氧化鈉溶液;標記為B的0.365%的鹽酸。假設本題所涉及到的各種稀溶液的密度均近似為1.00 g·mL-1,且每滴溶液的體積近似為0.05mL,試解答下列各小題。
(1)恰好完全中和20.0g A溶液,需加入B溶液多少克?
(2)在盛有20.0mL A溶液的錐形瓶中滴加2滴酚酞試液,再向瓶中緩緩倒入10.0mL B溶液,邊倒邊振蕩,充分混合后溶液呈無色。若取該無色混合液3.00mL于一支試管內(nèi),再向試管內(nèi)滴加1滴A溶液,試通過計算說明此時試管內(nèi)溶液呈現(xiàn)的顏色。
[參考答案和評分建議](1)2.00g(2分,其中列式正確給1分)。(2)因為3mL中多余的鹽酸是(3mL/30mL)×(10mL-2mL)=0.8mL(1分);而2mL鹽酸可中和20mL A溶液,所以0.8mL鹽酸應中和8mL A溶液;因此1滴A溶液遠遠小于8mL A溶液(1分),不能中和0.8mL鹽酸;所以此時溶液呈酸性,顯無色(1分)。
4.2 先設置恰好反應的宏量計算,再思考微量“返滴”與溶液濃度的關系
第36題第(1)小題均分1.26,得分率0.63,中難題,屬于根據(jù)單一化學反應,按化學方程式求某一反應物的基本計算。現(xiàn)在凡涉及到數(shù)字運算的最基本化學計算題,對于部分考生來說已經(jīng)是中等難度了。
第36題第(2)小題均分0.84,得分率僅0.28,是本試卷中最難的一道題。根據(jù)閱卷情況顯示,考生中有15種解題方法,此題達到了解題方法開放性的目的,有利于拓展學生的創(chuàng)造性思維。由于教材中的實驗沒有定義和給出酸、堿的濃、稀及其具體濃度,而“基礎實驗8 酸、堿的化學性質(zhì)”中僅僅告知用稀鹽酸、稀氫氧化鈉溶液[9]。因此最后一步用氫氧化鈉溶液“返滴”中和后的溶液時,是否會變紅是不確定的。鑒于此,命題者給出了兩種濃度差異較大的稀溶液的濃度值,而且考慮到學生數(shù)字計算的簡便,給出與其相對分子質(zhì)量數(shù)值相同的濃度值,從高中化學角度來看其實與物質(zhì)的量濃度是非常接近的。其次本題給出的濃度數(shù)值三位有效數(shù)字的精度保證其密度[10]可以近似為1.00 g·mL-1,而每滴溶液的體積近似為0.05mL也是根據(jù)滴定管的體積以毫升為單位的精度可讀到小數(shù)點后第2位來近似確定的。即儀器的精度決定讀數(shù)的有效位數(shù),有效數(shù)字也保證了所給密度的近似程度。
當然題干所給的數(shù)據(jù)只是決定題干內(nèi)容的科學性,而不是針對考生解題要求的。再者針對考生有關微量物質(zhì)的化學計算要求,以及數(shù)字運算過程中的科學計數(shù)表達法[11],這對于初三學生沒有超出“新版課標”和蘇州市中考考試說明的要求。
5 結語
新版課標對于紙筆檢測要求“編制聯(lián)系實際考查學生能力的試題時,情景要真實,避免出現(xiàn)科學性錯誤;編制聯(lián)系實際的化學計算題時,要根據(jù)內(nèi)容標準控制試題難度,不要超越學生的知識基礎”[12]。本文枚舉的三個試題案例就是在初中化學計算教學中把握“可計量、可操作”的原則,符合“真實、簡捷”和“不越位”的典型。
參考文獻:
[1][12]中華人民共和國教育部制定.義務教育化學課程標準(2011年版)[S].北京:北京師范大學出版社,2011:12~13.
[2]毛明.初中化學“可計量”實驗與計算相融合的題例評析[J].化學教與學,2014,(10):67~69.
[3]中國社會科學研究院語言研究所詞典編輯室.現(xiàn)代漢語大詞典[S].北京:商務印書館,1996:596.
[4]畢華林,盧巍.義務教育教科書·化學(九年級上冊)[M].濟南:山東教育出版社,2014:40.
[5]周公度.化學辭典[S].北京:化學工業(yè)出版社,2004:292.
[6]盧小泉等.化學計量學研究方法[M].北京:科學出版社,2013:前言.
[7]梁逸曾,易倫朝.化學計量學基礎[M].上海:華東理工大學出版社,2010:前言2.
[8]王祖浩主編.普通高中課程標準實驗教科書·化學反應原理[M].南京:江蘇教育出版社,2009:73~77.
[9][11]王祖浩主編.義務教育教科書·化學(九年級下冊)[M].上海:上海教育出版社,2013:48~64,116.
[10]編寫組編.中學教師化學手冊[S].北京:科學普及出版社,1981:308,328.

