地佐辛注射液與常用輸液的配伍穩定性研究
劉光斌 任潔 何苗苗 高穎
(酒鋼醫院藥學部,甘肅 嘉峪關735100)
地佐辛注射液與常用輸液的配伍穩定性研究
劉光斌 任潔 何苗苗 高穎
(酒鋼醫院藥學部,甘肅 嘉峪關735100)
目的:在常溫條件下考察8 h內地佐辛注射液與5種常用輸液的配伍穩定性。方法:采用高效液相色譜法測定地佐辛注射液在5種輸液中的含量變化,同時測定pH值、5-羥甲基糠醛變化。結果:與5種常用輸液配伍后,在8 h內pH值和5-羥甲基糠醛基本沒有變化,有效成分地佐辛的含量在8 h內基本無變化。結論:地佐辛注射液在5種常用輸液中8 h內穩定。
地佐辛注射液;配伍;穩定性;高效液相色譜;含量
地佐辛是阿片受體混合激動-拮抗劑,對κ受體完全激動,對μ受體有部分激動、部分拮抗作用,不產生典型的μ受體依賴,可使胃腸平滑肌松弛,減少惡心嘔吐的發生率,對δ受體幾乎無活性,很少產生煩躁、焦慮不適感。其鎮痛強度、起效時間和作用持續時間與嗎啡相當,成癮性小[1],對血壓、心功能影響小[2]。已廣泛用于圍手術期鎮痛、癌性疼痛、無痛麻醉技術等[3]。地佐辛注射液說明書中要求肌內或靜脈注射,注射本品可完全快速吸收,建議首選肌注。然而臨床實際使用地佐辛注射液與輸液配伍靜脈輸注者仍然比較多[4],而關于地佐辛與常用輸液的配伍穩定性未見公開報道。本研究從臨床實際需要出發,采用高效液相色譜法(HPLC)對地佐辛注射液與5%葡萄糖注射液,10%葡萄糖注射液,生理氯化鈉溶液,5%葡萄糖氯化鈉注射液和乳酸林格氏注射液等5種常用輸液配伍后的穩定性進行考察,為臨床用藥提供參考依據。
1 儀器與材料
1.1 儀器
LC-2010AHT型高效液相色譜儀(日本島津),島津LC solution工作站;AUY220電子分析天平(日本島津);756紫外可見分光光度計(上海奧譜勒儀器有限公司);PHS-3C型實驗室酸度計(上海偉業儀器廠)。
1.2 藥品與試劑
地佐辛對照品(揚子江藥業集團有限公司,含量99.9%);地佐辛注射液(揚子江藥業集團有限公司,批號:12030121,13102541,14033041,規格:1 mL∶5 mg);5-羥甲基糠醛對照品(含量 >99%,批號:1415620,Aldrich公司);5%葡萄糖注射液(石家莊四藥有限公司,規格:250 mL,批號:1403220509);10%葡萄糖注射液(西安京西雙鶴藥業有限公司,規格:500 mL,批號:1311169B);生理氯化鈉溶液(西安京西雙鶴藥業有限公司,規格:250 mL,批號:131101 6G);5%葡萄糖氯化鈉注射液(山東齊都藥業有限公司,規格:500 mL,批號:3B13081904);乳酸林格氏注射液(石家莊四藥有限公司,規格:500 mL,批號:131218518);乙腈為色譜純;水為超純水;其他試劑均為分析純。
2 方法與結果
2.1 溶液的制備
2.1.1 對照品溶液的制備 精密稱取地佐辛對照品20 mg,置100 mL量瓶中,加流動相稀釋制成200 μg/mL地佐辛對照品儲備溶液。
2.1.2 供試品溶液的制備 取地佐辛注射液1支(5 mg),置100 mL容量瓶中,加流動相稀釋至刻度,制成每1 mL約含地佐辛50 μg的溶液。
2.1.3 配伍溶液的制備 取上述5種輸液各200 mL,按照臨床常用量分別加入地佐辛注射液4支(20 mg),搖勻;即得每1 mL約含地佐辛100 μg的配伍溶液。
2.1.4 陰性樣品溶液的制備 參考其處方除不加地佐辛外,其他輔料正常加入,制備陰性制劑。按“2.1.2”項下方法制備陰性對照液。
2.2 檢測波長的確定
取地佐辛對照品,用水制成50 μg/mL溶液,置于紫外-可見分光光度計中,以水為空白對照,在200~ 400 nm波長范圍內進行掃描,記錄紫外吸收光譜圖,見圖1。由圖1可見,地佐辛溶液在282 nm波長有特征吸收峰,故確定本實驗中地佐辛的測定波長為282 nm。
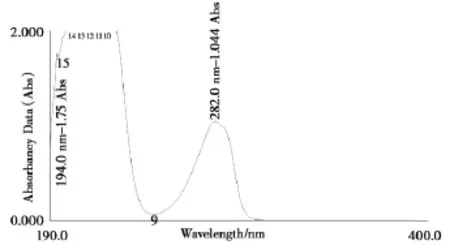
圖1 地佐辛紫外吸收光譜圖
2.3 色譜條件
色譜柱:Kromasil C18柱(250 mm×4.6 mm,5 μm);流動相:乙腈-三乙胺溶液(取水1 000 mL加三乙胺2.5 mL,用稀磷酸溶液(1→5)調pH值為3.0)(9∶91);流速:1.0 mL/min;柱溫:25℃;檢測波長:282 nm;進樣量:10 μL。地佐辛對照品、陰性對照液、5種配伍劑溶液和5種配伍液的色譜圖見圖2。由圖2可見,陰性對照液中的輔料和6種配伍劑溶液對配伍液中地佐辛的測定不產生干擾。
2.4 線性關系考察
分別精密量取200 μg/mL地佐辛對照品儲備溶液,加流動相配制成濃度分別為25.0,50.0,100.0,150.0,200.0 μg/mL的溶液。按“2.3”項下色譜條件測定峰面積。以峰面積(A)對質量濃度(C)進行線性回歸,得回歸方程:
A=12 169.26 C+2 627.078,
r=0.999 999,n=5。結果表明地佐辛在25.0~ 200.0 μg/mL濃度范圍內峰面積與質量濃度呈良好的線性關系。見圖3。
2.5 精密度試驗
取“2.4”項下濃度100.0 μg/mL的溶液,按照“2.3”項色譜條件重復進樣 6次,記錄峰面積,測得RSD=0.36%。結果表明,該方法精密度良好。

圖2 高效液相色譜圖注:A陰性對照液;B地佐辛對照品溶液;C生理氯化鈉溶液;D生理氯化鈉溶液配伍液;E乳酸林格氏注射液;F乳酸林格氏注射液配伍液;G 5%葡萄糖氯化鈉注射液;H 5%葡萄糖氯化鈉注射液配伍液;I 5%葡萄糖注射液;J 5%葡萄糖注射液配伍液;K 10%葡萄糖注射液;L 10%葡萄糖注射液配伍液;M 5-羥甲基糠醛對照品溶液;1地佐辛;2 5-羥甲基糠醛

圖3 地佐辛標準曲線
2.6 重復性試驗
取批號為 14033041的地佐辛注射液 5支(5 mg),按“2.1.2”項制備樣品溶液5份。按“2.3”項色譜條件分析測定,結果供試品中地佐辛平均含量為99.60%,RSD為0.78%,低于1.5%的要求。
2.7 回收率試驗
取已知含量的同批樣品 3份(14033041),分別取 2支(10 mg),再分別精密加入地佐辛對照品8 mg(80%),10 mg(100%),12 mg(120%),按“2.1.2”項制備溶液。按“2.3”項色譜條件測定,記錄色譜圖,用回歸方程計算,然后計算加樣回收率。結果表明,該含量測定方法回收率良好。見表1。
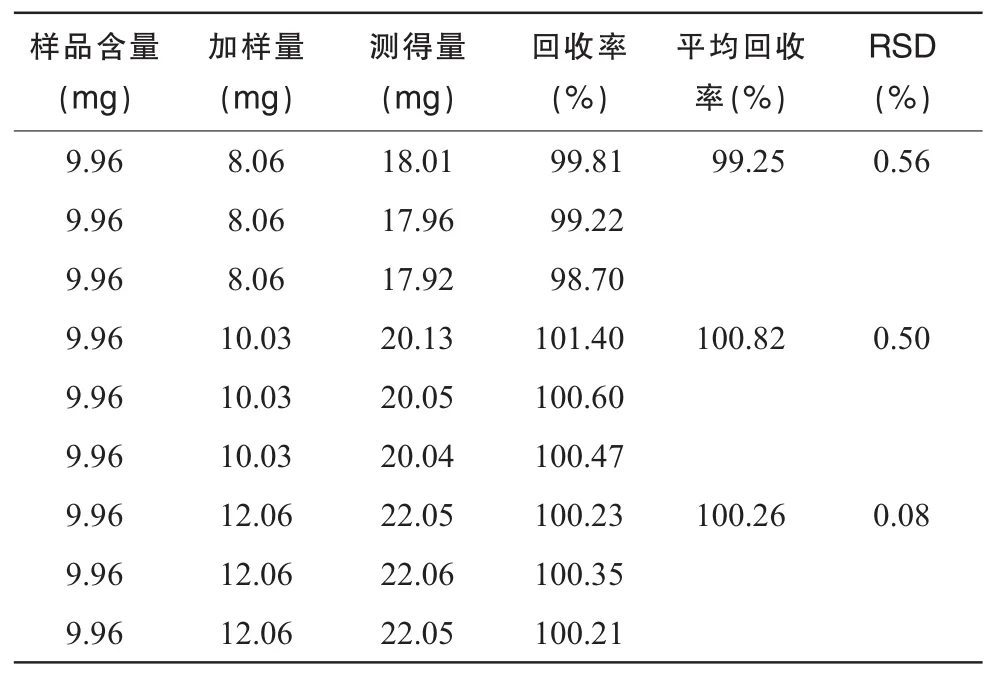
表1 回收率試驗結果(n=9)
2.8 含量測定
分別取批號為12030121,13102541,14033041的地佐辛注射液各5支(5 mg),按“2.1.2”項制備樣品溶液。按“2.3”項色譜條件測定,記錄色譜圖,按外標法以峰面積計算。結果見表2。
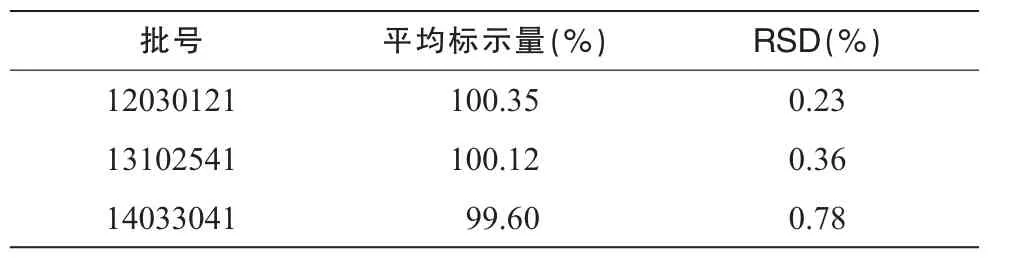
表2 樣品含量測定結果(n=5)
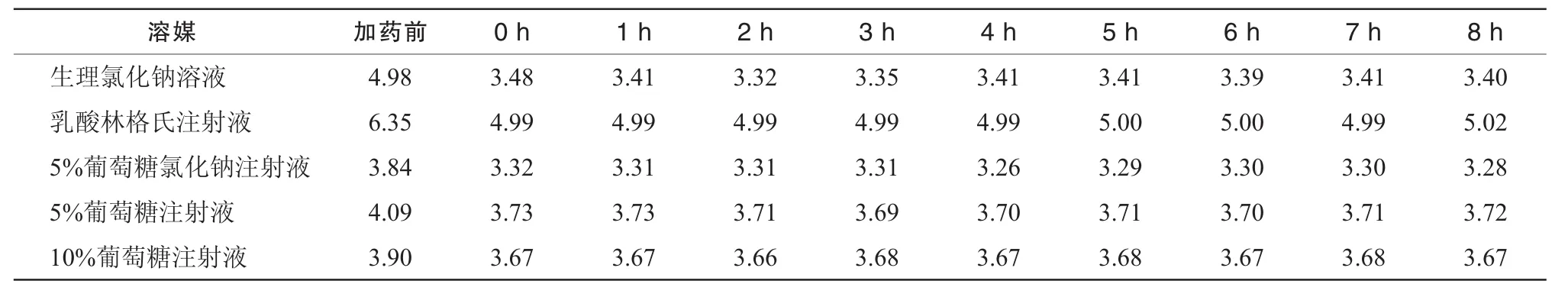
表3 5種配伍液在不同時間點的pH值測定結果
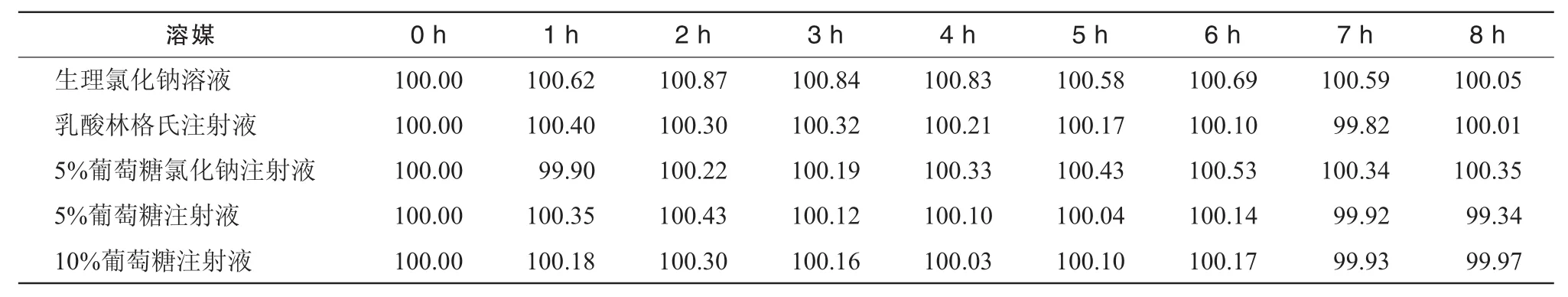
表4 5種配伍液中地佐辛的相對含量變化結果 (%)
2.9 配伍穩定性考察[5]
2.9.1 pH值變化情況 在室溫下測定5種輸液的pH值后,模擬臨床用藥,將地佐辛注射液 20 mg與生理氯化鈉溶液,乳酸林格氏注射液,5%葡萄糖氯化鈉注射液和5%,10%葡萄糖注射液各200 mL配伍后,在0,1,2,3,4,5,6,7,8 h時分別測定配伍液的pH值。因地佐辛注射液本身呈弱酸性,所以添加地佐辛注射液后的5種配伍液的pH值均有所下降,試驗結果見表3。結果表明5種含藥輸液的pH值在加藥后8 h內均未發生顯著變化。
2.9.2 地佐辛含量變化情況 在室溫(25±1)℃下,模擬臨床用藥,將地佐辛注射液20 mg與5種輸液各200 mL配伍后,在0,1,2,3,4,5,6,7,8 h時分別按照“2.1.3”項制備配伍溶液,測定配伍溶液放置不同時間地佐辛的含量。試驗結果見表4,結果表明5種含藥輸液的地佐辛含量均無顯著變化。2.9.3 5-羥甲基糠醛(5-hydroxymethyl furfural,5-HMF)含量的變化 按照文獻方法[6],取 5-HMF對照品適量,精密稱定,加水制成每1 mL中約含10 μg的溶液,取20 μL注入液相色譜儀,色譜條件同地佐辛含量測定。在此色譜條件下,5-HMF與地佐辛能夠很好地分離。經過考察,其精密度、穩定性、回收率試驗均符合要求。
在測定配伍液中地佐辛濃度的同時檢測5-HMF的含量。試驗結果見表5。
根據《中國藥典》2010年版規定:葡萄糖注射液中5-HMF“在284 nm的波長處測定,吸光度不得大于0.32”。有研究認為[7],《中國藥典》所規定的“吸光度不得大于 0.32”時相對應的 5-HMF濃度約為2 μg/mL,所有葡萄糖類注射液中5-HMF的限度應定為 2 μg/mL。本試驗結果表明3種含葡萄糖配伍液的5-HMF的吸光度均小于2 μg/mL,在限度控制范圍內,且在8 h內無顯著變化。
2.9.4 有關物質測定 取配伍溶液作為供試品溶液;另精密量取供試品溶液2.5 mL置100 mL量瓶中,加流動相稀釋至刻度作為對照溶液;按“2.3”項色譜條件測定,對照溶液以 20 μL進樣,調節檢測靈敏度,使地佐辛的峰高約為滿量程的20%;再取供試品溶液以20 μL進樣,記錄色譜圖至地佐辛峰保留時間的3.5倍,結果見表6。結果表明,供試品溶液色譜圖中雜質峰面積(5-HMF峰和溶劑峰除外)的和均小于對照溶液主峰面積(2.5%),未見有新物質峰出現。
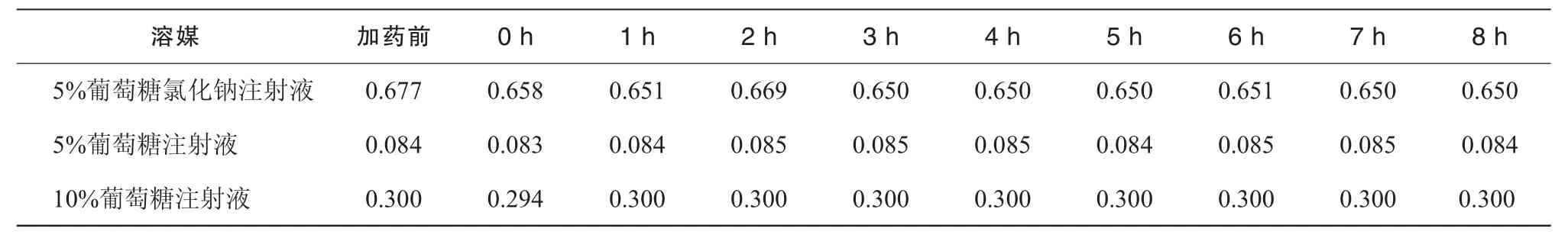
表5 3種含糖配伍液的5-HMF含量變化結果 (μg/mL)
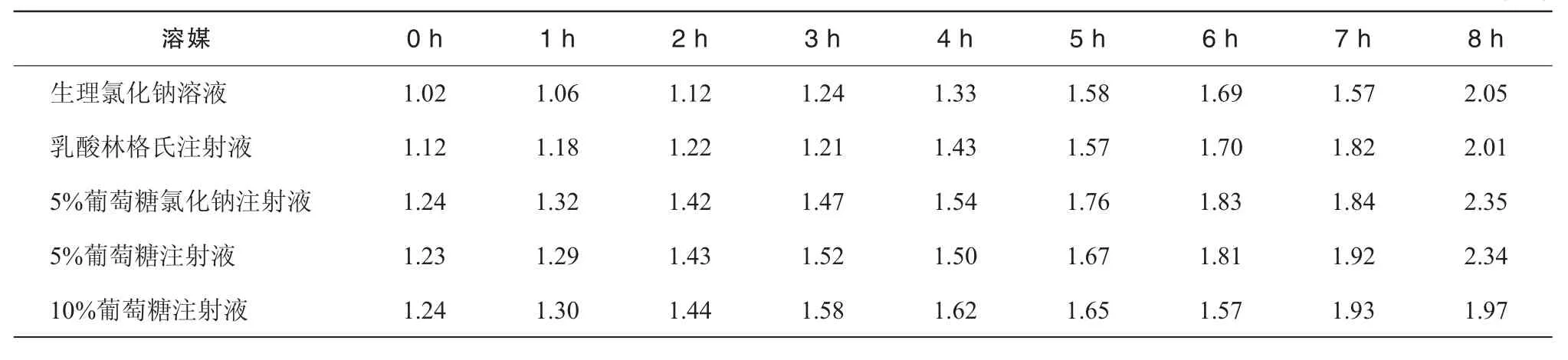
表6 5種配伍液中有關物質變化結果 (%)
2.9.5 溶液顏色變化和可見異物觀察 在0,1,2,3,4,5,6,7,8 h時分別用燈檢法檢查5種配伍液的顏色,并觀察有無可見異物。結果配伍液在8 h內顏色均無變化,亦無明顯可見異物,檢查結果符合規定。
3 討論
國家食品藥品監督管理總局批準的地佐辛注射液的試行標準(YBH09182006)中,地佐辛的含量采用分光光度在281 nm波長處測定。含糖輸液中5-HMF的最大吸收波長為284 nm,因此在研究地佐辛與含糖輸液的配伍時無法用分光光度法直接測定地佐辛的含量。本研究建立了地佐辛注射液含量的HPLC測定方法,方法簡便、準確、靈敏度高,可用于該藥品的含量測定。
5-HMF是葡萄糖等單糖化合物在高溫或弱酸等條件下脫水產生的一個醛類化合物,該化合物對人體橫紋肌和內臟有損害[7],而地佐辛注射液與含有葡萄糖的輸液所配溶液均呈弱酸性,在放置過程中可能會分解產生5-HMF。因此有必要檢測和控制5-HMF的含量。
試驗結果表明:地佐辛與5種輸液配伍液的pH值、主藥含量在前8 h變化不顯著,地佐辛與3種含葡萄糖輸液配伍液的5-HMF的含量在8 h內均在限度控制范圍內;經有關物質測定,不同時刻的HPLC色譜圖也未見有新物質色譜峰出現;地佐辛的5種配伍液在不同時間顏色無顯著變化,也無明顯可見異物,說明地佐辛與臨床5種常用輸液配伍在8 h內是相對穩定的。需要特別指出的是:藥品應遵照說明書使用,本試驗結果僅可為臨床特殊情況下使用地佐辛注射液提供參考。
[1] Loeniskar A,Greenblatt DJ,Zinny MA.Pharmacokinetics of dezocine,a new analgesic:effect of dose and route of administration[J].Eur J Clin Pharmacol,1986,30(1):121-123.
[2] O’Brien JJ,Benfield P.Dezocine a preliminary review of its pharmacodynamic and pharmacokinetic properties and therapeutic efficacy[J].Drugs,1989,38(2):226-248.
[3] 耿立成,李麗,馮潔.地佐辛藥理及臨床應用新進展[J].醫學綜述,2012,18(23):4029-4031.
[4] 柯秀容,王小芳.靜脈輸注地佐辛致260例不良反應分析[J].海峽藥學,2012,24(10):271.
[5] 劉光斌,趙麗萍,姜芳寧,等.注射用間苯三酚與6種常用輸液的配伍穩定性考察[J].中國藥房,2013,24(10):918-920.
[6] 曾令高.高效液相色譜法測定替硝唑葡萄糖注射液中5-羥甲基糠醛含量[J].中國藥業,2010,19(19):18-19.
[7] 何伍,凌霄.含葡萄糖注射液中5-羥甲基糠醛限度的檢測方法[J].中國醫藥工業雜志,2008,39(1):47-49.
Study on the Compatible Stability of Dezocine Injection in Commonly Used Infusions
Liu Guangbin,Renjie,He Miaomiao,Gao Ying(Department of Pharmacy of Jiugang Hospital,Gansu Jiayuguan 735100,China)
Objective:To study the compatible stability of dezocine injection dissolved in five commonly used infusions within 8 hours at a normal temperature.Methods:The content of compatible dezocine in the five transfusions were determined by HPLC and the pH values and 5-HMF of the solutions were also measured. Results:The pH values and 5-HMF and the effective components of dezocine dissolved in five infusions had basically no change within 8 hours.Conclusion:Dezocine injection was stable when compatible with 5 commonly used infusions within 8 hours.
Dezocine Injection;Compatibility;Stability;HPLC;Content
10.3969/j.issn.1672-5433.2015.11.003
2015-07-04)
劉光斌,男,主任藥師。研究方向:臨床藥學、醫院藥學。E-mail:jgyylgb@sina.com

