三七總皂苷對巨噬細胞分泌NO、TGF-β1、MMP-9的影響研究
祁 燕,袁嘉麗,萬春平,趙文娟,陳一紓,邢海晶
(1.云南中醫學院第一附屬醫院,云南昆明650000;2.云南中醫學院,云南昆明650500)
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一種氣流受限呈進行性發展,以氣道炎癥和氣道重建為主要特征,可以預防和治療的慢性肺部疾病。COPD氣道炎癥以中性粒細胞、巨噬細胞、CD8+T淋巴細胞浸潤為主,其中巨噬細胞作為參與氣道固有免疫應答的重要細胞,廣泛分布在肺泡內及支氣管表面,也是肺部接觸抗原較早、機會最多的免疫細胞,在氣道防御反應中發揮吞噬作用的同時也參與了氣道炎癥的形成[1]。氣道反復的慢性炎癥刺激導致氣道壁組織損傷和異常修復過程反復進行,在此異常修復過程中發生的氣道壁結構重構即氣道重建。氣道重建呈進行性發展,最終造成氣道狹窄、氣流受限。所以,防治炎癥是COPD長期以來的重點和難點。當巨噬細胞受到細菌內毒素等因素刺激時被激活會釋放一系列細胞因子如一氧化氮(NO)、轉化生長因子-β1(TGF-β1)、基質金屬蛋白酶-9(MMP-9)等參與 COPD氣道炎癥及氣道重建等病理過程[2-4]。三七總皂苷是我國名貴中藥三七的主要活性成分,其可加快血流速度,降低血液黏度,改善機體微循環;可緩解支氣管痙攣,抑制炎癥反應,改善肺泡通氣功能,促進慢性阻塞性肺疾病急性加重期(AECOPD)患者的恢復[5]。其用于治療COPD也獲明顯療效[6-7]。課題組前期動物實驗研究也表明,三七總皂苷可降低COPD模型大鼠血清中TGF-β1、MMP-9水平,從而達到緩解COPD發展進程中氣道炎癥及氣道重建的作用[8]。本研究以前期課題組用三七總皂苷干預COPD動物模型的療效為基礎,采用脂多糖(LPS)激活RAW264.7巨噬細胞構建COPD發病過程中氣道組織損傷的炎癥細胞模型,在細胞水平觀察三七總皂苷對巨噬細胞分泌及表達NO、MMP-9、TGF-β1的作用,以進一步探討三七總皂苷防治COPD發病過程中氣道炎癥及氣道重建的效應機制,為三七總皂苷臨床治療COPD提供實驗依據。
1 實驗資料
1.1 藥物 三七總皂苷(注射用血塞通)購自昆明制藥集團股份有限公司,400 mg/支,批號:100707。地塞米松注射液購自西南藥業股份有限公司,5 mg/支,批號:120721。
1.2 細胞 RAW264.7巨噬細胞購自中國科學院昆明細胞庫。
1.3 實驗試劑及儀器 RPMI-1640培養基購自GibcoBRL公司;胎牛血清購自Hyclone;總RNA提取試劑盒購自天根;逆轉錄試劑盒及SYBR Premix Ex TaqⅡ均購自TaKaRa;引物(TGF-β1,MMP-9)均由大連寶生物工程有限公司合成。恒溫CO2細胞培養箱(Trermo公司,型號:3111);ABI PCR儀(Gene公司,型號:Veriti);安捷倫核酸擴增熒光檢測儀(Gene公司,型號:MX3000P);Epoch連續波長酶標儀購自美國Bio-Tek公司。
1.4 方法
1.4.1 細胞培養 用含10%胎牛血清的1640培養基于37℃,5%CO2恒溫培養箱中常規培養RAW264.7巨噬細胞,細胞經傳代至4~5代,處于對數生長期時進行實驗。
1.4.2 MTT法測定三七總皂苷對RAW264.7細胞增殖的影響 RAW264.7細胞以1×109L-1接種于96孔板,每孔100 μL。細胞分為 3組:三七總皂苷組每孔加入不同濃度的三七總皂苷藥液(10,30,100,300,900,2700 μg/mL),地塞米松組每孔加入100 μg/mL地塞米松,正常對照組以1640培養基正常培養。每組3個復孔,以37℃、5%CO2培養24 h后每孔加入終濃度5 mg/mL MTT,繼續培養4 h,小心吸棄上清,每孔加入150 μL DMSO,震蕩10 min后在酶標儀上570 nm處測各孔的吸光值(OD)。
1.4.3 Griess法測定RAW264.7細胞培養上清液中NO的含量 RAW264.7細胞分為正常對照組(以1640培養基正常培養)、LPS組(1 μg/mL LPS)、LPS+三七總皂苷不同濃度組(1 μg/mL LPS+10,30,100,300 μg/mL 三七總皂苷)、LPS+地塞米松組(1 μg/mL LPS+100 μg/mL地塞米松)。細胞以1×109L-1接種于96孔板,每孔100 μL,每組重復3孔,同時按照分組加入對應濃度藥物50 μL置于37℃,5%CO2培養箱中孵育1 h 后,再加入1 μg/mL LPS 50 μL 以激活 RAW264.7 細胞。24 h后收取細胞培養上清,置于-20℃待測。檢測時以50 μL培養液上清與100 μL Griess混合試劑[1%對氨基苯磺酸溶液+0.1%N-(1-萘基)乙二胺二鹽酸鹽溶液等體積]充分混合、振搖10 min,酶標儀上540 nm處測量吸光度。根據標準曲線計算NO釋放量。
1.4.4 RAW264.7細胞培養上清液中 TGF-β1、MMP-9含量檢測 細胞分組及給藥同1.4.3,取細胞培養上清后按照酶聯免疫(ELISA)試劑盒說明書檢測上清中 TGF-β1及MMP-9含量。
1.4.5 實時熒光定量PCR檢測 RAW264.7細胞TGF-β1mRNA、MMP-9mRNA水平 RAW264.7細胞以1×109L-1接種于6孔板,每孔1 mL。細胞分組及給藥同1.4.3,細胞培養24 h后每孔細胞加入1 mL trizol提取試劑提取細胞總RNA,按TaKaRa逆轉錄試劑盒說明書操作合成cDNA,采用SYBR GreenI嵌合熒光法于熒光定量PCR儀中進行擴增,以小鼠β-actin基因為內參對照。反應體系為:SYBR Premix Ex TaqⅡ12.5 μL ,Primer F 1 μL,Primer R 1 μL,cDNA 2μL,ddH2O 8.5 μL 擴增條件:95 ℃ 30 s,95 ℃ 5 s,62℃ 30 s,共40個循環。實驗設置3個平行復孔,并重復3次實驗,取平均值。用2-ΔΔCT計算基因相對表達量。根據基因庫中基因序列設計TGF-β1、MMP-9基因及內參基因β-actin引物,各基因引物序列見表1。
1.5 統計學方法 所有實驗數據采用SPSS 17.0統計軟件包處理。均值間差異比較采用t檢驗或單因素方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 各組RAW264.7細胞增殖情況 三七總皂苷在10~300 μg/mL范圍內細胞增殖情況與正常對照組比較差異無統計學意義,900 μg/mL和2700 μg/mL細胞增殖情況與正常對照組比較差異有統計學意義(P均<0.01),見表2。提示三七總皂苷在10~300 μg/mL范圍內對細胞無毒性作用,可在此劑量范圍內進行實驗。

表1 Q-PCR引物序列
表2 各組RAW264.7細胞增殖情況(±s)
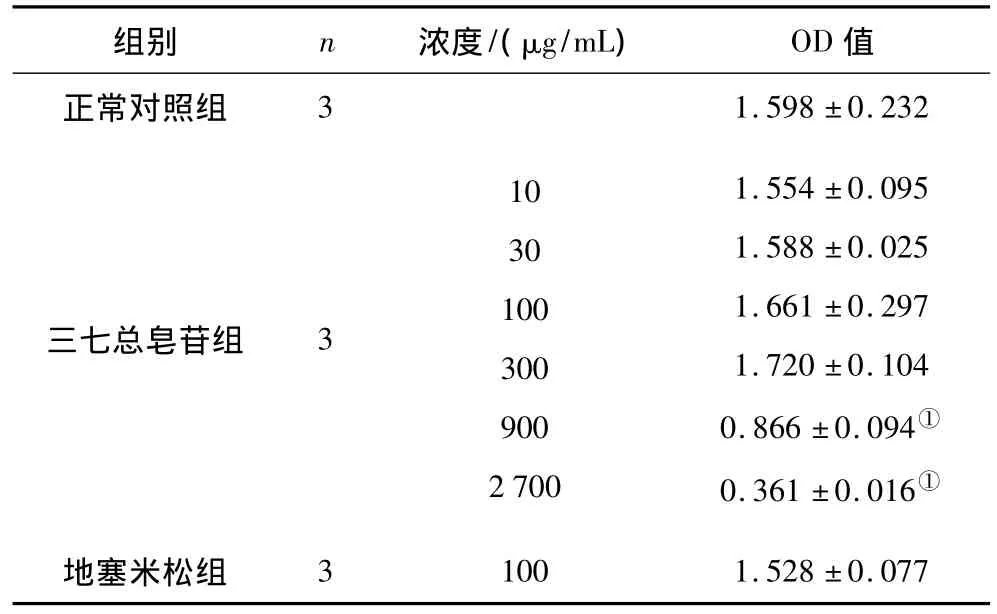
表2 各組RAW264.7細胞增殖情況(±s)
注:①與正常對照組比較,P<0.01。
組別 n 濃度/(μg/mL) OD值正常對照組31.598 ±0.232三七總皂苷組 3103010030090027001.554 ±0.0951.588 ±0.0251.661 ±0.2971.720 ±0.1040.866 ±0.094①0.361 ±0.016①地塞米松組31001.528 ±0.077
2.2 各組RAW264.7細胞NO釋放情況 LPS組細胞培養液中NO含量顯著高于正常對照組(P<0.01)。三七總皂苷100,300 μg/mL組和地塞米松組細胞培養液中NO含量顯著低于LPS組(P均<0.01)。見表3。
表3 各組RAW264.7細胞NO釋放情況(±s)
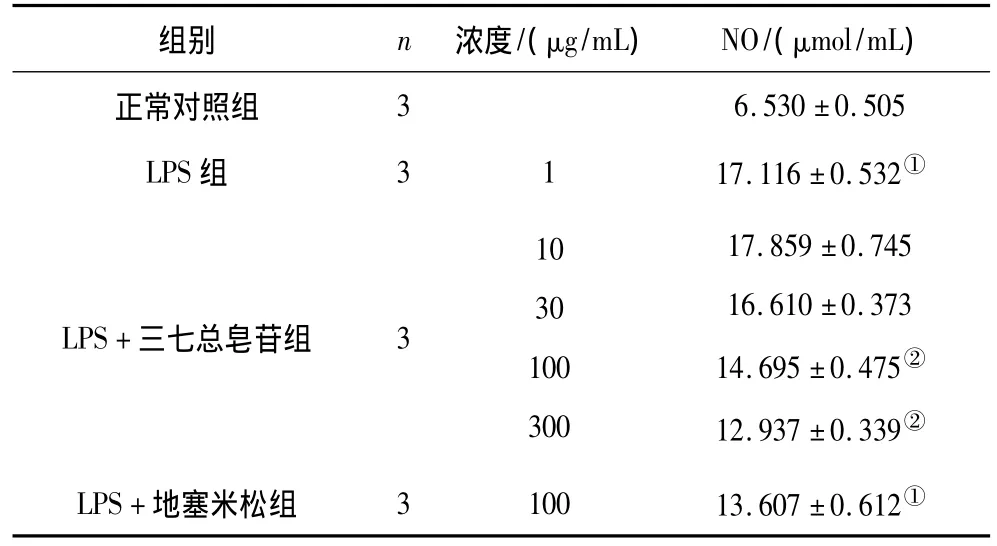
表3 各組RAW264.7細胞NO釋放情況(±s)
注:①與正常對照組比較,P <0.01;②與 LPS組比較,P <0.01。
組別 n 濃度/(μg/mL) NO/(μmol/mL)正常對照組36.530 ±0.505 LPS 組 3117.116 ±0.532①LPS+三七總皂苷組 3103010030017.859 ±0.74516.610 ±0.37314.695 ±0.475②12.937 ±0.339②LPS+地塞米松組 310013.607 ±0.612①
2.3 各組RAW264.7細胞上清中TGF-β1、MMP-9分泌情況 LPS組細胞培養液中TGF-β1、MMP-9含量顯著高于正常對照組(P<0.05或P<0.01)。LPS+三七總皂苷100,300 μg/mL組及LPS+地塞米松組細胞培養液中TGF-β1含量顯著低于LPS組(P均<0.05);LPS+三七總皂苷300 μg/mL組、LPS+地塞米松組細胞培養液中MMP-9含量顯著低于 LPS組(P<0.01或P<0.05)。見表4。
2.4 各組RAW264.7細胞TGF-β1mRNA、MMP-9mRNA表達情況 檢測所提取樣本總 RNA A260/A280在1.8~2.0,RNA較純,無蛋白質污染,內參及目的基因標準曲線相關系數大于0.99,擴增效率90%~120%,內參及目的基因溶解曲線峰形單一,擴增產物特異性較好。Real-time PCR檢測結果顯示,LPS組中TGF-β1mRNA、MMP-9 mRNA的表達量明顯高于正常對照組(P均<0.05)。LPS+三七總皂苷300 μg/mL組、LPS+地塞米松組MMP-9 mRNA表達量明顯低于 LPS組(P均 <0.05);LPS+三七總皂苷100,300 μg/mL組及LPS+地塞米松組TGF-β1mRNA表達量明顯低于LPS組(P<0.05或P<0.01)。見表5。
表4 各組RAW264.7細胞上清中TGF-β1、MMP-9分泌情況(±s)
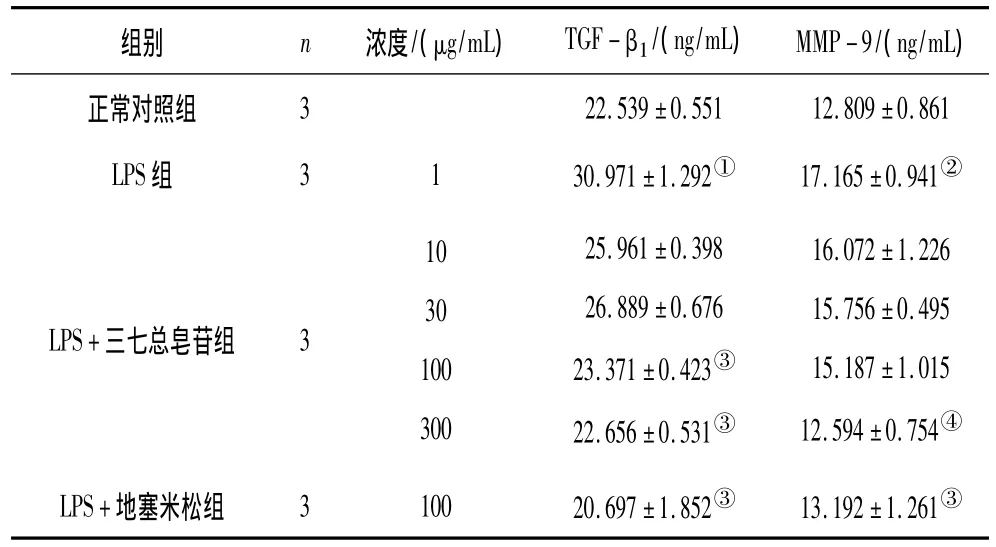
表4 各組RAW264.7細胞上清中TGF-β1、MMP-9分泌情況(±s)
注:①與正常對照組比較,P<0.05;②與正常對照組比較,P<0.01;③與 LPS組比較,P <0.05;④與 LPS組比較,P <0.01。
組別 n 濃度/(μg/mL) TGF-β1/(ng/mL) MMP-9/(ng/mL)正常對照組322.539±0.55112.809±0.861 LPS組 3130.971±1.292① 17.165±0.941②LPS+三七總皂苷組 3103010030025.961±0.39826.889±0.67623.371±0.423③22.656±0.531③16.072±1.22615.756±0.49515.187±1.01512.594±0.754④LPS+地塞米松組 310020.697±1.852③ 13.192±1.261③
表5 各組RAW264.7細胞TGF-β1mRNA、MMP-9 mRNA表達情況(±s)
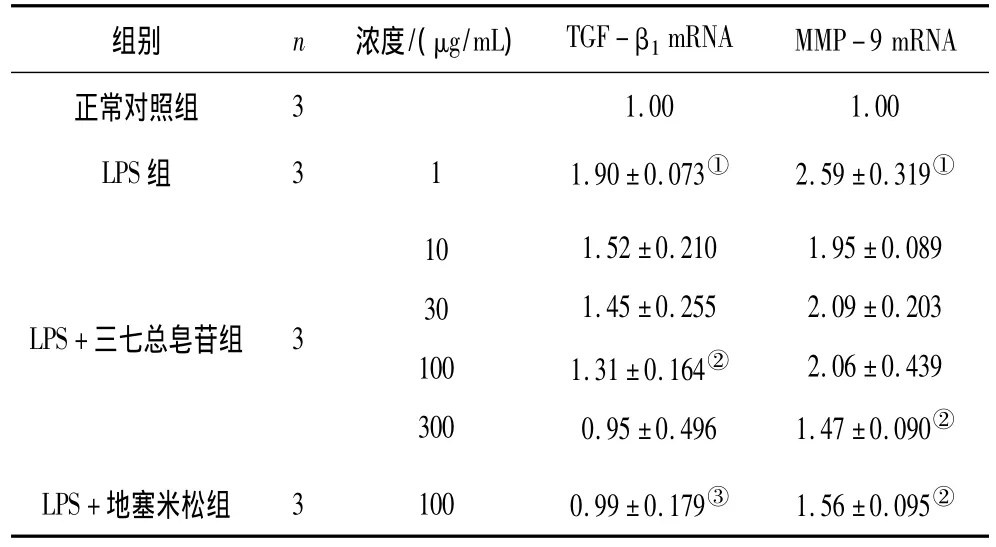
表5 各組RAW264.7細胞TGF-β1mRNA、MMP-9 mRNA表達情況(±s)
注:①與正常對照組比較,P<0.05;②與 LPS組比較,P<0.05;③與 LPS組比較,P <0.01。
組別 n 濃度/(μg/mL) TGF-β1mRNA MMP-9 mRNA正常對照組31.001.00 LPS組 311.90±0.073① 2.59 ±0.319①LPS+三七總皂苷組 310301003001.52±0.2101.45 ±0.2551.31±0.164②0.95 ±0.4961.95 ±0.0892.09 ±0.2032.06 ±0.4391.47 ±0.090②LPS+地塞米松組 31000.99±0.179③ 1.56±0.095②
3 討論
巨噬細胞的激活是炎癥反應的重要環節,LPS等激活巨噬細胞后在酶的催化下合成過量的NO[9],可介導并放大炎癥反應,促進肺組織的炎性滲出及肺泡的損傷。研究報道COPD患者NO的生成及釋放增多,測定NO升高可提示存在氣道炎癥[10]。巨噬細胞激活后分泌過高的MMP-9對炎性細胞有趨化作用,可促進炎癥發展,更為重要的是MMP-9可降解細胞外基質,使肺泡結構破壞,參與COPD氣道重建過程,導致氣流阻塞。對COPD動物模型及COPD患者的研究表明,其體內肺組織、血液中MMP-9表達水平均升高[11-12]。此外巨噬細胞分泌的TGF-β1是氣道重建的主要調控因子[13],其表達增高,可引起氣道上皮細胞損傷,誘導成纖維細胞向肌成纖維細胞轉化,肌成纖維細胞具有更強的膠原合成活性,故促進氣道膠原沉積和基底膜增厚,促進結締組織蛋白合成[14-16],在氣道重建中發揮重要作用,最終可導致氣道狹窄和不可逆的肺功能改變。因此,能拮抗巨噬細胞分泌NO、MMP-9、TGF-β1的藥物可能減輕氣道炎癥反應,延緩氣道重建過程,減緩COPD的發病。
本研究通過MTT法檢測發現三七總皂苷在10~300 μg/mL范圍內未對細胞產生明顯毒性作用;未經LPS刺激的正常對照組NO、MMP-9、TGF-β1分泌較少,且 MMP-9、TGF-β1mRNA 表達較低,加入 LPS刺激后,NO、MMP-9、TGF-β1釋放量顯著增加,MMP-9、TGF-β1mRNA表達亦上調,表明LPS能夠誘導RAW264.7巨噬細胞過度激活,釋放炎癥相關遞質。經三七總皂苷干預后,三七總皂苷100 μg/mL組和300 μg/mL組與 LPS組相比,NO、MMP -9、TGF - β1含量均降低 ,MMP-9、TGF-β1mRNA表達亦明顯下調,提示三七總皂苷能夠從細胞水平和轉錄水平上抑制 LPS誘導的RAW264.7巨噬細胞分泌的功能。
綜上所述,三七總皂苷可能是通過下調 NO、TGF-β1、MMP-9的表達抑制巨噬細胞產生的炎癥反應,從而推測此途徑可能是其臨床治療COPD獲效的作用機制之一,而要明確三七總皂苷治療COPD的分子調控體系、信號轉導通路尚需進一步深入研究,這也是今后積極研究的方向。
[1] 常嘉琛,焦宗憲.肺泡巨噬細胞及其相關細胞因子與慢性阻塞性肺疾病相互關系研究進展[J].國際呼吸雜志,2012,32(21):1641-1645
[2] 王月州.COPD患者治療前后血清NO、NOS和GM-CSF檢測的臨床意義[J].放射免疫學雜志,2011,24(6):631-633
[3] 李若葆,王菁,李洪先,等.COPD模型大鼠肺組織TGF-β1的表達及意義[J].山東醫藥,2008,48(13):7-8
[4] 畢輝,李玲玲,姚欣.sirtuin-1在肺泡巨噬細胞金屬基質蛋白酶9表達中作用[J].南京醫科大學學報:自然科學版,2014,34(8):1015-1018
[5] 徐勇.三七總皂苷在AECOPD治療中的臨床應用[J].臨床肺科雜志,2013,18(3):515 -522
[6] 周愛珠.三七總皂苷注射液治療慢性阻塞性肺疾病急性加重期療效觀察[J].中華實用診斷與治療雜志,2013,27(7):696-698
[7] 吉冬元,孟慶華,李承紅.三七總皂苷片改善慢性阻塞性肺疾病穩定期患者生活質量的研究[J].湖北中醫雜志,2010,32(2):7-8
[8] 吳敏.益氣活血法對OOPD模型大鼠氣道重塑調節作用的初步研究[D].昆明:云南中醫學院,2013
[9] 何濤,陳宏輝,王正根.埃索美拉唑抑制LPS誘導小鼠巨噬細胞產生 NO 和 PGE2[J].免疫學雜志,2014,30(1):61-64
[10] 劉紅艷,趙卉.慢性阻塞性肺疾病患者呼出氣一氧化氮測定的臨床意義[J].安徽醫學,2013,34(8):1115-1117
[11] Yao H,Hwang JW,Sundar IK,et al.SIRT1 redresses the imbalance of tissue inhibitor of matrix metalloproteinase-1 and matrix metalloproteinase-9 in the development of mouse emphysema and human COPD[J].Am J Physiol Lung Cell Mol Physiol,2013,305(9):615
[12] Kobayashi S,Fujinawa R,Ota F,et al.A single dose ofLipopolysaccharide into mice with emphysema mimics human chronic obstructive pulmonary disease exacerbation as assessed by micro-computed tomography[J].Am J Respir Cell Mol Biol,2013,49(6):971
[13] Chen M,Lv Z,Huang L,et al.Triptolide inhibits TGF - β1- induced cell proliferation in rat airway smooth muscle cells by suppressing Smad signaling[J].Exp Cell Res,2015,331(2):362-368
[14] Kohan M,Bader R,Puxeddu I,et al.Enhanced osteopontin expression in a murine model of allergen-induced airway remodeling[J].Clin Exp Allergy,2007,37(10):1444 -1454
[15] Doherty T,Broide D.Cytokines and growth factors in airway remodeling in asthma[J].Curr Opin Immunol,2007,19(6):676 - 680
[16] Bhaskaran M,Kolliputi N,Wang Y,et al.Trans-differentiation of alveolar epithelial typeⅡcells to typeⅠcells involves autocrine signaling by transforming growth factor betal through the smad pathway[J].Biol Chem,2007,282(6):3968 -3976

