全氟化合物對(duì)水生植物的生態(tài)效應(yīng)研究Ⅱ—金魚藻對(duì)水中PFOS的生物富集及生理響應(yīng)
孔瀟瀟,王鐵宇,張曉軍,蔣曌澤,周云橋,李奇鋒,孟晶,朱朝云
1. 牡丹江師范學(xué)院生命科學(xué)與技術(shù)學(xué)院,牡丹江 157012 2. 中國(guó)科學(xué)院生態(tài)環(huán)境研究中心城市與區(qū)域生態(tài)國(guó)家重點(diǎn)實(shí)驗(yàn)室,北京 100085 3. 中國(guó)科學(xué)院大學(xué),北京 100049
全氟化合物對(duì)水生植物的生態(tài)效應(yīng)研究Ⅱ—金魚藻對(duì)水中PFOS的生物富集及生理響應(yīng)
孔瀟瀟1,2,王鐵宇2,*,張曉軍1,#,蔣曌澤1,2,周云橋2,3,李奇鋒2,3,孟晶2,3,朱朝云2,3
1. 牡丹江師范學(xué)院生命科學(xué)與技術(shù)學(xué)院,牡丹江 157012 2. 中國(guó)科學(xué)院生態(tài)環(huán)境研究中心城市與區(qū)域生態(tài)國(guó)家重點(diǎn)實(shí)驗(yàn)室,北京 100085 3. 中國(guó)科學(xué)院大學(xué),北京 100049
為探究全氟化合物對(duì)水生植物的生態(tài)效應(yīng),選擇金魚藻(Ceratophyllum demersum L.)為受試生物,設(shè)定5、100、1 000、10 000、50 000、100 000 μg·L-1以及對(duì)照共7個(gè)PFOS濃度梯度進(jìn)行水培,分析包括超氧化物歧化酶(SOD)、過(guò)氧化氫酶(CAT)、過(guò)氧化物酶(POD)在內(nèi)的抗氧化系統(tǒng)酶和細(xì)胞色素含量等生理響應(yīng)特征,并研究金魚藻對(duì)PFOS的生物有效性及富集能力。結(jié)果表明:金魚藻對(duì)PFOS的富集量最高可達(dá)3 180 mg·kg-1dw,最大富集系數(shù)高達(dá)40.7倍,可作為PFOS污染水體植物修復(fù)的遴選物種。隨PFOS濃度升高,SOD活力總體上沒有明顯變化,但POD活力表現(xiàn)為雙重效用,即低濃度促進(jìn)酶活力積累,而高濃度抑制酶活力積累。CAT活力在低濃度組(0、5、100、1 000 μg·L-1),未表現(xiàn)出明顯異常,在高濃度組(10 000、50 000、100 000 μg·L-1),出現(xiàn)先升高后降低的趨勢(shì)。色素含量也反應(yīng)較為敏感,低濃度處理后色素含量升高,高濃度處理則導(dǎo)致色素含量先升高后降低,最高濃度處理下一直處于較低水平,可作為評(píng)價(jià)PFOS污染水體的生理敏感性指標(biāo)。
全氟化合物;金魚藻;PFOS生物有效性;抗氧化系統(tǒng);生態(tài)效應(yīng)
全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)及其鹽類是一類含氟持久性有機(jī)物,具有性質(zhì)穩(wěn)定、不易降解等特點(diǎn),已成為全球性普遍關(guān)注的新型污染物,并在全球范圍內(nèi)均有不同程度地有檢出[1-4]。鑒于PFOS存在的廣泛性和對(duì)環(huán)境的危害性,2000年12月,3M公司發(fā)布了停止生產(chǎn)全氟類有機(jī)磺酸鹽的公告[5]。2006年12月,歐洲議會(huì)和部長(zhǎng)理事會(huì)聯(lián)合發(fā)布《關(guān)于限制全氟辛烷磺酸銷售及使用的指令》(2006/122/EC)。2009年5月,《關(guān)于持久性有機(jī)污染物的斯德哥爾摩公約》將全氟辛烷磺酸及其鹽類列入持久性有機(jī)污染物(POPs)優(yōu)控名單[6]。國(guó)外PFOS的生產(chǎn)量在2000年以后已明顯下降,但我國(guó)的生產(chǎn)量卻在2002-2006年間呈增加趨勢(shì),目前我國(guó)每年的PFOS產(chǎn)量在100 t左右。由于PFOS相比其他類POPs具有一定的弱水溶性,因此水體成為PFOS賦存和傳輸?shù)闹匾d體。已有研究表明,在世界范圍內(nèi)的海水、地表水和飲用水等都檢測(cè)到了PFOS的污染。其中,現(xiàn)有數(shù)據(jù)中污染最嚴(yán)重的是多倫多Etobicoke河,濃度高達(dá)2.2 mg·L-1[7],我國(guó)黃河、長(zhǎng)江、渤海、大遼河、淮河等幾大流域,水體、土壤、沉積物中均檢出較高水平的PFOS[8-11],香港近海域、珠江三角洲,包括南海以及韓國(guó)海域海水中PFOS濃度范圍分別為0.09~3.1 ng·L-1,0.02~12 ng·L-1,0. 04~730 ng·L-1[12-13]。
目前,國(guó)內(nèi)外對(duì)PFOS的研究主要集中在水環(huán)境以及魚、蝦、蟾蜍、海豚、水鳥等動(dòng)物層面[14-17],對(duì)植物的研究也多集中于陸生植物如小麥、萵苣、玉米、胡蘿卜、土豆等體內(nèi)PFOS含量測(cè)定[18-23],有關(guān)水生植物對(duì)PFOS富集和生態(tài)效應(yīng)的研究極為匱乏。金魚藻是華北水系普遍存在的水生植物優(yōu)勢(shì)物種,因此本研究選用該類沉水生植物為對(duì)象,通過(guò)分析金魚藻對(duì)PFOS的吸收及抗氧化系統(tǒng)反應(yīng),研究金魚藻對(duì)PFOS的生物有效性及富集效果,以期為水環(huán)境中PFOS生態(tài)風(fēng)險(xiǎn)評(píng)價(jià)及污染水體修復(fù)提供理論依據(jù)。
1 材料與方法(Materials and methods)
1.1 實(shí)驗(yàn)材料
金魚藻取自沭陽(yáng)縣蘇怡花卉園藝場(chǎng)水草培養(yǎng)池塘,首先對(duì)金魚藻進(jìn)行挑選,選擇長(zhǎng)勢(shì)相同,莖粗為(0.8±0.1) mm,長(zhǎng)度為(20±1) cm的金魚藻用于馴養(yǎng)。實(shí)驗(yàn)前,金魚藻在測(cè)試溫度為(25±2) ℃下的0.1 Hoagland培養(yǎng)液中實(shí)驗(yàn)室馴養(yǎng)2周。
1.2 實(shí)驗(yàn)儀器與試劑
實(shí)驗(yàn)儀器:為高效液相色譜(Agilent 1200型,美國(guó))/質(zhì)譜(SCIEX 3000型,美國(guó))聯(lián)用儀(HPLC/MS-MS)、酶標(biāo)儀(SPECTRAmax190,美國(guó))、紫外可見光分光光度計(jì)(UV-1700,日本島津)、氮吹儀(Organomation,美國(guó))等。
試劑:ENVI-carb(Supelco公司,美國(guó))、Florisi SPE(Supelco公司,美國(guó))、全氟辛烷磺酸鹽(98%,Matrix Scientific公司,美國(guó))、同位素標(biāo)記物為13C4PFOS(98% Wellington實(shí)驗(yàn)室,加拿大)、色譜級(jí)甲醇、四丁基硫酸氫銨(TBAHS)、甲基叔丁基醚(MTBE)和醋酸鈉(J.T.Baker公司,美國(guó))。
1.3 實(shí)驗(yàn)處理
根據(jù)預(yù)實(shí)驗(yàn)條件分析和Felizeter等有關(guān)PFOS脅迫對(duì)水培生菜的已有報(bào)道,本研究共設(shè)6個(gè)實(shí)驗(yàn)組和1個(gè)空白對(duì)照組,并設(shè)置為0、5、100、1 000 μg·L-1的低濃度組和10 000、50 000、100 000 μg·L-1的高濃度組,每組設(shè)3個(gè)平行。在配制好的0.1 Hoagland溶液中加入用去離子水沖洗3次并晾干表面的金魚藻,密度為8 L的0.1 Hoagland溶液內(nèi)25棵金魚藻,置于(28±2) ℃溫室內(nèi)培養(yǎng),用無(wú)菌培養(yǎng)容器封口膜(12 cm×12 cm)將實(shí)驗(yàn)容器10 L廣口瓶封口。通入潔凈的中空玻璃管,內(nèi)徑1 cm,長(zhǎng)50 cm。光照14 h:10 h,光強(qiáng)260~350 μmol·m-2·s-1,水深(25±0.5) cm相對(duì)濕度60%~70%,每天充氣12 h。試驗(yàn)開始前先在樣品未分組時(shí)隨機(jī)取樣測(cè)定每組樣品各項(xiàng)指標(biāo)的初始值,初始值是植物分剪前的狀態(tài),可反映植物馴化后的最初生長(zhǎng)狀況。另外在分剪過(guò)程中植物會(huì)被從培養(yǎng)液中取出,受光照、溫度、濕度等外界因素影響,植物會(huì)出現(xiàn)少量失水或人為機(jī)械損傷,致使初始值與0處理的0天有差異。因此設(shè)定0處理的第0天作為分揀后的初始樣品,試驗(yàn)過(guò)程中每日記錄金魚藻的表觀狀況,于每日9時(shí)每瓶取出金魚藻4棵,剪碎后稱重并用于其他各項(xiàng)指標(biāo)測(cè)定。
1.4 分析方法
1.4.1 生理生化指標(biāo)測(cè)定前處理
將培養(yǎng)后的金魚藻小心取出,用去離子水沖洗3次,甲醇沖洗1次,而后用濾紙陰干表面后液氮冷凍,放入研缽加入9倍體積的0.1 PBS緩沖液(pH=7.4),手動(dòng)冰浴研磨后將勻漿液放入離心管中,在4 ℃、3 500 r·min-1條件下離心10 min,取上清液置于-80 ℃冰箱待測(cè)。采用丙酮提取法測(cè)定葉綠素含量,氮藍(lán)四唑(NBT)還原法測(cè)定超氧化物歧化酶(SOD)活性,愈創(chuàng)木酚顯色法測(cè)定過(guò)氧化物酶(POD)活性,紫外吸收法測(cè)定過(guò)氧化氫酶(CAT)活性。
1.4.2 植物體PFOS的提取與凈化
用甲醇淋洗20 s后去離子水沖洗3次,在濾紙上陰干用鋁箔紙包裹,冷凍干燥后研磨成粉末。稱取0.2 g干燥的植物樣于50 mL的聚丙烯離心管中,加入5 ng PFOS內(nèi)標(biāo),2 mL氫氧化鈉溶液(0.4 mol·L-1),渦旋后置于冰箱過(guò)夜。然后依次加入1 mL TBAHS(0.5 mol·L-1)、2 mL碳酸鈉-碳酸氫鈉緩沖液(0.25 mol·L-1)渦旋,5 mL MTBE,700 r·min-1條件下震動(dòng)5 min,超聲10 min,3 000 r·min-1條件下離心10 min,轉(zhuǎn)移上清液,用5 mL MTBE重復(fù)2次,共收集15 mL MTBE,高純氮?dú)獯抵? mL。取Florisil SPE小柱,用5 mL的甲醇、5 mL的MTBE對(duì)其活化。將1 mL樣品通過(guò),并用甲醇沖洗聚丙烯離心管3次,用5 mL的MTBE沖洗Florisil SPE柱,用5 mL的甲醇MTBE溶液(30:70,V:V )洗脫小柱并收集。將收集到的到的溶液氮吹至1 mL。最后通過(guò)ENVI-Carb小柱凈化,首先用1 mL甲醇沖洗ENVI-Carb小柱,重復(fù)3次,然后將1 mL的樣品通過(guò),用1 mL甲醇沖洗聚丙烯管,沖洗3次,同樣甲醇沖洗小柱3次,速度始終控制在1滴每秒,共收集樣液10 mL。用高純氮?dú)獯抵? mL,0.2 μm的尼龍濾膜過(guò)濾,分液待上機(jī)。
1.5 質(zhì)量保證與控制
為了最大限度地降低PFOS污染,實(shí)驗(yàn)所用器皿均先用自來(lái)水洗凈,用甲醇沖洗3遍后,再用去離子水沖洗3次。每批樣品中加1個(gè)方法空白,方法空白不加植物樣,但加入相同量的回收率指示物,按與樣品相同的步驟進(jìn)行分析。每個(gè)濃度設(shè)定0 μg·L-1為對(duì)照組,樣品分揀前測(cè)定植物樣品各項(xiàng)指標(biāo)的初始值。
1.6 數(shù)據(jù)處理方法
數(shù)據(jù)處理和圖表制作采用Excel 2010,所有結(jié)果為3次重復(fù)數(shù)據(jù)的平均值,差異顯著性采用SAS 8.0的One-way ANOVA (Ducan法)進(jìn)行檢驗(yàn),顯著性水平為P<0.05。
2 結(jié)果與分析(Results and analysis)
2.1 金魚藻對(duì)PFOS的生物富集特征
金魚藻在水體PFOS脅迫處理后,不同濃度不同時(shí)間處理?xiàng)l件下表現(xiàn)出不同的生物富集程度,隨溶液PFOS濃度的增高,金魚藻體內(nèi)PFOS積累量呈持續(xù)增長(zhǎng)態(tài)勢(shì)(表1),在初始的第0天金魚藻體內(nèi)均檢測(cè)到PFOS存在,其值為(4.05~7.60 ng·g-1dw,均值5.29 ng·g-1dw)。低濃度PFOS處理(5、100、1 000 μg·L-1)之間沒有較大差異,但均顯著低于高濃度PFOS處理組(10 000、50 000、100 000 μg·L-1),高濃度組各處理間均存在不同程度的顯著性差異(P<0.05)。各植株之間PFOS初始含量均保持在4.05~7.60 μg·kg-1dw范圍,并隨水培溶液中PFOS濃度的遞增而呈增加態(tài)勢(shì),金魚藻體內(nèi)PFOS含量呈直線性增長(zhǎng),無(wú)拐點(diǎn)出現(xiàn)(表2)。其中,高濃度組在第4天金魚藻中PFOS含量降低,葉片出現(xiàn)萎蔫現(xiàn)象。但第5、6天含量又逐步回升。此外,金魚藻PFOS富集量在培養(yǎng)液濃度為100 000 μg·L-1時(shí)的第3天出現(xiàn)最高值(3 180 mg·kg-1dw),富集系數(shù)為31.7,在培養(yǎng)液PFOS濃度為50 000 μg·L-1時(shí)的第6天富集量為2 040 mg·kg-1dw,富集系數(shù)達(dá)到最高值(40.74)。可以看出,在PFOS污染水體的植物修復(fù)中,金魚藻具有潛在的應(yīng)用價(jià)值。
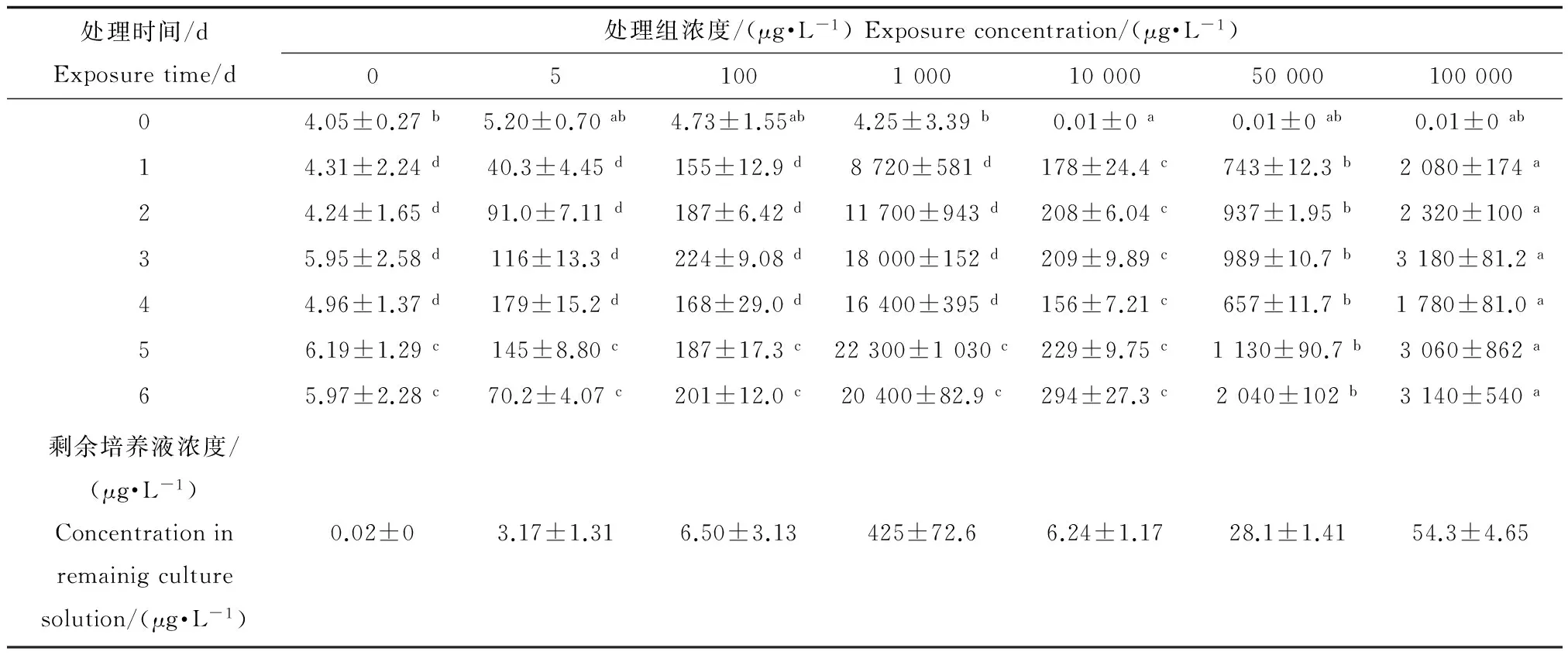
表1 不同處理時(shí)間下金魚藻體內(nèi)PFOS的含量Table 1 PFOS concentrations in Ceratophyllum demersum at different treatments
注:表中數(shù)據(jù)為3個(gè)重復(fù)的平均值±標(biāo)準(zhǔn)差;橫排不同字母標(biāo)注(a,b,c,d)為顯著差異(P<0.05),低濃度處理(0、5、100、1 000 μg·L-1)金魚藻體內(nèi)PFOS含量單位為μg·kg-1(干重),高濃度處理(10 000、50 000、100 000 μg·L-1)單位為mg·kg-1(干重)。Note: values represent mean ± standard deviation of three repeats; letter (a,b,c,d) characterize significant difference (P<0.05); units of PFOS concentrations in low (0, 5, 100, 1 000 μg·L-1) and high (10 000,50 000,100 000 μg·L-1) level treatments were μg·kg-1dw and mg·kg-1dw, respectively.
2.2 PFOS不同處理水體中金魚藻的生長(zhǎng)狀況
PFOS對(duì)金魚藻的生理效應(yīng)隨著濃度的增大和時(shí)間的延長(zhǎng)而加重。加入PFOS的第1天各濃度處理的金魚藻表觀上均未發(fā)生明顯的急性毒理變化。第2天最高濃度處理開始出現(xiàn)葉片萎蔫現(xiàn)象。第4天,高濃度組中的2個(gè)較高濃度處理均出現(xiàn)萎蔫,其中,最高濃度處理開始出現(xiàn)葉片脫落。由表3對(duì)比發(fā)現(xiàn),50 000 μg·L-1濃度及以上的PFOS處理下的金魚藻長(zhǎng)勢(shì)逐漸變?nèi)酰⒂诘?天出現(xiàn)死亡現(xiàn)象。
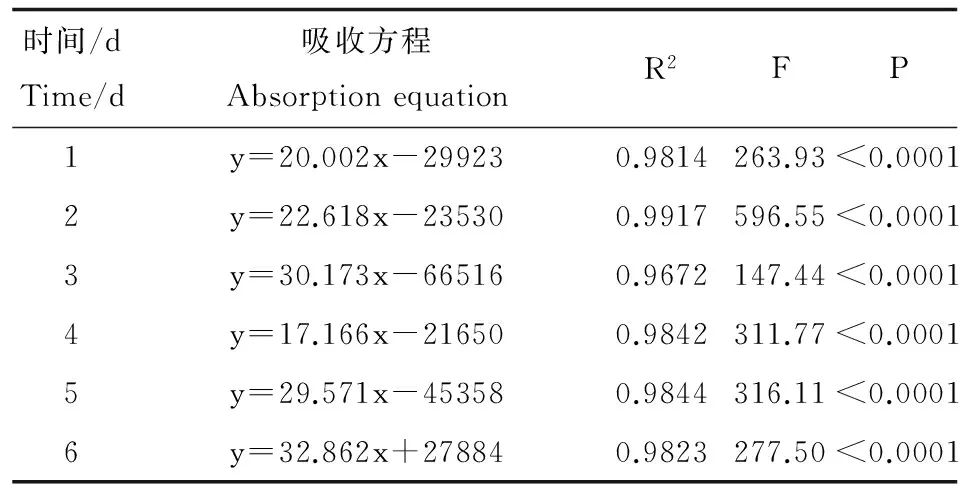
表2 金魚藻對(duì)水體中PFOS的吸收方程Table 2 Absorption equation of Ceratophyllum demersum intake of PFOS from water
注:R2擬合優(yōu)度;P值為結(jié)果可信程度的一個(gè)遞減指標(biāo);F是回歸方程的顯著性檢驗(yàn)。
Note: R2is coefficient of determination; P value is the credibility of the results; F is the significant test of regression equation.
2.3 PFOS不同處理水體中金魚藻的色素變化
不同濃度PFOS處理對(duì)金魚藻體內(nèi)色素的影響如圖1所示。整體來(lái)看,金魚藻體內(nèi)色素含量隨著PFOS濃度的升高,呈現(xiàn)先降低、后升高、而后又降低的趨勢(shì),初始階段PFOS對(duì)金魚藻起到一定刺激作用,但隨天數(shù)遞增,低濃度脅迫下金魚藻體內(nèi)色素含量逐步升高。當(dāng)PFOS濃度為100 000 μg·L-1時(shí),金魚藻體內(nèi)色素含量降低后沒有發(fā)生明顯抬升,基本低于初始值,說(shuō)明高濃度的PFOS能夠在一定程度上抑制金魚藻體內(nèi)色素的形成。但在10 000、50 000 μg·L-1濃度處理下,總色素含量呈先升高后降低趨勢(shì),并在第4天達(dá)到最高值。此時(shí),金魚藻體內(nèi)的PFOS濃度也達(dá)到最高值,部分植株在表觀上出現(xiàn)萎蔫現(xiàn)象。在PFOS濃度為10 000 μg·L-1時(shí),金魚藻體內(nèi)色素總量高于其他處理。
2.4 PFOS不同處理水體中金魚藻的酶活性變化
不同濃度處理下,PFOS脅迫對(duì)金魚藻SOD活性的影響如圖2所示。可以看出,SOD的活性隨PFOS濃度遞增總體變化不大。但在PFOS處理濃度低于10 000 μg·L-1時(shí),SOD活性呈先升高后降低的趨勢(shì),當(dāng)濃度高于10 000 μg·L-1后,SOD活力整體無(wú)明顯趨勢(shì),且均低于初始值,這與金魚藻體內(nèi)PFOS的富集呈現(xiàn)相同趨勢(shì)。高濃度組在第4天時(shí),金魚藻體內(nèi)SOD活力最低,此時(shí),金魚藻體內(nèi)的總色素含量也達(dá)到最大值,這與低濃度處理下總色素量隨濃度升高而增加趨勢(shì)基本一致。
不同濃度處理下,PFOS脅迫對(duì)金魚藻CAT活性的影響整體變化不大(圖3),但在PFOS濃度為10 000 μg·L-1時(shí),CAT活力隨培養(yǎng)天數(shù)的變化有所升高,在最高濃度處理?xiàng)l件下(100 000 μg·L-1)CAT活力呈現(xiàn)先升高后降低的趨勢(shì),并在實(shí)驗(yàn)第3天達(dá)最高值,第6天達(dá)最低值。
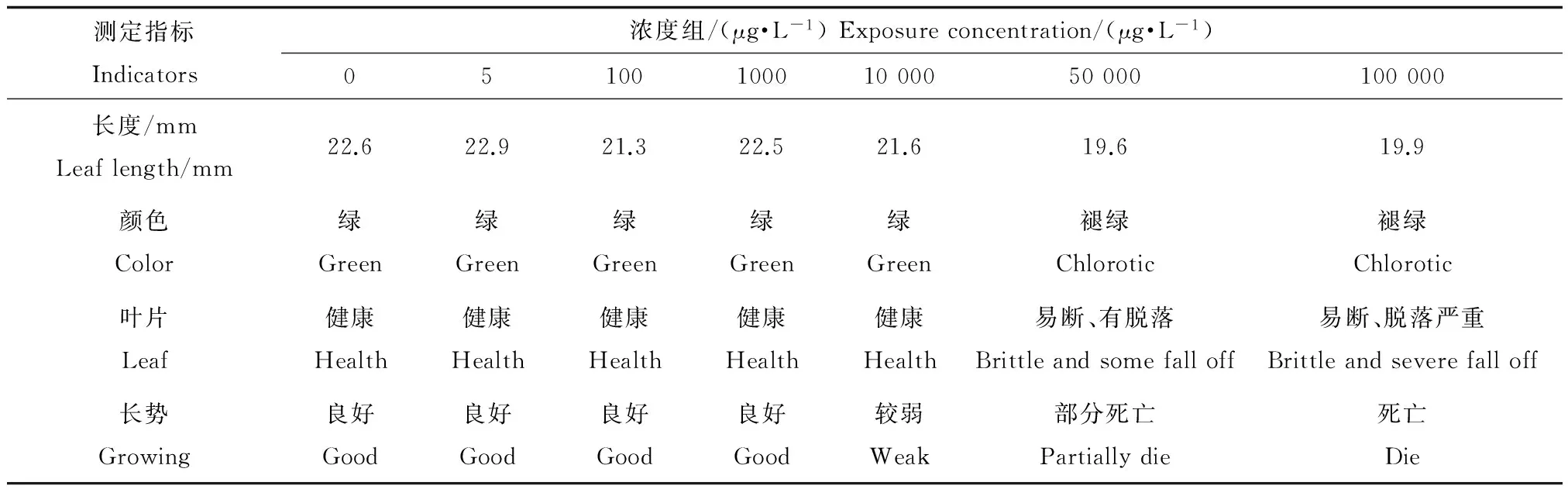
表3 不同濃度PFOS處理下第6天的植物生長(zhǎng)狀況Table 3 Plant growth after six days exposure to different concentrations of PFOS
注:5、100、1 000 μg·L-1為低濃度處理組,10 000、50 000、100 000 μg·L-1為高濃度處理組。
Note: 5, 100, 1 000 μg·L-1are low concentration treatments; 10 000, 50 000, 100 000 μg·L-1are high concentration treatments.
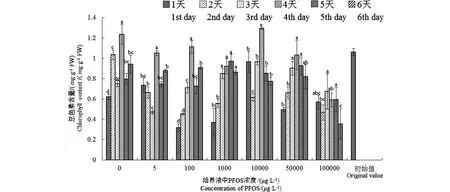
圖1 不同濃度PFOS處理下金魚藻體內(nèi)色素含量Fig. 1 Pigment content in Ceratophyllum demersum after exposure to different PFOS concentrations
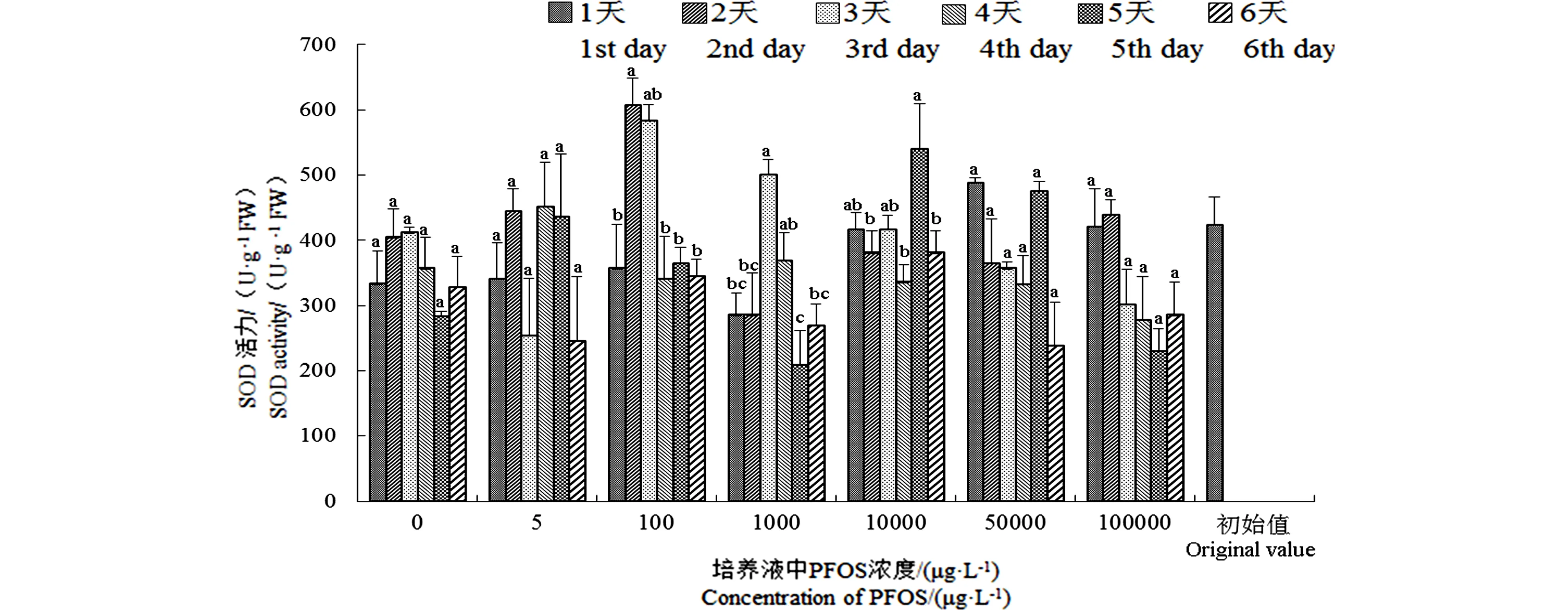
圖2 不同濃度PFOS處理下金魚藻SOD活力變化Fig. 2 SOD activities of Ceratophyllum demersum after exposure to different PFOS concentrations

圖3 不同濃度PFOS處理下金魚藻CAT活力變化Fig. 3 CAT activities of Ceratophyllum demersum after exposure to different PFOS concentrations
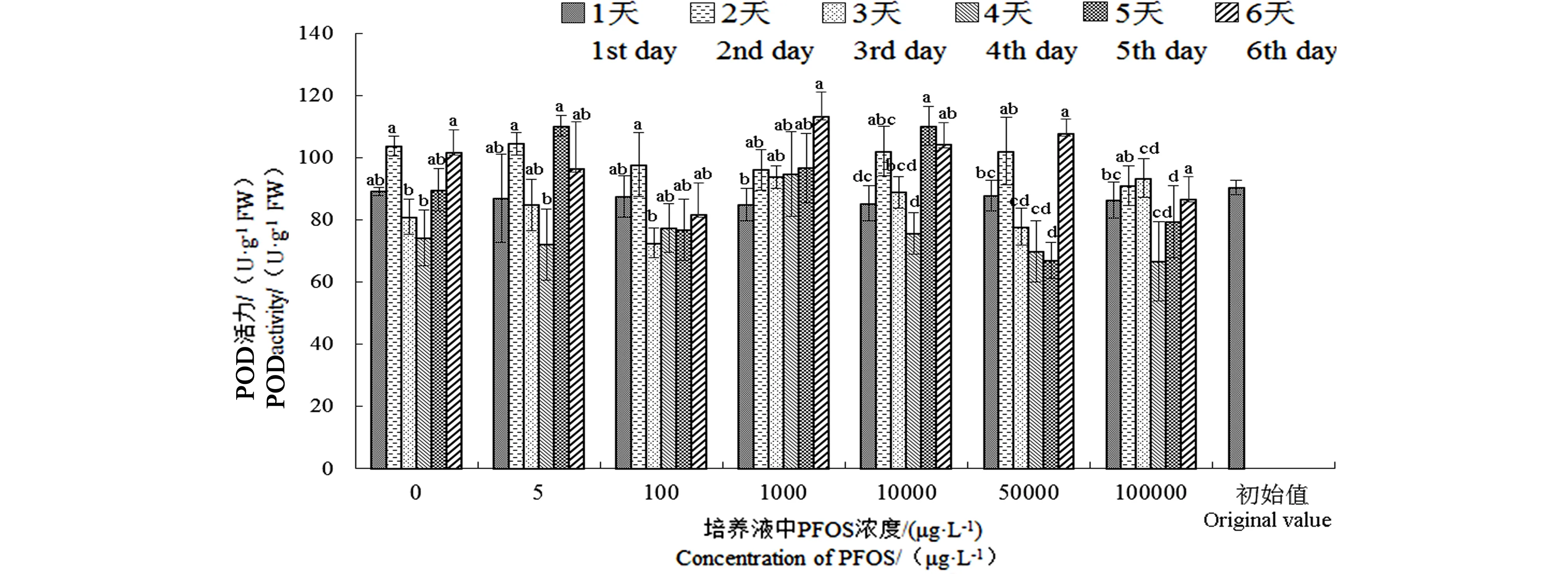
圖4 不同濃度PFOS處理下金魚藻POD活力變化Fig. 4 POD activities of Ceratophyllum demersum after exposure to different PFOS concentrations
POD活性隨PFOS濃度的升高并沒有顯著性變化,但不同處理時(shí)間呈波動(dòng)性變化(圖4)。整體上,處理第2天時(shí)POD有所升高,但在處理后的第3、4、5天,金魚藻體內(nèi)POD活力降低,并在第4天降至最低值,這與金魚藻對(duì)PFOS的富集、色素含量和SOD活力的變化趨勢(shì)基本一致。在PFOS濃度低于10 000 μg·L-1時(shí),POD活力隨時(shí)間變化逐步升高,當(dāng)PFOS濃度高于10 000 μg·L-1時(shí),POD活力呈明顯下降趨勢(shì)。表明在低濃度PFOS處理下,短時(shí)間內(nèi)對(duì)金魚藻并未有顯著的生理抑制效應(yīng)。
3 討論(Discussion)
隨PFOS濃度增高,金魚藻體內(nèi)PFOS累積量呈線性增長(zhǎng)趨勢(shì),說(shuō)明影響植物吸收和富集PFOS的主要因素是生長(zhǎng)介質(zhì)內(nèi)PFOS的濃度。金魚藻在初始的第0天檢測(cè)到PFOS(4.05~7.60 μg·kg-1dw均值為5.29 μg·kg-1dw),可能因?yàn)榻痿~藻初期生長(zhǎng)階段是在環(huán)境中由自然水體養(yǎng)殖,自然水體中已存在少量的PFOS。實(shí)驗(yàn)中高濃度組在第4天含量均降低,葉片萎蔫,生長(zhǎng)受到抑制,植物生長(zhǎng)減慢,新陳代謝水平下降。但第5、6天含量又有所升高,應(yīng)是因?yàn)橹参锼劳觯湮辗绞接稍瓉?lái)的主動(dòng)吸收變?yōu)楸粍?dòng)吸收,從而導(dǎo)致PFOS在體內(nèi)大量聚集,這與水生植物蘆葦、菖蒲和水蔥對(duì)水體中Cd富集結(jié)果極為相似[24]。Felizeter等[19]研究PFOS脅迫對(duì)水培生菜的富集態(tài)勢(shì)時(shí)也呈直線增長(zhǎng),且根部富集量高于葉片,根部和葉子富集系數(shù)分別達(dá)25和3.2。本研究發(fā)現(xiàn)當(dāng)PFOS濃度達(dá)100 000 μg·L-1時(shí),金魚藻對(duì)PFOS的富集量在第3天達(dá)最高值(3 180 mg·kg-1),富集系數(shù)為31.7,當(dāng)PFOS濃度為50 000 μg·L-1時(shí),金魚藻對(duì)PFOS的富集量在第6天達(dá)最大值(2 040 mg·kg-1),富集系數(shù)高達(dá)40.7,說(shuō)明水培生菜和金魚藻對(duì)PFOS表現(xiàn)為相似的吸收規(guī)律。潘義宏等[25],研究發(fā)現(xiàn)金魚藻對(duì)重金屬有更高的生物有效性,其中As、Zn、Cu、Cd、Pb的富集系數(shù)分別達(dá)到887、759、148、1 094、58。水生植物對(duì)環(huán)境中污染物的去除普遍優(yōu)于陸生植物,而且金魚藻對(duì)PFOS也有較強(qiáng)的耐受性,當(dāng)濃度達(dá)10 000 μg·L-1濃度時(shí),才開始出現(xiàn)生理抑制。因此,在PFOS水體污染的植物修復(fù)中,金魚藻具有潛在的應(yīng)用價(jià)值。
SOD、CAT和POD被認(rèn)為是抵抗過(guò)氧化反應(yīng)的關(guān)鍵酶,其活性直接影響活性氧(ROS)的生成和代謝,高活性抗氧化酶有利于提高植物對(duì)各種生物及非生物脅迫的耐受性[26]。SOD作為清除活性氧的防御酶,其活性升高通常反映逆境脅迫下植物體內(nèi)活性氧自由基增多,膜脂過(guò)氧化加劇[27]。本研究中SOD活性隨PFOS濃度變化總體變化不大,說(shuō)明SOD對(duì)PFOS的刺激響應(yīng)并不明顯,但仍出現(xiàn)了雙重效應(yīng),即PFOS濃度低于10 000 μg·L-1時(shí),SOD未出現(xiàn)明顯規(guī)律,PFOS濃度高于10 000 μg·L-1時(shí),SOD活性變化不大,但在最高濃度處理時(shí)100 000 μg·L-1均低于初始值,這與Hanson等[28]對(duì)PFOS毒性研究中發(fā)現(xiàn)PFOS對(duì)狐尾藻的最大無(wú)影響濃度為11.4 mg·L-1出現(xiàn)相似的結(jié)果。高濃度短期脅迫下之所以會(huì)受到抑制,是因?yàn)楦邼舛萈FOS處理下脅迫強(qiáng)度的增強(qiáng)可能超過(guò)了分子防御系統(tǒng)負(fù)荷,部分酶活、色素含量顯著降低,甚至出現(xiàn)金魚藻死亡的現(xiàn)象[29]。在氧化脅迫時(shí),植物體內(nèi)會(huì)產(chǎn)生ROS,SOD能夠?qū)OS轉(zhuǎn)化成H2O2,而H2O2的清除需要POD和CAT的參與[30]。本研究中POD隨PFOS濃度遞增呈波動(dòng)式變化,可能是毒物興奮作用、抗氧化防御與酶蛋白破壞的平衡作用以及高濃度酶蛋白破壞共同作用的結(jié)果,這一結(jié)果與張蕾等[31]關(guān)于麝香酮和鎘單一與復(fù)合污染對(duì)金魚藻生態(tài)毒理作用結(jié)果一致。而且POD與SOD在高濃度處理下,均在第4天出現(xiàn)最低值,金魚藻出現(xiàn)萎蔫死亡現(xiàn)象,證明此時(shí)為金魚藻對(duì)PFOS吸收方式由主動(dòng)變?yōu)楸粍?dòng)的一個(gè)轉(zhuǎn)折點(diǎn)。
葉綠素含量可反映植物生長(zhǎng)發(fā)育是否受到污染物的損害,有研究表明,葉綠體是氟化物積累的主要場(chǎng)所[32]。類胡羅卜素也可作為光保護(hù)劑抵抗光、氧和光敏色素的有害作用,抵抗細(xì)胞產(chǎn)生的化學(xué)物質(zhì)引起的氧化損傷。本研究中金魚藻體內(nèi)色素隨PFOS濃度變化有先降低后升高再降低的趨勢(shì),即短時(shí)間內(nèi)PFOS對(duì)金魚藻起到一定的刺激作用,但隨實(shí)驗(yàn)天數(shù)遞增,低濃度PFOS處理使金魚藻體內(nèi)色素含量升高。高濃度PFOS處理,則使金魚藻體內(nèi)色素含量降低,表明植物光合作用對(duì)PFOS的生理響應(yīng)表現(xiàn)為雙重效應(yīng),即高濃度短期脅迫下光合作用受到抑制,低濃度短期脅迫下光合作用受到促進(jìn)[33]。此外,PFOS濃度為100 000 μg·L-1,金魚藻體內(nèi)色素含量一直處于最低狀態(tài),且均低于初始值,說(shuō)明PFOS對(duì)金魚藻的生長(zhǎng)發(fā)育存在生理毒性,能夠抑制金魚藻體內(nèi)色素的形成。類胡羅卜素占總素色的比例在PFOS處理濃度為50 000 μg·L-1時(shí)達(dá)最大,說(shuō)明高濃度處理下,金魚藻體內(nèi)的色素合成已經(jīng)受到傷害。整體來(lái)看,研究基本證明了金魚藻對(duì)PFOS表現(xiàn)出較強(qiáng)的抗逆特性和較強(qiáng)的生物有效性,對(duì)其吸收累積機(jī)制以及毒性作用機(jī)理尚需從細(xì)胞結(jié)構(gòu)、生物特性、吸附條件等方面開展深入研究。
[1] Giesy J P, Kannan K. Global distribution of perfluorooctane sulfonate in wildlife [J]. Environmental Science & Technology, 2001, 35(7): 1339-1342
[2] Kannan K, Tao L, Sinclair E, et al. Perfluorinated compounds in aquatic organisms at various trophic levels in a great lakes food chain [J]. Archives of Environmental Contamination and Toxicology, 2005, 48(4): 559-566
[3] Yeung L W Y, Miyake Y, Sachi T, et al. Perfluorinated compounds and total and extractable organic fluorine in human blood samples from China [J]. Environmental Science & Technology, 2008, 42(21): 8140-8145
[4] Naile J E, Khim J S, Hong S J, et al. Distributions and bioconcentration characteristics of perfluorinated compounds in environmental samples collected from the west coast of Korea [J]. Chemosphere, 2013, 90(2): 387-394
[5] Tomy G T, Tittlemier S A, Palace V P, et al. Biotransformation of N-ethyl perfluorooctane sulfonamide by rainbow trout (Onchorhynchus mykiss) liver microsomes[J]. Environmental Science & Technology, 2004, 38(3):758-762
[6] Wang T, Wang Y, Liao C, et al. Perspectives on the inclusion of perfluorooctane sulfonate into the Stockholm Convention on persistent organic pollutants[J]. Environmental Science & Technology, 2009, 43(14):5171-5175
[7] Moody C A, Martin J W, Kwan W C, et al. Monitoring perfluorinated surfactants in biota and surface water samples following an accidental release of fire-fighting foam into etobicoke creek[J]. Environmental Science &Technology, 2002, 36(4): 545-551
[8] So M K, Miyake Y, Yeung W Y, et al. Perfluorinated compounds in the Pearl River and Yangtze River of China [J]. Chemosphere, 2007, 68(11): 2085-2095
[9] Wang T Y, Lu Y L, Chen C L, et al. Perfluorinated compounds in estuarine and coastal areas of North Bohai Sea, China[J]. Marine Pollution Bulletin, 2011, 62(8):1905-1914
[10] Bao J, Jin Y H, Liu W, et al. Perfluorinated compounds in sediments from the Daliao River system of Northeast China [J]. Chemosphere, 2009, 77(5): 652-657
[11] Meng J, Wang T Y, Wang P, et al. Perfluoroalkyl substances and organochlorine pesticides in sediments from Huaihe Watershed in China[J]. Journal of Environmental Sciences, 2014, 26(11): 2198-2206
[12] Boulanger B, Vargo J, Schnoor J L, et al. Detection of perfluorooctane surfactants in great lakes water [J]. Environmental Science & Technology, 2004, 38(15): 4064-4070
[13] Naile J E, Khim J S, Wang T Y, et al. Perfluorinated compounds in water, sediment, soil and biota from estuarine and coastal areas of Korea[J]. Environmental Pollution, 2010, 158(5): 1237-1244
[14] 蘇紅巧, 任東凱, 曹閃, 等. 全氟辛烷磺酸鹽(PFOS)及其替代品對(duì)兩棲類蝌蚪的急性毒性[J]. 生態(tài)毒理學(xué)報(bào), 2012, 7(5): 521-524
Su H, Ren D, Cao S, et al. Acute toxicity of perfluorooctane sulfonate (PFOS) and its substitutes to amphibian tadpoles[J].Asian Journal of Ecotoxicology, 2012, 7(5): 521-524 (in Chinese)
[15] Kannan K, Hansen K J, Wade T L, et al. Perfluorooctane sulfonate in oysters, crassostrea virginica, from the Gulf of Mexico and the Chesapeake Bay, USA[J]. Archives of Environmental Contamination and Toxicology, 2002, 42(3): 313-318
[16] Kowalczyk J, Ehlers S, Furst P, et al. Transfer of perfluorooctanoic acid (PFOA) and perfluorooctane sulfonate (PFOS) from contaminated feed into milk and meat of sheep: Pilot study[J]. Archives of Environmental Contamination and Toxicology, 2012, 63(2): 288-298
[17] Chinje E, Kentish P, Jarnot B, et al. Induction of the cyp4a subfamily by perfluorodecanoic acid: The rat and the guinea pig as susceptible and non-susceptible species[J]. Toxicology Letters, 1994, 71(1): 69-75
[18] Zhao H, Guan Y, Zhang G, et al. Uptake of perfluorooctane sulfonate (PFOS) by wheat (Triticum aestivum L.) plant [J]. Chemosphere, 2013, 91(2): 139-144
[19] Felizeter S, McLachlan M S, de Voogt P. Uptake of perfluorinated alkyl acids by hydroponically grown lettuce (Lactuca sativa)[J]. Environmental Science & Technology, 2012, 46(21): 11735-11743
[20] Krippner J, Brunn H, Falk S, et al. Effects of chain length and pH on the uptake and distribution of perfluoroalkyl substances in maize (Zea mays) [J]. Chemosphere, 2014, 94: 85-90
[21] Lechner M, Knapp H. Carryover of perfluorooctanoic acid (PFOA) and perfluorooctane sulfonate (PFOS) from soil to plant and distribution to the different plant compartments studied in cultures of carrots (Daucus carota ssp. Sativus), potatoes (Solanum tuberosum), and cucumbers (Cucumis sativus)[J]. Journal of Agricultural and Food Chemistry, 2011, 59(20): 11011-11018
[22] Zhao H, Guan Y, Zhang G, et al. Uptake of perfluorooctane sulfonate (PFOS) by wheat [J]. Chemosphere, 2013, 91(2): 139-144
[23] 呂振娥, 蘇玉紅, 喬敏. 全氟辛烷磺酸短期暴露對(duì)不同作物苗期生長(zhǎng)的影響[J]. 生態(tài)毒理學(xué)報(bào), 2013, 8(5): 695-701
Lv Z, Su Y, Qiao M. Influence of short-term exposure of PFOS on seedling growth of different plants [J]. Asian Journal of Ecotoxicology,2013,8(5): 695-701 (in Chinese)
[24] 任珺, 陶玲, 楊倩, 等. 蘆葦、菖蒲和水蔥對(duì)水體中Cd富集能力的研究[J]. 農(nóng)業(yè)環(huán)境科學(xué)學(xué)報(bào), 2010, 29(9): 1757-1762
Ren J, Tao L, Yang Q, et al. Accumulation ability of Cd in water for Phragmites australis, Acorus calamus and Scirpus tabernaemontani [J]. Journal of Agro-Environment Science, 2010, 29(9): 1757-1762 (in Chinese)
[25] 潘義宏, 王宏鑌, 谷兆萍, 等. 大型水生植物對(duì)重金屬的富集與轉(zhuǎn)移[J]. 生態(tài)學(xué)報(bào), 2010, 30(23): 6430-6441
Pan Y, Wang H, Gu Z, et al. Accumulation and translocation of heavy metals by macrophytes[J]. Acta Ecologica Sinica, 2010, 30(23): 6430-6441 (in Chinese)
[26] 張蕾, 周啟星, 孫福紅, 等. 麝香酮和鎘單一與復(fù)合污染對(duì)金魚藻的生態(tài)毒理效應(yīng)研究[J]. 生態(tài)毒理學(xué)報(bào), 2009, 4(4): 507-515
Zhang L, Zhou Q, Sun F, et al. Single and joint effects of musk ketone and cadmium on coontail (Ceratophyllum demersum L.) [J]. Asian Journal of Ecotoxicology, 2009, 4(4): 507-515 (in Chinese)
[27] Monk L S, Fagerstedt K V, Crawford R M M. Oxygen-toxicity and superoxide-dismutase as an antioxidant in physiological stress[J]. Physiologia Plantarum, 1989, 76(3): 456-459
[28] Hanson M L, Sibley P K, Brain R A, et al. Microcosm evaluation of the toxicity and risk to aquatic macrophytes from perfluorooctane sulfonic acid [J]. Archives of Environmental Contamination and Toxicology, 2005, 48(3): 329-337
[29] Lichtenthaler H K. Vegetation stress: An introduction to the stress concept in plants[J]. Journal of Plant Physiology, 1996, 148(1-2): 4-14
[30] Borges T, Glauert H P, Robertson L W. Perfluorodecanoic acid noncompetitively inhibits the peroxisomal enzymes enoyl-CoA hydratase and 3-hydroxyacyl-CoA dehydrogenase[J]. Toxicology and Applied Pharmacology, 1993, 118(1): 8-15
[31] 顧曉軍, 田素芬. 毒物興奮效應(yīng)概念及其生物學(xué)意義[J]. 毒理學(xué)雜志, 2007(5): 425-428
[32] Zhou Q. Interaction between heavy metals and nitrogen fertilizers applied to soil-vegetable systems [J]. Bulletin of Environmental Contamination and Toxicology, 2003, 71(2): 338-344
[33] 李砧, 胡濤, 李艷暉, 等. 金魚藻對(duì)水中氟污染物去除作用的研究[J]. 廣東農(nóng)業(yè)科學(xué), 2013, 40(18): 165-168
Li Z, Hu T, Li Y, et al. Research on removal effect of fluoride in water by Ceratophyllum demersum [J].Guangdong Agricultural Sciences, 2013, 40(18): 165-168 (in Chinese)
◆
Ecological Effects on Aquatic Plants Induced by Perfluorinated Compounds II—Bioaccumulation and Physiological Response ofCeratophyllumDemersumin PFOS Polluted Water
Kong Xiaoxiao1,2, Wang Tieyu2,*, Zhang Xiaojun1,#, Jiang Zhaoze1,2, Zhou Yunqiao2,3, Li Qifeng2,3, Meng Jing2,3, Zhu Zhaoyun2,3
1. College of Life Sciences and Technology, Mudanjiang Normal University, Mudanjiang 157012, China 2. State Key Lab of Urban and Regional Ecology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China 3. Graduate University of Chinese Academy of Sciences, Beijing 100049, China
16 January 2015 accepted 21 March 2015
In order to explore the aquatic ecological effects of perfluorooctane sulfonate (PFOS), Ceratophyllum demersum was selected as a target endpoint to analyze its bioavailability and physiological responses. Hydroponic experiments at seven grades of PFOS concentrations (0, 5, 100, 1 000, 10 000, 50 000, 100 000 μg·L-1), were designed to detect the activities of superoxide dismutase (SOD), peroxide enzyme (POD), catalase(CAT), as well as PFOS bioaccumulation. Ceratophyllum demersum showed significant higher bioaccumulation of PFOS with maximum of 3 180 mg·kg-1dw and the bioaccumulation factor up to 40.7. The activitiy of SOD did not show significant changes. POD activity showed two different trends: lower concentrations of PFOS promoted POD activities, while higher concentrations inhibited POD activities. With increasing concentrations of PFOS, CAT did not exhibit significant changes at low concentration treatments (0, 5, 100, 1 000 μg·L-1), while CAT activity showed increasing then decreasing trend at higher concentration treatments (10 000, 50 000, 100 000 μg·L-1). With increasing concentrations of PFOS, the reactions of pigment contents were very sensitive. Pigment contents increased in the treatments of low concentrations, while pigment contents increased and then decreased in the treatments of high concentration. Pigment content of Ceratophyllum demersum could be used as a sensitive indicator to assess environmental contamination induced by PFOS. In general, Ceratophyllum demersum showed higher capacity of PFOS bioavailability and expressed sensitive responses to PFOS pollution, thus, Ceratophyllum demersum could be used for bioremediation and bio-indicator for PFOS contaminated waterbodies.
perfluorinated compounds; Ceratophyllum demersum; PFOS bioavailability; antioxidant system; ecological effects
國(guó)家自然科學(xué)基金項(xiàng)目(41171394);科技基礎(chǔ)性工作專項(xiàng)(2013FY11110);中國(guó)科學(xué)院重點(diǎn)部署項(xiàng)目(KZZD-EW-TZ-12)
孔瀟瀟(1989-),女,碩士,研究方向?yàn)榄h(huán)境植物學(xué),E-mail: kongxiao0705@126.com;
*通訊作者(Corresponding author), E-mail: wangty@rcees.ac.cn
10.7524/AJE.1673-5897.20150116002
2015-01-16 錄用日期:2015-3-21
1673-5897(2015)2-445-09
X171.5
A
王鐵宇(1973-),男,博士,研究員,主要研究方向?yàn)閰^(qū)域污染生態(tài)過(guò)程與風(fēng)險(xiǎn)管理。近幾年重點(diǎn)關(guān)注新型污染物的環(huán)境行為、生態(tài)效應(yīng)及其風(fēng)險(xiǎn)管理,已在國(guó)內(nèi)外核心刊物發(fā)表論文100余篇(其中SCI收錄70余篇)。
# 共同通訊作者(Co-corresponding author), E-mail: swxzxj@126.com
孔瀟瀟, 王鐵宇, 張曉軍, 等. 全氟化合物對(duì)水生植物的生態(tài)效應(yīng)研究Ⅱ-金魚藻對(duì)水中PFOS的生物富集及生理響應(yīng)[J]. 生態(tài)毒理學(xué)報(bào), 2015, 10(2): 445-453
Kong X X, Wang T Y, Zhang X J, et al. Ecological effects on aquatic plants induced by perfluorinated compounds II-Bioaccumulation and physiological response of Ceratophyllum demersum in PFOS polluted water [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 445-453 (in Chinese)
- 生態(tài)毒理學(xué)報(bào)的其它文章
- 菲脅迫下濕生植物美人蕉(Cannaindica)對(duì)斜生柵藻(Scenedesmusobliquus)生長(zhǎng)的影響
- 酚類化合物短期暴露對(duì)小麥和大麥苗期根伸長(zhǎng)的影響
- BDE-47對(duì)人胚腎細(xì)胞HEK293的毒理效應(yīng)及作用機(jī)制
- 納米Al2O3和Cd聯(lián)合暴露對(duì)銅銹環(huán)棱螺體內(nèi)Cd的生物積累和抗氧化酶活性的影響
- 敵百蟲致小鼠外周血淋巴細(xì)胞DNA-蛋白質(zhì)交聯(lián)作用研究
- 有機(jī)化學(xué)品不同溫度下(過(guò)冷)液體蒸氣壓預(yù)測(cè)模型的建立與評(píng)價(jià)

