一株水產益生菌的鑒定及其凈水研究
王 軍,姜文聯
(廣東科貿職業學院動物科技系, 510640)
?
一株水產益生菌的鑒定及其凈水研究
王 軍,姜文聯
(廣東科貿職業學院動物科技系, 510640)
鑒定1株分離自刺參養殖水體的益生菌DR1,進行了常規生理生化及16S rRNA基因序列分析,將DR1鑒定為馬氏副球菌。進一步研究了該益生菌水質凈化能力,結果表明:該菌株能有效降低水體化學耗氧量(COD),減少氨氮、亞硝酸鹽等有害物質含量。
益生菌;16S rRNA基因;生物學鑒定;凈水研究
隨著我國水產養殖業的飛速發展,大規模、集約化的養殖模式逐漸取代了粗放、半粗放、半精養的養殖模式。集約化養殖過程中天然餌料已經不能完全滿足養殖生物生長的需要,必須補充投喂人工配合飼料,以保證養殖生物的快速生長。不科學的投喂和管理模式使得飼料的利用率低下,沒有被養殖生物攝食的殘餌以及糞便等有機物沉入養殖池底,從而造成水體中營養物質和有機物大量積累,在水體溶氧不足的情況下經不完全氧化轉化為對養殖生物有毒有害的氨氮及亞硝酸鹽等物質,進而引起養殖生物中毒或死亡。
水產益生菌通過氨化、氧化、硝化、反硝化和固氮等作用[1],將養殖過程中產生的殘餌、糞便以及水體中其他的有害物質等迅速地分解為二氧化碳、硝酸鹽、磷酸鹽、硫酸鹽等無毒無害的營養物質來達到凈化水質的目的,在此過程中水體的溶解氧也得到了提高,以此保證養殖水環境的潔凈,從而促進養殖生物的健康生長。由于其綠色環保、不產生抗性、無毒副作用、無殘留污染、無記憶性、作用范圍廣等優點目前已廣泛應用于水產養殖。
從刺參養殖池塘水體中分離篩選出1株海洋益生菌DR1。然后采用常規的生理生化方法和細菌16S rRNA基因序列測定,進行了該菌株的生物學分類鑒定,并在實驗室條件下研究了該菌株對養殖污水中COD、氨氮及亞硝酸鹽的降解能力。
1 材料與方法
1.1 待測菌種及培養基
菌株DR1分離自刺參養殖池塘水體中。選用2216E海水培養基:酵母膏 1g,蛋白胨 5g,FePO40.1g,陳海水 1 000mL,pH=7.6~7.8,瓊脂 2%。
1.2 形態學鑒定
將兩菌株分別接種于2216E固體培養基上,28℃恒溫培養24h 后,觀察平板上的菌落形態及表面特征,常規的檢驗還包括革蘭氏染色、芽孢染色、菌體運動性觀察以及形態觀察,具體方法和步驟參照《常見細菌系統鑒定手冊》和《微生物學實驗技術》[2-3]。
1.3 生理生化指標測定
測定菌株DR1的生理生化特性,具體鑒定內容及方法參照武心華《刺參池塘有機物降解菌固定化及其對水質凈化作用研究》[4]進行。
1.4 待測菌株的16S rRNA基因序列鑒定和分析
1.4.1 PCR模板制備
將細菌接種在平板上,28℃培養過夜。取單一菌落懸浮于50 L無菌蒸餾水中,于100℃水浴加熱5min,離心,取上清作為PCR模板DNA。
1.4.2 16S rRNA基因的PCR擴增與測序
以細菌16S rDNA擴增常用引物27F(5'-A G A G T T T G A T CC T G G C T CA G -3')和1492R(5'-A C G G C T A C C T T G T T A C G A C T -3')為PCR引物。 采用50μL的反應體系,擴增模板DNA,并交由相關測試公司(北京三博遠志生物技術有限責任公司)進行序列測定。
1.4.3 16S rRNA基因的序列分析及數據處理
將菌株 DR1的 16S rRNA基 因序列與從Genbank數據庫中獲得的細菌的16S rRNA基因序列進行比對,采用ClustalX、BioEdit和MEGA4.1等軟件對菌株DR1進行系統進化分析,用Neighbor-Joning法構建系統發育樹,1000次RePlications,計算Bootstrap值評估樹的置信度,對DR1進行系統發育樹的構建。
1.5 水質凈化研究
將經過2216E液體培養基培養至對數期的DR1培養液離心收集菌體,用無菌生理鹽水洗滌2次后重懸作為水質凈化研究的接種菌液,并用血球計數板計數菌濃度。本實驗按施用終濃度1.0×l06cfu/mL接種于盛有3L養殖污水的三角瓶中,以不加菌的處理作為對照組,每個處理設5個重復,每天定時取樣測定水體中COD、氨氮及亞硝酸鹽含量,連續監測一周。水體中COD、氨氮、亞硝酸鹽測定方法參照照雷衍之《養殖水環境化學實驗》[5]進行。
2 結果
2.1 菌株的形態學鑒定
熒光顯微鏡下DR1菌體呈球狀,無鞭毛,無芽孢,2216E平板上培養48~72h,肉眼觀察菌落呈橘黃色、圓形、隆起、不透明、邊緣整齊、表面較濕潤光滑。
2.2 生理生化指標測定結果
菌株DR1生理生化鑒定結果見表1。
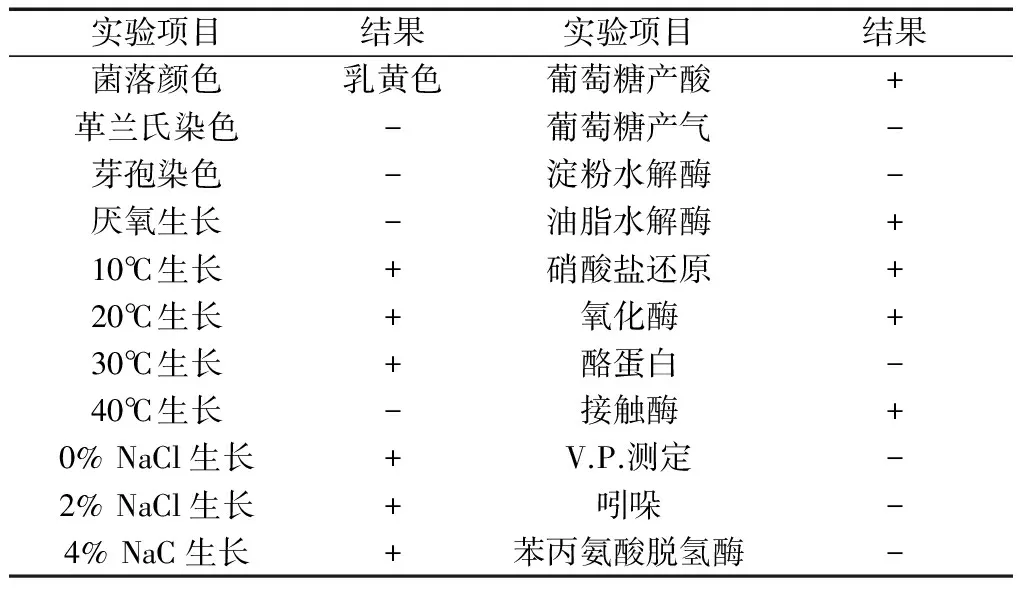
表1 菌株生理生化特性
可以看出,該菌株為低溫種,在水溫超過25℃,菌體生長明顯受到抑制,最適生長溫度10~18℃。DR1對鹽度的適應范圍較廣,在0~4%的水體中均能正常生長。
2.3 16S rRNA 基因序列分析和系統發育樹的構建
將菌株DR1的16S rRNA基因序列在GenBank數據庫中進行比對,發現與該菌株序列同源性最高的絕大多數為副球菌屬的細菌,選取相關菌株的16S rRNA序列用Neighbour-Joining method構建系統發育樹(圖1)。如圖1所示,菌株DR1與副球菌屬的Paracoccus marcusii(EF491972)序列相似性達99%以上,結合形態特征、生理生化特性,將菌株DR1初步鑒定為馬氏副球菌。
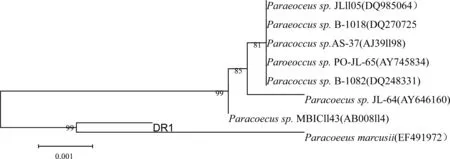
圖1 DR1的16S rDNA 基因序列聚類分析結果
2.4 DR1凈水結果
菌株DR1對水體中COD、氨氮及亞硝酸鹽的降解效果見圖2。
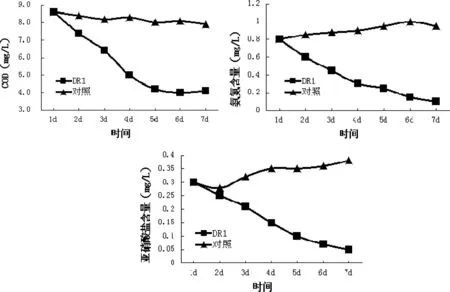
圖2 DR1對水體COD、氨氮及亞硝酸鹽的降解
由圖2可以看出,與對照組相比,施加DR1可以明顯降低養殖廢水中的化學耗氧量(COD),間接提高水體中溶解氧供養殖生物呼吸作用。同時,添加DR1的處理組,氨氮1周內由0.9mg/L迅速降低到0.15mg/L,達到安全濃度;而水體中的亞硝酸鹽也由0.3mg/L降低到0.05mg/L,而對照組2個指標在此過程中均有所上升。
3 討論
根據常見細菌的鑒定方法,菌株DR1屬于革蘭氏陰性球狀菌;菌株好氧,無運動能力;接觸酶、氧化酶陽性;不產芽孢;不能利用檸檬酸鹽,硝酸鹽還原陽性。具有上述顯著特征的代表是副球菌屬菌株。
16S rRNA作為一種重要的核酸水平鑒定工具,其顯著特點就是能及時鑒定出生長緩慢或生化惰性、細菌培養陰性以及非常規的菌株[6]。近年來,大量細菌的16S rRNA序列已被檢測并被NCBI等國際基因數據庫收錄,成為目前細菌鑒定和分類的主要參照系統,并得到NASA、FDA、TIGR、NIAID等多個國際權威機構的認可[7-8]。從16S rRNA基因序列相似性和系統發育樹上看,菌株DR1與Paracoeeus marcusii聚為一群,具有最高的相似性。從形態、生理、生化、系統發育學、16S rRNA基因序列同源性等方面分析,菌株DR1可鑒定為馬氏副球菌。
水中氨態氮含量增加會抑制魚體內的氮排泄,損害養殖生物鰓等器官組織,消耗水中溶解氧;亞硝態氮毒性較強,是養殖水域中誘發暴發性疾病的重要因素,因此去除水體中過量的氨氮、亞硝態氮對于改善水質、提高養殖生物成活率和生長率、保護環境等具有重要意義。水體有益微生物能通過降低水體中有機物含量,以及一系列的消化、反硝化作用,降低水體中氨氮、亞硝酸鹽的含量,提高水體溶氧,是進行養殖生態防治重要手段。本文在實驗室條件下,研究了DR1對養殖污水的凈化能力,結果顯示,在小水體中,DR1對水體化學耗氧量(COD)、氨氮、亞硝酸鹽均有較好的降解能力,可以作為商業微生態制劑開發材料。
[1] 馮俊榮,陳營,付學軍,等. 微生態制劑對養殖水體水質條件的影響[J].海洋湖沼通報,2005,(4):104-108.
[2] 東秀珠, 蔡妙英. 常見細菌系統鑒定手冊[M]. 北京: 科學出版社, 2001:349-370.
[3] 林連祥, 路福平. 微生物學實驗技術[M]. 北京: 中國輕工業出版社, 2006:25-31.
[4] 武心華. 刺參池塘有機物降解菌固定化及其對水質凈化作用研究[D]. 青島:中國海洋大學, 2011.1-76.
[5] 雷衍之. 養殖水環境化學實驗[M]. 北京:中國農業出版社,2006.
[6] 劉朝軍. 16SrDNA 序列測定在細菌鑒定中的應用[J]. 軍醫進修學院學報, 2011,32(7):774-777.
[7] Hugenholtz P, Huber T. Chimeric 16SrDNA sequences of diverse origin are accumulating in the public databases[J]. International journal of systematic and evolutionary microbiology, 2003, 53(1):289-293.
[8] Fuller N, Marie D, Partensky F, et al. Clade-specific 16S ribosomal DNA oligonucleotides reveal the predominance of a single marine Synechococcus clade throughout a stratified water column in the Red Sea[J]. Applied and environmental microbiology, 2003,69(5): 2430-2443.

