原花青素對鎘引起的雞胚睪丸氧化損傷的緩解作用
侯福銀,宓君鵬,劉興廷,李劍,米玉玲,張才喬
浙江大學(xué)動(dòng)物科學(xué)學(xué)院,杭州 310058
原花青素對鎘引起的雞胚睪丸氧化損傷的緩解作用
侯福銀,宓君鵬,劉興廷,李劍,米玉玲*,張才喬#
浙江大學(xué)動(dòng)物科學(xué)學(xué)院,杭州 310058
為探索原花青素對鎘引起的雞胚睪丸氧化損傷的緩解作用,本實(shí)驗(yàn)設(shè)置了對照組、鎘、葡萄籽提取物原花青素(grape seed proanthocyanidin extract,GSPE)和鎘+GSPE組,在胚胎期第6.5天(E6.5)注射0.05 mg·kg-1鎘或2.5 mg·kg-1GSPE,統(tǒng)計(jì)孵化率和睪丸指數(shù),并在E17.5檢測睪丸形態(tài)、氧化指標(biāo)、細(xì)胞凋亡和內(nèi)質(zhì)網(wǎng)應(yīng)激相關(guān)基因的表達(dá)情況。結(jié)果表明:與對照組相比,鎘處理組孵化率和睪丸指數(shù)均顯著降低;睪丸組織結(jié)構(gòu)出現(xiàn)了細(xì)胞核固縮、空泡化和染色質(zhì)周緣化等變化,過氧化氫和丙二醛水平升高、超氧化物歧化酶活性顯著降低、谷胱甘肽含量明顯減少,凋亡細(xì)胞顯著增多;睪丸中抗凋亡基因Bcl-2 mRNA表達(dá)水平下降,同時(shí)促凋亡基因Caspase3和內(nèi)質(zhì)網(wǎng)應(yīng)激相關(guān)基因(XBP-1和HO-1)mRNA表達(dá)水平顯著上升。然而,GSPE聯(lián)合處理,明顯緩解了鎘引起的睪丸損傷,使孵化率和睪丸指數(shù)回升,抗氧化水平和內(nèi)質(zhì)網(wǎng)應(yīng)激得到改善,凋亡細(xì)胞顯著減少,睪丸形態(tài)趨于正常。結(jié)果表明:GSPE可通過其抗氧化作用降低XBP-1相關(guān)的內(nèi)質(zhì)網(wǎng)應(yīng)激基因的表達(dá),從而緩解鎘引起的雞胚睪丸生殖毒性。
鎘;雞胚;睪丸;氧化損傷;原花青素
鎘(Cadmium,Cd)是一種人體非必需的二價(jià)重金屬離子,隨著工農(nóng)業(yè)的迅速發(fā)展,其廣泛應(yīng)用于電鍍、核工業(yè)和蓄電池等生產(chǎn)中,極易造成生態(tài)環(huán)境的污染[1-3]。同時(shí),Cd易通過飲水、吸煙、食物和空氣進(jìn)入人和動(dòng)物體內(nèi),繼而蓄積在肝臟、腎臟和睪丸等組織器官,造成不同程度損害[4-9]。近些年,有關(guān)職業(yè)接觸引發(fā)的鎘疾病、環(huán)境污染導(dǎo)致的鎘超標(biāo)和鎘大米等事件,引起了人們的廣泛重視。越來越多的研究表明,Cd能夠引起睪丸發(fā)育異常,生精作用紊亂甚至不育[10]。并且,Cd可顯著降低雞胚抗氧化水平和孵化率[11]。有學(xué)者認(rèn)為,內(nèi)質(zhì)網(wǎng)應(yīng)激和線粒體信號(hào)通路共同作用,調(diào)節(jié)Cd引起的睪丸生殖細(xì)胞凋亡[12]。我們通過預(yù)實(shí)驗(yàn)發(fā)現(xiàn)Cd能夠引起雞胚睪丸氧化損傷,但其具體的生殖毒性機(jī)制和防御措施仍不清楚。
葡萄籽提取物原花青素(grape seed proanthocyanidin extract,GSPE)作為一種天然的食物源性抗氧化劑,可以有效清除自由基,具有抗癌、抗炎、抗氧化和抗凋亡等生物學(xué)活性[13]。研究報(bào)道,GSPE能夠通過抵抗機(jī)體的氧化應(yīng)激和細(xì)胞凋亡,緩解硫酸鎳導(dǎo)致的大鼠睪丸氧化損傷[14],兔類固醇性骨壞死[15]和糖尿病大鼠肝臟的組織損傷[16]等,說明了GSPE本身具有良好的抗氧化作用。此外,褪黑素[17]、鋅[18]和α-生育酚(維生素E)[19]等也有一定的緩解鎘引起的機(jī)體氧化損傷的作用,但日常生活中攝取的含量遠(yuǎn)不能達(dá)到防治Cd致毒的效果。因此,探索Cd的致毒機(jī)制和有效的防御措施十分必要,而食源性GSPE是否對其有較好的緩解作用及其調(diào)節(jié)機(jī)制尚不清楚,值得進(jìn)一步研究。
因此,本試驗(yàn)選用海蘭雞胚作為試驗(yàn)動(dòng)物模型,使用一定劑量的Cd和適量GSPE,通過蘇木素-伊紅染色、生化檢測、TUNEL細(xì)胞凋亡染色以及熒光定量PCR等方法,檢測Cd對雞胚睪丸損傷的毒性機(jī)制,并探索GSPE的緩解效果。這些結(jié)果將有助于提高人們對生殖健康和重金屬Cd毒理學(xué)的認(rèn)識(shí),為緩解其毒性的進(jìn)一步研究提供試驗(yàn)依據(jù)。
1 材料與方法(Materials and methods)
1.1 試驗(yàn)材料與試劑
1.1.1 主要儀器及試劑
儀器:輪轉(zhuǎn)式石蠟切片機(jī)(HM340E,MICROM,German),石蠟組織包埋機(jī)(EC-350,MICROM,German),Real-time PCR 擴(kuò)增儀(ABI7500,USA),電子天平(AB104-N,Mettler-toledo 公司),激光共聚焦顯微鏡(FV1000,Olympus,Japan),分光光度計(jì)(OD-1000,Thermo,USA),旋轉(zhuǎn)孵化箱(Victoria SRL,Italy),顯微鏡(Eclipse 80i,Nikon,Japan)。
試劑:氯化鎘(CdCl2,99.99%,C116344,Aladdin,中國),原花青素(GSPE,純度≥ 95%,天津尖峰天然產(chǎn)物研究開發(fā)有限公司,中國),反轉(zhuǎn)錄試劑盒(Thermo,Lithuania),SYBR green RT-PCR kit(Takara,Japan),DAPI(300 nM,Sigma Aldrich),生化檢測試劑盒(南京建成生物工程研究所,中國),TUNEL細(xì)胞凋亡試劑盒(A112-03,南京諾唯贊生物科技有限公司,中國)。
1.1.2 試驗(yàn)動(dòng)物及樣品采集
試驗(yàn)雞胚:海蘭白雞種蛋(59.8±2.5) g,購自杭州市蛋雞試驗(yàn)場),在旋轉(zhuǎn)孵化箱中38.5 ℃和60%濕度的正常條件下孵化至所需的胚齡,在胚胎期第6.5 d(E6.5,即性腺分化后)注射0.05 mg·kg-1Cd或2.5 mg·kg-1GSPE,注射方法參照前人研究[18],對照組注射0.9%的滅菌生理鹽水,即分為對照組、Cd組、GSPE組和GSPE+Cd組。出殼時(shí)統(tǒng)計(jì)孵化率和睪丸指數(shù),并對發(fā)育至出現(xiàn)典型曲精細(xì)管、精原細(xì)胞分層排布于管腔的E17.5的睪丸進(jìn)行形態(tài)學(xué)觀察、生化檢測、凋亡染色和熒光定量PCR檢測。
1.2 試驗(yàn)方法
1.2.1 孵化率和睪丸指數(shù)
對剛出殼小雞進(jìn)行孵化率的統(tǒng)計(jì),同時(shí),取材測睪丸指數(shù)(睪丸重/體重,mg·g-1)。
1.2.2 蘇木素-伊紅染色
4%中性多聚甲醛固定組織24 h,自來水緩慢沖洗過夜,70%~100%梯度酒精脫水,二甲苯:酒精(1:1)和二甲苯透明、浸蠟2 h后即可包埋,制作厚度為5 μm的石蠟切片,40 ℃水浴展片,60 ℃烘干2 h,100%~70%逐級酒精脫蠟后,用蘇木素和伊紅染色,二甲苯透明之后即可封片,在光學(xué)顯微鏡下,進(jìn)行對組織的切片拍照和形態(tài)學(xué)觀察分析。
1.2.3 生化指標(biāo)的檢測
取新鮮睪丸組織0.1~0.2 g放置于預(yù)冷的玻璃勻漿管內(nèi),按重量體積1:9的比例加入預(yù)冷的0.9%生理鹽水,使用超聲勻漿器進(jìn)行研磨,當(dāng)細(xì)胞完全破碎后將勻漿吸出,于4 000 r·min-1離心15 min,取出上清用于各項(xiàng)生化指標(biāo)的檢測,試劑盒檢測丙二醛(MDA)、過氧化氫(H2O2)、谷胱甘肽(GSH)的含量和超氧化物歧化酶(SOD)的活性。
1.2.4 TUNEL染色
石蠟切片置于二甲苯中15 min,酒精逐級浸水,PBS清洗3次,每張片子滴加100 μL終濃度為20 μg·mL-1的Proteinase K工作液,室溫孵育10 min。配制TUNEL檢測液:按比例,每個(gè)樣品分別取10 μL 5×Reaction Buffer,38 μL ddH2O,1 μL FITC-dUTP和1 μL TdT酶,混勻。在樣品上加入50 μL TUNEL檢測液,37 ℃避光孵育60 min;DAPI染核8 min,封片,在激光共聚焦顯微鏡下觀察、拍照并統(tǒng)計(jì)TUNEL陽性細(xì)胞。
1.2.5 RNA提取、cDNA合成及熒光定量PCR
根據(jù)Trizol說明書,提取睪丸組織的總RNA,提取的RNA立即用于反轉(zhuǎn)錄以免降解。cDNA的合成:加入已純化的2 μg總RNA(具體體積根據(jù)測得的總RNA濃度計(jì)算),1 μL Random引物,加水(nuclease-free)補(bǔ)足至12 μL,稍離心,于65 ℃反應(yīng)5 min,之后,立即放置冰上冷卻5 min至室溫。然后,每孔加入5×緩沖液4 μL,RNA酶抑制劑1 μL,10 mmol·L-1dNTP 混合物2 μL,反轉(zhuǎn)錄酶(200 U·μL-1)1 μL至20 μL體系,輕柔混勻離心,置于42 ℃,60 min溫育;70 ℃,5 min終止反應(yīng)。熒光定量PCR的擴(kuò)增:將cDNA模板稀釋20倍,反應(yīng)體系為20 μL,即加入SYBR Premix Ex Taq (2X) 10.0 μL,PCR 上下游引物各0.4 μL,ROX Reference Dye II(50x) 0.4 μL,DNA模板2.0 μL和ddH2O 6.8 μL。反應(yīng)條件是95 ℃ 10 s;95 ℃ 5 s和 60 ℃ 34 s 40個(gè)循環(huán),最后95 ℃15 s,60 ℃ 1 min,95 ℃ 15 s終止反應(yīng)。表1為試驗(yàn)中所用引物序列。
1.3 數(shù)據(jù)處理
所得數(shù)據(jù)采用SAS(9.0 版本)軟件進(jìn)行方差分析和Duncan氏多重比較,用平均值±標(biāo)準(zhǔn)誤差表示,P<0.05表示差異顯著。
2 結(jié)果(Results)
2.1 原花青素和鎘對孵化率和睪丸指數(shù)的影響
與對照組相比,Cd處理組孵化率和睪丸指數(shù)(睪丸/體重)均顯著性降低(P<0.05),GSPE聯(lián)合后,雞胚孵化率和睪丸指數(shù)有了明顯升高(P<0.05),見表2。

表1 Real-time PCR 所用引物Table 1 Primers for real-time PCR analyses
注: 睪丸指數(shù)為睪丸重/體重(mg·g-1),n=100,同列不同的字母表示差異顯著(P<0.05)。Note: Testis index is testis weight/body weight (mg·g-1),n=100,a,bvalues with different letters in the same column were statistically different ( P<0.05).
2.2 原花青素和鎘引起雞胚睪丸形態(tài)的變化
圖1顯示GSPE組和對照組睪丸細(xì)胞形態(tài)正常,然而Cd處理組睪丸生精上皮遭到一定的破壞,核發(fā)生固縮,染色質(zhì)周緣化,間質(zhì)出現(xiàn)空泡狀變化;但是,Cd +GSPE組從形態(tài)學(xué)上明顯緩解了Cd導(dǎo)致的睪丸組織損傷。
2.3 原花青素和鎘對睪丸氧化和抗氧化系統(tǒng)的影響
與對照組相比,H2O2和MDA含量均在Cd處理組明顯升高 (P<0.05),Cd處理組SOD活性和GSH含量都顯著降低 (P<0.05);GSPE組與對照組沒有明顯的區(qū)別;然而,Cd + GSPE組與Cd處理組相比,明顯降低了MDA的含量 (P<0.05),H2O2的含量也略有下降趨勢,但差異不顯著 (P>0.05),同時(shí),顯著提高了SOD活性和GSH含量 (P<0.05),見表3。
2.4 原花青素和鎘對睪丸細(xì)胞凋亡的影響
圖2顯示,與對照組相比,鎘處理組TUNEL陽性細(xì)胞明顯增多(P<0.05),GSPE聯(lián)合后,GSPE + Cd組與Cd處理組相比,TUNEL陽性細(xì)胞數(shù)明顯減少(P<0.05),GSPE單獨(dú)處理組與對照組無顯著差別。
2.5 原花青素和鎘對細(xì)胞凋亡和內(nèi)質(zhì)網(wǎng)應(yīng)激相關(guān)基因表達(dá)的影響
圖3為各組雞胚睪丸的凋亡相關(guān)基因Bcl-2和Caspase3,內(nèi)質(zhì)網(wǎng)應(yīng)激相關(guān)基因HO-1和XBP-1 mRNA的相對表達(dá)量。與對照組相比,鎘處理組Bcl-2顯著性降低(P<0.05,圖3A),Caspase3、HO-1和XBP-1 mRNA明顯升高(P<0.05,圖3B、3C和3D)。然而,與Cd處理組相比,GSPE + Cd組中Bcl-2顯著性升高(P<0.05),同時(shí),Caspase3、HO-1和XBP-1 mRNA表達(dá)水平明顯降低(P<0.05)。
3 討論(Discussion)
Cd作為現(xiàn)代工業(yè)和農(nóng)業(yè)生產(chǎn)中危害較大的環(huán)境污染物之一,對人體和動(dòng)物的健康造成嚴(yán)重威脅。有研究表明,Cd暴露能夠?qū)е掳l(fā)育階段的胚胎生長緩慢或畸形[20]。Cd的劑量超過1微克/雞胚時(shí),隨著劑量的增加孵化率顯著降低[18]。2 mg·kg-1Cd暴露的小鼠睪丸發(fā)育異常,睪丸重量明顯低于對照組[21]。本試驗(yàn)結(jié)果顯示,Cd處理組雞胚孵化率和睪丸重量均顯著性下降,同時(shí),聯(lián)合GSPE促進(jìn)了睪丸組織的生長發(fā)育。形態(tài)學(xué)上,HE染色結(jié)果表明鎘引起了睪丸生殖上皮損傷,空泡化增多、細(xì)胞排列散亂等。GSPE + Cd組細(xì)胞形態(tài)與Cd處理組相比,趨于正常,生殖上皮較完整,細(xì)胞排列均勻,明顯緩解了Cd的致毒作用,這一結(jié)果與黨衛(wèi)紅[22]研究的水果蔬菜中抗氧化成分對Cd損傷的營養(yǎng)干預(yù)作用一致。可能的原因是,GSPE發(fā)揮了強(qiáng)有效的自由基清除功能,但GSPE的修復(fù)效果也會(huì)受到Cd的暴露劑量、毒性作用時(shí)間以及動(dòng)物年齡等因素的影響。
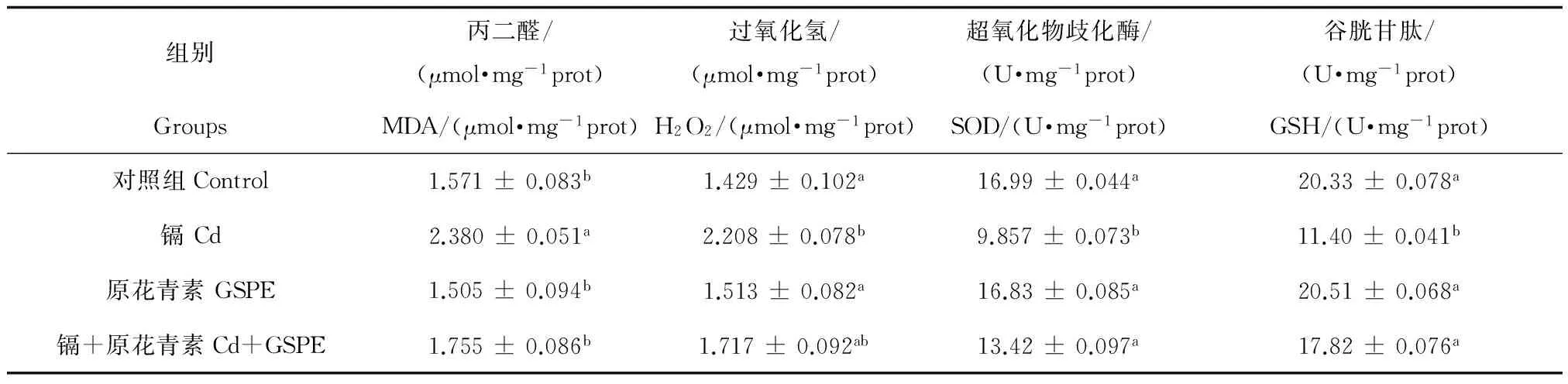
表3 原花青素和鎘對雞胚睪丸氧化和抗氧化系統(tǒng)的影響Table 3 Effects of GSPE and Cd on oxidation and antioxidant system in chicken testis
注: n=110,同列不同的字母表示差異顯著(P<0.05)。
Note: n=110,a,bvalues with different letters in the same column were statistically different ( P<0.05).
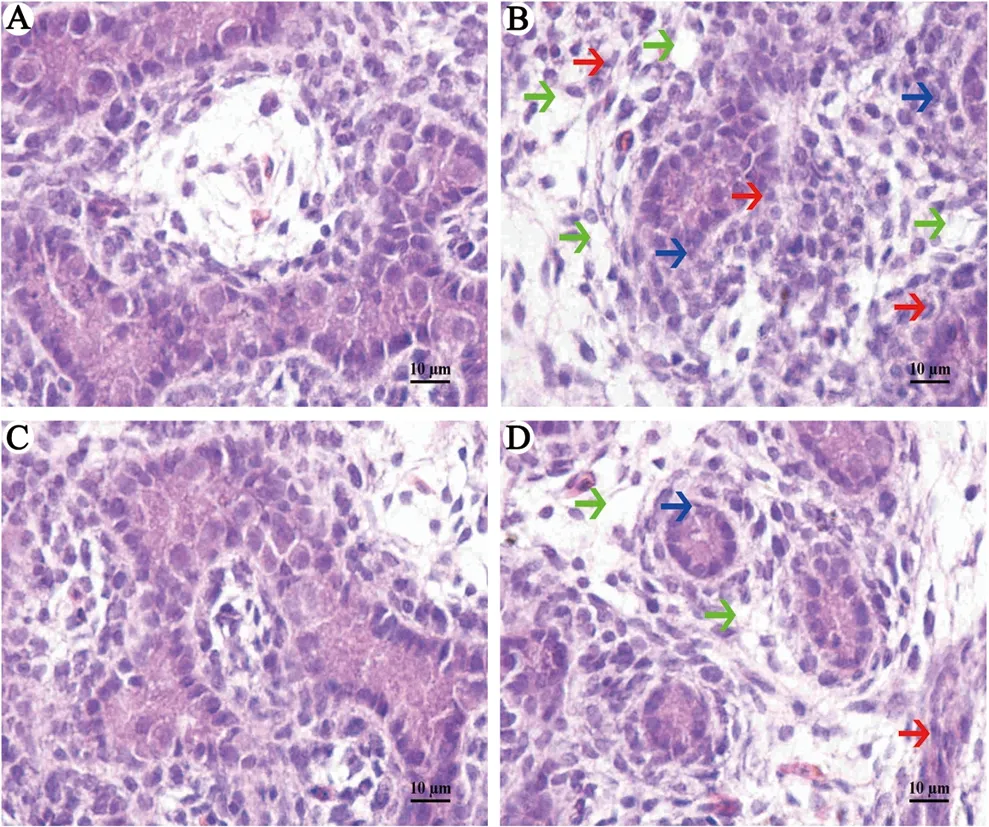
圖1 GSPE和Cd對睪丸形態(tài)學(xué)的影響 A:對照組,B: Cd組,C: GSPE組,D: Cd + GSPE組。
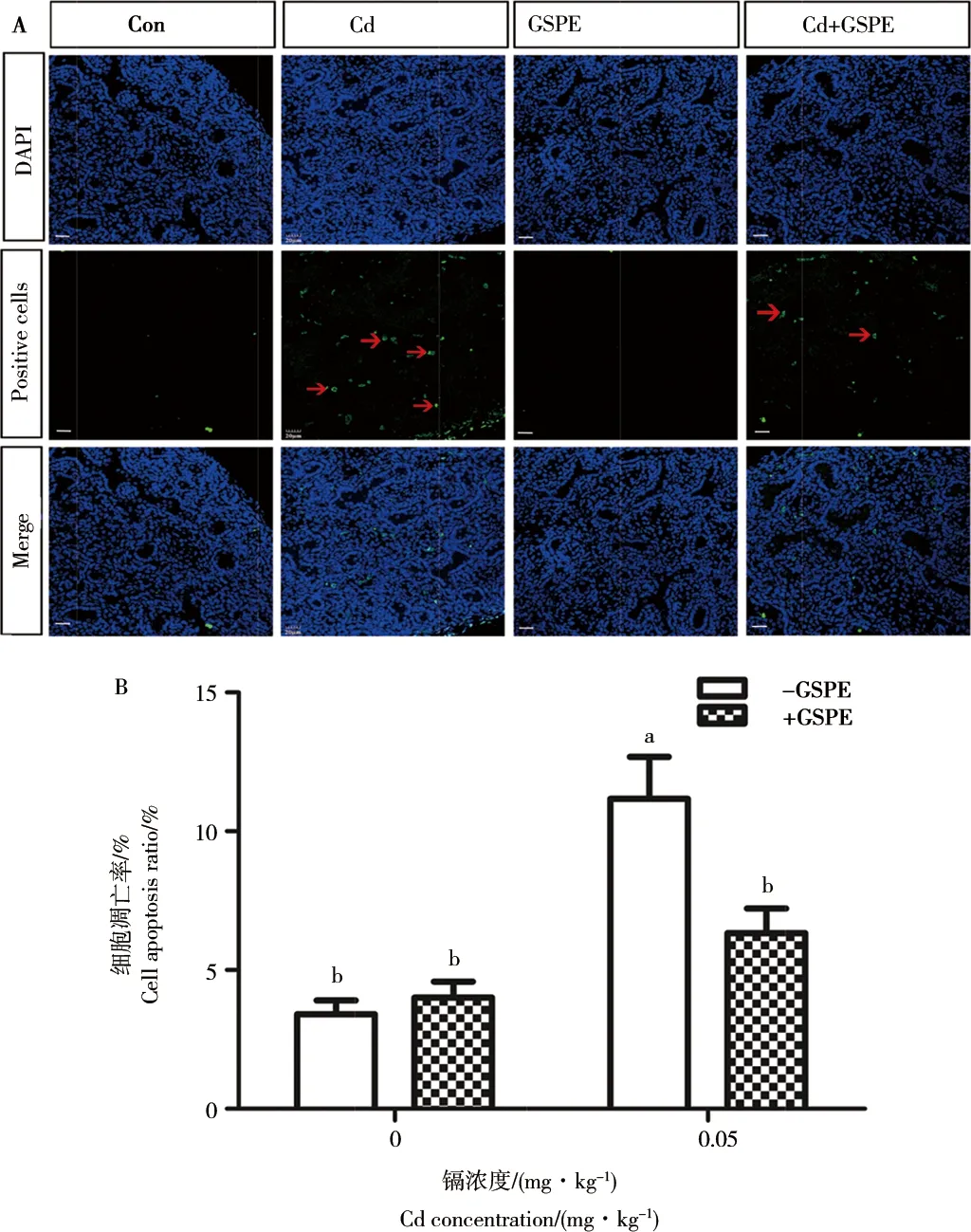
圖2 GSPE和Cd對睪丸細(xì)胞凋亡的影響
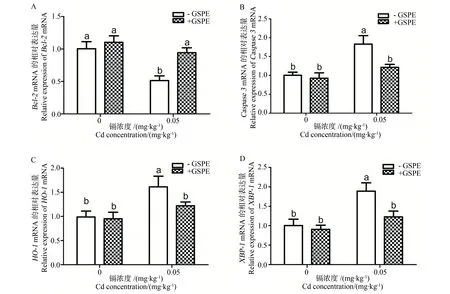
圖3 GSPE和Cd對睪丸細(xì)胞凋亡與內(nèi)質(zhì)網(wǎng)應(yīng)激相關(guān)基因表達(dá)的影響 A: Bcl-2,B: Caspase3,C: HO-1,D: XBP-1
當(dāng)內(nèi)分泌干擾毒物進(jìn)入機(jī)體后,往往引起自由基產(chǎn)生過多,組織內(nèi)抗氧化體系耗竭,從而導(dǎo)致組織、器官損傷。為維護(hù)機(jī)體自身功能的正常運(yùn)轉(zhuǎn)和健康狀態(tài),體內(nèi)有許多抗氧化物質(zhì)如還原型GSH、維生素E、維生素C和各種抗氧化酶,如GSH-Px、SOD等,以抵抗各種活性氧和自由基產(chǎn)生的氧化損傷[4-7]。同時(shí),MDA含量的測定,在一定程度上可以反映脂質(zhì)過氧化損傷的程度,在外源性物質(zhì)的刺激下,機(jī)體MDA和H2O2含量將會(huì)升高。本試驗(yàn)結(jié)果顯示,Cd暴露導(dǎo)致了MDA和H2O2含量顯著升高,SOD的活性明顯降低,GSH含量也有一定的下降,繼而導(dǎo)致凋亡細(xì)胞的增多,這一結(jié)果與Malgorzata等[11]發(fā)現(xiàn)的鎘引起新生雛雞血清抗氧化水平的變化和Bu等[23]研究的鎘誘導(dǎo)小鼠睪丸損傷結(jié)果一致。然而,在聯(lián)合GSPE后,睪丸的抗氧化水平有了顯著的恢復(fù),同時(shí),鎘誘導(dǎo)的凋亡細(xì)胞數(shù)量也有了明顯減少。GSPE良好的緩解效果與另一種天然抗氧化產(chǎn)物槲皮素緩解Cd引起的睪丸損傷作用類似[23]。我們的研究結(jié)果表明,在本試驗(yàn)Cd暴露的劑量下,GSPE有效緩解了Cd引起的雞胚睪丸氧化損傷和細(xì)胞凋亡。
內(nèi)質(zhì)網(wǎng)應(yīng)激在機(jī)體氧化應(yīng)激和細(xì)胞凋亡過程中發(fā)揮著重要的調(diào)節(jié)作用。近年來,研究發(fā)現(xiàn)鎘暴露引起的氧化應(yīng)激過程中,受到了內(nèi)質(zhì)網(wǎng)應(yīng)激信號(hào)通路的調(diào)控[24],同時(shí),Ji等[25]發(fā)現(xiàn)N-乙酰半胱氨酸可通過抑制內(nèi)質(zhì)網(wǎng)應(yīng)激,有效緩解了Cd誘導(dǎo)的睪丸生殖細(xì)胞凋亡。此外,內(nèi)質(zhì)網(wǎng)應(yīng)激往往激活未折疊蛋白反應(yīng),其中XBP -1轉(zhuǎn)錄因子具有重要的調(diào)節(jié)作用。本試驗(yàn)也發(fā)現(xiàn)在Cd暴露的雞胚睪丸組織中,細(xì)胞凋亡和內(nèi)質(zhì)網(wǎng)應(yīng)激相關(guān)基因的表達(dá)變化密切相關(guān),Cd處理組抗凋亡基因Bcl-2 mRNA的表達(dá)明顯降低,促凋亡基因Caspase3 mRNA表達(dá)水平顯著升高;內(nèi)質(zhì)網(wǎng)應(yīng)激XBP -1和HO -1 mRNA的表達(dá)水平同樣明顯升高。以上結(jié)果進(jìn)一步表明,內(nèi)質(zhì)網(wǎng)應(yīng)激在Cd導(dǎo)致的雞胚睪丸細(xì)胞凋亡的過程發(fā)揮著重要作用。而且,聯(lián)合GSPE后,GSPE +Cd組明顯緩解了Cd誘導(dǎo)的細(xì)胞凋亡和內(nèi)質(zhì)網(wǎng)應(yīng)激。另外,研究發(fā)現(xiàn),抗壞血酸(維生素C)可以一定程度上緩解鎘引起的內(nèi)質(zhì)網(wǎng)應(yīng)激和睪丸損傷[26],這與本試驗(yàn)結(jié)果類似。因此,GSPE可能通過XBP-1相關(guān)的內(nèi)質(zhì)網(wǎng)應(yīng)激信號(hào)通路,發(fā)揮抗氧化的功能,緩解了氧化損傷,其具體作用機(jī)制還有待于進(jìn)一步研究。
[1] Nordberg G F.Historical perspectives on cadmium toxicology [J].Toxicology and Applied Pharmacology,2009,238(3): 192-200
[2] Jarup L,Akesson A.Current status of cadmium as an environmental health problem [J].Toxicology and Applied Pharmacology,2009,238: 201-208
[3] 趙艷芳,吳繼法,翟毓秀,等.鎘脅迫對不同鎘富集能力海水養(yǎng)殖貝類(扇貝和菲律賓蛤仔) 抗氧化能力的影響[J].生態(tài)毒理學(xué)報(bào),2014,9(2): 224-232
Zhao Y F,Wu J F,Zhai Y X,et al.Effects of cadmium stress on the antioxidant responses in two biovalves (the scallop Chlamys farreri and the clam Ruditapes philippinarum) with different abilities to accumulate cadmium [J].Asian Journal of Ecotoxicology,2014,9(2): 224-232 (in Chinese)
[4] Amamou F,Nemmiche S,Meziane R K,et al.Protective effect of olive oil and colocynth oil against cadmium-induced oxidative stress in the liver of Wistar rats [J].Food and Chemical Toxicology,2015,78: 177-184
[5] 余娜,鐘志勇,唐小江,等.鎘引起腎臟毒性的細(xì)胞凋亡通路[J].生態(tài)毒理學(xué)報(bào),2014,9(3): 407-412
Yu N,Zhong Z Y,Tang X J,et al.Apoptotic pathways for cadmium-induced renal toxicity [J].Asian Journal of Ecotoxicology,2014,9(3): 407-412 (in Chinese)
[6] Soodvilai S,Nantavishit J,Muanprasat C,et al.Renal organic cation transporters mediated cadmium-induced nephrotoxicity [J].Toxicology Letters,2011,204(1): 38-42
[7] Niknafs B,Salehnia M,Kamkar M.Induction and determination of apoptotic and necrotic cell death by cadmium chloride in testis tissue of mouse [J].Journal of Reproduction & Infertility,2015,16(1): 24-29
[8] Weng S,Wang W,Li Y,et al.Continuous cadmium exposure from weaning to maturity induces downregulation of ovarian follicle development-related SCF/c-kit gene expression and the corresponding changes of DNA methylation/micro RNA pattern [J].Toxicology Letter,2014,225: 367-377
[9] Soares M B,Izaguirry A P,Vargas L M,et al.Catechins are not major components responsible for the beneficial effect of Camellia sinensis on the ovarian delta-ALA-D activity inhibited by cadmium [J].Food and Chemical Toxicology,2013,55: 463-469.
[10] Zhang X,Lui W Y.Dysregulation of nectin-2 in the testicular cells: An explanation of cadmium-induced male infertility [J].Biochimica et Biophysica Acta - Gene Regulatory Mechanisms,2014,1839(9): 873-888
[11] Dzugan M,Lis M,Droba M,et al.Effect of cadmium injected in ovo on hatching results and the activity of plasma hydrolytic enzymes in newly hatched chicks [J].Acta Veterinaria Hungarica,2011,59(3): 337 -347
[12] Ji Y L,Wang H,Zhao X F,et al.Crosstalk between endoplasmic reticulum stress and mitochondrial pathway mediates cadmium-induced germ cell apoptosis in testes [J].Toxicological Sciences,2011,124(2): 446-459
[13] 苗智如,袁夏,廖麗娜,等.葡萄籽提取物原花青素磷脂復(fù)合物抗氧化功能的實(shí)驗(yàn)研究[J].藥學(xué)實(shí)踐雜志,2013,31(5): 362-365
Miao Z R,Yuan X,Liao L N,et al.Experimental study on anti-oxidative effect of proanthocyanidins phospholipid complex in grape seed [J].Journal of Pharmaceutical Practice,2013,31(5): 362-365 (in Chinese)
[14] Su L,Deng Y,Zhang Y,et al.Protective effects of grape seed procyanidin extract against nickel sulfate-induced apoptosis and oxidative stress in rat testes [J].Toxicology Mechanisms and Methods,2011,21(6): 487- 494
[15] Song Q,Shi Z,Bi W,et al.Beneficial effect of grape seed proanthocyanidin extract in rabbits with steroid-induced osteonecrosis via protecting against oxidative stress and apoptosis [J].Journal of Orthopaedic Science,2015,20(1): 196-204
[16] Mansouri E,Khorsandi L,Abedi H A.Antioxidant effects of proanthocyanidin from grape seed on hepatic tissue injury in diabetic rats [J].Iranian Journal of Basic Medical Sciences,2014,17: 460-464
[17] Ji Y L,Wang H,Meng C,et al.Melatonin alleviates cadmium-induced cellular stress and germ cell apoptosis in testes [J].Journal of Pineal Research,2012,52: 71-79
[18] Dzugan M,Lis M W,Droba M,et al.Protective effect of zinc on cadmium embryotoxicity and antioxidant status of blood plasma in newly hatched chicks [J].Journal of Environmental Science and Health Part A,Toxic/Hazardous Substances & Environmental Engineering,2012,47(9): 1288-1293
[19] Yang H S,Han D K,Kim J R,et al.Effects of alpha-tocopherol on cadmium-induced toxicity in rat testis and spermatogenesis [J].Journal of Korean Medical Science,2006,21: 445-451
[20] Thompson J,Bannigan J.Cadmium: Toxic effects on the reproductive system and the embryo [J].Reproductive Toxicology,2008,25: 304-315
[21] 金龍金,張軍明,樓哲豐,等.氯化鎘對雄性小鼠的生殖毒性作用[J].中國男科學(xué)雜志,2004,18(1): 15-18
Jin L J,Zhang J M,Lou Z F,et al.Toxic effects of cadmium chloride on the reproductive function and reproductive organs of male mice [J].Chinese Journal of Andrology,2004,18(1): 15-18 (in Chinese)
[22] 黨衛(wèi)紅.鎘的毒性及鎘損害的營養(yǎng)干預(yù)[J].鄭州輕工業(yè)學(xué)院學(xué)報(bào),2008,23(4): 10-12
Dang W H.Toxicity of cadmium and nutrition intervention against cadmium poisoning [J].Journal of Zhengzhou University of Light Indusrty,2008,23(4): 10-12 (in Chinese)[23] Bu T L,Mi Y L,Zeng W D,et al.Protective effect of quercetin on cadmium-induced oxidative toxicity on germ cells in male mice [J].Anatomical Record,2011,294: 520-526
[24] Kitamura M,Hiramatsu N.The oxidative stress: Endoplasmic reticulum stress axis in cadmium toxicity [J].Biometals,2010,23(5): 941-950
[25] Ji Y L,Wang H,Zhang C,et al.N-acetylcysteine protects against cadmium-induced germ cell apoptosis by inhibiting endoplasmic reticulum stress in testes [J].Asian Journal of Andrology,2013,20: 290-296
[26] Ji Y L,Wang Z,Wang H,et al.Ascorbic acid protects against cadmium-induced endoplasmic reticulum stress and germ cell apoptosis in testes [J].Reproductive Toxicology,2012,34: 357-363
◆
Ameliorative Effect of Grape Seed Proanthocyanidin Extract on Cadmium-induced Testicular Oxidative Damage in Chicken Embryos
Hou Fuyin,Mi Junpeng,Liu Xingting,Li Jian,Mi Yuling*,Zhang Caiqiao#
College of Animal Sciences,Zhejiang University,Hangzhou 310058,China
9 March 2015 accepted 13 May 2015
This study was conducted to explore the ameliorative effect of grape seed proanthocyanidin extract (GSPE) on cadmium (Cd)-induced testicular oxidative damage in chicken embryos.Embryos of 6.5 days (E6.5) were injected with or without Cd (0.05 mg·kg-1) in the presence or absence of GSPE (2.5 mg·kg-1),then the hatchability and testis index were made statistically.Additionally,testicular morphology,parameters related to oxidative damage,apoptosis and the expression of endoplasmic reticulum (ER) stress related genes (XBP-1 and HO-1) mRNA were all measured at E17.5.The results showed that Cd exposure significantly reduced the hatchability and testis index,with the lesions of testis characterized by karyopyknosis,vacuolation and chromatin margination,compared with the control group.Cd exposure resulted in increased H2O2and malondialdehyde level,reduced superoxide dismutase activity and glutathione level,enhanced apoptotic cells in the testis as well.Meanwhile,Cd exposure also down-regulated Bcl -2 mRNA level,up-regulated the expression of caspase3,XBP -1 and HO-1 mRNA.However,GSPE supplementation attenuated the Cd-induced oxidative damage,along with the increase of hatchability and testis index,the improvement of antioxidant level and ER stress,the marked decrease of apoptotic cells,and the testicular morphology tended to be normal.In conclusion,GSPE via the antioxidative ability could ameliorate the Cd-induced testicular reproductive toxicity in chicken embryos by decreasing the expression of XBP-1 related ER stress genes mRNA.
cadmium; chicken embryo; testis; oxidative damage; proanthocyanidin
教育部新世紀(jì)項(xiàng)目(NCET-13-0519);國家自然科學(xué)基金項(xiàng)目(31001041,31472160)
侯福銀(1989-),女,碩士研究生,研究方向?yàn)榄h(huán)境毒理與生殖內(nèi)分泌學(xué),E-mail: houfuyin2008@126.com;
*通訊作者(Corresponding author),E-mail: yulingmi@zju.edu.cn
10.7524/AJE.1673-5897.20150309008
2015-03-09 錄用日期:2015-05-13
1673-5897(2015)4-138-08
X171.5
A
米玉玲(1975-),女,副研究員,博士,博導(dǎo),主要從事環(huán)境毒理學(xué)、動(dòng)物生殖內(nèi)分泌學(xué)方面的研究,發(fā)表學(xué)術(shù)論文40余篇。
侯福銀,宓君鵬,劉興廷,等.原花青素對鎘引起的雞胚睪丸氧化損傷的緩解作用[J].生態(tài)毒理學(xué)報(bào),2015,10(4): 138-145
Hou F Y,Mi J P,Liu X T,et al.Ameliorative effect of grape seed proanthocyanidin extract on cadmium-induced testicular oxidative damage in chicken embryos [J].Asian Journal of Ecotoxicology,2015,10(4): 138-145 (in Chinese)
張才喬(1965-),教授,博士,博導(dǎo),主要從事卵泡發(fā)育和閉鎖調(diào)節(jié)、環(huán)境內(nèi)分泌干擾物生殖毒理相關(guān)研究,發(fā)表學(xué)術(shù)論文100余篇。

