全氟辛烷磺酸(PFOS)對半滑舌鰨肝臟細胞的毒性效應
黨紅蕾,那廣水,高會,李瑞婧,高艷飛,姚子偉,祖國仁,#
1.大連工業大學生物工程學院,大連 116034 2.國家海洋局近岸海域生態環境重點實驗室 國家海洋環境監測中心,大連 116023
全氟辛烷磺酸(PFOS)對半滑舌鰨肝臟細胞的毒性效應
黨紅蕾1,2,那廣水2,*,高會2,李瑞婧2,高艷飛1,姚子偉2,祖國仁1,#
1.大連工業大學生物工程學院,大連 116034 2.國家海洋局近岸海域生態環境重點實驗室 國家海洋環境監測中心,大連 116023
為探究海洋環境中持久性有機污染物——全氟辛烷磺酸(PFOS)的生物毒性效應,以半滑舌鰨肝臟細胞(HTLC)為研究對象,將其暴露于含不同濃度PFOS的DMEM-F12培養基中,分別染毒24、48、72 h后,利用噻唑藍比色法(MTT)和透射電鏡實驗評價PFOS的細胞毒性; 同時測定活性氧自由基(ROS)和超氧化物歧化酶(SOD)活性來探討PFOS對細胞的氧化損傷效應。結果發現,細胞活性隨PFOS濃度升高呈先促進后抑制趨勢,當PFOS濃度達到1 000mol·L-1時細胞活性受到顯著抑制(P<0.01);電鏡結果顯示PFOS能引起與代謝相關的細胞器如線粒體、 內質網等發生腫脹甚至破損; 與對照組相比,ROS含量和SOD活性分別在20mol·L-1、200mol·L-1開始出現顯著性差異(P<0.05),證實在PFOS引起的氧化應激反應中SOD起到了清除自由基作用以維持細胞穩態。研究表明,PFOS對海洋魚類細胞具有一定的生物毒性,能引起細胞產生氧化應激反應,并進一步破壞生物膜系統,從而導致細胞增殖和多種代謝途徑受到抑制。
全氟辛烷磺酸; 肝細胞; 半滑舌鰨; 細胞毒性; 氧化應激
全氟辛烷磺酸(PFOS)是一種具有疏水、疏油特性的表面活性劑,在工業生產中具有重要應用,包括金屬電鍍、潤滑劑、農藥、紡織、造紙、食品包裝等[1-2]。由于具有持久性、生物蓄積性和毒性,PFOS及其鹽類在2009年被《斯德哥爾摩公約》確定為新興持久性有機污染物。由于沒有很好的替代產品,PFOS仍在金屬電鍍、半導體、航空液壓油、泡沫滅火器等領域生產和使用[3]。PFOS上的C-F鍵穩定性強、難被降解,在全球范圍內的多種環境介質中均檢測到不同程度的PFOS污染[4-5],并且PFOS在生物體和人體中也有大量富集[6],因此近幾年PFOS的環境風險問題開始受到人們普遍關注。
相比于其他持久性有機污染物,PFOS溶解度較高、不易揮發,所以水環境是其污染傳播的重要途徑[7-8]。從世界多地海水和海洋生物的檢測結果來看,表層海水和近海岸地區的可食用海產品中PFOS均有檢出[9-12],并且廢水和半導體制造廠附近海水中PFOS污染較嚴重[13],在東京灣、佛蘭德斯地區以及滅火泡沫意外溢漏區域的檢測結果發現,魚體肝臟是PFOS的重要富集場所,其最大檢出范圍為1.8~9.03 μg·g-1[14-16]。關于PFOS對水生生物特別是魚類的毒性研究表明,PFOS屬于中等毒性并能損傷全身器官的有毒污染物,將胚胎期海洋青鱂暴露于PFOS導致魚幼體免疫抑制并引發炎癥反應[17];水中PFOS暴露引起斑馬魚胚胎致畸、影響金魚游泳性能等毒性效應[18-20];Jennifer等[21]發現低濃度PFOS染毒下大頭魚腮內多種蛋白質差異性表達,并且這些蛋白可能與能量代謝和細胞骨架系統相關。迄今為止,PFOS對海洋生物毒性效應機制還不明確。
PFOS對海洋生物毒理效應的研究方法大多以魚類胚胎或魚體為實驗對象,由于生物體的免疫調節作用,沒有很好反映PFOS毒性作用機制。本文根據體外細胞穩定和對污染物敏感性高的特點,并基于魚類肝臟作為PFOS在魚體內的主要富集場所、同時也是生物體主要解毒器官的事實,以典型近海魚類半滑舌鰨肝臟細胞(HTLC)為實驗對象,研究PFOS對細胞活性及細胞器損傷影響,揭示在氧化應激反應下PFOS的致毒過程,為PFOS對海洋環境和海洋生物的潛在風險研究提供海洋生物細胞毒理的依據。
1 材料與方法(Materials and methods)
1.1 主要儀器與試劑
儀器: 細胞培養箱(上海一恒科技有限公司),Model 680型酶標儀(美國BioRad公司),374型熒光酶標儀(美國Thermo公司),XD-202型倒置顯微鏡(南京江南永新光學有限公司)。
試劑: 青鏈霉素抗體、四甲基偶氮噻唑藍MTT(北京索萊寶科技有限公司),全氟辛烷磺酸鉀鹽PFOSK(純度98%,上海晶純生化科技有限公司),DMEM-F12培養基(美國Thermo公司),成纖維生長因子bFGF(美國PeproTech公司),胎牛血清(浙江天杭生物科技有限公司),ROS試劑盒、SOD試劑盒、BCA法蛋白定量測試盒(南京建成生物工程研究所)。
1.2 細胞培養
半滑舌鰨肝臟細胞(HTLC)來源于任國誠等[22]建立的海洋魚類半滑舌鰨的肝臟組織細胞,該細胞系是貼壁生長細胞,形態呈纖維樣,傳代穩定,細胞培養條件為24 ℃,全培養基為含15%胎牛血清、1%青鏈霉素抗體、1% bFGF的DMEM-F12培養基。
1.3 MTT實驗
配置濃度為1 mol·L-1的PFOS標準品母液,逐級稀釋至實驗所需濃度,培養基中DMSO濃度<0.1%。將長勢良好的HTLC細胞以2×105個·mL-1密度接種于96微孔板中,培養24 h后,移出舊培養基,加入含不同濃度PFOS(20、100、200、400、1 000 μmol·L-1)標準培養基,同時設定無PFOS培養基作為空白對照組。每個實驗濃度包括6個平行,細胞于24 ℃培養,暴露時間24、48、72 h。染毒結束后,每孔加20 μL MTT(5 mg·mL-1)溶液,孵育4 h,再加入150 μL DMSO,振蕩10 min,用酶標儀在490 nm下測定吸光值。
1.4 透射電鏡實驗
依據MTT實驗結果,選擇20 μmol·L-1及200 μmol·L-12個濃度,對細胞染毒24 h后,進行電鏡實驗。收集106個細胞,進行固定、包埋、超薄切片、染色[23],利用JEOL JEM-1200EX型電子顯微鏡觀察。
1.5 ROS含量及SOD活性測定
使用化學熒光法和四唑鹽WST-1法測定細胞內ROS含量和SOD活性。PFOS(20、100、200、400、1 000 μmol·L-1)染毒24、48、72 h后收集細胞,PBS重懸沉淀,調整細胞濃度1×106個·mL-1,每組實驗設定3個平行,對照組為無PFOS培養基。實驗方法參照ROS、SOD及BCA試劑盒。
1.6 數據處理
運用Excel軟件計算各組數據平均值及標準差,采用SPSS 19.0軟件對實驗數據進行單因素ANOVA分析和t檢驗,完成對照組與染毒組之間的顯著性差異分析(*P<0.05差異顯著,**P<0.01差異極顯著)。
2 結果(Results)
2.1 細胞形態觀察
不同濃度PFOS作用于HTLC細胞24 h后,顯微鏡下觀察結果見圖1。發現隨著PFOS染毒濃度升高,200、400、1 000 μmol·L-1染毒組中HTLC細胞不規則程度增加,貼壁能力下降,細胞數量減少,PFOS對HTLC細胞具有明顯的增殖抑制效應。
2.2 MTT實驗結果
在檢測PFOS細胞毒性的MTT實驗中,PFOS濃度分別為200 μmol·L-1、400 μmol·L-1和1 000 μmol·L-1染毒組與對照組的細胞活性出現顯著差異(圖2)。當PFOS以200 μmol·L-1濃度作用72 h后,HTCL細胞活性顯著增加(P<0.05);PFOS濃度為400 μmol·L-1時,染毒48 h后的細胞活性與對照組相比具有顯著差異(P<0.05),染毒72 h差異極顯著(P<0.01);在PFOS濃度為1 000 μmol·L-1時,染毒24、48、72 h后細胞活性均受到極顯著抑制(P<0.01)。可見,隨著PFOS濃度增加及作用時間延長,HTCL細胞活性變化更顯著(圖2)。
2.3 透射電鏡實驗結果
透射電鏡觀察HTCL細胞受PFOS作用實驗結果見圖3。空白對照組HTCL細胞中線粒體清晰可見,細胞核及內質網完整;PFOS濃度20 μmol·L-1染毒組細胞核結構完整但形態發生變化、線粒體及內質網腫脹;PFOS濃度為200 μmol·L-1時,HTCL細胞細胞核并無裂解現象、但細胞核被擠到細胞膜內側,胞內產生大量脂質,線粒體及內質網模糊不清,細胞內膜系統破壞,損傷較嚴重。

圖1 不同濃度PFOS染毒24 h后HTLC細胞形態變化
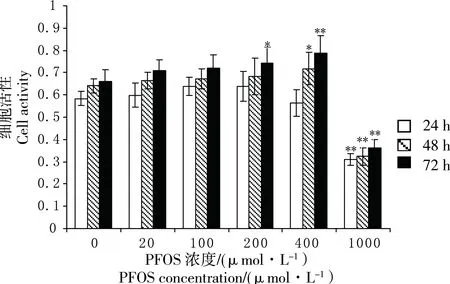
圖2 不同濃度PFOS對HTLC細胞活性的影響
2.4 ROS含量測定結果
不同濃度PFOS作用于HTLC細胞,細胞內ROS含量變化情況見圖4。HTLC細胞內ROS含量隨PFOS濃度增加而先升高后降低,隨PFOS作用時間延長呈升高趨勢。染毒24 h結果表明,HTLC細胞內ROS含量在PFOS濃度20 μmol·L-1染毒組與對照組相比顯著升高(P<0.05),200、400、1 000 μmol·L-1染毒組ROS含量極顯著降低(P<0.01);染毒48 h后,400、1 000 μmol·L-1組與對照組相比ROS含量極顯著降低(P<0.01);而染毒72 h時,20 μmol·L-1組細胞內ROS含量顯著升高(P<0.05),100、200、400、1 000 μmol·L-1染毒組ROS含量均顯著降低(P<0.05,P<0.01)。

圖3 不同濃度PFOS染毒24 h后電鏡觀察HTCL細胞結果(A,B:對照組;C,D:20 μmol·L-1;E,F:200 μmol·L-1)
2.5 SOD活性測定結果
在生物體內存在自由基產生和清除的動態平衡,SOD是清除ROS的典型抗氧化酶。PFOS染毒后,HTLC細胞內SOD含量升高(圖5)。PFOS濃度400 μmol·L-1和1 000 μmol·L-1組均具有極顯著差異(P<0.01)。在染毒24 h時,PFOS濃度200 μmol·L-1組的HTLC細胞內SOD含量與對照組相比具有顯著差異(P<0.05),染毒48 h和72 h后,隨PFOS濃度增加,SOD含量顯著升高(圖5),HTLC細胞表現出明顯的劑量依賴效應,說明在氧化應激過程中,SOD起到了清除HTLC細胞內自由基的作用。

圖4 不同濃度PFOS對HTLC細胞ROS含量影響

圖5 不同濃度PFOS對HTLC細胞SOD活性影響
3 討論(Discussion)
PFOS具有高蛋白結合性,易在動物的血液和肝臟中蓄積[24-25],高濃度暴露下,PFOS能影響生物體的免疫系統、生殖系統和神經系統發育,造成生物毒性效應[17,26-27]。Liu等[28]研究發現PFOS濃度大于500 μmol·L-1時對原代培養的羅非魚肝臟細胞具有毒性效應,并認為目前污染程度對魚類生殖發育帶來的風險很小。本研究中HTLC細胞比羅非魚肝臟細胞對PFOS的敏感性高,結果顯示PFOS濃度為100 μmol·L-1時可導致細胞形態發生明顯變化,并隨PFOS濃度升高細胞變形率增多;不同濃度PFOS作用下,細胞活性表現出低濃度促進高濃度抑制的毒性特點,因此,HTLC細胞可以作為PFOS對海洋生物毒性機理研究的理想模型。在PFOS染毒濃度為20~400 μmol·L-1時,細胞活性有增加現象,這可能與細胞為防止毒性產生而啟動了DNA修復過程有關[29],端正花等[30]的研究中同樣有PFOS顯著促進細胞增殖這一現象,并認為PFOS可能具有類雌激素風險。當染毒濃度為1 000 μmol·L-1時,PFOS極顯著抑制細胞活性,Arnaud和Shan等[31-32]研究PFOS對人體肝癌細胞毒性時也得出相似結論,即較高濃度暴露下PFOS具有明顯的細胞毒性效應。


圖6 PFOS引起細胞內產生氧化應激反應及毒性作用過程
綜上所述,本研究通過測定PFOS對細胞活性、細胞器損傷和氧化損傷相關酶活性的影響,初步揭示了不同染毒濃度和染毒時間下PFOS對海洋魚類細胞的致毒過程,即低濃度PFOS進入HTLC細胞后,通過與線粒體呼吸鏈輔酶結合,產生ROS同時阻礙ATP合成過程,進而造成琥珀酸脫氫酶(SDH)含量積累,產生細胞活性增加的假象,誘導細胞啟動DNA修復與SOD防御作用維持細胞代謝平衡,但細胞將長期處于由PFOS引起的氧化脅迫狀態;當高濃度PFOS所造成的損傷作用超出細胞自身修復防御能力時,細胞內ROS氧化與SOD還原失衡,產生氧化應激反應,大量ROS破壞生物膜系統及線粒體等細胞器,導致細胞內多種代謝途徑受到抑制,細胞活性降低,并由此引發細胞凋亡過程。
致謝:感謝青島黃海水產研究所陳松林研究員贈送本實驗所用HTLC細胞系,感謝孫愛老師對本實驗的幫助。
[1] 楊莉莉,金芬,李敏潔,等.食品和食品包裝材料中全氟化合物(PFCs)的研究進展[J].食品工業科技,2014,35(8): 367-373
Yang L L,Jin F,Li M J,et al.Research progress in advance of perfluorochemicals in food [J].Science and Technology of Food Industry,2014,35(8): 367-373 (in Chinese)
[2] 梅勝放.我國PFOS/PFOA的生產,應用以及國內外標準現狀[J].有機氟工業,2008 (1): 21-25
[3] Wang T,Wang Y,Liao C,et al.Perspectives on theinclusion of perfluorooctane sulfonate into the stockholm convention on persistent organic pollutants 1 [J].Environmental Science & Technology,2009,43(14): 5171-5175
[4] 楊永亮,路國慧,楊偉賢,等.沈陽地區水環境和生物樣品中全氟化合物的污染分布特征[J].環境科學學報,2010,30 (10): 2097-2107
Yang Y L,Lu G H,Yang W X,et al.Levels and distribution of perfluorinated compounds in water and biological samples from the Shenyang area,China [J].Acta Scientiae Circumstantiae,2010,30 (10): 2097-2107 (in Chinese)
[5] 潘媛媛,史亞利,蔡亞岐.土壤,底泥和活性污泥中全氟化合物的高效液相色譜-串聯質譜分析方法[J].環境化學,2010,29(3): 519-523
Pan Y Y,Shi Y L,Cai Y Q.Determination of perfluorinated compounds in soil,sediment and sludge using HPLC-MS/MS [J].Environmental Chemistry,2010,29(3): 519-523 (in Chinese)
[6] 胡佳玥,戴家銀.全氟及多氟類化合物在人體分布及其毒性研究進展[J].生態毒理學報,2013,8(5): 650-657
Hu J Y,Dai J Y.Advance instudies on human distribution and toxic effects of perfluoroalkyl and polyfluoroalkyl substances [J].Asian Journal of Ecotoxicology,2013,8(5): 650-657 (in Chinese)
[7] 楊蘭琴,馮雷雨,陳銀廣.中國水環境中全氟化合物的污染水平及控制策略[J].化工進展,2012,31(10): 2304-2312
Yang L Q,Feng L Y,Chen Y G.Pollution status and control strategies of perfluorinated compounds in water environments over China: A review [J].Chemical Industry and Engineering Progress,2012,31(10): 2304-2312 (in Chinese)
[8] 韓建,方展強.水環境PFOS和PFOA的污染現狀及毒理效應研究進展[J].水生態學雜志,2010,3(2): 99-105
[9] Pan Y,Shi Y,Wang Y,et al.Investigation of perfluorinated compounds (PFCs) in mollusks from coastal waters in the Bohai Sea of China [J].Journal of Environmental Monitoring,2010,12(2): 508-513
[10] Chen C,Wang T,Naile J E,et al.Perfluorinated compounds in aquatic products from Bohai Bay,Tianjin,China [J].Human and Ecological Risk Assessment: An International Journal,2011,17(6): 1279-1291
[11] Gulkowska A,Jiang Q,So M K,et al.Persistent perfluorinated acids in seafood collected from two cities of China [J].Environmental Science & Technology,2006,40(12): 3736-3741
[12] Zhao Y G,Wan H T,Law A,et al.Risk assessment for human consumption of perfluorinated compound-contaminated freshwater and marine fish from Hong Kong and Xiamen [J].Chemosphere,2011,85(2): 277-283
[13] Lin A Y C,Panchangam S C,Lo C C.The impact of semiconductor,electronics and optoelectronic industries on downstream perfluorinated chemical contamination in Taiwanese rivers [J].Environmental Pollution,2009,157(4): 1365-1372
[14] Moody C A,Martin J W,Kwan W C,et al.Monitoring perfluorinated surfactants in biota and surface water samples following an accidental release of fire-fighting foam into Etobicoke Creek [J].Environmental Science & Technology,2002,36(4): 545-551
[15] Taniyasu S,Kannan K,Horii Y,et al.A survey of perfluorooctanesulfonate and related perfluorinated organic compounds in water,fish,birds,and humans from Japan [J].Environmental Science & Technology,2003,37(12): 2634-2639
[16] Hoff P T,Van Campenhout K,Van de Vijver K,et al.Perfluorooctane sulfonic acid and organohalogen pollutants in liver of three freshwater fish species in Flanders (Belgium): Relationships with biochemical and organismal effects [J].Environmental Pollution,2005,137(2): 324-333
[17] Fang C,Huang Q,Ye T,et al.Embryonic exposure to PFOS induces immunosuppression in the fish larvae of marine Medaka [J].Ecotoxicology and Environmental Safety,2013,92: 104-111
[18] 葉露,吳玲玲,蔣雨希,等.PFOS/PFOA對斑馬魚(Danio rerio)胚胎致毒效應研究[J].環境科學,2009,29(6): 170-174
Ye L,Wu L L,Jiang Y X,et al.Toxicological study of PFOS/PFOA to zebrafish (Danio rerio) embryos [J].Environmental Science,2009,29(6): 170-174 (in Chinese)
[19] Shi X,Du Y,Lam P K S,et al.Developmental toxicity and alteration of gene expression in zebrafish embryos exposed to PFOS [J].Toxicology and Applied Pharmacology,2008,230(1): 23-32
[20] Xia J,Fu S,Cao Z,et al.Ecotoxicological effects of waterborne PFOS exposure on swimming performance and energy expenditure in juvenile goldfish (Carassius auratus) [J].Journal of Environmental Sciences,2013,25(8): 1672-1679
[21] Dorts J,Kestemont P,Marchand P A,et al.Ecotoxicoproteomics in gills of the sentinel fish species,Cottusgobio,exposed to perfluorooctane sulfonate (PFOS) [J].Aquatic Toxicology,2011,103(1): 1-8
[22] 任國誠,陳松林,沙珍霞.半滑舌鰨肝臟細胞系的建立與鑒定[J].高技術通訊,2008,18(6): 657-660
Ren G C,Chen S L,Sha Z X.Development and characterization of a liver cell line from half-smooth tongue-sole (Cynoglossus semilaevis) [J].Chinese High Technology Letters,2008,18(6): 657-660 (in Chinese)
[23] 李龍,陳家堃.現代毒理學實驗技術原理與方法[M].北京: 化學工業出版社,2006: 79
[24] 沈葆真,曹文軍,鐘鍵.全氟化合物在生物體內污染水平的研究進展[J].化學與生物工程,2014,31(1): 6-9
[25] Bao J,K?rrman A,van Bavel B,et al.Perfluoroalkyl substances in the blood samples from a male population of Sweden [J].Chinese Science Bulletin,2014,59(4): 388-395
[26] 劉曉暉,胡宏,李雙月,等.全氟辛烷磺酸神經發育毒性機制研究進展[J].生態毒理學報,2013,8(5): 643-649
Liu X H,Hu H,Li S Y,et al.Research progress on mechanisms in the developmental neurotoxicity of PFOS [J].Asian Journal of Ecotoxicology,2013,8(5): 643-649 (in Chinese)
[27] Pereiro N,Moyano R,Blanco A,et al.Regulation of corticosterone secretion is modified by PFOS exposure at different levels of the hypothalamic-pituitary-adrenal axis in adult male rats [J].Toxicology Letters,2014,230(2): 252-262
[28] Liu C,Du Y,Zhou B.Evaluation of estrogenic activities and mechanism of action of perfluorinated chemicals determined by vitellogenin induction in primary cultured tilapia hepatocytes [J].Aquatic Toxicology,2007,85(4): 267-277
[29] Kienzler A,Bony S,Devaux A.DNA repair activity in fish and interest in ecotoxicology: A review [J].Aquatic Toxicology,2013,134: 47-56
[30] 端正花,王勛功,王華.全氟辛烷羧酸(PFOA)與全氟辛烷磺酸(PFOS)的細胞毒性效應[J].生態毒理學報,2014,9(2): 353-357
Duan Z H,Wang X G,Wang H.The cytotoxic effect of PFOA and PFOS [J].Asian Journal of Ecotoxicology,2014,9(2): 353-357 (in Chinese)
[31] Florentin A,Deblonde T,Diguio N,et al.Impacts of two perfluorinated compounds (PFOS and PFOA) on human hepatoma cells: Cytotoxicity but no genotoxicity? [J].International Journal of Hygiene and Environmental Health,2011,214(6): 493-499
[32] Shan G,Ye M,Zhu B,et al.Enhanced cytotoxicity of pentachlorophenol by perfluorooctanesulfonate or perfluorooctanoic acid in HepG2 cells [J].Chemosphere,2013,93(9): 2101-2107
[33] Reuter S,Gupta S C,Chaturvedi M M,et al.Oxidative stress,inflammation,and cancer: How are they linked? [J].Free Radical Biology and Medicine,2010,49(11): 1603-1616
[34] 張晶,梁岳,方展強.全氟辛烷磺酸類物質對劍尾魚Cu/Zn-SOD及相關應激基因表達的影響[J].水產學報,2014,38(4): 482-490
[35] 王賀威,馬勝偉,張喆,等.全氟辛烷磺酸鹽(PFOS)脅迫對翡翠貽貝抗氧化酶的影響[J].生態毒理學報,2012,7(5): 508-516
Wang H W,Ma S W,Zhang Z,et al.Effects of perfluorooctane sulfonate (PFOS) exposure on antioxidant enzymes of Perna viridis [J].Asian Journal of Ecotoxicology,2012,7(5): 508-516 (in Chinese)
[36] Wang X,Zhao G,Liang J,et al.PFOS-induced apoptosis through mitochondrion-dependent pathway in human-hamster hybrid cells [J].Mutation Research/Genetic Toxicology and Environmental Mutagenesis,2013,754(1): 51-57
[37] Klaunig J E,Kamendulis L M.The role of oxidative stress in carcinogenesis [J].Annual Review of Pharmacology and Toxicology,2004,44: 239-267
[38] Orrenius S,Nicotera P,Zhivotovsky B.Cell death mechanisms and their implications in toxicology [J].Toxicological Sciences,2011,119(1): 3-19
[39] Zhang D Y,Xu X L,Shen X Y,et al.Analysis of apoptosis induced by perfluorooctane sulfonates (PFOS) in mouse leydig cells in vitro [J].Toxicology Mechanisms and Methods,2015,25(1): 21-25
◆
Toxicity Effects of Perfluorooctane Sulfonate (PFOS) on Liver Cells ofCynoglossussemilaevis
Dang Honglei1,2,Na Guangshui2,*,Gao Hui2,Li Ruijing2,Gao Yanfei1,Yao Ziwei2,Zu Guoren1,#
1.School of Biological Engineering,Dalian Polytechnic University,Dalian 116034,China 2.Key Laboratory for Ecological Environment in Coastal Areas of State Oceanic Administration,National Marine Environmental Monitoring Center,Dalian 116023,China
11 November 2014 accepted 3 December 2014
MTT assay and transmission election microscope (TEM) were used to analyze the cytotoxicity of perfluorooctane sulfonate (PFOS) on liver cells of Cynoglossus semilaevis (HTLC).Reactive oxygen species (ROS) and superoxide dismutase (SOD) activity were applied to evaluate the oxidative damage of HTLC exposed to different concentrations of PFOS for 24,48,72 h,respectively.The results indicated that cell activity was promoted under the low concentration of PFOS.However,the activity was inhibited obviously when PFOS concentration increased to 1 000 μmol·L-1(P<0.01).TEM results showed that organelles relevant to metabolism,such as intracellular mitochondria and endoplasmic reticulum,would swell and/or be damaged under the condition of high PFOS concentration in HTLC.ROS contents and SOD activity also displayed significant difference at 20 μmol·L-1and 200 μmol·L-1of PFOS,respectively (P<0.05),indicating that SOD can maintain the cellular homeostasis by removing free radicals induced in the process of oxidative stress caused by PFOS.The results confirmed that the proliferation and metabolic pathways can be inhibited significantly by PFOS in HTLC by the oxidative stress and then the destruction of the biomembrane system of HTLC in marine fish.
PFOS; Cynoglossus semilaevis; liver cell; cytotoxicity; oxidative stress
國家海洋局海洋公益性科研專項(201105013);國家自然科學基金(21377032);國家海洋局近岸海域生態環境重點實驗室開放 基金(201506)
黨紅蕾(1990-),女,碩士研究生,研究方向為污染物毒理,E-mail: hongleidang@163.com;
*通訊作者(Corresponding author),E-mail: gsna@nmemc.org.cn
10.7524/AJE.1673-5897.20141111002
2014-11-11 錄用日期:2014-12-03
1673-5897(2015)4-162-08
X171.5
A
那廣水(1977-),男,博士,研究員,碩士生導師,從事新型污染物環境行為及其毒理學研究。
#共同通訊作者(Co-corresponding author),E-mail: zugr@dlpu.edu.cn
黨紅蕾,那廣水,高會,等.全氟辛烷磺酸(PFOS)對半滑舌鰨肝臟細胞的毒性效應[J].生態毒理學報,2015,10(4): 162-169
Dang H L,Na G S,Gao H,et al.Toxicity effects of perfluorooctane sulfonate (PFOS) on liver cells of Cynoglossus semilaevis [J].Asian Journal of Ecotoxicology,2015,10(4): 162-169 (in Chinese)

