急性脊髓損傷后的炎癥反應及其抗炎治療
王濤麗,顧 兵,李華南,張國福,張 思
(1. 江西科技師范大學生命科學學院,江西 南昌 330013; 2. 江西中醫藥大學附屬醫院脊柱外科,江西 南昌 330006)
急性脊髓損傷后的炎癥反應及其抗炎治療
王濤麗1,顧 兵1,李華南2,張國福2,張 思1
(1. 江西科技師范大學生命科學學院,江西 南昌 330013; 2. 江西中醫藥大學附屬醫院脊柱外科,江西 南昌 330006)
急性脊髓損傷可導致嚴重的運動、感覺和括約肌功能障礙。由炎癥因子引起的炎癥反應在繼發性損傷的發生、發展過程中起關鍵作用。通過恰當的抗炎干預維持機體致炎/抗炎平衡,將成為脊髓損傷藥物治療的一條重要策略。該文主要介紹炎癥反應的產生原因、作用過程以及參與急性脊髓損傷的病理生理機制,并綜述抗炎藥物實驗研究的最新進展,旨在為尋找安全有效的藥物提供參考依據。
脊髓損傷;繼發性損傷;炎癥反應;抗炎治療;甲基強的松龍;米諾環素
脊髓損傷(spinal cord injury, SCI)按發生機制可以分為原發性損傷與繼發性損傷。前者是由于初始外力直接或間接作用于脊髓所造成的,后者則是在前者的基礎上通過一系列生理生化機制,如氧化應激、炎癥反應及興奮性氨基酸過度釋放等,使病灶周圍完整的組織發生自身破壞性病變,進一步加深損傷程度,擴大損傷范圍[1]。SCI后的炎癥反應比較復雜,涉及神經、免疫兩大系統,各種因子的動態作用,成為組成繼發性損傷的重要事件。大量研究表明,SCI引起的炎癥反應具有神經損傷與神經保護的雙重效果[2]。因此,需要利用其在SCI修復中的正、負兩相作用,在選擇性發揮其修復潛能的同時,最大限度的減小其破壞作用。本文就急性SCI后的炎癥反應及其抗炎治療藥物做一總結,旨在揭示炎癥反應在繼發性損傷中的作用機制,幫助尋找安全有效的抗炎靶標。
1 脊髓損傷與炎癥反應
炎癥趨化因子和細胞因子能夠補充、激活免疫細胞和中樞神經細胞,在促進和維持炎癥反應的過程中起關鍵作用。任何組織中,炎癥應答都有其自身極限并能適時消退。消退程序還包括細胞因子從促炎轉向抗炎,以及類花生四烯酸從促炎因子轉向促炎癥消退的脂質介質[3]。炎癥反應如果不能在受傷區域以恰當的免疫應答方式結束,其不利影響將會擴大。中樞神經系統軸突再生及受損神經元的補充能力有限,因此炎癥對其產生的不利影響比其他組織更為明顯,能引起神經元、少突膠質細胞的凋亡及瘢痕的形成。
1.1 免疫細胞活化參與免疫應答的細胞有淋巴細胞、中性粒細胞、抗原提呈細胞及吞噬細胞等。免疫炎癥細胞在SCI時被激活,能夠釋放細胞因子和炎癥介質來攻擊靶細胞。在SCI后迅速發生殘存膠質細胞活化,外源炎性細胞向損傷區遷移、浸潤等一系列反應而產生神經毒性作用。
1.1.1 淋巴細胞 SCI可以導致脫髓鞘反應,產生的髓鞘堿性蛋白可激活T細胞。活化后的T細胞表面出現大量細胞粘附分子,易與血管內皮細胞粘附使T細胞進入CNS,抑制軸突的枯死并促進神經保護作用。Aharoni等[4]報道,實驗性自身免疫性腦脊髓炎大鼠T細胞能夠分泌腦源性神經營養因子(BDNF),有助于抑制神經元死亡、促進軸突再生及髓鞘再生與重建。然而,T、B細胞的活化也有可能加劇脊髓或外周神經的損傷程度。因此,這些炎癥信號的發生可以作為治療損傷后炎癥反應的新靶點。
1.1.2 中性粒細胞 SCI早期中性粒細胞迅速進入損傷區域,并在24 h內達到峰值,活化的中性粒細胞和巨噬細胞通過釋放細胞因子、自由基、類花生四烯酸和蛋白酶產生神經細胞毒性。SCI后靜脈注射CD11d/CD18的抑制素,能夠顯著減少中性粒細胞侵入,可有效促進其功能恢復。但同時也能夠減少巨噬細胞的數目,所以該類方法促進神經恢復不能完全歸功于對中性粒細胞的抑制。Stirling等[5]使用Ly6G/Gr-1單克隆抗體有選擇性地降低小鼠SCI組織內中性粒細胞數量,結果損傷組織惡化加劇,表明SCI后中性粒細胞的侵入對損傷組織可能有好處。因此,不能完全的將減少中性粒細胞浸潤損傷區作為治療SCI的一種策略。
1.1.3 巨噬細胞/小膠質細胞 它們最先對CNS損傷做出響應,并在損傷區產生多種促炎因子、蛋白酶和其他細胞毒性的因子。活化的巨噬細胞能夠產生Ca2+結合蛋白,從而促進損傷區的組織恢復。在體外用脂多糖LPS激活巨噬細胞,能夠通過Toll-4樣受體誘導iNOS和TNF-α的表達,促進炎癥反應的發生。然而,Boven等[6]報道在體外攝取髓鞘能夠改變巨噬細胞的功能,使其釋放抗炎因子。SCI早期,損傷區的小膠質細胞活化能夠產生促炎因子(IL-1β、TNF-α等)、蛋白酶及其他細胞毒性物質,導致細胞死亡和脫髓鞘反應。此外,超氧化物和NO誘導過氧亞硝酸鹽的生成,促進小膠質細胞殺死神經元。David等[7]實驗表明,抑制巨噬細胞和小膠質細胞進入正常的髓鞘區能夠減少炎癥病變的擴散。因此,SCI后活化的巨噬細胞和小膠質細胞是一把“雙刃劍”,需要在多個方面、多個層次研究巨噬細胞和小膠質細胞的作用機制。
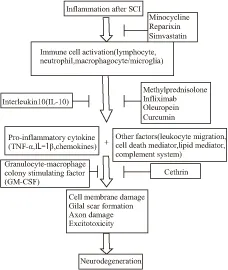
Fig 1 Schematic mechanisms linking inflammatory response and secondary injury/repair in acute SCI
SCI-triggered inflammatory response results in a series of pathophysiological changes, and consequently leads to neurodegeneration. Conventional anti-inflammatory drugs (e.g., methylprednisolone, minocycline), new anti-inflammatory approaches (e.g., cethrin,infliximab, reparixin,and other anti-inflammatory agents) and immune mediators in the body shown to be neuroprotective through their specific pathway in SCI models.
In figure: + represents induction of the next step, ├represents inhibition of the next step.
1.2 炎癥反應
1.2.1 促炎因子
1.2.1.1 TNF-α SCI后15min檢測到TNF-α mRNA的表達,至損傷后1 h,其表達水平達到最大值。SCI后期,TNF-α可誘導神經元和少突膠質細胞的死亡,導致運動和感覺功能的喪失。此外,它能夠調節興奮性神經遞質介導的中樞敏感化和痛覺過敏[8]。其次,它能夠誘導核轉錄因子(NF-κB)的活化,形成級聯反應,介導白介素、蛋白酶、細胞黏附分子表達上調加強炎癥應答,SCI后可以通過給予TNF-α抑制劑,或者通過TNFR1的基因敲除改善運動功能,以減少細胞凋亡和組織損傷及降低與SCI有關的炎癥反應[9]。Dinomais等報道患有強直性脊柱炎的病人服用依那西普(Etanercept),兩年后神經功能缺失得到較大改善,說明TNF-α阻斷劑在治療SCI方面具有潛在的功效,應加以深入研究。
1.2.1.2 IL-1β 不同類型的白細胞介素在SCI時發揮不同的作用。其中,IL-1β、IL-6具有促炎作用。IL-1β可以協同NF-κB、TNF-α、INF-γ上調黏附分子的表達,介導損傷后的炎癥反應,引起繼發性損傷。SCI后30 min,IL-1β在神經元和軸突中表達;損傷后5 h,在小膠質細胞中檢測到IL-1β的表達。Zong等[10]給SCI大鼠髓鞘內注入IL-1β受體拮抗劑,損傷區的神經功能得到顯著改善, 表明IL-1β在損傷早期對神經元及組織損傷嚴重。此外,IL-1β有助于誘發周圍神經和組織的損傷。它不僅對損傷病變的恢復(病灶大小和神經膠質的活化)不利,而且影響CNS軸突可塑性[11]。因此,深入了解IL-1β將有利于對炎癥反應實施更合理的控制,以降低其不利影響。
1.2.2 趨化因子 趨化因子(chemotactic factor)是細胞因子的一個亞家族,具有促炎和遷移的作用,在SCI引發的炎癥反應中作為免疫細胞的化學誘導物[12]。SCI 后給予CXCL-10封閉抗體治療可以顯著降低炎癥反應、細胞凋亡、神經元及組織的缺失,增強功能的恢復、組織和神經元軸突再生[13],說明CXCL-10對SCI的恢復不利,可通過中和或者抑制其表達,減輕CXCL-10 在SCI中的不利影響。另有研究發現,CXCL-12能夠通過CNS髓鞘的生成,促進神經突的生長,增強SCI后軸突再生和重建。趨化因子及其受體在CNS中廣泛表達,對于干細胞的遷移、軸突的生長和神經傳導的調節有重要作用。外周神經損傷后,單核細胞趨化蛋白-1(MCP-1)能夠增加疼痛感受器的興奮性,阻斷MCP-1信號抑制神經性疼痛的傳導。脊髓中小膠質細胞表達的MCP-1受體CCR2在引發和維持過敏性疼痛中發揮積極作用,并且MCP-1也可能改變脊髓神經元興奮性。SCI后,MCP-1對于巨噬細胞的補充和髓磷脂吞噬起重要作用,關于其是否能夠促進繼發性損傷仍待驗證。
1.2.3 細胞防護因子
1.2.3.1 粒細胞-巨噬細胞集落刺激因子 粒細胞-巨噬細胞集落刺激因子(GM-CSF)是一種血細胞生成的細胞因子,它可通過抑制膠質瘢痕形成和提高軸突結構完整性而促進SCI后的長期恢復。調查顯示,在體外系統使用轉化生長因子-β(TGF-β)治療原發性膠質細胞后,GM-CSF能夠抑制硫酸軟骨素蛋白多糖(CSPGs)在星形膠質細胞中表達,進而抑制膠質瘢痕形成,為神經細胞的損傷提供治療。GM-CSF也能調節巨噬細胞的功能,以增加大腦衍生的BDNF的產生。研究者通過GM-CSF治療SCI大鼠,其觸覺和冷覺感受器功能的恢復得到提高[14],表明其對于SCI導致的功能損失的修復有促進作用。缺氧狀態下,促紅細胞生成素能夠增強GM-CSF的表達,有利于移植的神經干細胞存活和行為改善,為SCI的治療提供幫助[15]。GM-CSF對于SCI的治療具有顯著意義,應該對其進行深入的研究,為更多的SCI病人解除病痛。
1.2.3.2 白介素-10 白介素-10(IL-10)是一種有效的抗炎細胞因子,能夠降低神經損傷炎癥的發生。Fink 等發現IL-10對于脊髓神經元有直接的營養影響,并且激活神經元的IL-10受體,能夠為克服體外的谷氨酸神經毒性提供營養支持。此外,IL-10能夠使促炎因子IL-1β、IL-2、IL-6、TNF-α等的表達下調,對于SCI引起的炎癥反應、興奮性毒性損傷及細胞凋亡具有潛在的治療作用[16]。對于CNS來說,IL-10能夠降低星形膠質細胞產生的TNF-α以及星形膠質細胞和小膠質細胞遞呈的抗原。體外研究表明,IL-10與其抗體結合對神經元產生直接的保護作用,說明IL-10可以為SCI提供直接的神經保護。針對IL-10在炎癥反應中的作用,我們應該做更細致的研究,為SCI病人提供更精準的治療。
1.3 促進繼發性損傷的其他因子
1.3.1 白細胞的遷移 白細胞在血管內皮的遷移是一項高度有規律的過程,是炎癥和免疫應答過程的核心環節。在正常的生理條件下,僅有少數的免疫細胞能夠通過血腦屏障進入CNS。SCI及其他CNS疾病發生后,血腦屏障受損、血管周圍的白細胞浸潤,除了促進血塊的形成、組織水腫,血清蛋白還能引起神經毒性[17]。血管壁上的白細胞通過內皮屏障進入到大腦軟組織,介導CNS早期免疫應答。白細胞β-整合蛋白家族成員與細胞間黏附分子-1(ICAM-1)和血管細胞間黏附分子-1(VCAM-1)相互作用促進白細胞遷移,導致劇烈炎癥、加劇神經元損害。在SCI后給予αDβ2(CD11d/CD18)和α4β1整合素的抑制性抗體,能夠降低中性粒細胞和巨噬細胞浸潤損傷組織,起神經保護和促進功能恢復的作用。這種減少白細胞的浸潤、自由基形成與增強運動恢復和組織保護相關聯[18]。用抗整合蛋白抗體阻斷白細胞進入的同時,也能減輕自主神經反射異常。血源性白細胞遷移對SCI后繼發性損害將產生不利影響。
1.3.2 細胞死亡介質 壞死性細胞死亡與急性損傷有關,可以導致細胞解體及釋放它的內含物到周圍組織。細胞凋亡又稱程序性細胞死亡,由細胞內半胱氨酸依賴性天冬氨酸特異性蛋白酶激活參與介導。SCI后神經元凋亡與壞死機制有關,細胞凋亡對受損區和繼發性變性區的少突膠質細胞及神經元的死亡起重要作用[19]。Villa-Alba等研究發現,SCI后3 d,CD95和CD95L表達上調,利用抗體中和CD95L的含量能夠減少細胞凋亡的數目,減少神經元和少突膠質細胞的死亡,且改善神經行為功能。小膠質細胞、淋巴細胞、星形膠質細胞和神經元能夠表達CD95L,表明它們在損傷脊髓中具有潛在的細胞毒性。然而,CD95L也能誘導小膠質細胞和淋巴細胞的死亡,而這些細胞在SCI后也能表達CD95。因此,CD95可能抑制這些免疫細胞的炎癥反應,誘導細胞凋亡,從而降低繼發性損傷。對于SCI后炎癥反應的消退是否涉及到CD95需要進一步評估。當然,導致細胞死亡的其他感受器(如TNF)也可以作為評估對象。
1.3.3 脂質介質 SCI中脂質介質,包括血栓素A2、PG、白三烯及血小板活化因子等,可調節炎癥反應,具有促進神經損傷及保護受損組織的雙重作用。一般都認為PG是炎癥介質,但個別PG也可能發揮抗炎作用。使用15d-PGJ2治療SCI小鼠能夠減少小膠質細胞活化,降低趨化因子、細胞因子表達,減少脫髓鞘作用,促進感覺功能恢復和運動功能改善[20]。磷脂酶A2(PLA2)家族的不同成員,可介導促炎或抗炎脂質的釋放。有研究顯示,對于實驗性EAE、PLA2超家族成員具有不同的作用,細胞內的PLA2s對于EAE的發病具有促進作用,而分泌型的PLA2s具有潛在的緩解作用。因此,選擇性阻斷PLA2家族成員的促炎作用可能是治療SCI的有效途徑[21]。通過對其家族主要成員中的小分子抑制劑的測試,表明其可能是潛在的SCI治療劑候選者。
1.3.4 補體系統 補體廣泛參與機體的防御反應和免疫調節,也可介導炎癥反應的損傷性反應。SCI后血腦屏障出現故障,允許補體循環進入CNS。SCI能夠激活補體系統,其介導的炎癥反應是繼發性損傷的重要環節。補體激活導致C3和C5裂解產生C3b,其結合免疫復合物與C5b啟動C5b-9復合物(膜攻擊復合物),引起細胞的死亡和活化。此外,過敏毒素C3a和C5a從炎癥區擴散,募集炎癥細胞引起炎癥反應,表明補體系統過度的激活可能會導致自身的損害,加重繼發性損傷。補體蛋白存在于變性細胞、神經元、少突膠質細胞,在經C1q和B因子染色后軸突中也能觀察到,說明補體蛋白在SCI中具有促進脫髓鞘和軸突退化的潛在作用[22]。SCI后補體蛋白能夠在神經元軸突和少突膠質細胞沉積,表明這些細胞可能是補體系統的靶點。另外,補體能夠顯著的影響T細胞活化、增殖以及抗原提呈細胞的功能,促進SCI免疫應答的發生。
2 SCI的抗炎治療
由SCI引發的免疫炎癥反應作為繼發性損傷的重要機制,始終是人們研究和關注的熱點。炎癥是SCI后血管組織正常的生理反應,過度產生將會導致嚴重的繼發性損傷,使組織損傷及神經元的死亡加劇,影響SCI后神經元的修復和功能的改善。目前,許多SCI藥物和治療方法已經進入臨床實驗,但調節免疫應答的效果仍有待提高。為減輕SCI后炎癥反應,減少炎性細胞因子的侵入,促進SCI后功能的恢復,研究者需要從引發炎癥機制的不同方面入手,如炎癥因子、趨化因子、細胞因子等作用過程,以期尋找治療SCI的最佳途徑。
2.1 傳統抗炎藥物
2.1.1 甲基強的松龍 甲基強的松龍(methylprednisolone,MP)作為糖皮質激素類甾體藥物,其神經保護機制主要是抑制創傷性SCI的脂質過氧化。MP治療SCI對于炎癥的抑制作用也有顯著的影響。研究發現,MP治療(30 mg·kg-1)SCI大鼠能夠抑制TNF-α的表達及NF-κB的活性,促進神經功能恢復。MP在損傷組織內能保持生物活性,顯著降低繼發性損傷引起的炎癥反應和蛋白的表達,從而降低水腫[23]。有研究發現,MP聯合羊膜間充質干細胞能夠降低髓過氧化酶的活性及細胞凋亡,降低TNF-α、IL-1β、IL-6等促炎因子的表達,增加IL-10的水平[24]。迄今為止,MP用于治療SCI已經20多年,但是由于時間窗和給藥劑量方面存在較大的問題,引起了各方面的爭議。因此,對于MP治療SCI需要進行嚴格的控制給藥劑量和給藥時間,為病人減輕病痛。
2.1.2 米諾環素 米諾環素(minocycline)能夠降低SCI模型的小膠質細胞的活化及炎癥應答,減輕神經元和小膠質細胞凋亡,改善神經及組織功能的恢復。Casha等[25]報道給予米諾環素治療SCI病人,12個月后其運動功能恢復得到改善。米諾環素可以通過抑制促神經生長因子(proNGF)的表達,降低少突膠質細胞凋亡,從而改善SCI后的功能恢復。SCI后給予米諾環素治療,能夠明顯降低caspase-3活性及TNF-α的表達,抑制神經營養因子p75受體表達和Rho A的激活。此外,米諾環素可以通過消除SCI繼發性損傷而達到神經保護及功能恢復的作用[26]。因而,米諾環素治療SCI能夠調節細胞因子的表達,減少細胞的死亡及損傷區的大小,并能促進功能恢復。
2.2 抗炎藥物實驗研究進展
2.2.1 C3轉移酶:賽生靈 賽生靈(cethrin,BA-210)作為一種新型的Rho抑制劑,是纖維蛋白粘合劑整合的可透過性C3轉移酶,能夠自由的穿過細胞膜[27]。SCI后Rho活化導致細胞死亡。BA-210能夠抑制Rho活性,對大鼠SCI模型具有神經保護和功能修復的作用。研究表明抑制Rho或其下游分子,比如Rho-相關蛋白激酶(ROCK),能引起軸突生長和功能的恢復。SCI后70%的RhoA-和RhoB-陽性細胞是免疫細胞,主要是中性粒細胞、小膠質細胞和巨噬細胞,這表明Rho抑制劑BA-210的保護效應可通過調節炎癥應答介導產生。BA-210臨床治療SCI的結果顯示,給藥劑量在0.3~6 mg·kg-1時,耐受性和安全性較好;其給藥劑量為3 mg·kg-1時,能夠顯著改善病人的損傷程度,增強功能恢復[28]。因此,在今后的SCI治療中,BA-210可能作為一種新型藥物進行使用。
2.2.2 TNF-α抑制劑:英夫利昔單抗 英夫利昔單抗(infliximab)是一種人鼠嵌合的IgG1單克隆抗體,能夠抑制TNF-α的生物活性。英夫利昔單抗用于治療SCI小鼠,抑制TNF-α的活性,明顯較少中性粒細胞的浸潤、細胞因子的表達,抑制細胞凋亡、脊髓炎癥及組織損傷的加劇[29]。此外,其用于急性SCI大鼠還能夠降低NF-κB的表達[30]。英夫利昔單抗治療炎癥反應在第2、6周給藥3~5 mg·kg-1能夠出現顯著的治療效果,并且耐藥性和安全性較好。然而,對于SCI患者,其臨床應用較少,需要進一步的研究調查。
2.2.3 瑞帕立辛 瑞帕立辛(reparixin)是CXCR2的功能抑制劑,能夠減輕SCI后的炎癥反應并且促進功能的恢復。Gorio等發現,瑞帕立辛能夠抑制SCI大鼠CXCR2受體活化,降低少突膠質細胞的凋亡、炎癥因子(MIP、TNF-α、IL-6及IL-1β)的表達及減少炎癥細胞浸潤,從而降低SCI的繼發性變性。此外,研究發現瑞帕立辛不僅能夠降低SCI后炎癥應答,而且能夠保存灰質的完整性及減少自主反射性異常[31]。SCI后給予瑞帕立辛治療情況顯示,損傷后0.5 h內靜脈注射15 mg·kg-1,6h內每2 h皮下給藥一次,其后每天2次給藥,到d 4~8的時候效果最為明顯, 說明其治療SCI后潛能較大。與MP相比,瑞帕立辛對于后肢功能的恢復效果較好,而MP只是短期內有效。因此,瑞帕立辛可以作為治療SCI引起的炎癥反應和繼發性病變的可選擇性藥物。
2.2.4 辛伐他汀 辛伐他汀(simvastatin)是3-羥基-3-甲基戊二酰輔酶A(HMG-CoA)還原酶,可以通過降脂作用發揮免疫調節和抗炎作用[32]。有文獻報道,他汀類藥物能抑制SCI后促炎癥因子如TNF-α和IL-1β的釋放,從而干預在脊髓繼發性損傷中發揮重要作用的炎癥應答。SCI小鼠,給予辛伐他汀治療能夠激活PPAR-α,從而抑制促炎轉錄因子NF-κB的信號通路,減少趨化因子、iNOS的表達以及中性粒細胞的浸潤,促進抗炎作用。此外,Han等[33]發現辛伐他汀可通過上調BDNF和GDNF的表達改善SCI大鼠的功能恢復及神經保護作用。因此,辛伐他汀可能成為治療SCI的有效藥物。
2.2.5 橄欖苦苷 橄欖苦苷(oleuropein)是橄欖油中的一種酚類化合物,具有清除自由基和抗氧化自由基、抗炎、抗癌活性、抗微生物活性、抗動脈粥樣硬化、抗病毒等功能。雖然橄欖苦苷的抗氧化和自由基的清除作用已經廣泛流傳,但是其抗炎作用也被陸續證實。研究顯示,橄欖苦苷能夠抵抗脂氧化酶及白三烯B4引起的的炎癥反應,抑制促炎因子的生物合成。在大鼠SCI模型中給予橄欖苦苷(20 mg·kg-1)進行治療,結果表明其能夠抑制TNF-α、IL-1β、3-NT、iNOS、COX-2及PARP的表達[34],從而調節炎癥反應,減輕其引起的繼發性損傷。對于橄欖苦苷抗炎效果的研究表明,其可用于SCI引起的炎癥反應,減輕繼發性損傷。
2.2.6 姜黃素 姜黃素(curcumin)是從植物姜黃中提取的多酚類化合物,能夠減弱SCI后的炎癥應答而起到保護作用。有研究結果顯示,姜黃素治療SCI大鼠能夠明顯下調NF-κB炎癥信號傳導、改善運動功能、脊髓水腫及抑制細胞凋亡[35]。Kim等[36]給予急性SCI大鼠腹腔注射姜黃素(200 mg·kg-1),巨噬細胞數量降低,抗炎抗氧化功能明顯,有助于ASCI大鼠神經的保護。此外,姜黃素還可能通過抑制膠質瘢痕的形成及抗炎作用促進受損脊髓的修復。然而,通過藥動學研究發現其體內吸收差且易代謝,因此在進一步的研究中,需要考慮開發合適的劑型,以提高其溶解度,增強其藥理作用及方便給藥途徑。
2.2.7 其他在SCI模型中具有抗炎作用的藥物 除了以上介紹的抗炎藥物外,還有一些其他的藥物可能對SCI引起的炎癥有抑制作用。例如神經節甘脂、促紅細胞生成素、免疫球蛋白G[37]、雷帕霉素[38]、右旋美托咪定、表沒食子兒茶素[39]、丹參酮ⅡA[40]、人參三七皂苷等對SCI后引起的炎癥反應均有一定的治療作用。其可通過抑制某些炎癥因子(TNF-α、IL-1β及IL-6等)的生成,從而減輕炎癥反應的發生。人們應該進一步研究它們對于SCI炎癥反應的作用機制,為尋找更好的治療藥物做鋪墊。
3 展望
炎癥反應是SCI繼發性損傷的重要因素之一,許多種因子的產生已經成為判定損傷程度的重要指標。采取各種措施防止或抑制炎癥的過程已經成為SCI治療的一種手段。由于炎癥反應在SCI的繼發性損傷中是一把“雙刃劍”,因此在治療過程中應明確治療的方向,使不利反應降低到最小、增強有利方面,而不是完全的阻止反應的發生。尤其是在最近數十年,分子控制炎癥反應的許多方法需要檢測SCI后小分子、抗體、重組蛋白的數目及其他試劑調節炎癥,大多數可以轉移到以后的臨床試驗中。目前治療SCI炎癥反應的藥物或者細胞因子抑制劑已經很多,但是其治療機制和用藥程度卻不很明確,更有甚者有些藥物對于實驗中的損傷模型有效,但是對于人類卻不一定有效。因此,為了有效的治療炎癥反應,臨床實驗必不可少。另外,聯合用藥以及配合穴位的治療可作為研究的方向。
[1] Schwab J M, Chiang N, Arita M, Serhan C N. Resolvin E1 and protectin D1 activate inflammation-resolution programmes[J].Nature, 2007, 447(7146): 869-74.
[2] Hohlfeld R, Kerschensteiner M, Meinl E. Dual role of inflammation in CNS disease[J].Neurology, 2007, 68(22 Suppl 3): S58-63.
[3] Yacoubian S, Serhan C N. New endogenous anti-inflammatory and proresolving lipid mediators: implications for rheumatic diseases[J].NatClinPractRheumatol, 2007, 3(10): 570-9.
[4] Aharoni R, Saada R, Eilam R, et al. Oral treatment with laquinimod augments regulatory T-cells and brain-derived neurotrophic factor expression and reduces injury in the CNS of mice with experimental autoimmune encephalomyelitis[J].JNeuroimmunol, 2012, 251(1-2): 14-24.
[5] Stirling D P, Liu S, Kubes P, Yong V W. Depletion of Ly6G/Gr-1 leukocytes after spinal cord injury in mice alters wound healing and worsens neurological outcome[J].JNeurosci, 2009, 29(3): 753-64.
[6] Boven L A, Van Meurs M, Van Zwam M, et al. Myelin-laden macrophages are anti-inflammatory, consistent with foam cells in multiple sclerosis[J].Brain, 2006, 129(2): 517-26.
[7] David S, Fry E J, López-Vales R. Novel roles for Nogo receptor in inflammation and disease[J].TrendsNeurosci, 2008, 31(5): 221-6.
[8] Kawasaki Y, Zhang L, Cheng J K, Ji R R. Cytokine mechanisms of central sensitization: distinct and overlapping role of interleukin-1 beta, interleukin-6, and tumor necrosis factor-alpha in regulating synaptic and neuronal activity in the superficial spinal cord[J].JNeurosci, 2008, 28(20): 5189-94.
[9] Genovese T, Mazzon E, Crisafulli C, et al. TNF-alpha blockage in a mouse model of SCI: evidence for improved outcome[J].Shock, 2008, 29(1): 32-41.
[10] Zong S, Zeng G, Wei B, et al. Beneficial effect of interleukin-1 receptor antagonist protein on spinal cord injury recovery in the rat[J].Inflammation, 2012, 35(2): 520-6.
[11] Boato F, Rosenberger K, Nelissen S, et al. Absence of IL-1β positively affects neurological outcome, lesion development and axonal plasticity after spinal cord injury[J].JNeuroinflammation, 2013, 10(1): 6.
[12] Hassanshahi G, Amin M, Shunmugavel A, et al. Temporal expression profile of CXC chemokines in serum of patients with spinal cord injury[J].NeurochemInt, 2013, 63(5): 363-7.
[13] Gonzalez R, Hickey M J, Espinosa J M, et al. Therapeutic neutralization of CXCL10 decreases secondary degeneration and functional deficit after spinal cord injury in mice[J].RegenMed, 2007, 2(5): 771-83.
[14] Kim J Y, Oh C H, Huang X, et al. Improvement in sensory function via granulocyte-macrophage colony-stimulating factor in rat spinal cord injury models[J].NeurosurgSpine, 2013, 18(1): 69-75.
[15] Kim H J, Oh J S, An S S, et al. Hypoxia-specific GM-CSF-overexpressing neural stem cells improve graft survival and functional recovery in spinal cord injury[J].GeneTher, 2012, 19(5): 513-21.
[16] Thompson C D, Zurko J C, Hanna B F, et al. The therapeutic role of interleukin-10 after spinal cord injury[J].JNeurotrauma, 2013, 30(15): 1311-24.
[17] Popovich P G, Longbrake E E. Can the immune system be harnessed to repair the CNS? [J].NatRevNeurosci, 2008, 9(6): 481-93.
[18] Bao F, Dekaban G A, Weaver L C. Anti-CD11d antibody treatment reduces free radical formation and cell death in the injured spinal cord of rats[J].JNeurochem, 2005, 94(5): 1361-73.
[19] Wu J, Kharebava G, Piao C, et al. Inhibition of E2F1/CDK1 pathway attenuates neuronal apoptosisinvitroand confers neuroprotection after spinal cord injuryinvivo[J].PLoSOne, 2012, 7(7): e42129.
[20] Kerr B J, Girolami E I, Ghasemlou N, et al. The protective effects of 15-deoxy-delta-(12,14)-prostaglandin J2 in spinal cord injury[J].Glia, 2008, 56(4): 436-48.
[21] López-Vales R, Ghasemlou N, Redensek A, et al. Phospholipase A2 superfamily members play divergent roles after spinal cord injury[J].FASEBJ, 2011, 25(12): 4240-52.
[22] Anderson A J, Robert S, Huang W, et al. Activation of complement pathways after contusion-induced spinal cord injury[J].JNeurotrauma, 2004, 21(12): 1831-46.
[23] Chvatal S A, Kim Y T, Bratt-Leal A M, et al. Spatial distribution and acute anti-inflammatory effects of Methylprednisolone after sustained local delivery to the contused spinal cord[J].Biomaterials, 2008, 29(12): 1967-75.
[24] Gao S, Ding J, Xiao H J, et al. Anti-inflammatory and anti-apoptotic effect of combined treatment with methylprednisolone and amniotic membrane mesenchymal stem cells after spinal cord injury in rats [J].NeurochemRes, 2014, 39(8): 1544-52.
[25] Casha S, Zygun D, McGowan M D, et al. Results of a phase II placebo-controlled randomized trial of minocycline in acute spinal cord injury[J].Brain, 2012, 135(4): 1224-36.
[26] Sonmez E, Kabatas S, Ozen O, et al. Minocycline treatment inhibits lipid peroxidation, preserves spinal cord ultrastructure, and improves functional outcome after traumatic spinal cord injury in the rat[J].Spine(PhilaPa1976), 2013, 38(15): 1253-9.
[27] Lord-Fontaine S, Yang F, Diep Q, et al. Local inhibition of Rho signaling by cell-permeable recombinant protein BA-210 prevents secondary damage and promotes functional recovery following acute spinal cord injury[J].JNeurotrauma, 2008, 25(11): 1309-22.
[28] Fehlings M G, Theodore N, Harrop J, et al. A phase I/IIa clinical trial of a recombinant Rho protein antagonist in acute spinal cord injury[J].JNeurotrauma, 2011, 28(5): 787-96.
[29] Genovese T, Mazzon E, Crisafulli C, et al. TNF-alpha blockage in a mouse model of SCI: evidence for improved outcome[J].Shock, 2008, 29(1): 32-41.
[30] Chengke L, Weiwei L, Xiyang W, et al. Effect of infliximab combined with methylprednisolone on expressions of NF-κB, TRADD, and FADD in rat acute spinal cord injury[J].Spine(PhilaPa1976), 2013, 38(14): E861-9.
[31] Marsh D R, Flemming J M. Inhibition of CXCR1 and CXCR2 chemokine receptors attenuates acute inflammation, preserves gray matter and diminishes autonomic dysreflexia after spinal cord injury[J].SpinalCord, 2011, 49(3): 337-44.
[32] Esposito E, Rinaldi B, Mazzon E, et al. Anti-inflammatory effect of simvastatin in an experimental model of spinal cord trauma: involvement of PPAR-α[J].JNeuroinflammation, 2012, 9(1): 81.
[33] Han X, Yang N, Xu Y, et al. Simvastatin treatment improves functional recovery after experimental spinal cord injury by upregulating the expression of BDNF and GDNF[J].NeurosciLett, 2011, 487(3): 255-9.
[34] Khalatbary A R, Zarrinjoei G R. Anti-inflammatory effect of oleuropein in experimental rat spinal cord trauma[J].IranRedCrescentMedJ, 2012, 14(4): 229-34.
[35] Jin W, Wang J, Zhu T, et al. Anti-inflammatory effects of curcumin in experimental spinal cord injury in rats[J].InflammRes, 2014, 63(5):381-7.
[36] Kim K T, Kim M J, Cho D C, et al. The neuroprotective effect of treatment with curcumin in acute spinal cord injury: laboratory investigation[J].NeurolMedChir(Tokyo), 2014, 54(5): 387-94.
[37] Nguyen D H, Cho N, Satkunendrarajah K, et al. Immunoglobulin G (IgG) attenuates neuroinflammation and improves neurobehavioral recovery after cervical spinal cord injury[J].JNeuroinflammation, 2012, 9(1): 224.
[38] Chen H C, Fong T H, Hsu P W, Chiu W T. Multifaceted effects of rapamycin on functional recovery after spinal cord injury in rats through autophagy promotion, anti-inflammation, and neuroprotection[J].JSurgRes, 2013, 179(1): e203-10.
[39] Khalatbary A R, Ahmadvand H. Anti-inflammatory effect of the epigallocatechin gallate following spinal cord trauma in rat[J].IranBiomedJ, 2011, 15(1-2): 31-7.
[40] Yin X, Yin Y, Cao F L, et al. Tanshinone IIA attenuates the inflammatory response and apoptosis after traumatic injury of the spinal cord in adult rats[J].PLosOne, 2012, 7 (6): e38381.
Inflammatory response and anti-inflammatory therapy after acute spinal cord injury
WANG Tao-li1, GU Bing1, LI Hua-nan2, ZHANG Guo-fu2, ZHANG Si1
(1.CollegeofLifeScience,JiangxiScience&TechnologyNormalUniversity,Nanchang330013,China;2.DeptofSpineSurgery,theAffiliatedHospitalofJiangxiUniversityofTraditionalChineseMedicine,Nanchang330006,China)
Acute spinal cord injury can lead to severe motor, sensory and sphincter muscle dysfunction. Inflammatory response caused by inflammatory cytokines plays a crucial role in the occurrence and development of secondary damage. Maintaining the body balance between inflammaion and anti-inflammation through an appropriate anti-inflammatory intervention will be an important strategy for drug therapy of spinal cord injury. This paper mainly introduces the cause, process and participation of inflammatory response in the pathophysiological mechanism of acute spinal cord injury, and also reviews the latest progress of experimental research of anti-inflammatory drugs, aiming to provide reference for finding the safe and effective drugs.
spinal cord injury;secondary damage;inflammatory response;anti-inflammatory therapy;methylprednisolone;minocycline
時間:2015-3-16 15:41 網絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150316.1541.007.html
2014-10-25,
2015-02-08
國家自然科學基金資助項目(No 30960448);江西省自然科學基金資助項目(No 20142BAB205023);江西省教育廳科學技術研究項目(No GJJ12584, GJJ14603)
王濤麗(1990-),女,碩士生,研究方向:神經免疫學,E-mail:574518176@qq.com; 顧 兵(1971-),男,博士后,教授,研究方向:神經精神藥物學,通訊作者,E-mail: bguemory@hotmail.com
10.3969/j.issn.1001-1978.2015.04.003
A
1001-1978(2015)04-0452-06
R-05;R364.5;R651.2; R826.64;R977.1;R978.14

