促腎上腺皮質激素釋放激素受體1拮抗劑CP154526對大鼠海馬神經元凋亡的影響
周 毅,劉 巍,張 悅
(河北醫科大學 1.第二醫院神經內科、2.病理學教研室、3.臨床診斷學教研室,河北 石家莊 050017)
促腎上腺皮質激素釋放激素受體1拮抗劑CP154526對大鼠海馬神經元凋亡的影響
周 毅1,劉 巍2,張 悅3
(河北醫科大學 1.第二醫院神經內科、2.病理學教研室、3.臨床診斷學教研室,河北 石家莊 050017)
目的 觀察促腎上腺皮質激素釋放激素(CRH)受體1拮抗劑CP154526對海馬神經元凋亡的影響。方法 原代培養大鼠海馬神經元,噻唑藍(MTT)法測定細胞存活率,然后分為4組:正常對照組(Con)、CRH刺激組(CRH)、CRH和CP154526共同刺激組(CRH+CP)、CP154526刺激組(CP)。TUNEL、流式細胞術Annexin Ⅴ-PI法檢測神經元凋亡率;Western blot檢測凋亡蛋白Bax、Bcl-2、caspase-3表達水平。結果 10-8mol·L-1的CRH作用于海馬神經元后,細胞存活率下降(P<0.05);50 mmol·L-1的CP154526可明顯提升神經元存活率(P<0.05)。與正常對照組相比,CRH刺激后神經元凋亡率增加,Bax/Bcl-2比值增高,caspase-3表達增加;加用CP154526可明顯降低神經元凋亡率、Bax/Bcl-2比值及caspase-3表達水平;而單獨應用CP154526對凋亡沒有明顯影響。結論 一定濃度的CRH可誘導海馬神經元細胞凋亡,其受體1拮抗劑CP154526可有效減輕細胞凋亡,發揮神經保護作用。
促腎上腺皮質激素釋放激素;CP154526;海馬;神經元;凋亡;原代培養
應激是指機體在受到內外環境因素及社會、心理因素刺激時所出現的全身性非特異性適應反應,其主要特征是以下丘腦-垂體-腎上腺皮質軸(hypothalamic pituitary adrenal axis,HPA)的激活為核心的生理和心理反應。促腎上腺皮質激素釋放激素(corticotropin releasing hormone,CRH)是下丘腦分泌的調節HPA軸功能的多肽類激素,也是機體應激反應時發揮神經內分泌調節的關鍵激素[1]。近年來發現,CRH不僅在HPA軸調節中起著重要作用,作為一種神經遞質,其在情緒反應、學習記憶和神經系統損傷與發育中也發揮著重要作用[2]。我們前期的研究發現,一定濃度的CRH可以降低海馬神經元細胞存活率,并且呈現出濃度和時間依賴模式[3]。CRH通過其受體發揮生物學作用,CRH受體1(CRH-R1)主要表達于哺乳動物的中樞神經系統中,如下丘腦、海馬、大腦皮層、杏仁體、藍斑等部位,與CRH有較高的親和力[4]。在應激狀態下,CRH主要通過CRH-R1發揮內分泌、行為改變和內臟反應等功能的調節作用[5-7],但有關CRH-R1發揮作用的方式尚不清楚。本實驗應用CRH-R1拮抗劑CP154526,重點探討其對海馬神經元凋亡的影響,以期明確CRH-R1在CRH誘導神經元凋亡中的作用,為應激所致精神損傷的防治提供一定的理論依據。
1 材料與方法
1.1 材料
1.1.1 動物 新生24 h內SD大鼠,♂♀不限,由河北醫科大學實驗動物中心提供。
1.1.2 主要試劑 DMEM培養基(Gibco)、胎牛血清(Cellgro)、Neurobasal培養基(Gibco)、B27(PAA)。CRH(Anaspec),CP154526(Tocris Bioscience,Bristol),0.25%胰蛋白酶(Sigma),四甲基偶氮唑藍(MTT,Sigma)。兔抗MAP2一抗(Cell Signaling),兔抗Bax、Bcl-2多克隆抗體(Protein Tech),鼠抗caspase3單克隆抗體(Cell Signaling),FITC標記的IgG二抗(北京中杉金橋生物技術有限公司)。TUNEL試劑盒(Roche)。Annexin Ⅴ/PI凋亡檢測試劑盒(聯科生物)。
1.2 方法
1.2.1 海馬神經元原代培養 新生24 h內SD乳鼠,75%乙醇消毒,無菌條件下斷頭、取雙側海馬,解剖顯微鏡下去除血管及腦膜,剪碎后以0.125%胰蛋白酶消化15 min,含10%胎牛血清的DMEM培養基終止消化,1 mm口徑吸管吹打均勻,細胞計數,稀釋成1×106ml-1的細胞懸液,接種于6孔培養板(預先經0.1%多聚賴氨酸鋪底),將培養板置于37℃、5%CO2培養箱內,3 h后補種植液,24 h后去除種植液,加入培養液(Neurobasal+B27)培養,每3 d換液,培養6~8 d神經細胞之間突觸聯成網狀用于后續研究[8]。
1.2.2 神經元鑒定 取培養7 d海馬神經元,70%酒精固定30 min,0.1%Triton 37℃孵育15 min,3%H2O2去除內源性過氧化物酶,山羊血清封閉30 min,兔抗MAP2一抗1 ∶200稀釋,4℃過夜,FITC標記的山羊抗兔二抗37℃孵育2 h,PBS沖洗,甘油封片,熒光顯微鏡觀察結果。
1.2.3 MTT檢測細胞存活率 細胞懸液200 μL接種于96孔培養板中,加入不同濃度的CRH(10-9、10-8、10-7、10-6、10-5mol·L-1)作用48 h后,每孔加5 g·L-1MTT溶液20 μL,37℃孵育4 h后小心吸出上清液,每孔加入150 μL二甲基亞砜(dimethyl-sulfoxide, DMSO)振蕩10 min,490 nm波長測定各孔吸光度值(A值),計算細胞存活率。存活率/%=實驗組A值/空白對照組A值×100%。實驗重復3次,找到誘導海馬神經元存活率降低的CRH的最低敏感濃度。
用神經元培養液將CRH受體1特異性拮抗劑CP154526稀釋至10、50、250 mmol·L-1的終濃度,與CRH共同刺激海馬神經元48 h,上述同樣方法檢測神經元存活率,找到CP154526的最低敏感濃度。
1.2.4 實驗分組 后續實驗分為4組:(1)空白對照組:神經元培養液正常培養;(2)CRH組:用MTT結果中CRH誘導海馬神經元凋亡的最低敏感濃度培養;(3)CRH+CP組:加入CRH同時加入CRH受體1拮抗劑CP154526;(4)CP組:只加入CP154526培養。各組培養液量一致,均培養48 h。
1.2.5 TUNEL檢測細胞凋亡率 以末端脫氧核苷酸轉移酶介導的dUTP缺口末端標記(TUNEL)法,按試劑盒說明進行細胞凋亡檢測,DAPI復染細胞核。凋亡神經元細胞核呈綠色熒光。每張切片于凋亡細胞分布區域隨機選取10個高倍視野,計算出平均每100個細胞中的凋亡細胞數,以百分數(%)表示凋亡百分率。
1.2.6 流式細胞術檢測 用0.25%胰蛋白酶制備單細胞懸液,用膜聯蛋白V (Annexin V) / 碘化丙啶(propidium iodide, PI)雙染色標記法進行流式細胞儀檢測細胞凋亡百分率。
1.2.7 Western blot檢測海馬神經元Bax、Bcl-2、caspase-3表達 收集各組細胞提取總蛋白,每組樣品取50 μg總蛋白,加6×上樣緩沖液,100℃變性5 min,經10% SDS-PAGE凝膠電泳后電轉移至PVDF膜。5%脫脂奶粉37℃封閉2 h,加入一抗Bax(1 ∶1 000)、Bcl-2(1 ∶200)、caspase-3(1 ∶1 000)和β-actin(1 ∶1 000),4℃孵育過夜。TTBS洗膜后加辣根過氧化物酶標記的羊抗兔/鼠IgG(1:5000),37℃孵育2 h,TTBS洗膜,滴加ECL發光劑,于Odyssey FC成像系統中顯影,并對條帶進行定量分析。以目的條帶和β-actin條帶積分光密度值比值作為最終結果。
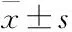
2 結果
2.1 原代培養海馬神經元的形態特征及鑒定倒置顯微鏡下可見,原代培養海馬神經元7 d時神經元胞體豐滿,周圍光暈明顯,立體感強,突起增粗增長,連接成網狀(Fig 1A),顯示神經元成熟。Fig 1B所示為神經元特異性標志物MAP2免疫熒光染色,可見神經元胞體和突起著色,經鑒定神經元純度在90%以上,可用于后續實驗研究。

Fig 1 Primary culture and immunofluorescence identification of hippocampal neuron
A: morphological characteristics of primary cultivated hippocampal neuron(×200); B: the immunofluorescence identification of hippocampal neuron (×200).
2.2 MTT檢測神經元存活率以正常對照組細胞存活率為100%計算,不同濃度的CRH刺激海馬神經元后,隨著濃度的增大,細胞存活率呈下降趨勢;與正常對照組相比,濃度為10-8mol·L-1的CRH刺激后,細胞存活率降低即具有統計學意義(P<0.05,Fig 2A),故CRH導致神經元存活率降低的最低敏感濃度為10-8mol·L-1。
將不同濃度的CRH受體1特異性拮抗劑CP154526分別加入10-8mol·L-1CRH刺激的神經元培養基中,可見,隨著濃度的增大,細胞存活率有所升高,與CRH組相比,50 mmol·L-1的CP154526可明顯提升神經元存活率(P<0.05,Fig 2B)。

Fig 2 Cell viability assayed by MTT
*P<0.05,**P<0.01vscontrol;#P<0.05vsCRH.
2.3 TUNEL檢測凋亡率TUNEL染色可見,與正常對照組相比,10-8mol·L-1的CRH刺激后凋亡細胞明顯增加(P<0.05),加用50 mmol·L-1的CP154526后,凋亡細胞明顯減少(P<0.05)。單獨應用CP154526,和正常對照組相比,凋亡細胞沒有明顯變化,見Fig 3。
2.4 流式細胞術檢測凋亡率Annexin Ⅴ是檢測細胞早期凋亡的敏感指標之一。流式細胞儀將收集到的細胞分為四個象限,左下象限代表的是活細胞,右下象限代表的是早期凋亡細胞,右上象限代表的是晚期凋亡細胞。早期凋亡和晚期凋亡比率之和作為總的凋亡率。如Fig 4所示,與正常對照組相比,CRH刺激后神經元凋亡率明顯增加(P<0.05);加用CP154526后,凋亡率明顯降低(P<0.05);而單獨應用CP154526,與正常對照組相比,神經元細胞凋亡率沒有明顯變化(P>0.05)。
2.5 Western blot檢測海馬神經元Bax、Bcl-2、caspase-3蛋白表達結果與正常對照組相比,CRH刺激后,凋亡標志蛋白Bax表達增加,Bcl-2表達降低,Bax/Bcl-2比值明顯升高(P<0.05);caspase-3蛋白表達增加(P<0.05)。加用CP154526后,Bax/Bcl-2比值明顯降低(P<0.05);caspase-3表達也明顯降低(P<0.05)。而單獨應用CP154526,Bax/Bcl-2比值和Caspase-3蛋白水平與對照組相比均無統計學意義(P>0.05),見Fig 5。

Fig 3 Neuron apoptotic rates of different groups examined by TUNEL(CRH: 10-8 mol·L-1; CP154526: 50 mmol·L-1)
*P<0.05vscontrol;#P<0.05vsCRH.
3 討論
應激反應中,HPA軸激活的中樞控制是十分復雜的,在這一系列神經內分泌調節過程中,下丘腦合成和釋放的CRH起著關鍵作用,它控制著HPA軸的興奮水平。隨著對應激反應研究的深入,發現CRH還是一種重要的神經遞質,在情緒反應、學習記憶和神經系統損傷與發育中也有著重要作用[2]。
海馬是邊緣系統的重要組成部分,是HPA軸應激反應的高位調節中樞,參與了情緒、學習和記憶、行為、免疫等的調節,對應激反應非常敏感且易損,它的損傷在各種應激所致疾患中起到關鍵作用。研究表明,慢性應激可能通過增加海馬神經元細胞凋亡,導致海馬損害,從而誘發抑郁癥[9-10]。因為位于海馬CA1區的錐體細胞表達糖皮質激素受體,而應激狀態下,腎上腺分泌的糖皮質激素可以通過血腦屏障作用于這些受體,因此,很多學者認為糖皮質激素及其受體介導應激對海馬功能產生影響[11]。但是,當腎上腺切除后,慢性應激一樣可以影響海馬功能。越來越多的研究結果顯示,CRH及其受體參與介導應激對海馬結構和功能產生影響[12]。

Fig 4 Neuron apoptotic rates of different groups examined by Annexin V/PI(CRH: 10-8 mol·L-1; CP154526: 50 mmol·L-1)
*P<0.05vscontrol;#P<0.05vsCRH.
目前已知的CRH受體有3種,即CRH-R1、CRH-R2和CRH-R3,均屬于G蛋白偶聯受體。3種受體的功能及與CRH的親和力不盡相同。其中CRH-R1由415~420個氨基酸組成,與CRH有較高的親和力。CRH-R1 mRNA主要表達于哺乳動物的中樞神經系統中,如下丘腦、海馬、大腦皮層、杏仁體、藍斑等部位,在外周的表達極其有限[4]。大量研究表明,在應激狀態下,CRH主要通過CRH-R1發揮內分泌、行為改變和內臟反應等功能的調節作用[5-7]。CRH-R2序列與CHR-R1有約70%的同源性,其在中樞神經系統表達有限,而在外周主要表達在心肌、骨骼肌、胃腸道等部位[13]。CRH-R3最早于2001年被分離出來,由428個氨基酸序列組成,但有關其分布、特性及作用尚不清楚[14]。

Fig 5 Protein expression of Bax, Bcl-2 and Caspase-3 in different groups examined by Western blot (CRH: 10-8 mol·L-1; CP154526: 50 mmol·L-1)
*P<0.05vscontrol;#P<0.05vsCRH.
關于CRH受體在應激中的作用,有研究報道,應用CRH-R1基因敲除鼠,基礎和應激狀態下HPA軸功能明顯受損。而邊緣系統CRH-R1對調控應激時HPA軸反應至關重要[15]。我們前期研究發現,一定濃度的CRH可以降低海馬神經元細胞存活率,但CRH的作用是否是通過其受體1來發揮的,及其具體的作用機制尚不清楚。本實驗中,我們應用TUNEL、流式Annexin Ⅴ-PI雙標染色、Western blot等方法進一步證實,CRH可以導致體外原代培養的大鼠海馬神經元細胞凋亡增加,應用CRH-R1特異性拮抗劑CP154526可以有效的降低神經元凋亡率,說明CRH-R1確實在CRH誘導神經元凋亡的過程中發揮了重要作用。
關于CP154526降低神經元凋亡的可能原因,目前尚無明確報道。我們考慮, 可能與CP154526高度親脂性及其半衰期較長有關,使得CP154526可與CRH-R1充分結合,從而抑制了CRH的作用。當然,細胞內調控凋亡的信號系統精細復雜,CP154526具體是如何發揮其調控作用的將是我們下一步研究的重點。
上述實驗結果說明,應激狀態下,一定濃度的CRH可通過其受體1誘導神經元細胞凋亡,而CP154526對神經細胞的凋亡具有一定的抑制作用,可為應激所致精神損傷的細胞保護治療提供新的思路。
[1] Vale W, Spiess J, Rivier C, et al. Characterization of a 41-residue ovine hypothalamic peptide that stimulates secretion of corticotropin and beta-endorphin [J].Science, 1981, 213(4514): 1394-7.
[2] Claes S J. Corticotropin-releasing hormone (CRH) in psychiatry: from stress to psychopathology [J].AnnMed, 2004, 36(1): 50-61.
[3] Zhang Y, Liu W, Ma C, et al. Endoplasmic reticulum stress contributes to CRH-induced hippocampal neuron apoptosis [J].ExpCellRes, 2012, 318(6): 732-40.
[4] Müller M B, Preil J, Renner U, et al. Expression of CRHR1 and CRHR2 in mouse pituitary and adrenal gland: implications for HPA system regulation [J].Endocrinology, 2001, 142(9): 4150-3.
[5] Boqdan R, Santesso D L, Faqerness J, et al. Corticotropin-releasing hormone receptor type 1 (CRHR1) genetic variation and stress interact to influence reward learning [J].JNeurosci, 2011, 31(37): 13246-54.
[6] Wasserman D, Wasserman J, Rozanov V, et al. Depression in suicidal males: genetic risk variants in the CRHR1 gene [J].GenesBrainBehav, 2009, 8(1): 72-9.
[7] Wasserman D, Sokolowski M, Rozanov V, et al. The CRHR1 gene: a marker for suicidality in depressed males exposed to low stress [J].GenesBrainBehav, 2008, 7(1): 14-9.
[8] 肖復茜, 李洪秀, 隋海娟, 等. 知母皂苷元對高糖引起的體外培養大鼠海馬神經元損傷的保護作用 [J]. 中國藥理學通報, 2013, 29(1): 107-12.
[8] Xiao F X, Li H X, Sui H J, et al. Protective effect of Sarsasapogenin against hyperglycemia induced neurotoxicity in cultured hippocampal neurons [J].ClinPharmacolBull, 2013, 29(1): 107-12.
[9] Bachis A, Cruz M I, Nosheny R L, et al. Chronic unpredictable stress promotes neuronal apoptosis in the cerebral cortex [J].NeurosciLett, 2008, 442(2): 104-8.
[10] Lucassen P J, Heine V M, Muller M B, et al. Stress, depression and hippocampal apoptosis [J].CNSNeurolDisordDrugTargets, 2006, 5(5): 531-46.
[11] McEwen B S. Mood disorders and allostatic load [J].BiolPsychiatry, 2003, 54(3): 200-7.
[12] Orozco-Cabal L, Pollandt S, Liu J, et al. Regulation of synaptic transmission by CRF receptors [J].RevNeurosci, 2006, 17(3): 279-307.
[13] Hashimoto K, Makino S, Asaba K, et al. Physiological roles of corticotropin-releasing hormone receptor type 2 [J].EndocrJ,2001, 48(1): 1-9.
[14] Paez-Pereda M, Hausch F, Holsboer F. Corticotropin releasing factor receptor antagonists for major depressive disorder [J].ExpertOpinInvestigDrugs, 2011, 20(4): 519-35.
[15] 曾 純, 嚴 燦, 徐志偉, 等. 促腎上腺皮質激素釋放激素受體在應激反應中的作用研究 [J]. 中國藥理學通報, 2006, 22(5): 517-20.
[15] Zeng C, Yan C, Xu Z W, et al. Research on the effect of corticotropin-releasing hormone receptors in stress reaction [J].ClinPharmacolBull, 2006, 22(5): 517-20.
Effects of CP154526,the corticotropin releasing hormone receptor 1 antagonist,on rat hippocampal neuron apoptosis
ZHOU Yi1, LIU Wei2, ZHANG Yue3
(1.DeptofNeurology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050017,China, 2.DeptofPathologyHebeiMedicalUniversity,Shijiazhuang050017,China, 3.DeptofClinicalDiagnostics,HebeiMedicalUniversity,Shijiazhuang050017,China)
Aim To investigate the effects of CP154526, a corticotropin releasing hormone (CRH) receptor 1 antagonist, on the hippocampal neuron apoptosis. Methods Rat hippocampal neurons were primarily cultured. Cell viability was estimated using MTT assays. Neurons were randomly divided into four groups: Normal cultures (Control); CRH-exposed cultures (CRH); CRH and CP154526 co-exposed cultures (CRH+CP); CP154526-exposed cultures (CP). Cell apoptosis was examined by TUNEL or flow cytometry Annexin Ⅴ-PI staining. The protein levels of Bax, Bcl-2 and Caspase-3 were investigated by Western Blotting. Results 10-8mol·L-1CRH decreased cell viability of cultured hippocampal neuron (P<0.05), while 50 mmol·L-1CP154526 significantly increased neuron viability (P<0.05). Compared with Control group, cell apoptotic rate, the ratio of Bax and Bcl-2 and the protein level of Caspase-3 were elevated in hippocampal neuron induced by CRH. Combined with CP154526 reversed the effects of CRH. Application of CP154526 alone had no obvious effects on cell apoptosis. Conclusions A certain concentration of CRH can induce hippocampal neuron apoptosis, and its receptor 1 antagonist CP154526 can effectively reduce the apoptosis and play a neuroprotective role.
CRH; CP154526; hippocampus; neuron; apoptosis; primary culture
時間:2015-3-16 15:41 網絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150316.1541.021.html
2014-11-09,
2015-01-23
國家自然科學基金資助項目(No 81302625);河北省高等學校科學技術研究優秀青年基金項目(No Y2012001)
周 毅(1978-),男,碩士,主治醫師,研究方向:神經系統疾病,Tel:0311-86265661,E-mail:lwei929@126.com; 張 悅(1978-),女,博士,副教授,研究方向:神經系統疾病,通訊作者,Tel:0311-86265661,E-mail:zhyue515@126.com
10.3969/j.issn.1001-1978.2015.04.013
A
1001-1978(2015)04-0504-06
R-332;R322.81;R329.25;R392.11;R977.11

