產青蒿二烯的人工酵母細胞的構建及發酵優化
郭睿,丁明珠,元英進
(系統生物工程教育部重點實驗室,天津大學化工學院制藥工程系,天津化學化工協同創新中心,天津300072)
引 言
青蒿素及其衍生物已被世界衛生組織認定為目前世界上最有效的治療腦型瘧疾和抗氯喹惡性瘧疾藥物。目前主要通過青蒿類植物提取[1]、化學合成[2]以及利用合成生物學手段[3]等方式獲得青蒿素。合成生物學由于快速安全綠色環保等優勢逐漸替代植物提取和化學全合成[4]。青蒿二烯(amorphadiene)是青蒿素的重要前體,青蒿植物中青蒿二烯的合成分兩個步驟:(1)乙酰輔酶A經MVA途徑生成法尼基焦磷酸[5](FPP);(2)青蒿二烯合成酶(ADS)[6]催化 FPP 經環化反應生成青蒿二烯。FPP是倍半萜類化合物的共同前體,主要通過兩條獨立的生物途徑合成[7]:甲羥戊酸途徑(MVA途徑,存在于真核生物、古生菌和部分原核生物中)和 2-C-甲基-D-赤藻糖醇-4-磷酸途徑 (MEP途徑,存在于細菌和光合真核生物中)。
目前,利用合成生物學方法進行青蒿二烯合成研究中應用最廣泛的底盤細胞是大腸桿菌和釀酒酵母[7]。大腸桿菌中存在具有較大萜類合成潛力的MEP途徑,適合萜類化合物碳骨架的合成[8]。Keasling課題組在大腸桿菌體內重構MVA途徑,優化后青蒿二烯產量達到27.4 g·L?1[9-11]。但大腸桿菌缺少糖基化和翻譯后修飾等功能,因此限制了后續青蒿酸合成基因高效表達。而釀酒酵母遺傳背景清楚、基因操作簡單、可進行大規模發酵生產,且次級代謝產物簡單[12],因此較多研究者選擇釀酒酵母作為青蒿二烯生物合成的底盤細胞。Kong等[13]通過在釀酒酵母體內過表達tHMGR和ERG20基因,并表達突變的ADS基因,使青蒿二烯產量達到123.2 mg·L?1。Keasling 課題組[14]通過過表達釀酒酵母MVA路徑基因和ADS基因,抑制鯊烯合酶表達,使青蒿二烯產量高達40 g·L?1。本課題組之前在該領域的工作主要集中在釀酒酵母底盤細胞與不同功能模塊之間適配性研究[15-16]。
HMGR催化MVA途徑中第一個可逆反應,是MVA途徑上第一個限速酶[17]。表達截短的HMGR基因——tHMGR(去除HMGR的調控區域)可以增加 HMGR的表達量[18],從而提高后續產物的產量[10]。增加ERG20基因的表達量[19]或減少FPP流向其他支路的流量[20],可以增加FPP的積累量,從而增加青蒿二烯的產量。Pitera等[21]研究發現增加HMGR和ERG20基因的拷貝數,可以提高青蒿二烯的產量。Delta位點在基因組中拷貝數大于100,利用 Delta位點進行外源基因整合,在沒有選擇壓力的存在下傳代50次整合基因型仍穩定存在,引入的外源基因經過傳代后仍能多拷貝存在[22-23]。
本研究通過過表達釀酒酵母tHMGR和ERG20基因、表達外源青蒿二烯合酶基因ADS實現釀酒酵母生產青蒿二烯的目的,如圖1所示。之前的大量研究都集中在上調或基因組單位點整合過表達內源基因,以基因組整合或導入外源質粒表達ADS基因,實現釀酒酵母中合成青蒿二烯的目的。內源基因多拷貝過表達,往往要進行多次整合,加大了實驗的工作量;若采取多拷貝游離質粒方式表達外源ADS基因,則不能保證人工菌株基因型的穩定性。本研究利用本實驗室構建的酵母啟動子、終止子載體模塊庫[24],以酵母基因組中多拷貝位點Delta作為整合位點,不僅可以單次整合多個基因,并且整合后的基因都以多拷貝形式存在于基因組,從而實現酵母內源基因tHMGR和ERG20的多拷貝過表達以及ADS基因的異源多拷貝表達,構建可以生產青蒿二烯且基因型較穩定的人工釀酒酵母菌株。除了考慮葡萄糖濃度以及氧氣通量等常用參數外,本研究還將某些必需氨基酸作為提高青蒿二烯產量的關鍵調控參數。
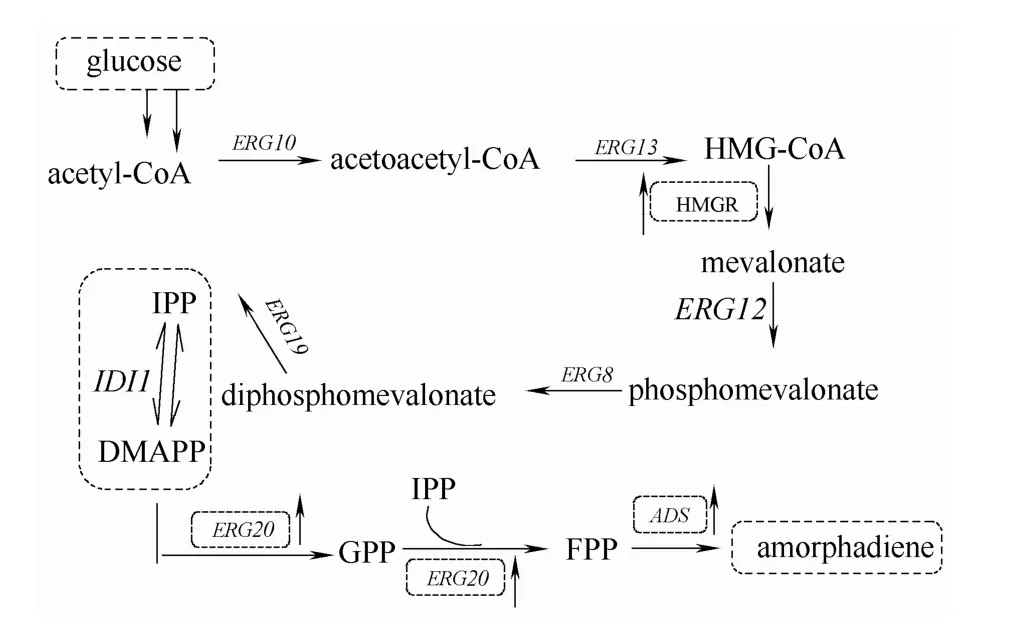
圖1 釀酒酵母體內青蒿二烯合成路徑的構建Fig.1 Biosynthesis of amorphadiene in engineered S.cerevisiae
1 實驗材料和方法
1.1 工具酶及試劑
大腸桿菌感受態細胞DH5α購自Biomed公司,TransStart FastPfu高保真DNA聚合酶購自TransGen公司;T4 DNA連接酶和限制性內切酶 PstI和BamHI購自Fermentas公司;限制性內切酶NotI-HF和BsaI-HF購自NEB公司;質粒小提試劑盒、酵母質粒小提試劑盒、普通 DNA產物純化試劑盒、瓊脂糖凝膠 DNA回收試劑盒購自天根公司;朱欒倍半萜標準品(Valencene)購自TCI公司;正十二烷購自天津市康科德試劑化工廠;PEG3350、鮭魚精DNA、各類氨基酸粉末購自鼎國昌盛公司;醋酸鋰購自北方天醫化學試劑廠;去氨基酸酵母氮源(YNB)購自GENVIEW公司。
1.2 菌株、質粒和培養基
宿主菌E. coliDH5α {endA1; hsdR17; gyrA96;thi-1; relA1; supE44; recA1; ΔlacU169(?80lac ΔZM15)} 和 釀 酒 酵 母 菌 株 W303-1a(MATa{leu2-3,112; trp1-1; can1-100; ura3-1; ade2-1;his3-11,15}),釀酒酵母菌株 BY4741(MATa{his3 Δ1;leu2 Δ0; met15 Δ0; ura3 Δ0} ), 釀 酒 酵 母 菌 株CEN.PK2-1C(MATa {ura3-52; trp1-289; leu2-3_112;his3 Δ1; MAL2-8C; SUC2}), 釀 酒 酵 母 菌 株CEN.PK2-1D (MATα{ura3-52; trp1-289; leu2-3_112;his3 Δ1; MAL2-8C; SUC2})購自 Euroscarf公司,酵母表達載體 pRS425K為本實驗室構建,詳見表1、表2。
LB 培養基(10 g·L?1氯化鈉;10 g·L?1胰蛋白胨;5 g·L?1酵母提取物;固體培養基添加1.5%瓊脂粉)用于大腸桿菌的培養;YPD培養基(20 g·L?1葡萄糖;20 g·L?1胰蛋白胨;10 g·L?1酵母提取物;固體培養基添加 2%瓊脂粉)用于釀酒酵母的培養;SC-ura培養基(20 g·L?1葡萄糖;6.7 g·L?1YNB;2 g·L?1drop-out 氨基酸混合物;固體培養基添加2% 瓊脂粉)用于酵母轉化子篩選和培養。
1.3 釀酒酵母表達載體構建

表1 實驗中涉及的酵母菌株Table 1 Yeast strains involved in this study
以BY4741基因組DNA為模板,通過特異性引物PCR擴增tHMGR和ERG20、終止子片段TTPI1和TENO2,用限制性內切酶BsaI對以上片段和本實驗室構建 pRS425K-啟動子-終止子模塊[24]LD55和LD19進行酶切;純化回收產物經T4連接酶連接,得到表達載體 pRS425K:TCYC1-PTEF1-tHMGR-TTEF1和 pRS425K: TTEF1-PGPM1-ERG20-TTPI1。用 overlap PCR方法得到TTPI1-TENO2片段,以BamHI和PstI對擴增片段和載體pRS425K分別進行酶切,純化回收片段以 T4連接酶連接,得到質粒 pRS425K:TTPI1-TENO2。
外源基因ADS參考GeneBank ID.AF-138959報道的序列經密碼子優化,利用Genewiz公司合成的60bp Oligos,用overlap PCR方法合成。利用BsaI限制性內切酶對ADS基因和相應的啟動子終止子元件LD01D進行酶切,純化回收產物,經T4連接酶連接得到 pRS425K:TENO2-PPDC1-ADS-TGPM1-Delta2表達載體。

表2 實驗中涉及的質粒Table 2 Plasmids involved in this study
1.4 表達模塊整合基因組和轉化子篩選
以上4個表達載體測序正確后,用 BamHI和PstI酶切,即可得到片段TCYC1-PTEF1-tHMGR-TTEF1、TTEF1-PGPM1-ERG20-TTPI1、TTPI1-TENO2和 TENO2-PPDC1-ADS-TGPM1-Delta2四個片段,用NotI限制性內切酶對 LDL06[24](pRS425K: Delta1-URA3-TCYC1)進行酶切,得到Delta-URA3-CYC1t片段。
采用醋酸鋰轉化法用上述 5個片段分別以W303-1a、BY4741、CEN.PK2-1C、CEN.PK2-1D為宿主菌株進行酵母轉化,用SC-ura培養基篩選,30℃恒溫倒置培養2~3 d,至長出重組克隆,分別挑取8個單菌落在SC-ura固體培養基上劃線分純,30℃恒溫倒置培養至長出單菌落,挑取單菌落到SC-ura液體培養基,30℃、200 r·min?1培養至OD600約為 4,取菌液 12000 r·min?1離心 2 min,棄上清收集菌體提取基因組,基因組PCR驗證過表達模塊和異源表達模塊,出現正確大小的目標條帶,則證明篩選到了正確的陽性克隆,得到人工酵母菌株 SyBE_Sc00011103、SyBE_Sc00011106、SyBE_Sc00011101、SyBE_Sc00011107。
人工酵母菌株功能模塊構建流程如圖2所示。分別構建tHMGR, ERG20, ADS基因的表達盒質粒,酶切得到 DNA片段,醋酸鋰法酵母轉化,將各個片段整合到酵母染色體上,經過PCR驗證篩選正確克隆。
1.5 人工酵母菌株發酵
1.5.1 搖瓶發酵 將正確陽性克隆接種到 5 ml SC-ura液體培養基中,30℃、200 r·min?1培養至OD600值約為5.0,以初始OD600值0.1轉接至SC-ura液體培養基,30℃、200 r·min?1培養12 h,按初始OD600值0.05轉接到50 ml液體培養基中,30℃、200 r·min?1培養,10 h后在發酵液中加入2.5 ml正十二烷進行兩相培養,以此條件繼續培養至72 h。1.5.2 發酵罐發酵 將正確陽性克隆接種到 5 ml SC-ura液體培養基中,30℃、200 r·min?1培養至OD600值約為5.0,以初始OD600值0.1轉接至SC-ura液體培養基中,30℃、200 r·min?1培養12 h,初始OD600值為0.05,初始培養基體積2 L,溫度30℃,pH為5.8,發酵培養10 h,加入400 ml正十二烷兩相培養。當發酵液中葡萄糖濃度接近2 g·L?1時,批式補料方式補給葡萄糖母液,使培養基中葡萄糖濃度到初始值。在OD600值進入平臺期后,按初始濃度補加氨基酸和YNB母液1~2次,至菌體密度保持24 h不再增加為止。
1.6 青蒿二烯的提取與檢測
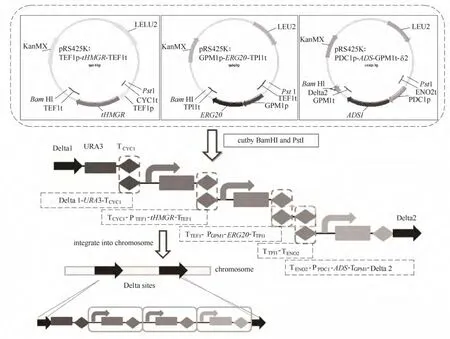
圖2 基因整合步驟示意圖Fig.2 Schematic of integrating genes into chrosome
發酵結束后,取發酵液 5000 r·min?1離心 10 min,吸取十二烷相,無水硫酸鈉干燥,用0.22 μm有機相濾膜過濾,用正己烷稀釋,用 GC-TOF/MS檢測產物。色譜條件:DB-5MS毛細管色譜柱(30 m×0.25 mm×0.25 μm);升溫程序:初始溫度100℃,保持 2 min,以8℃·min?1升溫至 160℃;以25℃·min?1升溫至250℃,保持5 min;進樣口溫度250℃,分流進樣(分流比1:50),進樣體積1 μl。質譜條件:EI+源;電子能量70 eV;離子源溫度250℃;溶劑延遲時間 5 min;質量掃描方式為選擇全離子掃描;定性離子為m/z204(青蒿二烯分子C15H24)和189([M-CH3]+)。
定量方法:使用相同色譜條件測定青蒿二烯的同分異構體朱欒倍半萜的標準溶液(5~150 mg·L?1),繪制濃度-峰面積標準曲線,對青蒿二烯進行定量。
2 實驗結果與結論
2.1 釀酒酵母底盤的構建
將 TCYC1-PTEF1-tHMGR-TTEF1、TTEF1-PGPM1-ERG20-TTPI1、TENO2-PPDC1-ADS-TGPM1-Delta2、Delta-URA3-TCYC1以及TTPI1-TENO2等片段同時進行酵母轉化,便可以多拷貝位點Delta為整合位點將tHMGR、ERG20、ADS基因依次整合到 CEN.PK2-1C、W303-1a、BY4741和CEN.PK2-1D基因組。經基因組 PCR驗證正確的重組轉化子,分別命名為:SyBE_Sc00011101、SyBE_Sc00011103、SyBE_Sc00011106、SyBE_Sc00011107。
釀酒酵母MVA途徑以乙酰輔酶A為底物,提供倍半萜類化合物合成前體FPP,因此增加FPP的積累量可以增加釀酒酵母生產倍半萜類化合物如青蒿二烯的能力。過表達tHMGR基因和ERG20基因可以增加FPP的積累量。關鍵酶基因的拷貝數影響青蒿二烯產量[21],但是表達多拷貝質粒的人工菌株往往基因型不夠穩定[25],而單拷貝整合過表達目標基因對產物產量的提升不顯著。本研究選用多拷貝序列 Delta作為整合位點[22-23],實現了關鍵酶基因的多拷貝表達,并且以基因組形式穩定存在。
2.2 人工釀酒酵母細胞底盤的優選
進行人工酵母菌株 50 ml搖瓶發酵。用GC-TOF/MS檢測產物,在保留時間為10.34 min時檢測到青蒿二烯的特征質譜峰m/z=204和m/z=189。根據相同測定條件下得到的朱欒倍半萜濃度-峰面積標準曲線,對人工酵母細胞發酵液中青蒿二烯濃度進行定量。
實驗結果表明,表達功能模塊的底盤細胞的生長狀況以及底盤細胞與功能模塊之間適配性的差異,導致人工細胞的生長情況和目標產物積累狀況的差異[16]。結果表明,底盤細胞 CEN.PK2由于其較好的生理學特征和生孢能力[25-26],從菌體生長狀況和青蒿二烯濃度(表 3)上都顯示出明顯優勢。因此,選擇人工酵母菌株SyBE_Sc00011101進行后續研究。
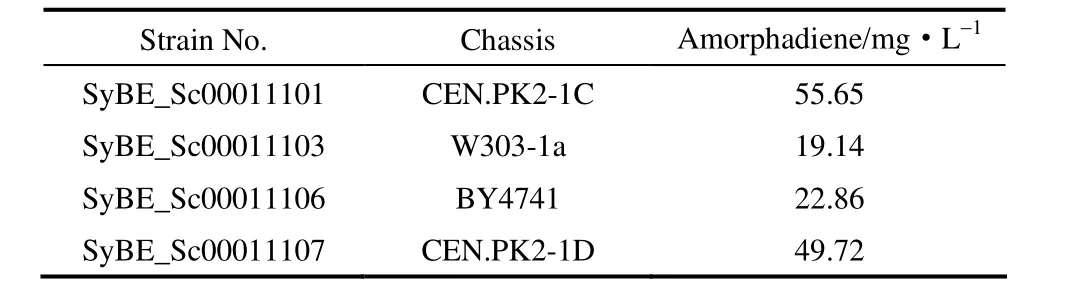
表3 不同底盤的人工菌株青蒿二烯產量Table 3 Production of amorphadiene in artificial strains with different chassis
2.3 發酵優化提高產量
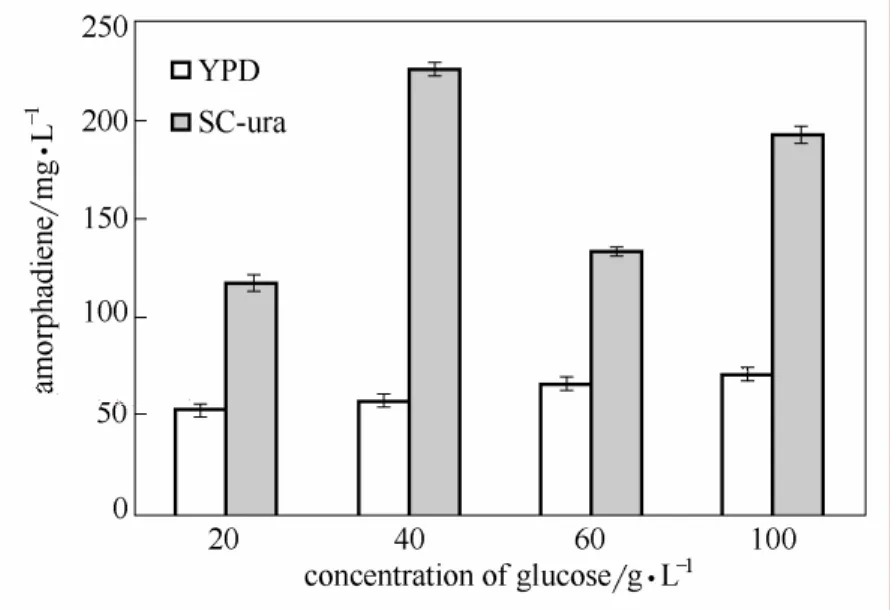
圖3 不同葡萄糖濃度下YPD和SC-ura培養基中青蒿二烯產量Fig.3 Production of amorphadiene in YPD and SC-ura with different glucose concentration
選擇產量較高的菌株 SyBE_Sc00011101進行搖瓶發酵優化,以期獲得更高的產量。
2.3.1 搖瓶發酵培養基成分對發酵過程中青蒿二烯積累的影響 培養條件對人工釀酒酵母的生長狀況和青蒿二烯產量影響較大。以不同培養基用SyBE_Sc00011101進行50 ml搖瓶發酵實驗。實驗發現,菌體在SC-ura培養基中生長速度不及YPD培養基中,但圖3青蒿二烯產量的比較顯示,菌體在SC-ura培養基中青蒿二烯產量高于YPD培養基中。Albers等[27]發現無氧發酵條件下氮源對釀酒酵母生長速率和產乙醇能力影響較大,因此氮源種類可能是菌體在兩種培養基中的生長能力和青蒿二烯生產能力差別的重要因素。培養基中葡萄糖濃度對青蒿二烯產量影響明顯。葡萄糖濃度為40 g·L?1的 SC-ura培養基中青蒿二烯濃度最高為 225.3 mg·L?1。
2.3.2 發酵罐分批次補料發酵 選擇 SyBE_Sc00011101以葡萄糖濃度為20 g·L?1的SC-ura培養基進行5 L發酵罐實驗,初始培養基體積2 L,溫度30℃,pH恒定為5.8,在發酵培養10 h時,加入400 ml正十二烷兩相培養。
為研究發酵罐中溶氧對發酵過程和產物積累的影響,設定轉速和空氣流量分別為250 r·min?1、2 L·min?1和 500 r·min?1、4 L·min?1,以 SC-ura(葡萄糖 20 g·L?1)培養基對 SyBE_Sc00011101菌株進行發酵培養,發酵過程中以分批補料方式補給葡萄糖,在不限制生長潛力的前提下,保證菌體有氧呼吸代謝[28]。生長進入平臺期后,補加氨基酸和YNB至初始濃度。結果(圖4)表明,在轉速較快、空氣流量較大時,OD600值明顯較高;發酵培養至155 h時,轉速為250 r·min?1、空氣流量為2 L·min?1的發酵罐中青蒿二烯濃度為 335.51 mg·L?1;而轉速為 500 r·min?1、空氣流量為 4 L·min?1的發酵罐中青蒿二烯濃度為562.81 mg·L?1,是前者的1.68倍。
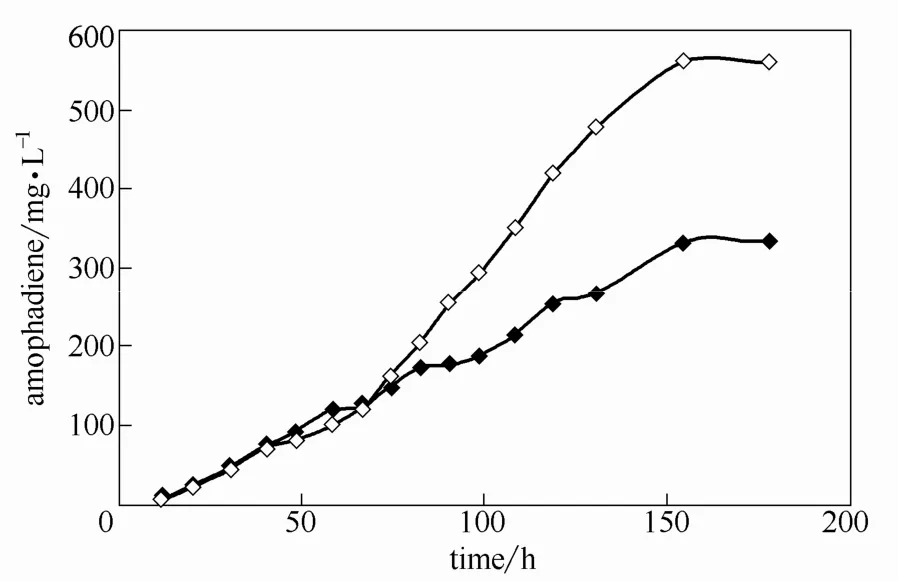
圖4 發酵罐轉速和空氣通量的優化Fig.4 Optimization of rotation speed and air flux
這可能是由于隨著溶氧量的增大,人工酵母細胞的呼吸代謝加強,葡萄糖生成丙酮酸的過程加快,同時削弱了無氧條件下丙酮酸生成乙醇和乙酸的過程,而生成更多乙酰輔酶A,經MVA途徑為青蒿二烯合成提供更充足的FPP。通過增加底物濃度加快反應速率,從動力學上加快青蒿二烯積累;根據巴斯德效應,酵母在氧氣充足時消耗更少的葡萄糖,產生更多的能量,在熱力學上促進了青蒿二烯的積累。
由于底盤細胞 CEN.PK2-1C部分氨基酸基因缺陷,經外源基因整合后仍不能合成部分必需氨基酸,如亮氨酸(Leu)、組氨酸(His)和色氨酸(Trp),需要在培養基中添加這些氨基酸。Watson[29]研究發現不同氮源和氨基酸比例影響酵母生長。培養基中這3種氨基酸的濃度是否會影響產量,仍需要進一步探索。選取 Leu、His、Trp初始濃度分別為 0.1 g·L?1、0.02 g·L?1、0.02 g·L?1和 1 g·L?1、0.2 g·L?1、0.2 g·L?1的 SC-ura 培養基(分別記為 SC-ura和 SC-ura+10aa),設定發酵條件為:初始OD600為0.05,培養基體積2 L,pH為5.8,轉速 500 r·min?1,空氣流量 4 L·min?1,10 h 后加入400 ml正十二烷兩相培養。當葡萄糖濃度接近2 g·L?1時,補加葡萄糖母液使其濃度達到約20 g·L?1,菌體進入生長平臺期時按初始濃度補加YNB和氨基酸。
實驗結果(圖5)表明:(1)發酵培養155 h時 SC-ura+10aa培養基中青蒿二烯濃度為 1.05 g·L?1;SC-ura培養基中青蒿二烯濃度為 562.81 mg·L?1,說明該人工酵母菌株生產青蒿二烯的過程受到氨基酸濃度的影響。(2)發酵培養35 h后,SC-ura培養基中人工菌株生長進入平臺期,在40 h補加 YNB和氨基酸母液至初始濃度,隨后菌體二次生長,說明氮源以及氨基酸濃度會限制該菌株的生長。但若菌株生長速度過快,而空氣通量保持不變,則單位OD600菌體溶氧量降低,一定程度上加快了單位菌體消耗葡萄糖的速率,而氮源的不充足使得人工菌株相關代謝失衡,所以SC-ura培養基中雖然有較高的菌體終密度,但青蒿二烯終濃度卻遠低于SC-ura+10aa培養基中。
本文通過多拷貝位點整合過表達MVA途徑關鍵基因HMGR以及FPP合成酶基因ERG20,增加MVA路徑通量以及FPP的積累量;同時表達青蒿二烯合成酶ADS,雖然經過發酵優化,在5 L發酵罐中青蒿二烯的產量達到1.05 g·L?1,但仍與國內外該領域相關研究存在差距。因此除了HMGR和ERG20之外,FPP向萜類物質的通量應該還受到其他因素的抑制,比如代謝流的平衡以及支路分流的作用。因此,在后續的研究中,將會繼續對相關代謝路徑上物料的均衡分配進行相關研究以達到提高青蒿二烯產量的目的。
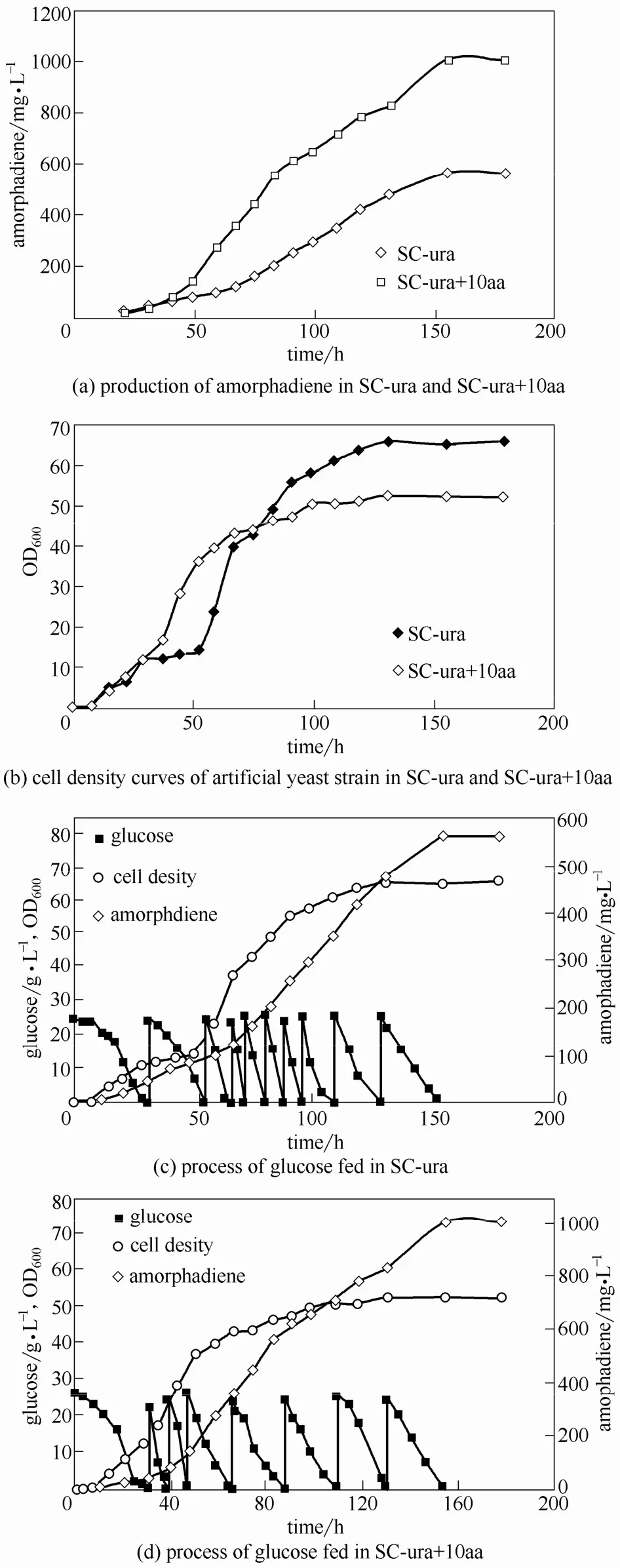
圖5 氨基酸濃度和補料發酵過程的優化Fig.5 Optimization of amino acid concentration and fed-batch process
3 結 論
(1)為了增加基因拷貝數,同時克服多拷貝質粒容易丟失的問題,選用基因組上多拷貝位點Delta作為整合位點,可以增加人工釀酒酵母細胞經過MVA途徑合成FPP的能力,從而提高青蒿二烯的產量。
(2)發酵過程中,培養基不同會影響菌體濃度和青蒿二烯產量。本研究中SC-ura培養基中青蒿二烯的產量高于 YPD培養基;并且菌體的生長和生產之間存在平衡關系,菌體的生長速率和青蒿二烯的生產速率并不呈正相關。
(3)培養基中葡萄糖濃度影響菌體生長,并且這種影響會反映到青蒿二烯的積累過程上。同時菌體生長依賴于部分必需氨基酸,由于氨基酸是組成蛋白的基本單位,因此對菌體生長以及青蒿二烯的生產影響顯著。本研究中發酵罐培養時,選用高濃度氨基酸發酵,可以改善菌體生長狀況,從而提高發酵液中青蒿二烯的濃度。
(4)發酵罐培養時,選擇較大轉速和較高空氣通量,能改善菌體生長狀況,增強其生產青蒿二烯的能力。
[1]Wallaart T E, Pras N, Qua X W J. Seasonal variations of artemisinin and its biosynthetic precursors intetraploidArtemisia annuaplants compared with the diploid wild-type [J].Plant Medica, 1999, 65(8):723-728
[2]Xu Xingxiang, Zhu Jie, Huang Dazhong, Zhou Weishan.Totalsynthesis of arteannuin and deoxyarteannui [J].Tetrahedron,1986, 42(3): 819 -828
[3]Kong Jianqiang(孔建強), Wang Wei(王偉), Cheng Kedi(程克棣),Zhu Ping(朱平). Research progress in synthetic biology of artemisinin [J].Acta Pharmaceutiaca Sinica(藥學學報), 2013, 48(2):193-205
[4]Liu Duo(劉奪), Du Jin(杜瑾), Zhao Guangrong(趙廣榮), Yuan Yingjin(元英進). Applications of synthetic biology in medicine and energy [J].CIESC Journal(化工學報), 2011, 62(9): 2391-2397
[5]Schramek N, Wang H, R?mischMargl W, Keil B, Radykewicz T,Winzenh?rlein B, Beerhues L, Bacher A, Rohdich F, Gershenzon J,Liu B, Eisenreich W. Artemisinin biosynthesis in growing plants ofArtemisia annua. A13CO2study [J].Phytochemistry, 2010, 71(2-3):179-187
[6]Bouwmeestera H J, Wallaartb T E, Janssena M H A, Loo B V, Jansen B J M, Posthumus M A, Schmidt C O, Kraker J W D, K?nig W A,Franssen M C R. Amorpha-4,11-diene synthase catalyses the first probable step in artemisinin biosynthesis [J].Phytochemistry, 1999,52(5): 843-854
[7]Kuzuyama T, Seto H. Diversity of biosynthesis of the isoprene units[J].Natural Product Reports, 2003, 20: 171-183
[8]Paddon C J, Keasling J D. Semi-synthetic artemisinin: a model for the use of synthetic biology in pharmaceutical development [J].Nature Reviews, 2014, 12(5): 335-367
[9]Martin V J, Pitera D J, Withers S T, Newman J D, Keasling J D.Engineering a mevalonate pathway inEscherichia colifor production of terpenoids [J].Nature Biotechnology, 2003, 21(7): 796-802
[10]Ro D K, Paradise E M, Ouellet M, Fisher K J, Newman K L,Ndungu J M, Ho K A, Eachus R A, Ham T S, Kirby J, Chang C Y M,Withers S T, Shiba Y, Sarpong R, Keasling J D. Production of the antimalarial drug precursor artemisinic acid in engineered yeast [J].Nature, 2006, 440(7086): 940-943
[11]Tsuruta H, Paddon C J, Eng D, Lenihan J R, Horning T, Anthony L C,Regentin R, Keasling J D, Renninger N S, Newman J D. High-level production of amorpha-4,11-diene, a precursor of the antimalarial agent artemisinin, inEscherichia coli[J].PLoS ONE,2009, 4(2):e4489
[12]Kong Jianqiang(孔建強), Shen Junhao(沈君豪), Huang Yong( 黃勇),Wang Wei(王偉), Cheng Kedi(程克棣), Zhu Ping(朱平). Production of amorpha-4,11-diene in engineered yeasts [J].Acta Pharmaceutiaca Sinica(藥學學報), 2009, 44(11): 1297-1303
[13]Kong Jianqiang, Wang Wei, Wang Lina, Zheng Xiaodong, Cheng Kedi, Zhu Ping. The improvement of amorpha-4,11-diene production by a yeast-conform variant of vitreoscillahemoglobin [J].Journal of Applied Microbiology, 2009, 106(3): 941-951
[14]Westfall P J, Pitera D J, Leihan J R, Eng D, Woolard F X, Regentin R,Horning T, Tsuruta H, MelisD J, Owens A, Fickes S, Diola D,Benjamin K R, Keasling J D, Leavell M D, McPhee D J, Renninger N S, Newman J D, Paddon C J. Production of amorphadiene in yeast,and its conversion to dihydroartemisinic acid, precursor to the antimalarial agent artemisinin [J].PNAS, 2012, 109(3): 111-118
[15]Wang Sijia(王思佳), Ding Mingzhu(丁明珠), Yuan Yingjin(元英進).The impact of promoters and vectors on the amorphadiene production in yeast cells [J].China Biotechnology(中國生物工程雜志), 2013,33(8): 15-23
[16]Jia Yunjing(賈云婧), Zhao Juan(趙娟), Ding Mingzhu(丁明珠),Yuan Yingjin(元英進). Fitness of amorphadiene production functional modules and yeast chassis [J].Chemical Journal of Chinese Universities(高等學校化學學報), 2013, 34(12): 2765-2771
[17]Lei Wei(雷桅), Tang Shaohu(湯紹虎), Zhou Qigui(周啟貴), Shui Xiaorong(稅曉容), Sun Yiming(孫一鳴), Sun Min(孫敏).Bioinformatics analysis of 3-hydroxy-3-methylglutaryl-coA reductase(HMGR)in isoprenoid biosynthesis of mulberry [J].Science of Sericulture(蠶業科學), 2008, 34(3): 4609-4614
[18]Donald K A, Hampton R Y, Fritz I B. Effects of overproduction of the catalytic domain of 3-hydroxy-3-methylglutaryl coenzyme A reductase on a qualene synthesis inSaccharomyces cerevisiae[J].Applied and Environmental Microbiology, 1997, 63(9): 3341-3344
[19]Han Junli, Liu Benye,Ye Hechun, Wang Hong, Li Zhenqiu, Li Guofeng. Effects of overexpression of the endogenous farnesyldiphosphate synthase on the artemisinin content inArtemisia annua[J].Journal of Integrative Plant Biology, 2006, 48(4): 482-487
[20]Paradise E M, Kirby J, Chan R, Keasling J D. Redirection of flux through the FPP branch-point inSaccharomyces cerevisiaeby down-regulating squalene synthase [J].Biotechnology and Bioengineering, 2008, 100(2): 371-378
[21]Pitera D J, Paddon C J, Newman J D, Keasling J D. Balancing a heterologous mevalonate pathway for imprive disoprenoid production inEscherichia coli[J].Metabolic Engineering, 2007, 9: 193-207
[22]Sakai A, Shimizu Y, Hishinuma F. Integration of heterologous genes into the chromosome ofSaccharomyces cerevisiaeusing a delta sequence of yeast retrotansposon Ty [J].Applied Microbiology and Biotechnology, 1990, 33(3): 302-306
[23]Lee Frank W F, SilvaNancy A D. Sequential Delta-integration for the regulated insertion of cloned genes inSaccharomyce scerevisiae[J].Biotechnology Progress, 1997, 13(4): 368-373
[24]Tianjin University. A standardized, high accuracy and general method for build of function module[P]: CN, 201310377238.1. 2013-08-27
[25]van Dijken J P, Bauer J, Brambilla L, Duboc P, Francois J M,Gancedo C, Giuseppin M L, Heijnen J J, Hoare M, Lange H C,Madden E A, Niederberger P, Nielsen J, Parrou J L, Petit T, Porro D,Reuss M, van Riel N, Rizzi M, Steensma H Y, Verrips C T, Vindelov J, Pronk J T. An interlaboratory comparison of physiological and geneticproperties of fourSaccharomyces cerevisiaestrains [J].Enzyme Microbiology Technology, 2000, 26: 706–714
[26]BenAri G, Zenvirth D, Sherman A, David L, Klutstein M, Lavi U,Hillel J. Four linked genes participate in controlling sporulation efficiency in budding yeast [J].PLoS Genetics, 2006, 2(11): e195
[27]Albers E, Larsson C, Lidén G, Niklasson C, Gustafsson L. Influence of the nitrogen source onSaccharomyces cerevisiaeanaerobic growth and product formation [J].Applied and Environmental Microbiology,1996, 62(9): 3187-3195
[28]Pham H T B, Larsson G, Enfors S O. Growth and energy metabolism in aerobic fed-batch cultures ofSaccharomyces cerevisiae: simulation and model verification [J].Biotechnology and Bioengineering, 1998,60(4): 474-482
[29]Watson T G. Amino-acid pool composition ofSaccharomyces cerevisiaeas a function of growth rate and amino-acid nitrogen source [J].Journal of General Microbiology, 1976, 96: 263-268

