靈芝孢子粉抑制人卵巢癌細胞增殖及誘導凋亡的體外研究
王衛霄 姚苗苗 呂艷茹 杜曉欣 張曉靜 趙素芬
·論著·
靈芝孢子粉抑制人卵巢癌細胞增殖及誘導凋亡的體外研究
王衛霄 姚苗苗 呂艷茹 杜曉欣 張曉靜 趙素芬
目的研究靈芝孢子粉對人卵巢癌OV2008細胞增殖及凋亡的影響,并探討其作用機制。方法采用WST-1比色法及顯微鏡觀察法研究靈芝孢子粉對OV2008細胞生長抑制作用及細胞形態的改變;流式細胞儀檢測細胞周期分布情況;Hoechst-33258染色方法評估細胞凋亡并采用western blot方法測定凋亡相關蛋白的表達。結果WST結果表明靈芝孢子粉可以抑制OV2008細胞的生長,并呈劑量和時間依賴性;流式細胞術結果提示靈芝孢子粉可使卵巢癌細胞生長阻滯于G1期。Hoechst-33258染色結果顯示靈芝孢子處理細胞后可以檢測出凋亡細胞。Western blot方法檢測到凋亡抑制蛋白bcl-2、bcl-xl隨靈芝孢子濃度增加而下降,而促凋亡蛋白bax及P27、casep具有抑制卵巢癌細胞生長及誘導凋亡的作用,其機制是作用于細胞周期的ase-3逐漸升高。結論靈芝孢子粉可以抑制卵巢細胞生長,使細胞生長阻滯于G1期,并可以通過上調bax、P27,下調bcl-2并活化casepase-3而發揮其作用。
靈芝孢子粉;卵巢腫瘤;增殖;凋亡;細胞周期
卵巢癌是婦科常見惡性腫瘤之一,其治療以手術和化療為主。隨著治療手段的提高,患者的生存率和生活質量也得到了一定程度的提高,但由于治療效果仍不十分理想,其病死率仍居婦科惡性腫瘤之首。因此尋求有效的治療方法仍然是卵巢癌的研究焦點。目前中藥作為卵巢癌輔助治療手段之一越來越受到重視。靈芝孢子在我國及其他亞洲國家已被公認為治療
多種疾病的中藥,并且已有大量應用靈芝孢子治療各種腫瘤的研究報道[1-3]。本研究觀察了在不同藥物濃度下靈芝孢子對體外培養人卵巢癌細胞增殖與凋亡的影響,探討其對人卵巢癌OV2008細胞生長抑制作用的機制,為其在卵巢癌的臨床應用提供理論依據。
1 材料與方法
1.1 材料
1.1.1 儀器:NU2600E型CO2培養箱(ESBE Scientific MC017A1C);超凈工作臺(Microzone coinporation F40BX/SPZ41);EL340酶標儀(Bio.TEK INSTRUMENTSINS);倒置相差電子顯微鏡(ZEISS AXIOVERT25);熒光顯微鏡(NIKON TE2000-U);水浴箱(Fisher Scientific ISOTEMP 210);離心機(SheltonScientific CENTRA CL2);流式細胞儀(BD FACS caliber:BD BIOsciences E97600092)。
1.1.2 試劑與藥品:靈芝孢子粉由加拿大energene天然藥品有限公司提供,批號為083668。WST-1/ECS溶液為Roche公司產品;RPMI 1640培養基為Fisher Scientific公司產品、新生小牛血清、Hoechst 33258為Invitrogen公司產品;青鏈霉素(含10 000 U青霉素及10 000微克鏈霉素)為Invitrogen公司產品,批號為15140-148。臺盼蘭(Trypan blue)EMD公司產品,批號EM8721-0;Trypsin、碘化丙啶(PI)、核糖核酸酶A (RnaseA)多聚甲醛溶液(Paraformaldehyde)、為Sigma公司產品;Bax、bcl-2、cleaved-casepase3抗體為cell signaling Technology公司產品;p27Kip1抗體為BD Bioscience產品。抗鼠及抗兔二抗購于Fisher Scientific公司。ECL化學發光試劑盒及感光膠片為GE公司產品。
1.2 方法
1.2.1 細胞來源及培養:人卵巢癌細胞系OV2008為完成該實驗的加拿大york大學生命科學系chun peng實驗室保存。用含10%胎牛血清(Sigma公司產品)、1%青霉素鏈霉素(Invitrogen公司產品)的RPMI 1640培養基(Thermo公司產品),在37℃,5%CO2培養箱中培養。
1.2.2 靈芝孢子粉工作液配制:靈芝孢子粉由加拿大energene天然藥品有限公司提供。將靈芝孢子粉500 mg溶于10 ml DD-H2O中配制成50 mg/ml的靈芝孢子液,高溫滅菌、促溶,靜置或離心后取上清,用0.20 μm微孔濾膜過濾器過濾除菌,即刻用于實驗或作為儲存液密封置于4℃冰箱,保存2周,再次使用前70℃孵育10 min。
1.2.3 WST-1法檢測靈芝孢子粉對人卵巢癌細胞增殖的抑制作用:取對數生長期的OV2008細胞,0.2% Trypsin消化后,以每孔4 000個細胞接種于96孔培養板,培養過夜后試驗組分別加入濃度為0.1、0.5、1、2、2.5 mg/ml的靈芝孢子液,每個濃度設5個復孔,對照組5個孔同時更換培養液,分別于24、48 h進行比色檢測細胞活力。按照試劑盒說明書于每一時間點每孔中加入10 μl WST-1/ECS溶液,培養箱培養30 min,充分振蕩1 min,酶標儀測定波長為450 nmOD值,計算藥物對細胞生長的抑制率,細胞抑制率=1-試驗組平均OD值/對照組平均OD值×100%。IC50用Logit法計算。
1.2.4 細胞計數法檢測靈芝孢子對人卵巢癌細胞生長抑制作用:OV20008細胞消化后以每孔10×104個細胞接種于12孔培養板,培養過夜后試驗組分別加入濃度為0.1、0.5、1、2 mg/ml的靈芝孢子液,每個濃度設3個復孔,對照組3個孔加入不含藥物的培養液。48 h顯微鏡下拍照各組細胞形態,之后收獲細胞,消化細胞后以1∶1比例與臺盼蘭混合,光學顯微鏡下死亡細胞被染成藍色,而存活細胞因有完整細胞膜存在不被染色,鏡下用細胞計數器計數未染色的活細胞數目。
1.2.5 流式細胞技術測定卵巢癌細胞細胞周期分布:取對數生長期的卵巢癌細胞系OV2008,消化后接種100×104個細胞于6 cm細胞培養板,培養過夜后實驗組吸去原培養液,分別置入終濃度為0.5、1、2 mg/ml的靈芝孢子粉溶液,對照組加入不含藥物的培養液,培養24、48和72 h,收集細胞。0.2%Trypsin消化后離心,棄去上清液,1×PBS 5 ml洗滌后以70%冷乙醇固定,冰上放置30 min后直接上機測定或保存于-20℃冰箱待測。上機前離心棄去冰乙醇,PBS洗2次后以預染溶液(0.2%Triton-100、1 mmol/L EDTA)洗滌一次,加50 μg/ml核糖核酸酶A(RnaseA)及50 μg/ml碘化丙啶(PI),避光染色60 min,經200目尼龍網過濾后,用流式細胞儀測定,計算出細胞周期分布情況。
1.2.6 Hoechst-33258染色方法評估細胞凋亡:采用Hoechst-33258染色方法評估細胞凋亡,接種50×104個細胞于6 cm細胞培養板,培養過夜后,以不同濃度靈芝孢子處理細胞,48 h后對照組和實驗組細胞分別吸掉培養液,以4%的多聚甲醛溶液(用1×PBS配制)固定細胞20 min,1×PBS洗滌后以1 μg/ml的Hoechst-33258染色15 min,1×PBS洗滌2次,熒光顯微鏡(NIKON ECLIPSE TE 2000-U)下通過紫外光觀察細胞核的改變。
1.2.7 Western blot方法測定bcl-2和Bax,cleavedcaspase3,P27蛋白表達:人卵巢癌細胞OV2008以每孔25×104個細胞數接種于6孔板,次日加入相應劑量的靈芝孢子粉溶液,對照組同時更換培養液,48 h提取總蛋白。細胞用冷PBS洗滌2次,用50 μl Rapa裂解液(radioimmune precipitation assay buffer)裂解細胞,冰上30 min后刮取細胞,以12 000 r/min 4℃離心15 min,收集上清移入新的1.5 ml離心管中,測定蛋白濃度。取20 μg(cleaved casepase-3取50 μg)蛋白樣品經12%SDS-聚丙烯酰胺凝膠(檢測cleaved casepase-3用15%SDS-聚丙烯酰胺凝膠)90V電壓進行電泳分離,之后電轉移至硝酸纖維素濾膜(Millipore公司產品)上,用含有50g/L去脂奶粉的TBST (10 mmol/L Tris-Cl(pH值8.0),150 mmol/L NaCl,0.05%Tween 20)封閉1 h,分別加入抗bcl-2(1∶1 000),bax(1∶4 000),cleaved-caspase-3(1∶500),P27 (1∶1 000)的抗體(cell signaling Technology公司產品) 4℃反應過夜,T-BST漂洗3次,每次10 min。HRP標記的抗兔IgG二抗孵育1 h;T-BST漂洗3次,應用ECL-plus Western Blot化學發光試劑盒顯色檢測信號。以β-actin為內參照。
1.3 統計學分析應用Sigmastat 3.5統計軟件,計量資料以ˉx±表示,采用t檢驗,兩組以上均數比較應用單因素方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 靈芝孢子抑制卵巢癌細胞增殖WST-1比色法顯示,靈芝孢子對卵巢癌OV2008細胞具有明顯的生長抑制作用,柱狀圖顯示活性細胞較對照組明顯減少,靈芝孢子作用48 h的IC50為(1.30±0.56)mg/ml。采用不同濃度的靈芝孢子處理接種于12孔培養板的OV2008細胞48 h,倒置顯微鏡下觀察到細胞數目隨濃度增加而減少,高濃度靈芝孢子組可見細胞脫離培養皿壁成懸浮狀態,致貼壁存活細胞數目極少(圖2A)。圖2B為細胞計數結果,提示隨靈芝孢子濃度增加存活細胞數目逐漸減少。見圖1、2。

圖1 靈芝孢子對人卵巢癌0V2008細胞的增殖抑制作用
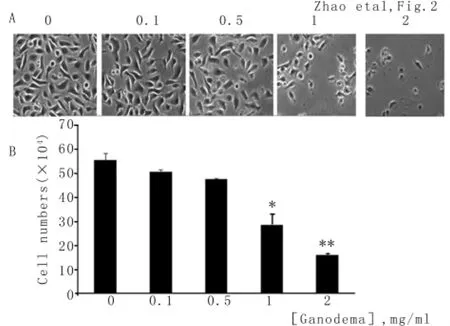
圖2 靈芝孢子對人卵巢癌OV2008細胞的生長抑制作用。A:不同濃度靈芝孢子處理細胞48 h的顯微鏡下改變(Hoechst-33258染色×4)。B:藥物處理后細胞數目的改變
2.2 靈芝孢子對卵巢癌細胞周期分布的影響本研究應用流式細胞技術檢測靈芝孢子作用于卵巢癌細胞后細胞周期的分布,靈芝孢子處理OV2008細胞后多數細胞聚集于G1期,并且G1期細胞數目隨作用時間延長而增加。而S期和G2/M期細胞數目較少,且G2/ M細胞隨作用時間延長而減少,S期細胞數目隨作用時間無明顯改變。見圖3。

圖3 靈芝孢子處理人卵巢癌OV2008細胞不同時間后細胞周期分布情況。A:處理組與對照組細胞周期比率變化,橫軸代表處理時間,縱軸代表周期比率;B:流式細胞儀檢測藥物處理不同時間的細胞周期分布情況
2.3 靈芝孢子誘導卵巢癌細胞凋亡為明確靈芝孢子是否通過凋亡途徑致卵巢癌細胞死亡,采用Hoechst-33258染色方法檢測卵巢癌細胞凋亡情況。結果顯示靈芝孢子可致卵巢癌細胞凋亡,并呈劑量依賴性。熒光顯微鏡觀察到典型凋亡細胞染色后表現為細胞核縮小,染色質濃縮,藥物濃度越大凋亡細胞越多。見圖4。

圖4 不同濃度靈芝孢子處理細胞48 h后細胞凋亡情況(Hoechst-33258染色×4)
2.4 靈芝孢子對卵巢癌細胞相關蛋白的表達靈芝孢子對bcl-2和Bax蛋白表達的影響:為明確靈芝孢子引起卵巢癌細胞凋亡的信號通道,利用靈芝孢子處理后細胞的蛋白質測定了bcl-2和Bax的表達情況。結果表明隨靈芝孢子濃度增加bcl-2蛋白表達水平降低,而bax蛋白水平升高靈芝孢子對P 27蛋白表達的影響:為了闡明靈芝孢子對卵巢癌細胞細胞周期影響的機制,采用western blot方法測定了P27的變化。結果顯示P27蛋白水平隨靈芝孢子濃度增加而增加。靈芝孢子對Casbase-3蛋白表達的影響:為了評估Casbase-3在靈芝孢子引起卵巢癌細胞凋亡中的作用,檢測了Casbase-3蛋白在卵巢癌細胞的表達情況。Western blot結果顯示35KD的Casbase-3被激活成活化的19、20 kD的cleaved-casepase3,并隨靈芝孢子濃度增加表達呈升高趨勢。見圖5。
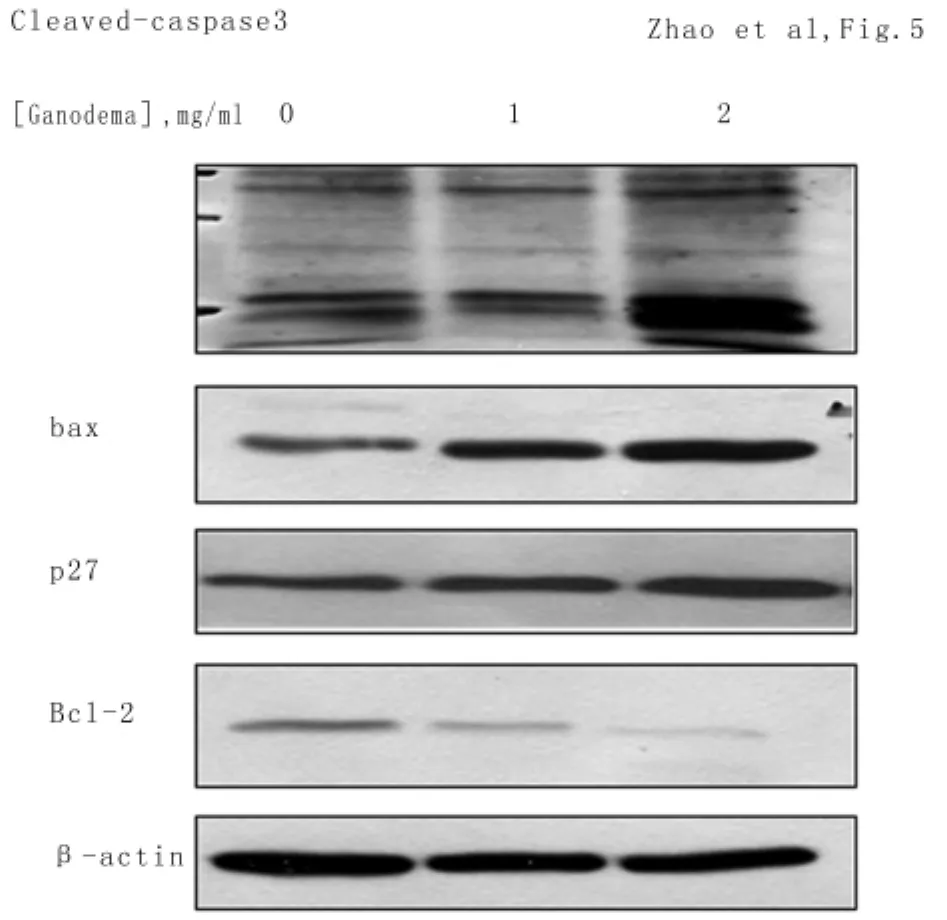
圖5 不同濃度靈芝孢子處理人卵巢癌OV2008后相關蛋白表達情況
3 討論
靈芝孢子是靈芝生長成熟期從菌蓋彈射出來的象淡霧狀的極其微小的孢子,其主要成分有靈芝多糖、三萜類化合物、生物堿類、多肽及微量元素鋅、鍺、硒等,有其發揮強大生理功能的重要分子學基礎。體內外研究表明靈芝孢子可以抑制多種腫瘤的生長[4-6]。并有實驗表明靈芝破壁孢子較完整孢子有更高的生物活性[7]。因此本研究采用破壁的靈芝孢子作為處理因素,用不同濃度的破壁靈芝孢子處理卵巢癌細胞株OV2008不同時間,觀察到靈芝孢子可以抑制卵巢癌細胞生長,使細胞生長阻滯于G1期;并能通過上調Bax,caspase-3及下調bcl-2蛋白途徑誘導細胞凋亡。
卵巢癌細胞OV2008加入不同濃度的靈芝孢子作用48 h可以觀察到細胞生長受到抑制,表現為細胞變圓,部分細胞脫離培養皿呈漂浮狀態,這種抑制作用呈劑量依賴性,靈芝孢子濃度的增加,對細胞的增殖抑制作用增強,半數抑制濃度為1.0977 mg/ml。通過DNA特異性結合的熒光染料Hoechst33258染色觀察到靈芝孢子作用于卵巢癌細胞后出現典型的凋亡細胞染色質聚集改變。提示靈芝孢子可以通過周期阻滯和誘導凋亡途徑發揮增殖抑制作用。
靈芝孢子對腫瘤細胞周期的影響有不同的報道,Zhu等[2]的研究表明靈芝孢子的酒精提取物可以使宮頸癌HeLa細胞停滯于G1/S期,Hu等[8]在乳腺癌MCF-7細胞的研究得到同樣的結果。靈芝孢子的水提取物作用于hepatoma細胞可以引起細胞G2/M期捕獲[9]。不同的結果可能由于不同的提取方法造成提取物成分有所差異所致[10]。本研究結果提示靈芝孢子作用于OV2008細胞48 h后,可使細胞周期的分布發生明顯變化,使停滯于G1期的細胞比例明顯增多并隨靈芝孢子作用時間而逐漸增加。表明靈芝孢子對OV2008細胞的增殖抑制作用可能與多數腫瘤細胞停滯于G1期,減少了DNA合成和有絲分裂有關。
P27屬于CKIs類蛋白,能廣泛抑制cyclinD/CDK復合物的活性,使細胞發生G1~S期阻滯,從而對細胞周期發揮負調控作用[11,12]。本研究結果顯示靈芝孢子處理OV2008細胞后P27蛋白表達水平隨靈芝孢子濃度增加而逐漸升高,與細胞周期的變化相一致。推測靈芝孢子通過P27調控細胞周期。
抑制腫瘤的重要途徑之一是誘導凋亡,bcl-2家族中的bcl-2和Bax是調控凋亡的重要基因,細胞中bcl-2可以抑制細胞凋亡,而bax可以促進凋亡[13],它可以與自身或bcl-2形成二聚體,從而抑制bcl-2活性,促進細胞凋亡發生[14]。P27可以通過調控細胞周期而誘導細胞凋亡[15]。本研究中卵巢癌細胞經靈芝孢子處理后Bax、P27蛋白表達水平升高而bcl-2、bcl-xl表達水平下降,可能是引起細胞凋亡的機制之一。
Casepase家族是凋亡過程中的效應蛋白,活化的casepase-3能通過蛋白酶的水解進行細胞內信號的轉導。其中casepase-3是casepase家族中最重要的凋亡執行者,廣泛分布于各種類型的細胞中。Casepase-3在細胞中是以無活性的酶原(32 kD)形式存在,活化的Casepase-3(17 kD和19 kD)能促進凋亡信號的轉導。研究表明,細胞凋亡信號轉導的關鍵是凋亡下游蛋白casepase-3的激活,裂解相應的胞漿胞核底物最終導致細胞凋亡[16]。靈芝孢子處理OV2008細胞48 h可產生活化的Casepase-3,并且其表達水平隨靈芝孢子濃度增大而升高,因而靈芝孢子可能通過casepase-3的信號途徑誘導凋亡的發生,從而發揮抑瘤效應。與Ibrado等[17]研究的抑瘤效應機制相一致。
綜上所述,體外實驗表明靈芝孢子可以抑制卵巢癌OV2008細胞的增殖并誘導其凋亡,其誘導凋亡的機制可能與Bax、P27的高表達、bcl-2、bcl-xl的低表達、激活卵巢癌細胞中Caspase-3的表達以及阻滯細胞周期有關。可以為靈芝孢子作為卵巢癌的輔助治療提供理論依據。
1趙旭東,楊新林,陳霖,等.靈芝孢子中抗腫瘤成分的提取與分離.中國中藥雜志,2000,25:288-290.
2Zhu HS,Yang Xl,Wang LB,et al.Effects of extracts from sporoderm-broken spores of Ganoderma lucidum on HeLa cells.Cell Biol Toxicol,2000,16:201-206.
3Calvino E,Manjon Jl,Sancho P,et al.Ganoderma lucidum induced apoptosis in NB4 human leukemia cells:involvement of Akt and Erk.J Ethnopharmacol,2010,128:71-78.
4張群豪,林志彬.靈芝多糖GL-B的抑瘤作用和機制研究.中國中西醫結合雜志,1999,19:544.
5Lu H,Kyo E,Uesaka T,et al.Prevention of development of N,N’-dimethylhydrazine-induced colon tumors by a water-soluble extract from cultured medium of Ganoderma lucidum(Rei-shi)mycelia in male ICR mice.Int J Mol Med,2002,9:113-117.
6Lee JM,Kwon H,Jeong H,et al.Inhibition of lipid peroxidation and oxidative DNA damage by Ganoderma lucidum.Phytother Res,2001,15: 245-249.
7Liu X,Yuan JP,Chung CK,et al.Antitumor activity of the sporodermbroken germinating spores of Ganoderma lucidum.Cancer Lett,2002,182:155-161.
8Hu H,Ahn NS,Yang X,et al.Ganoderma lucidum extract induces cell cycle arrest and apoptosis in MCF-7 human breast cancer cell.Int J Cancer,2002,102:250-253.
9Lin SB,Li CH,Lee SS,et al.Triterpene-enriched extracts from Ganoderma lucidum inhibit growth of hepatoma cells via suppressing protein kinase C,activating mitogen-activated protein kinases and G2-phase cell cycle arrest.Life Sci,2003,72:2381-2390.
10Tang W,Liu JW,Zhao WM,et al.Ganoderic acid T from Ganoderma lucidum mycelia induces mitochondria mediated apoptosis in lung cancer cells.Life Sci,2006,80:205-211.
11Ohtani M,Isozaki H,Fujii K,et al.Impact of the expression of cyclindependent kinase inhibitor p27Kip1 and apoptosis in tumor cells on the overall survival of patients with non-early stage gastric carcinoma.Cancer,1999,85:1711-1718.
12Santiago-Walker AE,Fikaris AJ,Kao GD,et al.Protein kinase C delta stimulates apoptosis by initiating G1 phase cell cycle progression and S phase arrest.J Biol Chem,2005,280:32107-32114.
13Yang E,Korsmeyer SJ.Molecular thanatopsis:a discourse on the BCL2 family and cell death.Blood,1996,88:386-401.
14Rawat S,Gray C,Johnson Ts,et al.Apoptosis and expression of BCL-2 and BAX in cyclosporine-induced experimental renal fibrosis.Transplant Proc,2003,35:187-188.
15Patel SD,Tran AC,Ge Y,et al.The p53-independent tumoricidal activity of an adenoviral vector encoding a p27-p16 fusion tumor suppressor gene.Mol Ther,2000,2:161-169.
16Yang XH,Sladek Tl,Liu X,et al.Reconstitution of caspase 3 sensitizes MCF-7 breast cancer cells to doxorubicin-and etoposide-induced apoptosis.Cancer Res,2001,61:348-354.
17Ibrado AM,Huang Y,Fang G,et al.Overexpression of Bcl-2 or Bcl-xL inhibits Ara-C-induced CPP32/Yama protease activity and apoptosis of human acute myelogenous leukemia HL-60 cells.Cancer Res,1996,56: 4743-4748.
Experimental study on the effect of GLSP on human ovarian cancer cell proliferation and apoptosis in vitro
WANG
Weixiao*,YAO Miaomiao,LV Yanru,et al.*Department of Obstetrics and Gynecology,Gaocheng People’s Hospital,Hebei,Gaocheng 052160,China
ObjectiveTo investigate the effect of Ganoderma lucidum spore powder(GLSP)on cell proliferation and apoptosis of human ovarian cell line-OV 2008,and to explore its action mechanism.MethodsThe effects of GLSP on OV2008 cell growth and cell morphous were detected by WST-1 colorimetric technique and microscopy;cell cycle was analyzed flow cytometry;cell apoptosis was detected by Hoechst-33258 staining method;the expression of apoptosis-related proteins(bcl-2 bax,P27,cleaved Caspase-3)were measured by Western blotting.ResultsThe results of WST-1 assays showed that GLSP could inhibit the growth of OV2008 cells,moreover,which was time and dose dependent.The results by flow cytometry showed that GLSP could block OV2008 cell growth at G1 phase.Hoechst 33258 staining results showed that GLSP could induce cell apoptosis.Western blotting results showed that the expression levels of bcl-2,bcl-xl were decreased with the increase of concentration of GLSP,however bax,P27,Caspase-3 could inhibit the growth of ovarian cancer cells and induce cell apoptosis,and its action mechanism was that the expression levels of Casbase-3 that affected cell cycle were gradually increased. ConclusionGLSP can inhibit the growth of ovarian cancer cells,block cell growth at G1 stage,furthermore,which can develop its effects by up-regulating the expression of bax,P27,down-regulating the expression of bcl-2 and activating Caspase-3.
Ganoderma lucidum spore powder;ovarian neoplasms;proliferation;apoptosis;cell cycle
R 737.31
A
1002-7386(2015)02-0165-05
2014-08-19)
10.3969/j.issn.1002-7386.2015.02.001
項目來源:河北省專家出國培訓項目資助(編號:200748)
052160河北省藁城市人民醫院婦產科(王衛霄);河北醫科大學(姚苗苗、呂艷茹、杜曉欣、張曉靜);河北醫科大學第二醫院婦產科(趙素芬)
趙素芬,050000河北醫科大學第二醫院婦產科; E-mail:zhaosfchina@hotmail.com

