頭頂一顆珠提取液對大鼠脊髓損傷后CNTF及CNTFRα表達的影響
陳顯兵,朱旻玥,覃芙蓉,唐尚權,王鳳杰,龍波霖,袁德培
頭頂一顆珠提取液對大鼠脊髓損傷后CNTF及CNTFRα表達的影響
陳顯兵,朱旻玥,覃芙蓉,唐尚權,王鳳杰,龍波霖,袁德培
目的觀察百合科延齡草屬植物頭頂一顆珠干燥根莖提取液對大鼠急性脊髓損傷模型睫狀神經營養因子(CNTF)及其受體(CNTFRα)表達的影響。方法健康成年Wistar大鼠45只,隨機分為對照組、模型組及實驗組(n=15),模型組及實驗組參照Allen's法建立脊髓損傷模型,對照組不損傷脊髓。實驗組于術前2周開始給予頭頂一顆珠提取液灌胃,模型組和對照組給予同劑量蒸餾水灌胃。分別于傷后1d、7d,14d處死動物,取脊髓組織行HE染色觀察組織病理學改變,Nissl染色觀察Nissl小體的變化,并通過免疫組化染色、Western-blotting及RT-PCR檢測觀察CNTF、CNTFRα mRNA及蛋白的表達情況。結果HE染色顯示實驗組脊髓結構比較清晰,神經細胞水腫、壞死較模型組減輕;Nissl染色見模型組和實驗組損傷后各時相點脊髓前角運動神經元尼氏小體減少或消失,實驗組尼氏小體減少程度較模型組明顯減輕;免疫組化染色顯示各組脊髓均有CNTF、CNTFRα蛋白表達。RT-PCR檢測顯示傷后7、14d模型組及實驗組脊髓組織中CNTF、CNTFRα mRNA表達水平均明顯高于對照組,且實驗組明顯高于模型組。Western blotting檢測顯示模型組傷后14d及實驗組傷后7、14d脊髓組織中CNTF、CNTFRα蛋白表達水平明顯高于對照組,且實驗組傷后14d的表達水平均明顯高于模型組。結論頭頂一顆珠能上調脊髓組織中CNTF、CNTFRα的表達,對脊髓損傷有一定的保護作用。
脊髓損傷;睫狀神經營養因子;延齡草
脊髓損傷(spinal cord injury,SCI)后各種機制引起的神經細胞壞死和凋亡在其病程進展過程中起重要作用。由于脊髓再生能力有限,減少脊髓通路的破壞、抑制神經元及膠質細胞凋亡是提高脊髓損傷治療效果的關鍵[1-2]。睫狀神經營養因子(ciliary neurotrophic factor,CNTF)在中樞及周圍神經系統中廣泛存在,在神經受到損傷后與其受體CNTFRα特異性結合,對損傷后神經的再生具有重要作用[3]。頭頂一顆珠(Trillium tschonoskiiMaxim)系百合科延齡草屬植物延齡草的干燥根莖(俗稱地珠),作為土家族地區的珍稀藥材,被土家族人奉為“神藥”,主要含有甾體皂甙、黃酮苷及倍半萜苷等有效成分[4],具有抗癌、抗炎、鎮痛、提高免疫力、改善心功能和降壓、抗衰老等功效[5-6]。本實驗模擬重物打擊法建立脊髓損傷大鼠模型,觀察脊髓損傷后CNTF及其受體的表達變化及頭頂一顆珠提取液的影響,為頭頂一顆珠的開發利用提供實驗依據。
1 材料與方法
1.1 主要試劑和儀器 藥材頭頂一顆珠于2013年9月采自巴東及神農架林區,經湖北民族學院醫學院中藥實驗室鑒定為延齡草,藥材經60℃恒溫烘箱干燥后粉碎,用75%乙醇浸泡數小時后回流提取,將提取液濾過并減壓濃縮、干燥,得到延齡草總提取物。加適量去離子水至總提取物全部溶解,采用水飽和的正丁醇萃取,減壓濃縮干燥,得到萃取物。以延齡草對照品制作標準曲線,紫外可見光光度測定藥品總皂苷含量為14.72mg/g藥材。兔抗大鼠CNTF及CNTFRα抗體購自美國Santa Cruz公司,免疫組織化學試劑盒為武漢博士德產品,RT-PCR試劑盒為上海生物工程公司產品。德國Eppendorf公司Mastercycler pro PCR擴增儀,Leica 1850冰凍切片機,Leica 2245石蠟切片機,美國Bio-Rad公司凝膠成像分析系統。
1.2 實驗分組 健康Wistar大鼠45只(由湖北省實驗動物中心提供),體重185~255g,鼠齡4個月,隨機分為3組,每組15只。A組:對照組,常規喂養,單純手術,不打擊脊髓。B組:模型組,常規喂養,手術并打擊脊髓。C組:頭頂一顆珠處理組,實驗前2周開始給予濃度1g/L的頭頂一顆珠提取液2ml灌胃,每天3次(A組和B組給予同劑量蒸餾水灌胃)。A、B、C組又分為術后1d、7d和14d亞組,每個亞組5只大鼠。術后青霉素40萬U常規肌內注射,1次/d,分籠飼養。
1.3 脊髓急性損傷模型的制備 實驗動物以2%戊巴比妥鈉(40mg/kg)腹腔注射麻醉后,參照改良Allen重物打擊法[7]建立大鼠急性脊髓損傷模型。將動物俯臥位固定于手術臺,背部剪毛,切除T9-T11棘突及椎板,暴露硬脊膜,用5.0g銅制重物在玻璃棒引導下自5cm高度自由落下撞擊暴露區,以觀察到鼠尾痙攣性擺動、雙下肢猛烈收縮為建模成功的標志。逐層關閉切口,敷料覆蓋傷口并加以固定。
1.4 標本取材 大鼠按實驗亞組分組達到相應時相點后再次麻醉,根據不同實驗取材方法如下:①用于RT-PCR、Western blotting檢測的大鼠活殺后取T9-T11節段置于液氮中保存備用;②用于常規及免疫組化檢測的大鼠,先用生理鹽水200ml經心臟行主動脈灌注,待流出液體變清,以4%中性多聚甲醛400ml灌注30min,獲取T9-T11節段,4%中性多聚甲醛保存。
1.5 HE及Nissl染色 石蠟標本常規切片,片厚5μm,常規行HE染色;Nissl染色時將固定標本放入30%蔗糖至標本沉底,冰凍切片,片厚20μm,水洗后加入工作液15min,常規脫水封片。
1.6 CNTF、CNTFRα免疫組化染色 取每組大鼠脊髓,用免疫組織化學鏈霉卵白素復合物(streptavidin peroxidase,SP)法染色,片厚10μm,以PBS代替一抗作為陰性對照。每隔5張切片取1張,共5張,用HPIAS-1000高清晰度彩色病理圖文分析系統對脊髓前角運動神經元灰度值進行測量分析。
1.7 脊髓總RNA的提取和RT-PCR測定 大鼠活殺后取T9-T11脊髓,采用Trizol試劑盒提取總RNA。引物由上海生物工程公司合成,序列如下:CNTF,正義5'-CTTTCGCAGAGCAAACACCTC-3',反義5'-ACTGTGAGAGCTCTTGAAGGAC-3',產物大小497bp;CNTFRα,正義5'-AGGAGGCACCCCATGT TCAG-3',反義5'-CATGTCACCTCCAGTCGACG-3',產物大小603bp;GAPDH,正義5'-ACCCCTTCATT GACCTCAACTA-3',反義5'-ATTGGGGGTAGGAAC ACGGAA-3',產物大小613bp。其中GAPDH為內參照。采用RT-PCR試劑盒測定CNTF及CNTFRα mRNA的表達,具體操作按說明書進行。采用凝膠圖像分析儀對電泳條帶進行分析,測定CNTF mRNA/GAPDH mRNA和CNTFRα mRNA/GAPDH mRNA吸光度(A)的比值。
1.8 脊髓蛋白的提取和Western blotting檢測 取大鼠脊髓組織,PBS(pH 7.2)清洗2次,棄去PBS,加入1ml RIPA裂解液,冰浴條件下進行勻漿;4℃下10 000×g,離心10min,去除沉淀,留取上清。用BCA法進行蛋白定量,取60μg蛋白加入上樣緩沖液,煮沸5min后進行SDS-PAGE電泳,轉PVDF膜,用PBS配制的5%脫脂奶粉室溫封閉2h,加一抗羊抗鼠CNTF IgG(200μg/ml,1:200)或CNTFRα(200μg/ml,1:200)4℃孵育過夜,PBS洗膜3次,每次15min,再加入二抗(HRP標記的羊抗兔IgG,1:7500)37℃孵育60min,PBS洗膜3次,每次10min,暗室加發光劑2min,壓片,顯影,定影,水洗,以GAPDH為內參照,用分子生物學圖像分析系統測定各目的條帶A值。
1.9 統計學處理 采用SPSS 16.0軟件進行統計分析,數據結果以表示,多組間比較采用方差分析,進一步兩兩比較采用SNK-q檢驗,P<0.05為差異有統計學意義。
2 結 果
2.1 脊髓組織學改變 HE染色結果顯示,對照組脊髓結構清晰,神經元無水腫變性;模型組脊髓組織可見炎癥細胞浸潤,神經元細胞間隙增大,細胞突起減少或消失,神經細胞水腫、壞死;頭頂一顆珠處理組脊髓結構比較清晰,神經細胞水腫、壞死較模型組輕。Nissl染色光鏡觀察顯示,對照組神經元尼氏小體著色呈虎斑狀,分布均勻,模型組和頭頂一顆珠處理組損傷后各時相點脊髓前角運動神經元尼氏小體減少或消失,頭頂一顆珠處理組尼氏小體減少程度較模型組明顯減輕(圖1)。
2.2 脊髓組織CNTF、CNTFRα免疫組化染色檢測結果 CNTF、CNTFRα免疫組化陽性染色均棕黃色顆粒,位于胞質中。3組均有CNTF、CNTFRα表達,模型組及頭頂一顆珠處理組傷后1、7、14d表達均增強,且頭頂一顆珠處理組表達高于模型組(圖2)。
2.3 脊髓組織CNTF及CNTFRα mRNA表達水平RT-PCR檢測結果顯示,與對照組比較,模型組及頭頂一顆珠處理組脊髓中CNTF和CNTRFα mRNA表達水平隨傷后時間延長逐漸增強,且頭頂一顆珠處理組表達水平高于模型組(表1,圖3)。
2.4 脊髓組織CNTF、CNTFRα蛋白表達水平Western blotting檢測結果顯示,模型組傷后14d時脊髓組織中CNTF、CNTFRα蛋白表達明顯高于對照組,頭頂一顆珠處理組傷后7d及14d時CNTF蛋白表達明顯高于對照組,傷后1、7、14d時CNTFRα蛋白表達明顯高于對照組,且傷后14d時CNTFR蛋白表達明顯高于模型組,傷后7d及14d時CNTFRα蛋白表達明顯高于模型組,差異均有統計學意義(P<0.05,圖4,表2)。
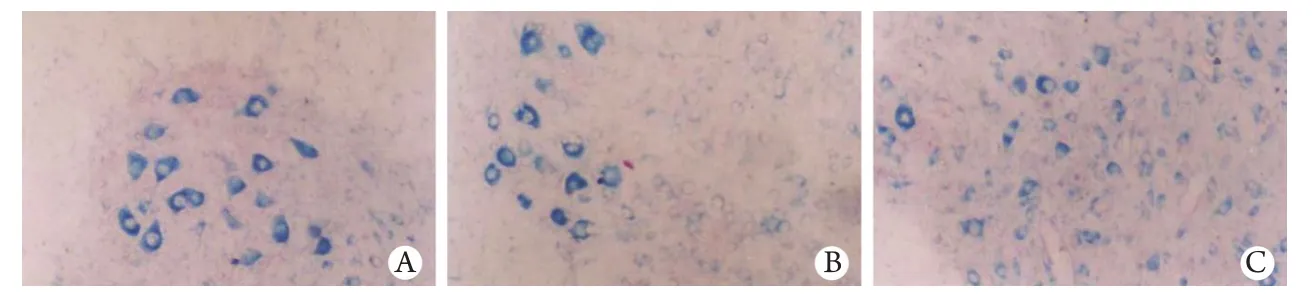
圖1 各組脊髓運動神經元尼氏小體變化(Nissl ×100)Fig. 1 The Nissl body of spinal cord motor neurons (Nissl ×100)A. Group A, Nissl body of spinal cord motor neurons; B. Group B, Nissl body of spinal cord motor neurons reduced; C. Group C, compared with the model group, the change of spinal cord motor neurons was slight
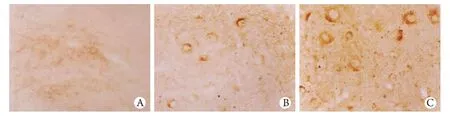
圖2 各組脊髓運動神經元CNTF和CNTFRα的表達(SP ×200)Fig. 2 Expression of CNTF and CNTFRα on motor neuron of the spinal cord in rats (SP ×200)A. Group A, expression of CNTF; B. Group B, 7d post-injury, expression of CNTF; C. Group C, 7d post-injury, expression of CNTFα
表1 各組脊髓組織CNTF、CNTFRα mRNA的表達(±s,n=5)Tab. 1 Expression of CNTF and CNTFRα mRNA in the spinal cord in rats (±s,n=5)

表1 各組脊髓組織CNTF、CNTFRα mRNA的表達(±s,n=5)Tab. 1 Expression of CNTF and CNTFRα mRNA in the spinal cord in rats (±s,n=5)
(1)P<0.05 compared with group A; (2)P<0.05 compared with group B
Group CNTF mRNA CNTFRα mRNA 1d 7d 14d 1d 7d 14d A 0.15±0.02 0.14±0.03 0.15±0.03 0.25±0.02 0.24±0.03 0.27±0.01 B 0.14±0.05 0.27±0.03(1) 0.49±0.04(1) 0.34±0.05 0.40±0.04(1) 0.55±0.04(1)C 0.19±0.07 0.38±0.01(1)(2) 0.62±0.02(1)(2) 0.34±0.04 0.55±0.01(1)(2) 0.78±0.02(1)(2)

圖3 各組脊髓組織CNTF和CNTFRα mRNA表達檢測Fig. 3 Agarose gel electrophoresis of RT-PCR products of CNTF and CNTFRα mRNALane 1. Group C, 14d post-injury; Lane 2. Group C, 7d postinjury; Lane 3. Group C, 1d post-injury; Lane 4. Group B, 14d postinjury; Lane 5. Group B, 7d post-injury; Lane 6. Group B, 1d postinjury; Lane 7. Group A, 14d post-injury; Lane 8. Group A 7d postinjury;Lane 9. Group A 1d post-injury; M. Marker
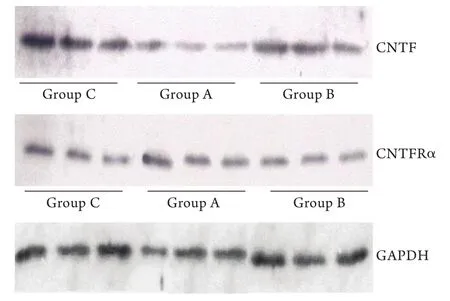
圖4 各組脊髓組織CNTF、CNTFRα蛋白表達水平的Western blotting檢測結果Fig. 4 Protein expression of CNTF and CNTFRα in spinal cord of each group detected by Western blotting
表2 各組脊髓組織CNTF、CNTFRα蛋白表達(±s,n=5)Tab. 2 Protein expression of CNTF and CNTFRα in spinal cord of each group (±s,n=5)

表2 各組脊髓組織CNTF、CNTFRα蛋白表達(±s,n=5)Tab. 2 Protein expression of CNTF and CNTFRα in spinal cord of each group (±s,n=5)
(1)P<0.05 compared with group A; (2)P<0.05 compared with group B
Group CNTF 449±80 406±62 581±104(1) 445±72 320±55 525±58(1)C 491±76 581±68(1) 844±83(1)(2) 486±40(1) 592±66(1)(2) 903±38(1)(2)CNTFRα 1d 7d 14d 1d 7d 14d A 311±62 320±35 318±50 279±42 264±54 255±52 B
3 討 論
脊髓損傷是中樞神經系統的嚴重損傷,目前其預防和治療是神經科學領域研究的熱點。研究表明,脊髓損傷對機體的損害是由兩種機制引起的,即原發損傷和繼發損傷。原發損傷是指創傷本身對神經細胞的損傷,主要包括神經細胞壞死、軸索斷裂等;繼發損傷是在原發損傷后逐漸形成的,并伴隨一系列細胞內代謝和基因的改變,包括水腫、炎癥反應、局部缺血、興奮性氨基酸的釋放、脂質過氧化、鈣離子超載等,最終導致神經細胞凋亡[8-9]。原發損傷是不可逆的,但通過早期積極、正確的醫療干預可預防和減輕繼發損傷。
CNTF是目前研究比較多的營養因子之一,它不僅對體內外多種神經元及神經膠質細胞的存活具有促進作用,而且在促進軸突再生、防止受損神經元退變、維持運動神經元功能、誘導神經元和膠質細胞分化等方面也具有重要作用[10-12]。神經元能否維持正常的生理功能與神經營養因子密切相關,研究證實新生大鼠神經元在軸突切除后易發生變性、壞死,與神經內營養因子含量過低有關,神經營養因子的減少是誘發神經元退變的原因[13-14]。本課題組前期研究發現,在正常狀態下脊髓灰質前角運動神經元中均有CNTF及CNTFRα表達,不同年齡組的含量存在一定差異,幼年組表達最高,其后逐步下降,這可能與不同年齡段對神經營養因子的需求不同有一定關系,同時還發現損傷后1d脊髓中CNTF及CNTFRα蛋白表達升高,損傷后7d、14d CNTF及CNTFRα蛋白和mRNA表達逐步升高,其后表達逐漸降低,推測在神經損傷后神經元及其周圍的細胞可分泌更多的CNTF和CNTFRα,以促進神經損傷的修復[15]。CNTF具有多種生物活性,可減輕神經細胞的損傷,對損傷的神經元特別是運動神經元具有保護作用。CNTF在中樞及周圍神經系統中廣泛存在,其受體由CNTFRα、LIFR-β、gp130組成,其中CNTFRα是CNTF的特異性結合蛋白,在CNTF參與神經損傷修復過程中具有重要作用。
本研究發現,采用頭頂一顆珠提取液干預后,脊髓損傷后1d時CNTF和CNTFRα的表達與模型組比較沒有明顯區別,但隨著時間延長,傷后7d及14d時CNTF和CNTFRα的表達明顯高于模型組(P<0.05),表明頭頂一顆珠干預后脊髓組織中CNTF、CNTFRα蛋白及mRNA表達上調,對脊髓損傷具有一定的保護作用,但其具體的機制有待進一步深入研究。
[1]Zhao Y, Xiao YL, Zuo Y,et al. Repair effect of neural stem cells transplantation combined with erythropoietin on spinal cord injury in rats[J]. J Jilin Univ (Med Ed), 2015, 41(2): 333-337, 441-442. [趙巖, 肖宇龍, 左媛, 等. 神經干細胞移植聯合促紅細胞生成素對大鼠脊髓損傷的修復作用[J]. 吉林大學學報(醫學版), 2015, 41(2): 333-337, 441-442.]
[2]Yue Y, Tan BT, Liu Y,et al. Effects of FTY720 on neurological function and blood-spinal cord barrier of rats with acute spinal cord injury[J]. Med J Chin PLA, 2015, 40(3): 200-205. [岳妍,譚波濤, 劉媛, 等. FTY720對急性脊髓損傷大鼠神經功能及血脊髓屏障的影響[J]. 解放軍醫學雜志, 2015, 40(3): 200-205.]
[3]Sendtner M, Gotz R, Holtmann B,et al. Endogenous ciliary neurotrophic factor is a lesion factor for axotomized motoneuron in adult mice[J]. J Neurosci, 2007, 17(18): 6999-7006.
[4]Yu LL, Zou K. Research progress of chemical constituents and pharmacological Trillium tschonoskii maxim[J]. Chin Tradit Patent Med, 2008, 30(9): 1350-1354.[喻玲玲, 鄒坤. 延齡草屬植物的化學成分及藥理活性研究進展[J]. 中成藥, 2008, 30(9): 1350-1354.]
[5]Li ZY,Zhou FQ, Tu Y,et al. Research progress of Tujia medicine: Trillium tschonoskii maxim[J]. Chin J Inf TCM, 2011, 18(1): 104-106.[李志勇, 周鳳琴, 圖雅, 等. 土家族藥頭頂一顆珠現代研究進展[J]. 中國中醫藥信息雜志, 2011, 18(1): 104-106.]
[6]Jiang GL, Yu X, Xu K,et al. Comparison between intraperitoneal and subcutaneous injection in senile rats model by injecting D-galactose[J]. Chin J Gerontol, 2013, 33(5): 1101-1103. [姜國良, 于曉, 徐愷, 等. 腹腔和皮下注射D-半乳糖衰老大鼠模型分析[J]. 中國老年學雜志, 2013, 33(5): 1101-1103.]
[7]Freeman LW, Wright TW. Experimental observations of concussion and contusion of the spinal cord[J]. Ann Surg, 1953, 137(4): 433-443.
[8]Diaz Ruiz A, Alcaraz Zubeldia M, Maldonado V,et al. Differential time-course of the increase of antioxidant thiol-defenses in the acute phase after spinal cord injury in tats[J]. Neurosci Lett, 2009, 452(1): 56-59.
[9]Cao ZH, Wang JG. Recent advances in the treatment of spinal cord injury[J]. Hainan Med J, 2012, 23(6): 123-128.[曹中華,王金光. 脊髓損傷治療進展[J]. 海南醫學, 2012, 23(6): 123-128.]
[10] Jakeman LB, Wei P, Guan Z,et al. Brain-derived neurotrophic factor stimulates hindlimb stepping and sprouting of cholinergic fibers after spinal cord iniury[J]. Exp Neurol, 1998, 154(1): 170-184.
[11] Xu B, Li JS, Jia LS,et al. Protective effect of ciliary neurotrophic factor on spinal neurons[J]. Acad J Sec Mil Med Univ, 2002, 21(5): 409-411. [許斌, 李家順, 賈連順, 等. 睫狀神經營養因子對脊髓神經元的保護作用[J]. 第二軍醫大學學, 2002, 21(5): 409-411.]
[12] Ishii K, Nakamura M, Dai H,et al. Neutralization of ciliary neurotrophic factor reduces astrocyte production from transplanted neural stem cells and promotes regeneration of corticospinal tract fibers in spinal cord injury[J]. J Neurosci Res, 2006, 84(8): 1669-1681.
[13] Albrecht PJ, Enterline JC, Cromer J,et al. CNTF-activated astrocytes release s soluble trophic activity for oligodendrocyte progenitors[J]. Neurochem Res, 2007, 32(2): 263-271.
[14] Masu Y, Wolf E, Holtmann B,et al. Disruption of the CNTF gene result in motor neuron degeneration[J]. Nature, 1993, 365(2): 27-32.
[15] Chen XB, Hu YP, Wang FJ,et al. Effect of sodium selenife on ciliary nerotropic factor and its receptor in different-aged rats suffering spinal cord injury[J]. Acta Nutrimenta Sinica, 2013, 35(5): 455-459.[陳顯兵, 胡玉萍, 王鳳杰, 等. 亞硒酸鈉對不同年齡大鼠脊髓損傷后睫狀神經營養因子及其受體的影響[J]. 營養學報, 2013, 35(5): 455-459.]
Effect of extract ofTrillium tschonoskiiMaxim on ciliary neurotropic factor and its receptor α in rats suffering from spinal cord injury
CHEN Xian-bing1, ZHU Min-yue2, QIN Fu-rong2, TANG Shang-quan2, WANG Feng-jie1, LONG Bo-lin2, YUAN De-pei31Key Laboratory of Biologic Resource Protection and Utilization of Hubei Province, Enshi, Hubei 445000, China
2Medical College,3College of Traditional Chinese Medicine, Hubei University for Nationalities, Enshi, Hubei 445000, China
This work was supported by the National Natural Science Foundation of China (81260521), the Natural Science Foundation of Hubei Province (2014CFB613), and the Fund of the Key Laboratory of Biologic Resource Protection and Utilization of Hubei Province (PKLHB1513)
ObjectiveTo investigate the effect ofTrillium tschonoskiiMaxim extract on the expression of ciliary neurotrophic factor (CNTF) and its receptor (CNTFRα) after spinal cord injury in rats.MethodsForty-five rats were equally and randomly divided into control group (group A), model group (group B) andTrillium tschonoskiiMaxim treated group (group C). Allen's weight drop method was used to reproduce acute spinal cord injury (SCI) model in rats of the group B and C. In group C, the rats were gavaged withTrillium tschonoskiiMaxim extract 2 weeks before the injury, while rats in group A and B were fed a same quantity of distilled water. 1, 7 or 14 days after injury, the rats were sacrificed to observe the structure of nerve cells after HE and Nissl staining, and the expression of CNTF and CNTFRα with immunohistochemical method, RT-PCR and Western blotting.ResultsHE staining showed that the structure of spinal cord in the the rats group C was more discernible, with milder edema and necrosis of nerve cells, as compared with that of group B. Nissl staining showed that Nissl bodies were decreased or disappeared in anterior horn motor neurons in both group B and C, but it was significantly less marked in group C than that in group B. Immunohistochemical staining, Western blotting and RT-PCR revealed that the protein and mRNA of CNTF and CNTFRα were positively expressed in rats of every group. The mRNA levels of CNTF and CNTFRα in group C were higher than those in group B.ConclusionsExtract ofTrillium tschonoskiiMaxim can up-regulate the expression of CNTF and CNTFRα, and plays a protective role against injury to spinal cord.
spinal cord injuries; ciliary neurotrophic factor;Trillium tschonoskii
R651.21
A
0577-7402(2015)08-0622-05
10.11855/j.issn.0577-7402.2015.08.04
2014-11-28;
2015-06-27)
(責任編輯:胡全兵)
國家自然科學基金(81260521);湖北省自然科學基金(2014CFB613);生物資源保護與利用湖北省重點實驗室基金(PKLHB1513)
陳顯兵,醫學碩士,副教授。主要從事脊髓損傷與修復的研究
445000 湖北恩施 生物資源保護與利用湖北省重點實驗室(陳顯兵、王鳳杰);445000 湖北恩施 湖北民族學院醫學院(朱旻玥、覃芙蓉、唐尚權、龍波霖);445000 湖北恩施 湖北民族學院中醫藥學院(袁德培)

