隱匿性乙型肝炎病毒感染患者S基因突變特點分析
陳建宏,劉妍,許智慧,思蘭蘭,戴久增,李奇,王帥,李進,韓聚強,徐東平
論 著
隱匿性乙型肝炎病毒感染患者S基因突變特點分析
陳建宏,劉妍,許智慧,思蘭蘭,戴久增,李奇,王帥,李進,韓聚強,徐東平
目的 分析1例血清HBV DNA長期陽性但HBsAg陰性的隱匿性乙型肝類病毒感染(OBI)患者HBV S基因突變特點,揭示S基因突變與OBI發生及肝臟疾病進展的關系。方法 收集該患者不同時間點的4份血清樣本,擴增HBV S基因并進行克隆測序,挑選代表性突變株病毒基因構建重組載體并進行表型分析。結果 從該患者4份血清樣本中檢出多種S基因突變形式,包括前S1區大片段缺失、s126–127“RPCMNCTI”插入突變、sQ129N、s131–133 TSM→NST和經典的sG145R突變等,其中s131–133 TSM→NST在前后4份動態樣本的檢測病毒克隆中所占比例分別為0%、26%、59%和74%;前S1區大片段缺失在4份樣本檢測病毒克隆中始終存在,所占比例分別為26%、17%、15%和21%。表型分析發現,sQ129N和s131–133 TSM→NST可以降低抗體對HBsAg的親和力,增加病毒分泌;與野生株相比,前S1區大片段(nt 3046–3177)缺失病毒株復制力下降了43.7%,表面抗原啟動子Ⅱ(SPⅡ)活性下降了97.2%;sG145R可降低病毒的分泌能力。結論 此例HBV感染患者的長期OBI臨床表現是由于其感染有多種S基因突變病毒株引起,其中一些S基因突變可以影響病毒的表型特點,可能與肝臟疾病進展密切相關。
肝炎病毒,乙型;突變;肝炎表面抗原,乙型
傳統觀點認為HBsAg轉陰和抗-HBs抗體的出現是HBV完全清除的標志,自20世紀70年代以來,隨著病毒檢測技術的進步,特別是PCR技術的不斷成熟,不斷有研究發現在HBsAg陰性者的血清或肝組織中仍可檢測到HBV DNA的存在[1-2],這種狀態被稱為隱匿性乙型肝炎病毒感染(occult hepatitis B virus infection,OBI)。有研究認為OBI的發生與宿主免疫功能低下和HBV極低水平復制和表達有關[3-5],也有研究認為其與HBV S基因突變有關[6-7]。過去一些OBI病例的出現是由于檢測方法的靈敏性不夠引起的[8],包括HBsAg檢測下限較低以及不能檢出sG145R等經典突變型HBsAg。近年隨著檢測技術的進步,臨床上OBI越來越少見。本研究縱向觀察1例OBI患者疾病進展過程中的4份血清樣本,以期闡明HBV S基因突變與OBI發生及肝臟疾病進展的關系。
1 資料與方法
1.1 研究對象 男,63歲,2002年體檢時發現血清HBsAg陽性,血清HBV DNA數值不詳,因無癥狀而未接受任何治療。2011年開始出現乏力伴納差,無發熱、咳嗽、咳痰,仍未重視。2012年5月因低熱、納差就醫,檢查顯示血清HBsAg陰性,HBV DNA 5.23×104拷貝/ml。隨后服用阿德福韋酯(ADV),但并未控制疾病進展,最后因肝功能衰竭死亡。采集該患者4次住院期間血清,–40℃凍存。樣本信息如表1所示。4份血清中HBsAg的檢測值均為陰性(化學發光法HBsAg<1.0U/ml),但血清中HBV DNA均為陽性,且病毒載量隨病程進展而逐漸升高。
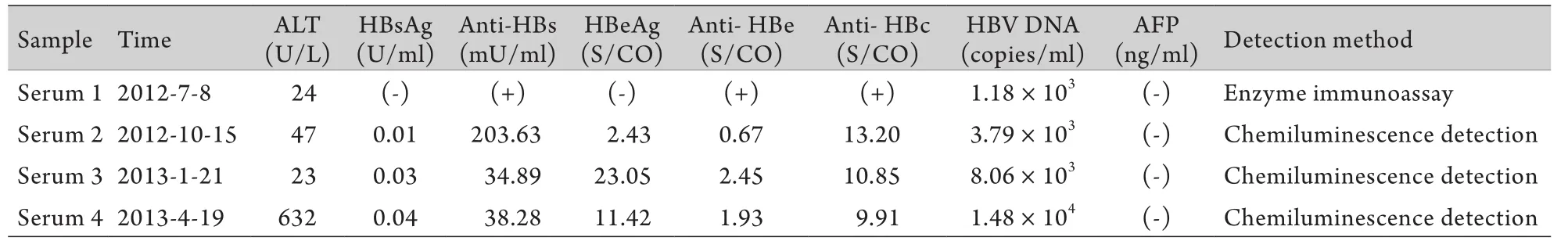
表1 OBI患者4份血清的臨床檢測指標Tab.1 Clinical parameters of four serums in one patient with OBI
1.2 主要試劑 病毒DNA提取試劑盒購自北京天恩澤公司;膠回收試劑盒購自美國QIAGEN公司;pGEM-Teasy載體、JM109感受態細胞、熒光素酶表達載體和檢測試劑盒購自美國Promega公司;pTriEx-1.1HBV表達載體由法國里昂大學Zoulim教授惠贈;BstEⅡ、SphⅠ、EcoRⅠ、KpnⅠ、BglⅡ購自日本TaKaRa公司;BspQⅠ和ScaⅠ購自美國NEB公司;真核細胞表達載體pcDNA3.1(-)/myc-His A購自美國Invitrogen公司;DMEM培養基購自美國Gibco公司;轉染試劑X-tremeGENE HD、地高辛標記檢測試劑盒購自德國Roche公司;實時熒光定量檢測試劑盒購自上海復興公司;尼龍膜購自美國安瑪西亞公司;HBsAg鼠單克隆抗體購自美國Santa公司;His標簽蛋白鼠單克隆抗體、β-actin抗體及二抗購自北京康為世紀公司。引物合成和基因測序由北京天一輝遠公司完成。
1.3 實驗方法
1.3.1 巢氏PCR擴增HBV S基因及克隆測序 采用病毒DNA提取試劑盒提取4份血清HBV DNA,采用巢式PCR方法擴增HBV S基因(前S1+前S2+S)。第一輪上下游引物分別為PSup3,SB1R;第二輪上下游引物為PSup4,SB2R(表2)。將PCR產物純化、膠回收后與pGEM-Teasy載體連接,轉化JM109感受態細胞,挑選陽性克隆抽提質粒進行測序。采用Mega 4進化樹軟件對克隆測序結果進行分析。
1.3.2 HBV S基因突變相關載體構建 采用Mega 4軟件分析HBV基因型,挑選標準序列用NTI軟件比對分析S基因突變,挑取代表性突變克隆和野生型克隆構建相關載體以進行功能學實驗。
1.3.2.1 pTriEx-1.1HBV重組載體構建 提取野生型和突變型克隆T-easy質粒,用BstEⅡ和SphⅠ分別雙酶切質粒和pTriEx-1.1HBV載體,將S基因替代到pTriEx-1.1HBV載體上,然后對重組質粒進行測序鑒定。鑒定成功后提取轉染級質粒備用。
1.3.2.2 pcDNA3.1(-)/myc-His A重組載體構建 以提取的野生型和突變型T-easy質粒為模板,PCR擴增HBsAg編碼區S區,所用引物為HIS-UP(上游引物),其中包含EcoRⅠ酶切位點;HIS-DOWN(下游引物),其中包含KpnⅠ酶切位點(表2)。將PCR產物純化膠回收,用EcoRⅠ和KpnⅠ同時雙酶切膠回收產物和載體,連接并轉化JM109感受態細胞,抽提質粒測序鑒定,鑒定成功后提取轉染級質粒備用。
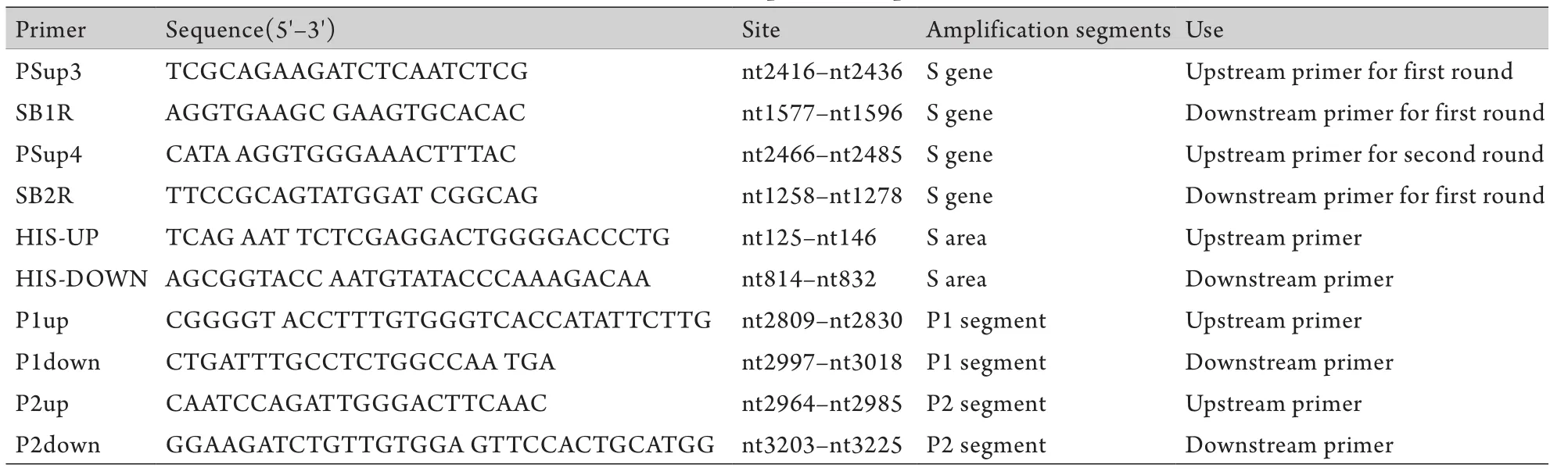
表2 PCR擴增所用引物Tab.2 PCR amplification primers
1.3.2.3 HBV pGL3-SPⅡ熒光素酶表達載體構建因前S1大片段缺失與HBV SPⅡ啟動子區域重疊,而SPⅡ啟動子啟動2.1kb mRNA,編碼中、主蛋白,因此構建HBV pGL3-SPⅡ熒光素酶表達載體檢測缺失株對SPⅡ啟動子活性的影響。采用重組PCR方法獲得野生型SPⅡ對照。以缺失株的T-easy質粒為模板,以P1up,P1down為上下游引物,擴增獲得P1段;以野生株的T-easy質粒為模板,以P2up,P2down為上下游引物擴增獲得P2段;用P1、P2作為模板,分別以P1up和P2down為上下游引物擴增獲得野生型的SPⅡ對照;以缺失株的T-easy質粒為模板,以P1up和P2down為上下游引物擴增獲得缺失性的SPⅡ(表2)。將重組PCR獲得的SPⅡ野生型、缺失型和pGL3-Basic載體分別用KpnⅠ和BglⅡ雙酶切,膠回收后連接并轉化JM109感受態細胞,挑取陽性菌落,測序鑒定,測序成功后提取轉染級質粒備用。
1.3.3 上清HBsAg定量檢測 將HepG2細胞在含10%胎牛血清(FBS)的DMEM培養液中傳代培養至最佳狀態,細胞以4×105/孔分到6孔板,于分板后16~18h用X-tremeGENE HD轉染試劑將pTriEx-1.1HBV重組載體按1μg/孔進行轉染,3d后收集上清進行HBsAg定量檢測(羅氏cobas E601)。
1.3.4 熒光定量及Dot blotting分析上清HBV和細胞內核心顆粒 細胞培養及轉染同上,3d后收集上清,DNA酶消化過夜,用于實時熒光PCR檢測HBV載量[9-10]。核心顆粒的提取方法參考文獻[11],–40℃儲存用于實時熒光PCR定量和Dot blotting檢測。Dot blotting分析:采用BspQⅠ和ScaⅠ雙酶切本課題組以前得到的C2基因型全長克隆,膠回收全長DNA片段,用于地高辛標記探針的制備。取3μl核心顆粒點到尼龍膜上,紫外交聯5min,用DIG Easy Hyb 42℃預雜交1h后用含地高辛標記探針的DIG Easy Hyb 42℃雜交過夜,洗膜,封閉,與anti-Digoxigenin-AP Fab孵育,用CSPD化學發光法檢測,Tanon 5200全自動化學發光成像分析系統進行分析。
1.3.5 Western blotting分析細胞內重組HBsAg的表達 細胞培養及轉染方式同上,將pcDNA3.1(-)/ myc-His A重組載體按2μg/孔進行轉染,3d后用1×PBS洗板2次,加入細胞裂解液(按100:1的比例加入蛋白酶抑制劑混合物),收集蛋白,煮沸10min充分變性,以β-actin為內參調整蛋白上樣量,用10% SDS-PAGE凝膠電泳分離蛋白,轉膜后分別以anti-HBsAg和anti-His鼠單克隆抗體為一抗4℃孵育過夜,洗膜后以帶有HRP的羊抗鼠單克隆抗體為二抗室溫孵育2h,用Tanon 5200全自動化學發光成像分析系統進行顯色分析。
1.3.6 雙熒光素酶報告基因檢測前S1大片段缺失突變對SPⅡ啟動子活性的影響 細胞培養同上,將細胞以3×105/孔分到24孔板,于分板后16~18h將HBV pGL3-SPⅡ熒光素酶表達載體與內參pRL-TK載體按30:1的比例共轉染,表達載體0.3μg/孔,內參0.01μg/孔,設置pGL3-Basic為陰性對照,pGL3-Control為陽性對照,48h后裂解細胞,進行熒光素酶活性檢測,并用內參校正,分析前S1區大片段缺失對啟動子活性的影響。
2 結 果
2.1 4份血清克隆測序結果分析 測序分析結果顯示,絕大多數序列為Y18856C2基因型,以該序列為標準序列用NTI軟件進行比對分析。4份血清96個克隆中僅1株為野生序列(WT),其余全部存在S基因突變,主要位于MHR,特別是a決定簇內(表3)。其中前S1區大片段缺失株在4份血清中始終穩定存在,所占比例分別為26%、17%、15%、21%,M2隨著病情的加重所占比例越來越大,分別為0%、26%、59%、74%。
2.2 上清HBsAg定量 HBsAg定量檢測結果如圖1所示。與野生株相比,M1–M5的上清HBsAg定量值分別下降了84.1%、85.6%、51.2%、83.4%、98.3%(P<0.05)。
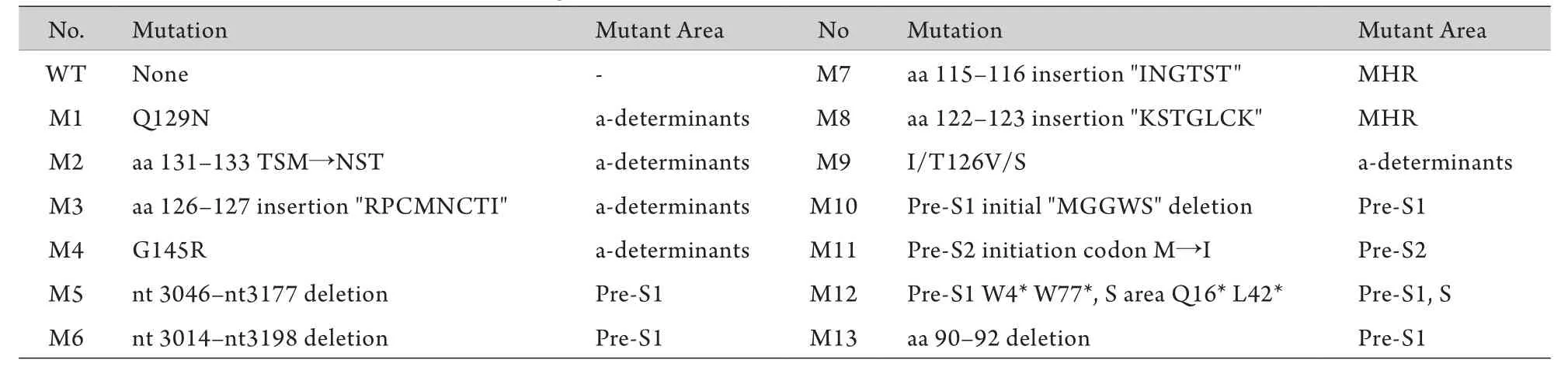
表3 OBI患者4份血清S基因突變形式Tab.3 S gene mutations of four serums in patient with OBI
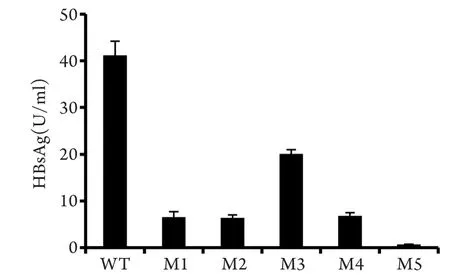
圖1 上清HBsAg定量(羅氏cobas E601)Fig.1 Quantitation of supernatant secreted HBsAg(Roch cobas E601)
2.3 細胞內重組HBsAg表達 Western blotting檢測結果表明,M1、M2可以降低HBsAg與抗體的親和力,尤其是M2突變株表達的HBsAg幾乎無法被其抗體結合,M3、M4對HBsAg和抗體親和力的影響不明顯(圖2)。
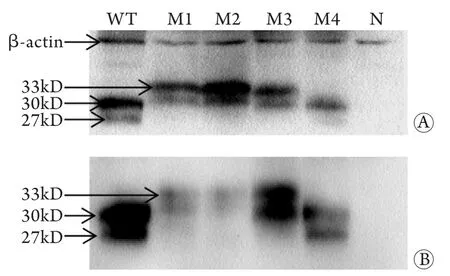
圖2 重組表達載體胞內HBsAg表達的Western blotting分析Fig.2 Western blotting analysis of intracellular recombinant HBsAg expression
2.4 上清HBV定量和復制力檢測 胞內HBV定量結果顯示,M5的復制力與野生株相比下降了43.7%(P<0.05),其他幾種突變形式對病毒的復制力無明顯影響(圖3A、B)。上清中HBV定量結果顯示,與野生株相比M2、M3上清中HBV載量分別升高了53.4%和60.7%,M4、M5分別下降了41.9%和33.5%,M3幾乎無變化(圖3C)。
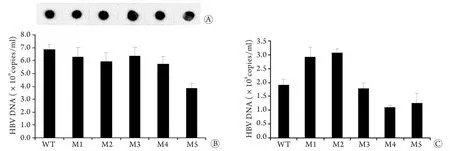
圖3 核心顆粒HBV及培養上清HBV的實時熒光PCR檢測及Dot blotting分析Fig.3 Real-time PCR detection and dot blotting of core particles and supernatant HBV
2.5 前S1大片段缺失突變對SPⅡ啟動子活性的影響 結果顯示,野生株表達的相對熒光素酶活性倍數(螢火蟲熒光素酶與內參表達的海腎熒光素酶比值)為26.69±1.33,nt 3046–3177缺失株為0.75±0.02,較野生株下降了97.2%(P<0.01)。
3 討 論
H BV包膜蛋白由S基因編碼,S基因包括前S1、前S2和S三個區[12],有2個串聯的啟動子SPⅠ(nt2219–2780)和SPⅡ(nt2809–3152),前者調節2.4kb mRNA轉錄,編碼大蛋白;后者調節2.1kb mRNA轉錄,編碼中蛋白和主蛋白。主蛋白即HBsAg,包括糖基化的GP27和非糖基化的P24,分子量分別為27kD和24kD。GP27的N端146位的門冬酰胺上連接一種復雜的糖基,形成NXS/T的結構。糖基化修飾是一種翻譯后的修飾,包膜蛋白每經過一次糖基化的修飾可以使其分子量增加3kD,包膜蛋白的糖基化修飾與病毒顆粒的組裝、穩定性、抗原性和感染性密切相關[13-14]。HBsAg99–169位氨基酸稱為主要親水區(major hydrophilic region,MHR),包含了HBV的主要構象表位。
本研究中該患者的4份血清獲得96個克隆,僅1株為HBV S基因野生序列(WT),其余95株全部存在S基因突變,這種情況引起的長期表現即為OBI病例,以往在國內未見報道。從該患者4份血清樣本中檢出的HBV S基因突變多數位于MHR的a決定簇(aa124–147)內,這是一段相對保守的區域,是免疫識別的主要位點。sQ129N(M1)和s131–133 TSM→NST(M2)導致的新發糖基化位點,可以降低HBsAg與抗體的親和力,導致病毒顆粒的抗原性下降;sQ129N突變、s131–133 TSM→NST突變株上清中HBV載量與野生株相比分別升高了53.4% 和60.7%,而核心顆粒定量無統計學差異,表明sQ129N突變、s131–133 TSM→NST突變可增加病毒的分泌能力,這也與臨床HBV DNA檢測值逐漸升高相符。
雙熒光素酶報告基因檢測顯示缺失株的相對熒光素酶活性較野生株下降了97.2%,說明前S1大片段缺失(M5)嚴重影響了SPⅡ啟動子活性,可能會嚴重影響2.1kb mRNA的轉錄,從而使HBsAg表達下降甚至不表達,這也與圖1中HBsAg極低的表達量相符。
許多研究發現sG145R(M4)突變與OBI的發生相關性很大,但是關于其發生機制,一些研究認為它可以降低HBsAg的抗原性[15-17],還有一些研究認為它是通過影響病毒或HBsAg的分泌從而導致OBI發生[18-19],我們的研究結果更傾向于后者,sG145R突變對病毒的抗原性和復制力無明顯影響,而上清中HBV的載量卻下降了41.9%,說明sG145R可以降低病毒顆粒的分泌能力,使分泌到上清中的病毒顆粒減少。關于其他幾種突變類型M6-M13(表3)與OBI發生的相關性有待進一步研究。
以往有研究發現,OBI患者肝臟疾病的進展要比普通乙肝更快[20-21],為了探討其與肝病進展可能相關的因素,我們對該患者4份血清克隆測序進行了縱向分析,發現隨著肝臟疾病的進展s131–133NST突變所占的比例越來越大,而前S1大片段缺失也伴隨疾病進展的全過程。s131–133NST突變可以增加病毒的分泌能力,降低病毒的抗原性,這可能使大量的病毒能夠逃逸免疫系統的清除,使機體處于一種長期隱匿的感染狀態,這也與該患者長期低熱、乏力和納差的臨床表現相符,從而加快了肝臟疾病的進展;前S1大段缺失可能也與疾病的進展有關,一些研究認為前S1大片段缺失可以使截短的大蛋白在內質網內積聚從而導致內質網壓力增加,DNA氧化損傷,加重肝臟疾病的進展甚至腫瘤發生[22-23]。
總之,S基因突變與OBI的發生密切相關,一些突變可能促進了肝臟疾病的進展。本研究結果揭示了HBV S基因復雜突變在OBI發生和肝臟疾病進展中的作用,對研發完善相關檢測試劑有重要意義。
[1] Fu XL, Wang L, Liu F. HBsAg quantitative value in different stages of hepatitis B virus infection and its correlations with serum HBV DNA and age[J]. J Shandong Univ (Health Sci), 2013, 51(5): 94-98. [符曉莉, 王磊, 劉峰. 乙肝病毒感染不同階段血清HBsAg定量值及其與HBV DNA水平和年齡的相關性[J]. 山東大學學報(醫學版), 2013, 51(5): 94-98.]
[2] Raimondo G, Allain JP, Brunetto MR, et al. Statements from the Taormina expert meeting on occult hepatitis B virus infection[J]. J Hepatol, 2008, 49(4): 652-657.
[3] Bes M, Vargas V, Piron M, et al. T cell responses and viral variability in blood donation candidates with occult hepatitis B infection[J]. J Hepatol, 2012, 56(4): 765-774.
[4] Wong DK, Huang FY, Lai CL, et al. Occult hepatitis B infection and HBV replicative activity in patients with cryptogenic cause of hepatocellular carcinoma[J]. Hepatology, 2011, 54(3): 829-836.
[5] Jiang L, Xu ZH, Liu Y, et al. Up-regulation effect of hepatitis B virus genome A1846T mutation on viral replication and core promoter activity[J]. Med J Chin PLA, 2013, 38(1): 10-14. [江玲, 許智慧, 劉妍, 等. HBV基因組A1846T變異對病毒復制力及核心啟動子活性的上調作用研究[J]. 解放軍醫學雜志, 2013, 38(1): 10-14.]
[6] Huang CH, Yuan Q, Chen PJ, et al. Influence of mutations in hepatitis B virus surface protein on viral antigenicity and phenotype in occult HBV strains from blood donors[J]. J Hepatol, 2012, 57(4): 720-729.
[7] Hong K, Seoung-Ae L, Dong-Won K, et al. Naturally occurring mutation in large surface genes related to occult infection of hepatitis B virus genotype C[J]. Plos One, 2013, 8(1): e54486.
[8] Ireland JH, OHeland JB, Basuni AA, et al. Ractivity of 13 in vitro expressed hepatitis B surface antigen variants in 7 commercialdiagnostic assays[J]. Hepatology, 2000, 31(5): 1176-1182.
[9] Liu Y, Xu Z, Liu L, et al. Genotypic and phenotypic characteristics of multidrug-resistant hepatitis B virus infection in Chinese hepatitis B patients[J]. Med J Chin PLA, 2012, 37(6): 539-543. [劉妍, 許智慧, 劉立明, 等. 我國患者多重耐藥乙肝病毒感染的基因型和表型特點[J]. 解放軍醫學雜志, 2012, 37(6): 539-543.]
[10] Wang X, LiuY, Si LL, et al. Analysis for phenotypic resistant characteristic of a novel mutation rtN236V in reversetranscriptase domain of hepatitis B virus isolated from an adefovir dipovoxil refractory-patient with chronic hepatitis B. Med J Chin PLA, 2013, 38(4):256-259. [王曉, 劉妍, 思蘭蘭, 等. 阿德福韋酯治療失敗的慢性乙型肝炎患者HBV反轉錄酶區新變異rtN236V的表型耐藥特點分析[J]. 解放軍醫學雜志, 2013, 38(4):256-259.]
[11] Ji D, Liu Y, Si LL, et al. Variable influence of mutational patterns in reverse-transcriptase domain on replication capacity of hepatitis B virus isolates from antiviral-experienced patients[J]. Clinica Chimica Acta, 2011, 412(3-4): 305-313.
[12] Gao SY. Correlation analysis of serum markers of HBV infection and HBVDNA test results[J]. J Jilin Univ (Med Ed) 2011, 37(1): 101. [高淑艷. HBV感染者血清標志物與HBVDNA檢測結果的關聯性分析[J]. 吉林大學學報(醫學版), 2011, 37(1): 101.]
[13] Renszel KM, Traister RS, Lynch WPk, et al. Unique N-linked glycosylation of CasBrE Env influences its stability, processing, and viral infectivity but not its neurotoxicity[J]. J Virol, 2013, 87(15): 8372-8387.
[14] Zai J, Mei L, Wang C, et al. N-glycosylation of the premembrane protein of Japanese encephalitis virus is critical for folding of the envelope protein and assembly of virus-like particles[J]. Acta Virol, 2013, 57(1): 27-33.
[15] Huang CH, Yuan Q, Chen PJ, et al. Influence of mutation in hepatitis B virus surface protein on viral antigenicity and phenotype in occult HBV strains from blood donors[J]. J Hepatol, 2012, 57(4): 720-729.
[16] Wu C, Deng L, Cao L, et al. Amino acid substitutions at position 122 and 145 of hepatitis B virus surface antigen (HBsAg) determine the antigenicity and immunogenicity of HBsAg and influence in vivo HBsAg clearance[J]. J Virol, 2012, 86(8): 4658-4669.
[17] Kajiwara E, Tanaka Y, Ohashi T, et al. Hepatitis B caused by a hepatitis B surface antigen escape mutant[J]. J Gastroenterol, 2008, 43(3): 243-247.
[18] Kalinina T, Iwanski A, Will H, et al. Deficiency in virion secretion and decreased stability of the hepatitis B virus immune escape mutant G145R[J]. Hepatology, 2003, 38(5): 1274-1281.
[19] Ito K, Qin Y, Guarnieri M, et al. Impairment of hepatitis B virus virion secretion by single-amino-acid substitutions in the small envelope protein and rescue by a novel glycosylation site[J]. J Virol, 2010, 84(24): 12850-12861.
[20] Ikeda K, Kobayashi M, Someya T, et al. Occult hepatitis B virus infection increases hepatocellular carcinogenesis by eight times in patients with non-B, non-C liver cirrhosis: A cohort study[J]. J Viral Hepat, 2009, 16(6): 437-443.
[21] Nishikawa H, Osaki Y. Clinical significance of occult hepatitis B infection in progression of liver disease and carcinogenesis[J]. J Cancer, 2013, 4(6): 473-480.
[22] Wang HC, Huang W, Lai MD, et al. Hepatitis B virus pre-S mutants, endoplasmic reticulum stress and hepatocarcinogenesis[J]. Cancer Sci, 2006, 97(8): 683-688.
[23] Su IJ, Wang HC, Wu HC, et al. Ground glass hepatocytes contain pre-S mutants and represent preneoplastic lesions in chronic hepatitis B virus infection[J]. J Gastroenterol Hepatol, 2008, 23(8 Pt1): 1169-1174.
Characteristics of S gene mutation in patients with occult HBV infection
CHEN Jian-hong1, LIU Yan2, XU Zhi-hui2, SI Lan-lan2, DAI Jiu-zeng2, LI Qi2, WANG Shuai4, LI Jin3, HAN Ju-qiang4*, XU Dong-ping1*1Viral Hepatitis Research Laboratory, 302 Hospital of PLA, Teaching Hospital of Peking University, Beijing 100039, China
2Viral Hepatitis Research Laboratory, Institute of Infectious Diseases/Liver Failure Research Center,3Department of Medical Administration, 302 Hospital of PLA, Beijing 100039, China
4Department of Liver Disease, General Hospital of Beijing Command, Beijing 100700, China
*
. XU Dong-ping, E-mail: xudongping302@sina.com; HAN Ju-qiang, E-mail: hanjq73@hotmail.com
This work was supported by the National Natural Science Foundation of China (81373136, 81271847)
ObjectiveTo analyze characteristics of HBV S gene mutation in one patient with occult hepatitis B virus infection, who was positive for serum HBV DNA for long term, but negative for HBsAg in order to reveal the correlation between S gene mutation and development of OBI as well as the progression of the liver disease.MethodsFour serum samples were collected at different time-points for the use of amplifying HBV S gene and performing cloning-sequencing. The representative S mutants were selected to construct recombinant vectors for phenotype analysis.ResultsSeveral S-gene mutational patterns were detected in the samples, including pre-S1 large fragment deletion, s126-127 "RPCMNCTI" insertion, sQ129N, s131-133 TSM→NST, and classical sG145R mutations. In sequential 4 samples, s131-133 TSM→NST mutation was detected in 0%, 26%, 59% and 74% of viral clones, respectively. The pre-S1 large fragment deletion was constantly found in the 4 serum samples, accounting for 26%, 17%, 15% and 21% of detected viral clones, respectively. Phenotypic analysis showed that sQ129N and s131-133 TSM → NST mutations reduced the affinity of the antibody to HBsAg and increased the secretion of virus particles. Compared with the wild-type strain, the replication capacity and surface antigen promoter Ⅱ (SPⅡ) activity of large fragment-deleted (nt 3046-3177 deletion) strain were decreased by 43.7% and 97.2%, respectively. In addition, sG145R-induced impairment to secretion capacity of viral particles was verified.ConclusionsClinical presentations of long-term OBI of this HBV-infected patient could be caused by multiple S-gene mutants.Some S-gene mutations influence viral phenotypic characteristics, which might closely be related to the progression of liver disease.
hepatitis B virus; mutation; HBsAg
R512.62
A
0577-7402(2015)03-0178-06
10.11855/j.issn.0577-7402.2015.03.02
2014-12-24;
2015-2-25)
(責任編輯:熊曉然)
國家自然科學基金(81373136、81271847)
陳建宏,醫學碩士。主要從事肝病的基礎與臨床研究
100039 北京大學解放軍302醫院教學醫院病毒性肝炎研究室(陳建宏、徐東平);100039 北京 解放軍302醫院全軍傳染病研究所、肝衰竭診療與研究中心病毒性肝炎研究室(劉妍、許智慧、思蘭蘭、戴久增、李奇),醫務部(李進);100700 北京軍區總醫院肝病科(王帥、韓聚強)
徐東平,E-mail:xudongping302@sina.com;韓聚強,Email:hanjq73@hotmail.com

