介孔SiO2固定化溶菌酶在柴油泄漏循環水系統中的緩蝕性能
仲慧赟,劉 芳,呂玉翠 陸津津,楊 偉
(中國石油大學 化學工程學院,山東 青島 266580)
介孔SiO2固定化溶菌酶在柴油泄漏循環水系統中的緩蝕性能
仲慧赟,劉 芳,呂玉翠 陸津津,楊 偉
(中國石油大學 化學工程學院,山東 青島 266580)
采用溶膠-凝膠法合成了介孔SiO2微球,并采用TEM、BET及FT-IR譜對其進行表征。以介孔SiO2微球為載體,利用物理吸附法制備固定化溶菌酶,優化了制備條件,并將在優化條件下制備的固定化溶菌酶投加于柴油泄漏循環水中,考察其對碳鋼的緩蝕效果。結果表明,制備固定化溶菌酶的最佳條件為溶菌酶質量濃度0.8 g/L、固定化時間10 h、pH值6.5、緩沖溶液摩爾濃度50 mmol/L。在柴油質量濃度為80 mg/L的冷卻循環水中,固定化溶菌酶對碳鋼的緩蝕率最高可達78.21%,且穩定性比游離溶菌酶有顯著提高。
介孔SiO2微球;固定化;溶菌酶;柴油泄漏;循環冷卻水;緩蝕
在我國石油煉化企業中,由于密封技術落后、換熱器質量差、管線老化、操作不當等原因,普遍存在著油品泄漏問題[1]。油品附著于管壁上,形成局部的保護膜,易造成嚴重的點蝕。油品泄漏下,投加常規的緩蝕劑不能達到高效的緩蝕效果,因此,需要篩選適用于油品泄漏情況下的新型緩蝕劑。
溶菌酶(Lysozyme,EC 3.2.1.17)是一種專門作用于微生物細胞壁的水解酶[2-3],是一種有效的抗菌劑,能引起細菌裂解[4-5],又稱胞壁質酶或N-乙酰胞壁質聚糖水解酶。根據來源不同可將溶菌酶分為動物源溶菌酶、植物源溶菌酶和微生物源溶菌酶3類[4]。Fleming等在1922年發現了溶菌酶[6],1965年,英國的菲利普弄清了溶菌酶完全的立體結構[7]。譙康全等[8]研究了硫酸介質中溶菌酶對Q235鋼的緩蝕作用,結果表明,在酸性條件下溶菌酶對Q235鋼有顯著的緩蝕作用。然而,游離的溶菌酶穩定性較差,易受環境條件影響而失活,且難以實現重復利用。因此,對溶菌酶進行固定化是實現其廣泛利用的有效途徑。
介孔材料不僅具有較大的孔徑,同時還具有高比表面積和大吸附容量,與傳統的微孔材料相比,更有利于分子的快速擴散,使之能為大分子(如石油化工中重油有機分子、生物酶分子等)的反應、酶的固定化提供適宜的空間,在催化、吸附、光、電、磁等許多領域有著廣泛的應用價值[9-10]。
筆者以十六烷基三甲基溴化銨為模板劑,采用溶膠-凝膠法合成介孔SiO2微球;以此為載體,制備固定化溶菌酶,優化了固定化條件,并初步考察其在柴油泄漏循環水中對碳鋼的緩蝕效果,為溶菌酶的工業化利用提供理論和技術支持。
1 實驗部分
1.1 原料和試劑
溶菌酶,生化試劑,M=14400,酶活力大于10000 U/mg,山東蘇柯漢生物工程股份有限公司產品;十六烷基三甲基溴化銨(CTAB)、正硅酸乙酯(TEOS)、羧甲基殼聚糖、鐵氰化鉀、無水乙醇、磷酸氫二鈉、磷酸二氫鉀等,均為分析純,國藥集團化學試劑有限公司產品。
直餾柴油,購于江蘇新海石化有限公司,20℃密度為0.8392 g/cm3,屬于輕質柴油。35℃下黏度較小,為3.26 mm2/s,因此當其泄漏到循環水中,經過曝氣循環后,能夠與水很好地混合,并有一部分溶解于水。柴油中Zn和Fe的質量分數分別為2.38 μg/g和0.91 μg/g。
實驗用循環水,取自青島某煉化企業的循環冷卻水系統。
1.2 介孔SiO2微球的制備及表征
采用溶膠-凝膠法制備介孔SiO2微球[11-12]。25℃下,1.5 g CTAB溶于300 mL蒸餾水中,磁力攪拌至澄清,加入75 mL無水乙醇攪拌10 min;逐滴滴加13 mL氨水,攪拌15 min;逐滴加入5 mL TEOS,持續攪拌2 h。將得到的乳白色渾濁液陳化,過夜;抽濾,先水洗后乙醇洗,用AgNO3檢驗濾液直至沒有沉淀為止。將得到的白色沉淀于90℃干燥、研磨、550℃下焙燒5 h,即得到介孔SiO2微球樣品。
分別采用日本日立公司JEM2100型透射電子顯微鏡、美國ASAP2020型比表面測試儀、美國Thermo Nicolet公司NEXUS型傅里葉變換紅外光譜儀表征所制備的介孔SiO2微球樣品。
1.3 溶菌酶的固定化
采用物理吸附法固定化溶菌酶。將一定量的介孔SiO2微球樣品加至含有一定濃度溶菌酶的Na2HPO4-KH2PO4緩沖溶液中,30℃下振蕩一定時間;抽濾,洗去多余的溶菌酶,得到白色沉淀;在30℃下烘干白色沉淀,即得到固定化溶菌酶樣品。
1.4 溶菌酶的相對活性測定
溶菌酶可以內切的方式作用于殼聚糖,斷開殼聚糖上的β-1,4-糖苷鍵,因此,通過測定溶液中還原糖的濃度,就可間接求出溶菌酶的活力[13-14]。取6 mL pH值為4.5、質量濃度為1.2 g/L的羧甲基殼聚糖溶液與0.1 g固定化溶菌酶在55℃反應60 min后,抽濾;取5 mL上清液于具塞試管中,加入1 mL堿性鐵氰化鉀溶液,混合搖勻,在沸水中煮沸10 min;冷卻,以試劑空白作參比,420 nm波長處測其吸光度A,用以計算固定化溶菌酶的相對活性,簡稱相對酶活(Relative activity)。
在同組實驗中,以最大吸光度(Amax)的固定化溶菌酶的相對酶活為100%,其余樣品的相對酶活為其吸光度A與Amax之比,以百分數表示。
1.5 循環水水質分析方法
循環水水質分析方法列于表1。

表1 循環冷卻水水質分析方法
1.6 生物酶緩蝕性能測定
參考GB/T 18175-2000旋轉掛片法測定生物酶的緩蝕性能。選用A3碳鋼掛片(50 mm×25 mm×2 mm)作為腐蝕對象,利用RCC-Ⅱ型旋轉掛片腐蝕試驗儀進行腐蝕實驗。以含柴油質量濃度為80 mg/L的循環水模擬循環水系統介質泄漏。在該系統中加入不同質量的固定化溶菌酶,置于哈爾濱東聯電子技術開發有限公司立體恒溫振蕩器中,在溫度40℃、轉速80 r/min的條件下運轉72 h。對掛片進行清洗處理,稱重,計算其質量損失,同時進行空白實驗。分別以式(1)、(2)計算碳鋼的腐蝕速率(X1)和固定化溶菌酶對碳鋼的緩蝕率(X2)。
(1)
(2)
式(1)、(2)中,m為試片質量損失,g;m0為空白實驗試片的質量損失平均值,g;S為試片的表面積,cm2;ρ為試片的密度,g/cm3;t為實驗時間,h;8760為與1 a相當的小時數,h/a;10為與1 cm相當的毫米數,mm/cm;X0和X1分別為空白實驗和加劑實驗中試片的腐蝕速率,mm/a。
2 結果與討論
2.1 所制備的介孔SiO2的表征結果
2.1.1 形貌
圖1為介孔SiO2微球樣品的TEM照片。從圖1(a)可以看出,所制備的介孔SiO2是一些形狀比較規則的圓形顆粒,顆粒粒徑在150~200 nm范圍,大小不一,分散性不太好,顆粒呈現堆積、掩蓋狀態。圖1(b)為一個完整顆粒的高分辨圖片,可以清楚地觀察到其具有介孔狀結構,孔道呈發散的蠕蟲狀。

圖1 介孔SiO2微球樣品的TEM照片
2.1.2 BET比表面性質
圖2為介孔SiO2微球樣品的N2吸附-脫附等溫線和孔徑分布。
根據BDDT(Brunauer deming deming teller)分類,圖2(a)顯示的N2吸附-脫附等溫線的起始段斜率變化由大到小,是典型的IV型等溫線,屬于多孔物質發生多分子層吸附時特有的等溫線[15]。在一定范圍的p/p0下出現滯后環,是非氣孔型固體表面的氣體物理吸附引起;由于多層吸附的存在,吸附量隨著p/p0的增加不斷增大,在0.2~0.3范圍有一個快速的上升,這是由介孔里N2的毛細凝聚引起的。脫附等溫線與吸附等溫線一致,說明介孔SiO2微球具有很好的介孔特性。BET測試得到介孔SiO2微球的比表面積為1088.9 m2/g。
從圖2(b)看出,介孔SiO2微球的孔徑分布在2~3 nm之間,平均孔徑為2.55 nm;孔徑分布曲線呈單峰狀,并且半峰寬較窄,說明樣品的孔徑均勻,其結構為介孔狀。

圖2 介孔SiO2微球樣品的N2吸附-脫附等溫線和孔徑分布
2.1.3 FT-IR分析
圖3為介孔SiO2微球的FT-IR譜。從圖3可以看出,464 cm-1附近有一窄而尖的峰,歸屬于Si—O—Si的伸縮振動,800 cm-1附近的吸收峰歸屬于Si—O—Si的彎曲振動,933 cm-1附近的吸收峰歸屬于Si—O的伸縮振動;1087 cm-1附近有一強且尖銳的峰,歸屬于硅氧烷中Si—O—Si的不對稱振動;1639 cm-1附近的吸收峰歸屬于SiO2表面吸水后形成的氫鍵,3415 cm-1附近的吸收峰歸屬于硅醇Si—OH及表面吸附水的—OH振動。由此證明,所制備的樣品為SiO2。
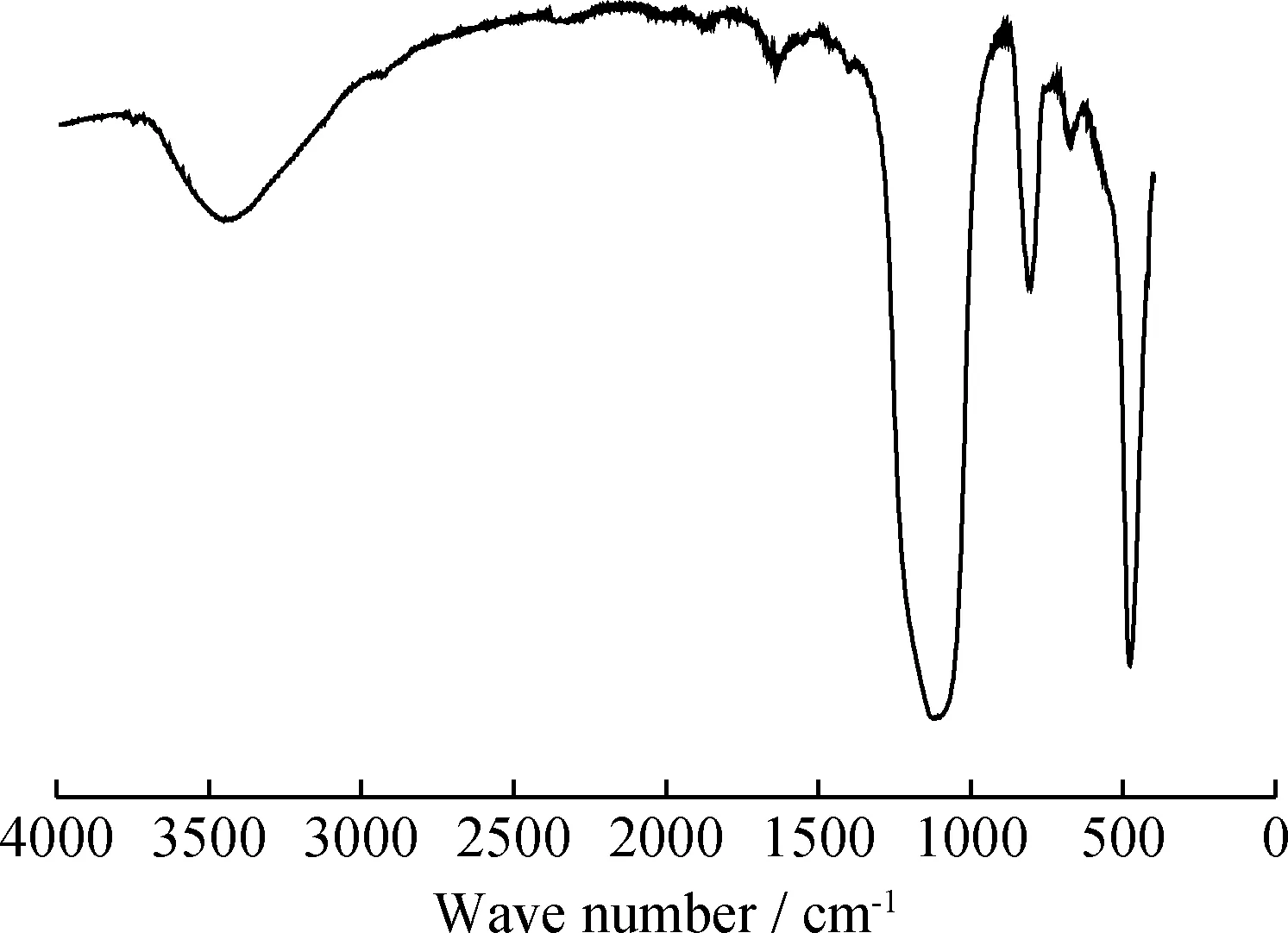
圖3 介孔SiO2微球的FT-IR譜
2.2 介孔SiO2固定化溶菌酶的制備條件優化
2.2.1 溶菌酶給酶量的優化
取等量介孔SiO2,投加到不同質量濃度溶菌酶的Na2HPO4-KH2PO4緩沖溶液(50 mmol/L,pH值7.0)中,其他條件相同,進行溶菌酶的固定化,得到的固定化溶菌酶的相對酶活示于圖4。
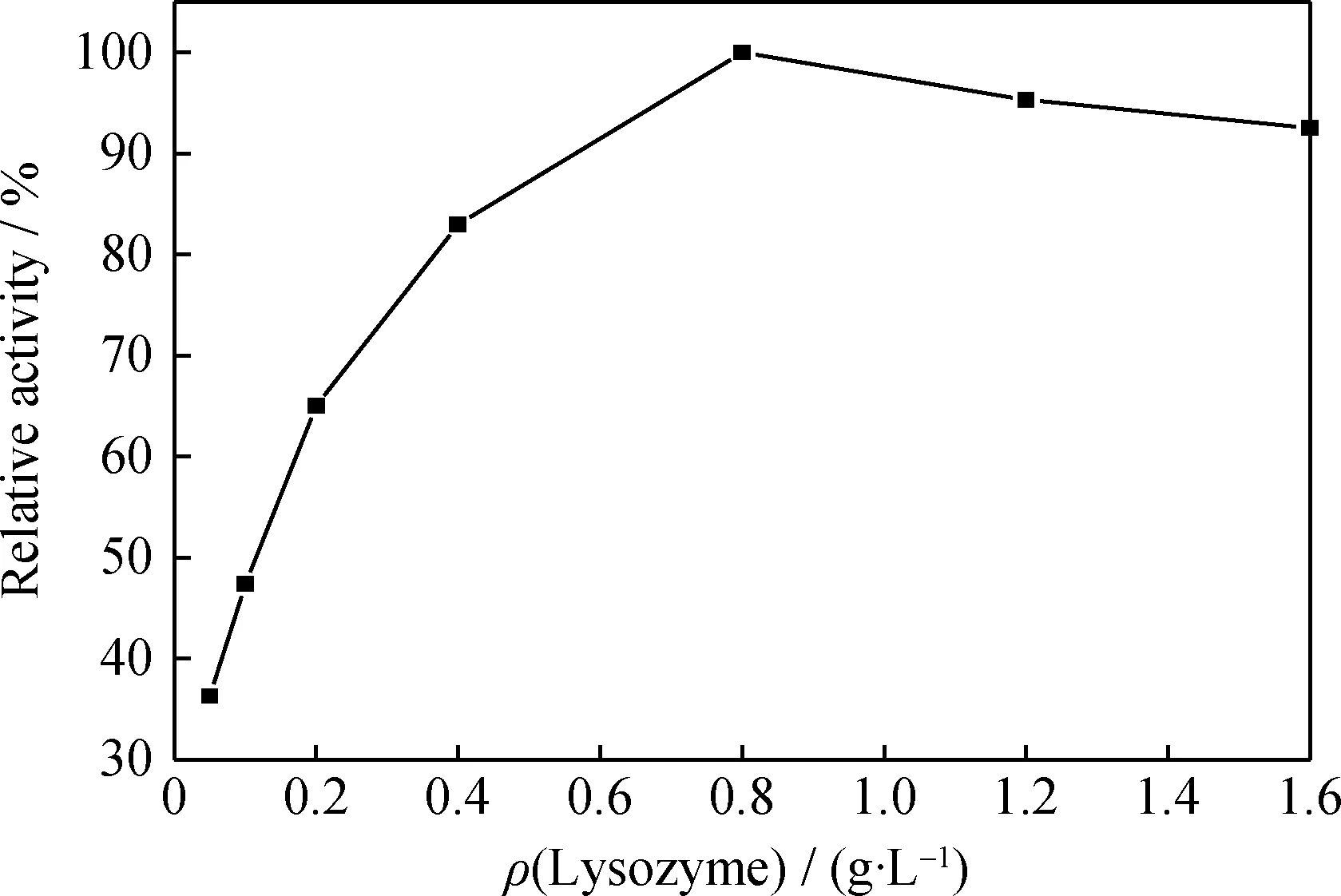
圖4 溶菌酶質量濃度(ρ)對固定化溶菌酶相對酶活的影響
由圖4看到,隨著溶菌酶質量濃度的增加,固定化溶菌酶的相對酶活逐漸增大,當溶菌酶質量濃度為0.8 g/L時,相對酶活達到最大;繼續增加給酶量,相對酶活反而略有下降。陳建龍[16]利用空氣玻纖濾材進行溶菌酶固定化時也發現,隨著給酶量增大,固定化酶活性先增大后減小。這是因為溶菌酶質量濃度增加,使固定在介孔SiO2上的酶量相應增加;然而,隨著載體負載酶量的增大,酶分子相互擁擠造成的空間位阻也增大,使溶菌酶活性中心互相遮蓋,底物與產物也不能及時擴散,因此,超過一定溶菌酶質量濃度后,固定化酶的活性反而下降。固定化溶菌酶最佳的溶菌酶質量濃度為0.8 g/L。
2.2.2 固定化時間的優化
取等量介孔SiO2,投加到溶菌酶質量濃度為0.8 g/L的Na2HPO4-KH2PO4緩沖溶液(50 mmol/L,pH值7.0)中,室溫下考察固定化時間對固定化溶菌酶相對酶活的影響,結果示于圖5。

圖5 固定化時間對固定化溶菌酶相對酶活的影響
從圖5可以看出,隨著固定化時間的延長,固定化酶的相對酶活先增大后減小;當吸附時間為10 h時,相對酶活達到最大。固定化時間小于10 h時,隨著時間的延長,溶菌酶的吸附量逐漸增大,因此相對酶活逐漸增大;當固定化時間為10 h時,反應達到吸附平衡,相對酶活達到最大;固定化時間超過10 h后,雖然溶菌酶固定量增大,但與給酶量過大效果類似,溶菌酶分子相互擁堵,使溶菌酶活性中心互相遮蓋,因此,超過一定時間后,固定化酶的相對酶活反而下降。制備固定化溶菌酶最佳的固定化時間為10 h。
2.2.3 pH值的優化
取等量介孔SiO2投加到溶菌酶質量濃度為0.8 g/L的Na2HPO4-KH2PO4緩沖溶液(50 mmol/L)中,室溫振蕩10 h,考察固定化pH值對固定化酶相對酶活的影響,結果示于圖6。從圖6可以看出,介孔SiO2固定化溶菌酶的最佳pH值為6.5。pH值增大或減小都會使固定化溶菌酶的相對酶活降低。

圖6 固定化pH值對固定化酶相對酶活的影響
劉慧等[17]的研究表明,溶菌酶的最適pH值在6~6.5范圍,在5~7范圍內酶活性相對比較穩定,而大于7時酶活性急劇下降,當pH值為8時,相對酶活下降至10%左右。本實驗結果與其研究大致相符。然而pH值低于6.5時,固定化溶菌酶的相對酶活下降較大,pH值為5.4時,相對酶活下降至71.74%。這是因為酸性條件下,溶菌酶活性中心氨基酸的解離狀態可能不利于酶活性的充分發揮;同時,溶菌酶的等電點為pH值10.8左右[4],在酸性條件下表面帶正電荷,使酶分子與介孔SiO2表面的硅羥基的相互作用減弱。
2.2.4 緩沖液濃度的優化
取等量介孔SiO2,投加到溶菌酶質量濃度為0.8 g/L的Na2HPO4-KH2PO4緩沖溶液(pH值6.5)中,在室溫振蕩10 h條件下,考察緩沖液濃度對固定化酶相對酶活的影響,結果示于圖7。
從圖7可以看出,當緩沖液摩爾濃度為50 mmol/L時,固定化溶菌酶的相對酶活最高,當濃度高于50 mmol/L時,固定化溶菌酶的相對酶活下降明顯。這是因為當緩沖液摩爾濃度為25 mmol/L時,緩沖效果較弱,不能保證溶菌酶固定化時的穩定環境,因此固定化效果較摩爾濃度為50 mmol/L時差;而當緩沖液摩爾濃度高于50 mmol/L時,由于濃度過高,蛋白亞基之間的相互作用可能會遭到破壞,引起亞基解離,同時,會影響酶分子與介孔SiO2表面的吸附作用力,從而影響酶的固定化效果。另外,當濃度過高時,可能導致電荷屏蔽作用,使底物分子不能接近酶的活性中心,從而降低了固定化溶菌酶的催化效率,使相對酶活降低。因此優選緩沖液摩爾濃度為50 mmol/L。

圖7 緩沖液摩爾濃度對固定化酶相對酶活的影響
2.3 固定化溶菌酶的緩蝕性能
2.3.1 實驗用循環水水質
一般情況下,循環水是中性和弱堿性的,pH值控制在7~9.5之間。實驗循環水的水質分析結果列于表2。

表2 實驗用循環水水質
1) Based on CaCO3
2.3.2 柴油投加量的確定
向2 L燒杯中加入1 L循環水,并向其中投加不同量的柴油,按1.6節中所述方法進行腐蝕實驗,測定碳鋼的腐蝕速率,結果示于圖8。
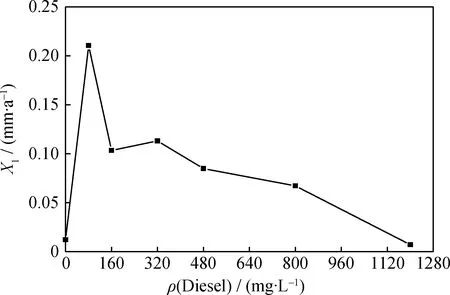
圖8 含不同質量濃度柴油循環水中碳鋼的腐蝕速率(X1)
從圖8可以看出,隨著循環水中柴油質量濃度的不斷增加,碳鋼的腐蝕速率呈現先上升后下降的趨勢。這是因為低濃度的柴油能為異養菌的生長提供碳源等營養條件,使細菌總數高于未投加柴油時[18],創造產生點蝕的環境[19];隨著柴油濃度的繼續增加,對異養菌產生了毒性,從而使細菌總數降低,減緩了碳鋼的腐蝕速率。
循環冷卻水中的油一般以分散態、乳化態或溶解態的形式存在,當油含量較高時可通過物理或化學方法破乳,最后的濃度往往較低。此外,由圖8可知,碳鋼在柴油質量濃度為80 mg/L的循環水中的腐蝕速率最高,故選擇80 mg/L作為模擬柴油泄漏腐蝕實驗的柴油質量濃度。
2.3.3 固定化溶菌酶的緩蝕效果
向2 L燒杯中加入1 L循環水,向其中投加少許柴油,使柴油的質量濃度為80 mg/L,并分別加入不同量的固定化溶菌酶進行腐蝕實驗,測定碳鋼的腐蝕速率和固定化溶菌酶對碳鋼的緩蝕率,結果示于圖9。
從圖9可以看出,隨著固定化溶菌酶質量濃度的增加,碳鋼的腐蝕速率下降明顯,相應的緩蝕率逐漸增大;當質量濃度為0.5 g/L時,緩蝕率達77.10%;增大固定化溶菌酶質量濃度至0.7 g/L時,緩蝕率為78.21%。
盧憲輝等[20]研究表明,使用游離溶菌酶進行腐蝕實驗時,雖緩蝕效果明顯,但隨著溶菌酶質量濃度增加,呈現先增大后減小的波動變化,即游離溶菌酶性質不穩定。這主要是由于循環冷卻水的pH值一般為7~9.5,在此范圍內,游離溶菌酶的活性穩定性較差[17]。實驗表明,固定化溶菌酶的穩定性較游離溶菌酶有了顯著提高。

圖9 含柴油循環水添加不同量固定化溶菌酶時碳鋼的腐蝕速率(X1)和緩蝕率(X2)
然而,游離溶菌酶對碳鋼的緩蝕率最高可達83%,略高于固定化溶菌酶。這是因為游離溶菌酶的酶分子直接分散在循環水中,而固定化溶菌酶的酶分子在介孔SiO2表面吸附,降低了與循環水中細菌的接觸能力,從而影響了其緩蝕效果。
3 結 論
采用溶膠-凝膠法合成了介孔SiO2微球,其粒徑在150~200 nm范圍,表面平均孔徑為2.55 nm,比表面積為1088.9 m2/g。利用物理吸附法固定化溶菌酶,確定固定化的最佳條件為溶菌酶質量濃度0.8 g/L、固定化時間10 h、pH值6.5、緩沖溶液摩爾濃度50 mmol/L。在模擬柴油泄漏循環冷卻水的腐蝕實驗中,當柴油投加質量濃度為80 mg/L時,固定化溶菌酶對碳鋼的緩蝕率最高可達78.21%,且穩定性較游離溶菌酶有顯著提高;然而,其最高緩蝕率較游離溶菌酶的最高緩蝕率(83%)低,表明固定化溶菌酶對細菌的親和力較游離溶菌酶弱。
[1] 劉芳,楊飛, 王飛揚,等. 油品泄漏對循環冷卻水系統生物黏泥生長特性的影響[J]. 石油學報(石油加工),2012, 28(5):883-888. (LIU Fang, YANG Fei, WANG Feiyang, et al. Effects of oil leakage in circulating cooling water system on biofouling growth characteristics[J]. Acta Petrolei Sinica(Petroleum Processing Section), 2012, 28(5):883-888.)
[2] 尹金鳳, 史鋒, 王小元. 蛋清溶菌酶與滲透劑對大腸桿菌的協同抑菌作用[J]. 食品科學, 2011, 32(11): 176-180. (YIN Jinfeng,SHI Feng,WANG Xiaoyuan. Synergistic antibacterial effect of lysozyme with cell permeabilizers on escherichia coli[J]. Food Science, 2011, 32(11): 176-180.)
[3] CALLEWAERT L, MICHIELS C W. Lysozymes in the animal kingdom[J]. J Biosci, 2010, 35(1): 127-160.
[4] 林翠花, 肖素榮, 孟慶國. 溶菌酶結構特點及其應用[J]. 濰坊學院學報, 2005, 5(2): 108-110.(LIN Cuihua, XIAO Surong, MENG Qingguo. The structure, characteristics of lysozyme and its application[J]. Journal of Weifang University, 2005, 5(2): 108-110. )
[5] BLAKE C, KOENIG D, MAIR G,et al.Structure of hen egg-white lysozyme.A three-dimensional Fourier synthesis at 2 Angstrom resolution[J].Nature,1965,206(4986):757-761.
[6] LENINGER A, NELSON D,COX M.Principles of Biochemistry[M].2nd Edition.New York:Worth Publishers, 1993:180-312.
[7] 肖懷秋, 林親錄, 李玉珍,等. 溶菌酶及其在食品工業中的應用[J]. 中國食物與營養, 2005, (2): 32-34.(XIAO Huaiqiu, LIN Qinlu, LI Yuzhen, et al. Application of lysozyme in the food industry[J]. Food and Nutrition in China, 2005, (2): 32-34. )
[8] 譙康全,吳永強, 劉新露. 溶菌酶在硫酸介質中對Q235鋼緩蝕行為的研究[J]. 腐蝕與防護,2012, 33(6):478-481.(QIAO Kangquan, WU Yongqiang, LIU Xinlu. Corrosion inhibition behavior of lysozyme on Q235 steel in H2SO4solution[J]. Corrosion & Protection, 2012, 33(6): 478-481.)
[9] LEE C, LIN T,MOU C.Mesoporous materials for encapsulating enzymes[J].Nano Today,2009,4(2):165-179.
[10] 呂勇軍,李佩晉, 郭楊龍,等.酶在有序介孔材料上的固定化[J].化學進展.2008,20(7-8):1172-1179. (Lü Yongjun, LI Peijin, GUO Yanglong, et al. Immobilization of enzymes on mesoporous materials[J]. Progress in Chemistry, 2008,20(7-8):1172-1179.)
[11] 楊沖. 介孔二氧化硅的制備及銀的負載性研究[D].南京:南京理工大學,2010.
[12] 方欣閃. 介孔二氧化硅微球的制備[J].長春理工大學學報(自然科學版),2010,33(2):90-93.(FANG Xinshan. Preparation of mesoporous silica microsphere[J]. Journal of Changchun University of Science and Technology(Natural Science Edition), 2010,33(2):90-93.)
[13] 郭慶啟, 張娜, 符群,等. AB-8 大孔樹脂固定化溶菌酶及酶學性質研究[J]. 食品科學, 2012, 33(17): 216-220. (GUO Qingqi, ZHANG Na, FU Qun, et al. Immobilization of lysozyme onto AB-8 macroporous resin and its enzymatic characterization[J]. Food Science, 2012, 33(17): 216-220.)
[14] 馬如, 黃明智. 殼聚糖的溶菌酶降解[J]. 北京化工大學學報, 2002, 29(6): 41-43. (MA Ru, HUANG Mingzhi. Hydrolysis of chitosan with lysozyme[J]. Journal of Beijing University of Chemical Technology, 2002, 29(6): 41-43.)
[15] 吳煥領,魏賽男, 崔淑玲.吸附等溫線的介紹及應用[J].染整技術,2006,28(10):12-14.(WU Huanling, WEI Sainan, CUI Shuling. Introduction and application of adsorption isotherm[J]. Textile Dyeing and Finishing Journal, 2006,28(10):12-14.)
[16] 陳建龍. 溶菌酶在高效空氣玻纖濾材上的固定化及其應用研究[D]. 蘭州:蘭州大學, 2006.
[17] 劉慧,王風山, 楚杰. 蛋清溶菌酶部分酶學性質及酶活性的影響因素研究[J].中國生化藥物雜志,2008,29(6):385-391. (LIU Hui,WANG Fengshan,CHU Jie.Study on some enzymological properties and activity influencing factors of egg white lysozyme[J]. Chinese Journal of Biochemical Pharmaceutics,2008,29(6):385-391.)
[18] 劉芳, 仲慧赟, 董文文,等. 泄漏柴油對殺菌劑生物黏泥控制效果的影響[J]. 石油學報(石油加工), 2013, 29(4): 712-716. (LIU Fang, ZHONG Huiyun, DONG Wenwen, et al. Influence of leaking diesel on biofouling control effects by biocide[J]. Acta Petrolei Sinica(Petroleum Processing Section), 2013, 29(4): 712-716.)
[19] 吳鳳,黃森, 劉貴. 氨和油進入循環冷卻水系統的危害及預防[J]. 川化,2012,(1):23-24.
[20] 盧憲輝, 劉芳, 陸津津,等. 柴油泄漏情況下生物酶緩蝕劑在循環水系統中的應用[J]. 石油學報(石油加工), 2013, 29(6): 1090-1095. (LU Xianhui, LIU Fang, LU Jinjin, et al. The biological enzyme corrosion inhibitors in the circulating water system with diesel leakage[J]. Acta Petrolei Sinica(Petroleum Processing Section), 2013, 29(6): 1090-1095.)
Corrosion Inhibition of Lysozyme Immobilized on Mesoporous SiO2in Circulating Cooling Water System With Diesel Leakage
ZHONG Huiyun, LIU Fang, Lü Yucui, LU Jinjin, YANG Wei
(CollegeofChemicalEngineering,ChinaUniversityofPetroleum,Qingdao266580,China)
Mesoporous SiO2microspheres were synthesized by using sol-gel method, and characterized by TEM, BET and FT-IR. Lysozyme was immobilized on mesoporous SiO2through physical adsorption and the conditions of immobilization were optimized. The immobilized lysozyme prepared under optimal conditions was used as corrosion inhibitor in cooling circulating water with diesel leakage. The results showed that the optimal preparation conditions for immobilized lysozyme were lysozyme mass concentration of 0.8 g/L, immobilization time of 10 h, the pH value of 6.5 and the buffer molar concentration of 50 mmol/L. In the cooling circulating water containing diesel of 80 mg/L and with immobilized lysozyme as corrosion inhibitor, the highest corrosion inhibition rate for carbon steel was 78.21%, and the stability of immobilized lysozyme had increased obviously compared to free lysozyme.
mesoporous SiO2microspheres; immobilization; lysozyme; diesel leakage; circulating cooling water; corrosion inhibition
2014-06-06
國家自然科學基金項目(21077133)和中國石油大學研究生創新工程項目(CX2013039)資助
仲慧赟,女,碩士研究生,從事水污染控制與資源化利用方面的研究;E-mail: huiyun0102@126.com
劉芳,女,教授,從事高濃度有機廢水的深度處理及回用技術方面的研究;E-mail: liufangfw@163.com
1001-8719(2015)05-1136-08
TQ085; Q71
A
10.3969/j.issn.1001-8719.2015.05.018

