心臟死亡器官捐獻供腎移植與司法途徑標準供者供腎移植術后早期效果分析比較
邱濤 張璐 周江橋 陳忠寶 馬梟雄 張龍
長久以來,我國的器官移植主要依賴于司法途徑來源的供器官。近5 年來,國家大力提倡心臟死亡器官捐獻(donation after cardiac death,DCD),為器官移植開辟了新的供器官來源[1]。DCD 供器官移植有別于傳統的司法途徑標準供者(standard criteria donors,SCD)供器官移植,在此過程中出現的許多新問題值得進一步研究探討。武漢大學人民醫院器官移植科從2011 年開始進行DCD 供腎移植,本文對我中心施行的DCD 供腎移植與同期開展的SCD 供腎移植的短期效果進行比較,現報道如下。
1 資料與方法
1.1 臨床資料
回顧性分析我中心2011 年1 月至2014 年12 月連續施行的74 例DCD 供腎移植和143 例SCD 供腎移植的臨床資料。DCD 組74 例受者中男性44 例,女性30 例,平均年齡(46 ±9)歲(21 ~63 歲),二次腎移植2 例;術前檢查群體反應性抗體(panel reactive antibodies,PRA)<10% 有61 例,10% ~30%有9 例,>30% 有4 例,HLA 錯配數平均為(3.1 ±1.3)個。SCD 組143 例受者中男性101 例,女性42 例,平均年齡(47 ±11)歲(19 ~64 歲),二次腎移植9 例;術前檢查PRA <10%有124 例,10% ~30%有16 例,>30% 有3 例;HLA 錯配數平均為(2.7 ±1.2)個。
74 例DCD 供腎來自于45 例供者,年齡2 ~71 歲;24 例為腦死亡,12 例為腦心雙死亡,9 例為心臟死亡;原發病中腦外傷19 例,腦血管疾病15 例,缺氧性腦病3 例,腦腫瘤6 例,其他2 例。DCD 組和SCD 組受者透析時間分別為5.6 ~53.9 個月、6.5 ~49.0 個月。
兩組受者性別、年齡、移植次數、PRA、HLA 錯配數、透析時間均具有可比性(P 均>0.05)。DCD組熱缺血時間平均為(16 ±6)min,SCD 組平均為(7 ±5)min,差異有統計學意義(t = 11. 72,P <0.05);而DCD 組冷缺血時間平均為(3.4 ±1.4)h,較SCD 組(11 ±7)h 短,差異有統計學意義(t =-11.40,P <0.05)。DCD 組中2 例供腎采用機械灌注,另外72 例DCD 供腎和143 例SCD 供腎全部采用單純靜態低溫保存。
移植物功能延遲恢復(delayed graft function,DGF)定義為移植術后1 周內因血清肌酐升高或尿量減少而導致受者出現容量負荷過重,常需要進行透析治療,以停止血液透析作為判斷DGF 恢復的標準[2]。根據2007 Banff 標準確診移植腎急性排斥反應,以尿量和血清肌酐恢復到發生排斥反應前的水平判定為治愈。根據呼吸道癥狀、體征、影像學檢查以及病原學檢查結果確診術后肺部感染,以臨床癥狀消失、肺部CT 提示感染灶全部吸收判定為治愈。
免疫誘導方案:標準雙劑巴利昔單抗或術中開始連續5 d 使用抗胸腺細胞免疫球蛋白(antithymocyte immune globulin,ATG)100 mg/d。DCD 組受者37 例采用ATG 誘導,37 例采用巴利昔單抗誘導;SCD 組受者32 例采用ATG 誘導,111 例采用巴利昔單抗誘導。免疫抑制方案:兩組受者均采用三聯免疫抑制方案(嗎替麥考酚酯+他克莫司+潑尼松)。術前開始口服免疫抑制劑嗎替麥考酚酯和他克莫司;術中靜脈應用甲潑尼龍0.5 ~1.0 g,術后0.5 g/d,連用3 d。出現移植腎排斥反應時,采用甲潑尼龍沖擊治療,0.5 g/d,總劑量1 ~2 g;若無法逆轉,改為ATG 25 ~50 mg/d,連用5 d。他克莫司血藥濃度谷值分別維持在8 ~12 μg/L(術后1 ~2 個月)、7 ~8 μg/L(術后3 ~6 個月)、5 ~8 μg/L(術后7 ~12 個月)。
1.2 隨 訪
術后3 個月內每周隨訪1 次,復查血常規及肝腎功能、電解質,監測他克莫司血藥濃度,監測排斥反應和感染情況。術后4 ~6 個月每2 周隨訪1 次,6 個月以后每個月隨訪1 次。當受者出現發熱、腹痛、腹瀉、尿量減少、血壓異常、尿常規提示蛋白尿和鏡下血尿等改變時,及時復查。
1.3 統計學方法
采用SPSS 18.0 統計軟件進行數據處理。計量資料以均數±標準差()表示,兩組受者年齡、透析時間、熱缺血時間、冷缺血時間等指標比較采用成組t 檢驗。計數資料以百分數表示,兩組受者和移植腎存活比例、DGF 發生率、排斥反應發生率、肺部感染發生率比較采用卡方檢驗。P <0.05 為差異有統計學意義。
2 結 果
2.1 受者和移植腎6 個月存活及并發癥情況
術后6 個月,DCD 組死亡5 例,其中1 例因發生DGF 后腦出血死亡,1 例因腎動脈破裂行移植腎切除后出現吻合口動脈瘤破裂死亡,3 例因肺部感染死亡;SCD 組死亡8 例,其中1 例因腎動脈破裂死亡,1 例二次腎移植受者因首次腎移植移植腎腫瘤伴轉移死亡,1 例因主動脈夾層破裂死亡,1 例因多囊腎切除后出血死亡,4 例因肺部感染死亡。兩組受者術后6 個月存活比例分別為93.2%(69/74)和94.4%(135/143),差異無統計學意義(χ2=0.12,P >0.05)。
DCD 組移植腎6 個月存活比例為90.5%(67/74),除5 例受者死亡外,1 例術后創面大出血,移植腎靜脈血栓形成行移植腎切除,1 例術后4 個月因發生急性排斥反應而導致移植腎失功,后恢復血液透析。SCD 組移植腎6 個月存活比例為93.0%(133/143),除8 例受者死亡外,1 例因腎靜脈根部撕裂出血無法控制致切腎,1 例術后5 個月因排斥反應致移植腎失功恢復透析。兩組移植腎存活比例差異無統計學意義(χ2=0.41,P >0.05)。DCD 組和SCD 組術后DGF 發 生 率 分 別 為28. 4% (21/74)和7. 0%(10/143),差異有統計學意義(χ2= 18. 21,P <0.05)。術后6 個月內DCD 組和SCD 組急性排斥反 應 發 生 率 分 別 為13. 5% (10/74)和7. 0%(10/143),差 異 無 統 計 學 意 義(χ2= 2. 48,P >0.05)。術后6 個月內肺部感染發生率分別為14.9%(11/74)和21.0%(30/143),差異無統計學意義(χ2=1.19,P >0.05)。DCD 組有3 例因肺部感染死亡(1 例真菌感染、2 例CMV 感染),SCD 組有4 例(1 例結核、1 例真菌感染,2 例混合感染)。
2.2 移植腎功能評價
DCD 組和SCD 組受者術后1 個月血清肌酐分別為(149 ±65)、(106 ±60)μmol/L,術后3 個月血清肌酐分別為(132 ±78)、(101 ±63)μmol/L,差異均有統計學意義(t =4.74 和2.95,P 均<0.05);術后6 個月血清肌酐分別為(122 ±90)、(107 ±78)μmol/L,差異無統計學意義(t = 1. 22,P >0.05)。詳見圖1。
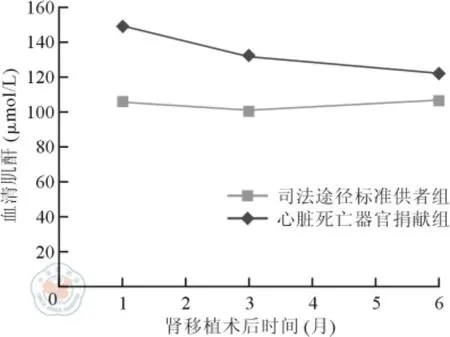
圖1 心臟死亡器官捐獻組和司法途徑標準供者組受者術后6 個月內血清肌酐比較
3 討 論
供器官來源短缺一直是制約器官移植發展的主要原因。許多終末期腎病患者因為等不到合適的供腎最終在透析中走向死亡[3]。擴展供器官來源,規范器官移植一直是器官移植領域長期追求的目標。2010 年起我國開始試行DCD,為擴展供器官來源提供了一條新的渠道,同時也避免了我國既往使用司法途徑來源供器官被國際社會詬病的弊端[4]。DCD供者經歷兒茶酚胺風暴,導致全身循環不穩定,易出現組織臟器缺血、缺氧。接受高齡邊緣供者,特別是伴有高血壓、糖尿病、高脂血癥等基礎疾病供者的供器官,受者術后并發癥更加明顯。國外報道,使用DCD 供腎移植,術后原發性移植物無功能和DGF 發生率較高[2]。國內研究也發現,DCD 供腎移植術后DGF 發生率增高[5-6]。本研究結果顯示,DCD 供腎移植受者中發生DGF 比例高達28.4%,而SCD 組只有7.0%。受者發生DGF 會增加圍手術期肺部感染發生率,DCD 組中21 例發生DGF 的受者中8 例發生肺部感染,其中1 例死亡。同時,DCD 供腎移植后DGF 持續時間長,平均15 d,最長一例達92 d;而SCD 組DGF 持續時間為1 ~3 周。可以通過改善供者血壓、氧飽和度以及腎組織間質水腫來降低DGF 發生率,還可以使用機械灌注和體外膜肺氧合(extracorporeal membrane oxygenation,ECMO)技術[7]。結合文獻報道發現,邊緣供腎使用機械灌注后,不僅DGF 發生率降低,同時還減少了DGF 的持續時間[8]。但有文獻報道,與腦死亡器官捐獻供腎移植相比,雖然DCD 供腎移植術后DGF 發生率更高、持續時間更長,但這并不足以比較在不同移植供者背景下的預后情況[9]。
由于免疫抑制劑的大量使用,特別是免疫誘導藥物的使用,可以顯著降低圍手術期急性排斥反應的發生,因此整體而言,本研究中兩組受者急性排斥反應發生率均較低,但與SCD 組相比,DCD 組受者仍顯示出較高的排斥反應發生率。出現急性排斥反應后使用甲潑尼龍或者T 細胞清除劑可獲得良好的治療效果[10]。
SCD 組觀察期長,病例主要集中在2011 ~2012 年;而DCD 組觀察期短,病例主要集中在2013 ~2014 年。因此,我們比較了DCD 組和SCD 組受者術后6 個月內肺部感染發生率,差異無統計學意義,但得出結論仍需長期、大樣本的觀察研究。Fernández-Ruiz等[11]研究顯示,與腦死亡器官捐獻組相比,DCD 組DGF 以及移植腎失功發生率更高,但是急性排斥反應發生率和總死亡率較低;DCD 組總體感染率、細菌、CMV 以及非CMV 感染發生率更高。DCD 供腎移植后DGF 狀態是感染的潛在危險因素,使用高效價免疫誘導藥物和發生排斥反應也增加了移植術后6 個月內機會性感染的風險,同時來源于供器官的病原體傳播也是感染增加的一個途徑。近2 年來,我中心開始實施全面預防治療,針對CMV 和肺孢子菌使用更昔洛韋和磺胺類藥物預防性治療6 個月,從而使腎移植術后6 個月內感染率顯著降低。目前針對腎移植受者,推薦普遍預防策略,即移植后對所有受者均給予抗病毒藥物預防性治療,特別是對接受ATG 誘導治療、伴發DGF、伴發排斥反應等高危受者,可以顯著降低移植后感染發生率[12]。
影響受者存活的因素除肺部感染外,還包括發生DGF 期間出現的心腦血管意外。有研究顯示,動脈粥樣硬化是腎移植術后早期移植失敗甚至受者死亡的高危因素[13]。本研究中,兩組都有因心腦血管意外造成受者死亡的病例。國外報道DCD 來源的供器官引發受者術后真菌感染率升高,真菌侵蝕移植腎動脈吻合口,會造成大出血死亡。由于真菌侵蝕腎動脈可能造成移植腎丟失甚至受者死亡,因此需要采取積極應對措施,包括預防供、受者真菌感染治療以及吻合口重建等[13]。
國內外研究均提示,DCD 移植腎功能恢復緩慢,術后3 個月基本可恢復正常,受者發生DGF 雖增加住院天數,但不影響受者和移植物生存率[14-15],這同本研究相一致。DCD 供腎移植后移植腎功能恢復緩慢,一部分原因是供腎本身質量問題:包括高齡供者、移植腎急性損傷、供者存在高血壓和糖尿病等基礎疾病以及較長的熱缺血時間。本研究中,腎移植術后1 個月內SCD 組受者血清肌酐明顯優于DCD 組,這種差距在術后6 個月后縮小,統計學上無明顯差異,這同其他研究報道的DCD 供腎移植后腎功能恢復的時間趨勢是相一致的[15-17]。
總體而言,DCD 供腎移植術后DGF 和急性排斥反應的發生率升高,短期移植腎功能恢復慢,肺部感染發生率增加,但短期移植物及受者存活情況同SCD 供腎移植相一致。
1 中華醫學會器官移植學分會. 中國心臟死亡器官捐獻工作指南(2 版)[J/CD]. 中華移植雜志:電子版,2012,6(3):221-220.
2 Seo CH,Ju JI,Kim MH,et al. Risk factors and long-term outcomes of delayed graft function in deceased donor renal transplantation[J].Ann Surg Treat Res,2015,89(4):208-214.
3 Link DK,Saxena R. The right patient,the right treatment,the right access and the right time[J]. Adv Chronic Kidney Dis,2014,21(4):360-364.
4 Huang J,Wang H,Fan ST,et al. The national program for deceased organ donation in China[J]. Transplantation,2013,96(1):5-9.
5 劉斌,曾凡軍,陳知水,等. 心臟死亡器官捐獻供者腎移植的近期效果評價[J]. 第三軍醫大學學報,2015,37(1):64-68.
6 陳國棟,袁小鵬,李軍,等. 心臟死亡器官捐獻供腎與傳統尸體供腎腎移植的療效比較[J]. 中華器官移植雜志,2013,34(7):392-395.
7 Wszola M,Kwiatkowski A,Diuwe P,et al. One-year results of a prospective,randomized trial comparing two machine perfusion devices used for kidney preservation[J]. Transpl Int,2013,26(11):1088-1096.
8 項和立,薛武軍,田普訓,等. 心臟死亡器官捐獻供體器官功能的評估和維護[J]. 中華泌尿外科雜志,2014,35 (1):20-23.
9 Tojimbara T,Fuchinoue S,Iwadoh K,et al. Improved outcomes of renal transplantation from cardiac death donors:a 30-year single ceter experience[J]. Am J Transplant,2007,7(3):609-617.
10 Chen GD,Lai XQ,Ko DS,et al. Comparison of efficacy and safety between rabbit anti-thymocyte globulin and anti-T lymphocyte globulin in kidney transplantation from donation after cardiac death:a retrospective cohort study[J]. Nephrology (Carlton),2015,20(8):539-543.
11 Fernández-Ruiz M,Andrés A,López-Medrano F,et al. Infection risk in kidney transplantation from uncontrolled donation after circulatory death donors[J]. Transplant Proc,2013,45(4):1335-1338.
12 Hodson EM,Craig JC,Strippoli GF,et al. Antiviral medications for preventing cytomegalovirus disease in solid organ transplant recipients[J]. Cochrane Database Syst Rev,2008,5(4):85-86.
13 Ram Reddy C,Ram R,Swarnalatha G,et al. " True" mycotic aneurysm of the anastomotic site of the renal allograft artery[J]. Exp Clin Transplant,2012,10(4):398-402.
14 Ledinh H,Weekers L,Bonvoisin C,et al. Results of kidney transplantation from controlled donors after cardio-circulatory death:a single center experience[J]. Transpl Int,2012,25(2):201-209.
15 Xiaoming P,Xiang H,LinJuan L,et al. Preliminary results of transplantation with kidneys donated after cardiac death:a path of hope for organ transplantation in China[J]. Nephrol Dial Transplant,2015,30(9):1590-1596.
16 Salmeron-Rodriguez MD, Navarro-Cabello MD, Agüera-Morales ML,et al. Short-term evolution of renal transplant with grafts from donation after cardiac death:Type Ⅲ Maastricht category[J].Transplant Proc,2015,47(1):23-26.
17 Wadei HM,Heckman MG,Rawal B,et al. Comparison of kidney function between donation after cardiac death and donation after brain death kidney transplantation[J]. Transplantation,2013,96(3):274-281.

