黃蜀葵莖枯病病原菌的分離與鑒定
夏敏媛,張瑜Δ,沈小林,秦軍,繆軼君,談獻和
(1.南京中醫藥大學 藥學院,江蘇 南京 210023;2.江蘇蘇中藥業集團股份有限公司,江蘇 姜堰 225500)
?
黃蜀葵莖枯病病原菌的分離與鑒定
夏敏媛1,張瑜1Δ,沈小林2,秦軍2,繆軼君1,談獻和1
(1.南京中醫藥大學 藥學院,江蘇 南京 210023;2.江蘇蘇中藥業集團股份有限公司,江蘇 姜堰 225500)
目的 分離黃蜀葵莖枯病病原菌并鑒定其種類。方法 取江蘇省宜興市采集的黃蜀葵發病植株病灶處(J)和健康處(W)的莖段,培養并篩選新生菌絲體,將分離獲得的幾種待定病原菌分別接種至健康黃蜀葵幼苗莖部,進行致病性檢測,隨后將獲得的有效致病菌株進行病原菌形態學鑒定、PCR擴增和rDNA-ITS檢測以確定菌種。結果 排除J與W中一致的菌種,分離得到3種真菌J2,J5和J6;致病性檢測結果發現J5為有效致病菌;根據病原菌形態特征觀察,初步鑒定J5為木賊鐮刀菌;J5病原菌基因組DNA擴增后得到了長度為524 bp的條帶,與木賊鐮刀菌(Fusarium equiseti)的ITS序列同源性最高,達到了100%。結論 黃蜀葵莖枯病病原菌為木賊鐮刀菌F.equiseti。
黃蜀葵;莖枯病;致病菌;木賊鐮刀菌
黃蜀葵Abelmoschusmanihot(L.) Medic.的干燥花冠稱之為黃蜀葵花,性味甘寒,具有清熱解毒、消炎利尿的功效[1],始見于《嘉祐本草》。現代中藥藥理研究表明,黃蜀葵花具有明顯的消炎、抗菌、止痛等作用[2]。近年來,黃蜀葵花及其提取物制劑的代表藥物有黃葵膠囊、黃葵片等,其主要用于治療感染性疾病如慢性腎炎,尿路感染等[3-4],由于其療效顯著,深受患者肯定,臨床需求量逐年增加。
目前,黃蜀葵花藥材主要來自于人工栽培,存在著嚴重的連作障礙,主要表現為大面積重茬種植導致黃蜀葵病害頻發且逐年加重。近年來,黃蜀葵莖枯病在全國各種植地時有發生,傳播速度快,擴散面積大,嚴重影響了黃蜀葵花的產量和質量,部分地區甚至大面積絕收。前人并未報道過黃蜀葵莖枯病的研究,因而,本研究對黃蜀葵莖枯病病原菌進行了分離和鑒定,為今后開展黃蜀葵莖枯病防治工作提供理論依據。
1 材料與方法
1.1 材料
1.1.1 植物:黃蜀葵發病植株,健康黃蜀葵幼苗,均種植于江蘇省宜興市太華鎮,經由南京中醫藥大學談獻和教授鑒定。
1.1.2 試劑:0.1%升汞溶液(姜堰市環球試劑廠);PDA培養基(200 g切塊的馬鈴薯放入1000 mL蒸餾水中加熱,煮沸30 min后,過濾后加20 g瓊脂,15 g瓊脂制得);1%瓊脂糖凝膠(Bio Basic Inc.);Ezup柱式真菌基因組DNA抽提試劑盒及SanPrep柱式DNA膠回收試劑盒購于上海生工生物工程技術服務有限公司;
1.1.3 引物:真菌rDNA-ITS區段通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)及ITS4(5’-TCCTCCGCTTA-TTGATATGC-3’)購自上海生工生物工程技術服務有限公司。
1.1.4 儀器:BA300型生物顯微鏡(美國Motic公司);2720 Thermal Cycler擴增儀(美國Applied Biosystems公司);3730XL測序儀(美國Applied Biosystems公司);FR980凝膠成像儀(上海復日科技儀器有限公司);DHP-9162恒溫培養箱(太倉市科技器械廠)。
1.2 方法
1.2.1 病原菌分離與培養:黃蜀葵發病植株2013年采自于江蘇省宜興市黃蜀葵栽培基地。用無菌刀片分別從病灶處(J)和健康處(W)切取1~1.5cm莖段,用0.1%升汞溶液消毒20 s后,再用75%乙醇消毒1 min,再次用無菌水沖洗,在PDA培養基上恒溫(25 ℃)培養3 d。從培養的莖段組織挑取少量新生菌絲體,將初步篩選的病原菌接至PDA培養基,純化后裝入斜面培養基4 ℃保存備用。
1.2.2 致病性測定:經過初步篩選,將分離獲得的幾種備用病原菌分別接種至PDA培養基上,恒溫(25 ℃)暗培養3 d后,接種至田間生長的健康黃蜀葵幼苗莖部,接種位置距離地面 10~15 cm。接種時先用無菌接種針順著垂直地面方向劃出傷口,挑去少量備用病原菌菌絲接種至傷口部位,噴灑適量無菌水進行潤濕,平行3組實驗。田間種植的黃蜀葵接種病原菌,自然發病。接種5d后觀察發病情況。
1.2.3 病原菌形態學觀察:將致病性測定結果中的有效致病菌株在PDA培養基上恒溫(25 ℃)培養7 d,觀察菌落顏色、形態,測量菌落直徑大小變化;14 d后用顯微鏡觀察真菌分生孢子的大小,形態,隔膜數目以及產孢結構。
1.2.4 病原菌rDNA-ITS序列分析
① 基因組DNA提取:經過致病性測定,將黃蜀葵致病菌于25 ℃在PDA培養基上培養5 d后,取0.1 g菌絲體,于液氮中研磨成粉末,用Ezup柱式真菌基因組DNA抽提試劑盒提取DNA,DNA提取液直接用于PCR擴增。
② rDNA-ITS區段擴增:用真菌rDNA-ITS區段通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)擴增病原菌基因組DNA。PCR反應體系為25 μL,包括:Template(基因組DNA20~50ng/ μL)0.5 μL,10×Buffer(with Mg2+)2.5 μL,dNTP(各2.5 mM)1 μL,Taq DNA聚合酶(2.5U/ μL)0.2 μL,F(10 μM)0.5 μL,R(10 μM)0.5 μL,加雙蒸水至25 μL。PCR擴增程序為:94 ℃預變性4 min;94 ℃變性45 s,55 ℃退火45 s,72 ℃延伸1 min,30個循環;72 ℃修復延伸10 min。用1%瓊脂糖凝膠電泳對PCR擴增產物進行檢測,同時Bio-Rad 凝膠成像系統進行觀察、照相。
③ 純化及測序:在紫外等照射下切取的目的條帶,經SanPrep柱式DNA膠回收試劑盒純化后,由上海生工生物工程技術服務有限公司測序。
④ 同源性比較:測得序列經BLAST(http://www.ncbi.nlm.nih.gov/blast)與NCBI數據庫中的已知序列進行同源性比較。鑒定黃蜀葵莖枯病病原菌歸屬。
2 結果
2.1 病害癥狀描述 黃蜀葵莖枯病發病部位在其莖部。通常最先危害其莖上部,隨后向兩側擴散蔓延。發病部位莖稈干枯呈深褐至黑色,該部位及其以上部分逐漸壞死(見圖1)。發病初期:黃蜀葵莖部出現多個紫色斑點,植株直立正常;發病中期:病斑發黑擴散,發病部位皺縮,植株萎蔫、葉片呈干枯狀卷曲垂下;發病后期:植株死亡。

圖1 致病菌侵染植株3 d后發病情況Fig.1 Symptom of diseased Abelmoschus manihot (L.) after inoculation with pathogen for three days
2.2 病原菌分離情況 從發病的黃蜀葵病灶處(J)與健康處(W)分離得到的真菌中,排除J中與W一致的菌種,初步確定3種真菌J2,J5和J6為黃蜀葵莖枯病病原菌。
2.3 致病性測定 為了驗證候選病原菌的致病性,對田間種植的黃蜀葵進行接種實驗。實驗發現,J5病原菌接種3 d后,接種部位長出紫色病斑,并迅速向周圍蔓延,病株葉片呈失水狀下垂、皺縮,癥狀與田間莖枯病發病植株相同;J2、J6病原菌接種3 d后,出現紫斑,7 d后仍健康生長;對照組植株健康生長。從病灶處重新提取病原微生物,結合顯微觀察發現,此次分離獲得的菌種與原接種菌在各項形態特征上完全一致。
2.4 顯微鑒定 黃蜀葵病灶處分離得到的有效真菌J5,在PDA培養基上生長率為5.8 cm,從平板底部觀察其顏色變化,先為桃紅,后變為淺黃褐色,最后變成深棕色。具有絮狀氣生菌絲,產孢。從培養基上挑取少量菌絲,鏡檢發現大量分生孢子和分生孢子梗。大分生孢子鐮刀形,具有一個逐漸變窄的頂細胞和小梗樣的足細胞,略微向內彎曲,4~7個薄而清晰的分隔(5~7個占多數);厚垣孢子成鏈或成結。根據病原菌形態特征觀察,參考Booth[5]的《鐮刀菌屬》一書,初步鑒定黃蜀葵病原菌為木賊鐮刀菌(Fusariumequiseti)。
2.5 病原菌分子鑒定 J5病原菌基因組DNA經通用引物ITS1-ITS4擴增,得到長度為524 bp的擴增條帶(見圖2、圖3)。通過與已知序列同源性比較發現,擴增條帶的核苷酸序列與GenBank中Fusariumequiseti的ITS序列(登錄號:KJ412501、JQ690085、AB425996、KM246255和KM111481)同源性最高,達到了100%。綜合致病性測定、形態學特征觀察以及ITS結果分析,最終確認本研究分離的黃蜀葵莖枯病病原菌為木賊鐮刀菌(Fusariumequiseti)。
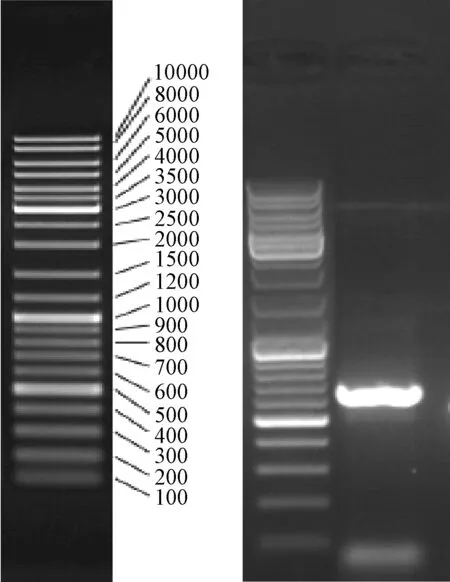
圖2 引物ITS1和ITS4擴增的凝膠電泳條帶Fig.2 Agarose gel electrophoresis of ITS region amplified by primers ITS1 and ITS4

圖3 ITS1和ITS4擴增的核苷序列表達Fig.3 Presentation of ITS sequences that amplified by ITS1 and ITS4
3 討論
本文描述的黃蜀葵莖部病害癥狀與易茜茜等[6]對荊芥莖枯病的發病癥狀的描述基本一致。本課題組在進一步研究及查閱文獻后[7-8]認為,黃蜀葵的該發病現象應稱之為“莖枯病”。
迄今,并未有關于黃蜀葵莖枯病的文獻報道。僅僅通過形態觀察將鐮刀菌菌株鑒別到種,對于非微生物學、非分類學專業的初學者來說存在很大的難度[9]。近年來,利用特異性PCR、特征DNA序列等分子技術輔助鑒定鐮刀菌的方法已經被廣泛應用[10]。本研究根據病原菌形態學特征初步鑒定到種,按照同源性比較結果,及致病性測定結果最終確定了黃蜀葵莖枯病病原菌為木賊鐮刀菌Fusariumequiseti。
本研究所采集的病樣中分離后進行反接種,同時有3種菌種使健康植株發生變化。其中分離的J5木賊鐮刀菌Fusariumequiseti接種到健康的黃蜀葵植株7 d后發黑萎蔫枯死,這與黃蜀葵莖枯病田間自然發病現象相同;同時分離得到的J2曲霉菌Aspergillus以及J6煙管菌Bjerkandera(同樣通過rDNA-ITS測序方式確定的種類)雖然能引起健康植株的葉片出現紫紅色斑紋,但發病現象緩慢,未能致死健康植株,這與黃蜀葵田間發病規律不符。綜上,可推斷出曲霉菌以及煙管菌并非黃蜀葵莖枯病的病原菌,而是其發病部位滋長的腐生真菌。但具體侵染過程及相對病害的影響有待進一步研究。
本研究初步確定了江蘇省宜興市黃蜀葵莖枯病的致病菌,對于研究莖枯病相關病害的流行規律及治理方法具有重要意義,同時為鐮刀菌引起的相關病害的防止奠定了一定的基礎。進一步的研究將致力于木賊鐮刀菌Fusariumequiseti的生理活性、致病力及殺菌劑敏感性等方面,為相關病害的綜合治理提供依據。
[1] 國家藥典委員會.中國藥典[S].一部.2010:287.
[2] 劉爽,江蔚新,吳斌.黃蜀葵化學成分及藥理活性研究進展[J].中國現代中藥,2010,12(8):5-9.
[3] 陳岱.黃葵膠囊治療慢性腎炎療效觀察[J].中國中西醫結合腎病雜志,2001,2(5):299-230.
[4] 徐錫蘭,鄔嘉琛,黃啟金.黃蜀葵花膠囊治療慢性腎炎濕熱證43例[J].山東中醫藥大學學報,2000,24(5):345-347.
[5] Booth C(Translated by Chen QY).Fusarium genus(in Chinese)[M].Beijing:Agriculture Press,1988.
[6] 易茜茜,張爭,丁萬龍,等.荊芥莖枯病病原菌的分離與鑒定[J].植物病理學報,2010,40(5):530-533.
[7] 佘小漫,何自福,羅方芳.廣東廣藿香青枯病病原菌鑒定[J].植物病理學報,2012,42(6):569-576.
[8] 楊迎青,李湘民,孟凡,等.蘆筍莖枯病抗性鑒定方法的建立及蘆筍抗病種質資源的篩選[J].植物病理學報,2012,42(6):649-654.
[9] 呂國忠,趙志慧,孫曉東,等.串珠鐮孢菌種名的廢棄及其與藤倉赤霉復合種的關系[J].菌物學報,2010,29(1):143-151.
[10] Hsuan HM,Salleh B,Zakaria L.Molecular identification of Fusarium species in Gibberella fujikuroi species complex from rice,sugarcane and maize from Peninsular Malaysia [J].Int J Mol Sci,2011,12(10):6722-6732.
(編校:王儼儼)
Isolation and identification of pathogen causing stem blight disease onAbelmoschusmanihot(L.) Medic
XIA Min-yuan1, ZHANG Yu1Δ, SHEN Xiao-lin2, QIN Jun2, MIAO Yi-jun1, TAN Xian-he1
(1.School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China; 2.SZYY Group Pharmaceutical Limited, Jiangyan 225500, China)
ObjectiveTo isolation and identify the pathogen of stem blight of Malvaceae.MethodsThe stems were collected from stem blight-diseased plants (J) and healthy ones (W) ofAbelmoschusmanihot(L.) Medic.in Yixing City of Jiangsu Province then cultured to isolate newborn mycelium.The pathogen isolated but unidentified were inoculated in stems of healthy plants ofAbelmoschusmanihot(L.) Medic.and pathogenicity was verified.Finally, the pathogenic specie(s) was or were identified by morphological characteristic, rDNA-ITS analysis and polymerase chain reaction (PCR) method.ResultsThe same fungus were excluded which were the same species in J and W, the three fungus of J2, J5 and J6 were acquired.J5 was preliminarily identified to have pathogenicity and it wasFusariumequisetiunder the microscope.The genome DNA of J5 was amplified to a length of 524bp, and homology highly withFusariumequiseti(100%).ConclusionThe pathogen was identified asFusariumequiseti.
Abelmoschusmanihot(L.) Medic.; stem blight; pathogen;Fusariumequiseti
江蘇高校優勢學科南京中醫藥大學中藥學學科開放研究課題(2011ZYX6-014)
夏敏媛,女,碩士在讀,研究方向:中藥資源生產研究,E-mail:xia2299@qq.com;張瑜,通訊作者,女,研究員,碩士生導師,副教授,研究方向:中藥資源生產研究,E-mail:catyuer@163.com。
S435.67
A
1005-1678(2015)09-0012-03

