一株植物乳桿菌產苯乳酸特性的研究
鄧 林,劉延嶺(四川工商職業技術學院,四川都江堰611830)
一株植物乳桿菌產苯乳酸特性的研究
鄧林,劉延嶺
(四川工商職業技術學院,四川都江堰611830)
摘要:研究了一株植物乳桿菌DL-13產苯乳酸特性,通過反相液相色譜對發酵產物進行了鑒定。結果表明:DL-13能還原苯丙酮酸生成苯乳酸,最佳發酵條件為:溫度36℃,初始培養pH 7.0,苯丙酮酸濃度10 g/L,搖瓶轉速為100 r/min。在此條件下24 h時獲得最大苯乳酸含量為3.86 g/L,轉化率達到38.6%。DL-13對其他底物如苯丙氨酸、苯丙酮酸鈉、苯丙酮酸銨、苯丙酮酸鈣等都具有一定的發酵能力。
關鍵詞:植物乳桿菌;苯乳酸;苯丙酮酸;特性
植物乳桿菌(Lactobacillus plantarum)是乳酸菌的一種,常存在于發酵的蔬菜和果汁中[1]。作為人體胃腸道的益生菌群,具有調節腸道內菌群的平衡、提高機體免疫力、促進營養物質吸收和降低膽固醇水平等保健作用[1-3]。除此之外,植物乳桿菌在發酵肉制品、發酵植物性食品等食品工業中應用也十分廣泛[4]。
苯乳酸(phenyllactic acid,PLA),也稱3-苯基乳酸或2-羥基-3-苯基丙酸,存在于天然蜂蜜中[5-6]。近年來研究發現,苯乳酸作為天然抑菌物質,可以抑制腐敗菌、致病菌,特別是對真菌的感染,有望在未來成為一種新型的防腐劑應用于食品工業及藥物制劑[7]。
在前期試驗中,研究了植物乳桿菌Lactobacillus plantarum DL-13的分離、鑒定。本試驗以其為出發菌株,研究了其產苯乳酸的特性,以期為進一步的菌種馴化選育及工業化發酵生產苯乳酸奠定理論基礎。
1 材料與方法
1.1材料與試劑
1.1.1菌株
植物乳桿菌Lactobacillus plantarum DL-13:由我院食品生物技術實驗室篩選并保藏。
1.1.2試劑
苯乳酸:美國Sigma公司。其他試劑均為分析純:成都金山化學試劑有限公司。
1.1.3培養基
斜面培養基(MRS):蛋白胨10.0 g,牛肉膏10.0 g,酵母膏5.0 g,檸檬酸氫二銨2.0 g,葡萄糖20.0 g,吐溫-80 1.0 mL,乙酸鈉5.0 g,磷酸氫二鉀2.0 g,硫酸鎂0.58 g,硫酸錳0.25 g,瓊脂18.0 g,蒸餾水1 000 mL,pH 6.2~6.6。
種子培養基:液體MRS培養基。
發酵培養基:蛋白胨10.0 g,牛肉膏10.0 g,酵母膏5.0 g,檸檬酸氫二銨2.0 g,葡萄糖10.0 g,苯丙酮酸10.0 g,吐溫-80 5.0 mL,乙酸鈉5.0 g,磷酸氫二鉀2.0 g,硫酸鎂 0.58 g,硫酸錳0.25 g,瓊脂18.0 g,蒸餾水1 000 mL,pH 6.2~6.4。
1.2儀器與設備
DYZ-160P型恒溫振蕩培養箱:上海德洋意邦儀器有限公司;721型分光光度計:上海精密科學儀器有限公司;Agilent 1100型高效液相色譜儀、Agilent Zorbax SB-C18 USP L1分析柱(4.6 mm×150 mm,5 μm):美國Agilent公司。
1.3方法
1.3.1菌體生長量的測定
采用離心干重法[7]。取發酵液100 mL,6 500 r/min離心10 min,用PBS磷酸緩沖液(pH=7.4)洗滌3次,105℃干燥至恒重后稱重。
1.3.2還原糖的測定
采用DNS(3,5-二硝基水楊酸)法測定發酵液中的還原糖(以葡萄糖計)[8]。取3 mL DNS試劑加到1 mL離心過的發酵液中,混勻,于熱水浴中加熱15 min后迅速冷卻至室溫。加水定容至25 mL,充分混勻后于520 nm處測定吸光度。同時做標準曲線。
1.3.3苯乳酸合成過程的分析
在裝液量為25 mL的250 mL錐形瓶中進行實驗,發酵24 h后進行分析,分別考察溫度、初始培養pH、苯丙酮酸濃度和搖瓶轉速對菌株DL-13合成苯乳酸的影響。
每隔2小時取一次樣,測定苯丙酮酸在苯乳酸產生過程中的變化情況。采用反相高效相色譜對苯丙酮酸分解前后的組成成分進行分析、鑒定。
反相高效液相色譜法條件為:流動相A為0.5g/L三氟乙酸溶液,B為乙腈溶液,洗脫程序是0~20 min為10%~100%B,20min~23min保持100%B。檢測波長為210 nm,柱溫30℃;流速1 mL/min,進樣量10 μL[9-10]。
2 結果與討論
2.1菌株DL-13的培養過程
菌株DL-13于36℃、初始培養pH 6.4,搖瓶轉速為150 r/min條件下,在發酵培養基上培養的過程參數見圖1。
菌株在培養基中生長良好,當培養基中葡萄糖在22 h左右徹底耗盡后,菌體干重達到最大值4.8 g/L。在培養過程中,pH在前2 h有稍微上升,接著逐漸下降,在12 h時降至6.0,最后降至4.3。
2.2發酵產物的鑒定
李興峰等研究發現[10]:在乳酸菌利用苯丙氨酸合成苯乳酸的過程中,轉氨反應是限速步驟,成為苯乳酸產生的瓶頸,可以采用苯丙酮酸代替苯丙氨酸作為底物合成苯乳酸。本試驗采用苯丙酮酸作為底物,使用反相高效相色譜對苯丙酮酸分解前后的組成成分進行分析、鑒定。結果表明,苯丙酮酸在菌株DL-13的生長代謝過程中,通過合成苯乳酸的途徑進行分解。
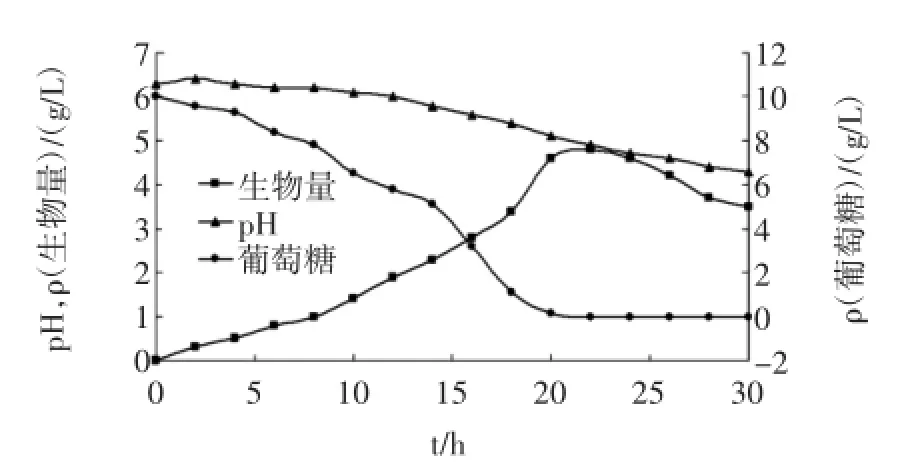
圖1 菌株DL-13的培養過程Fig.1 Time course of strain DL-13
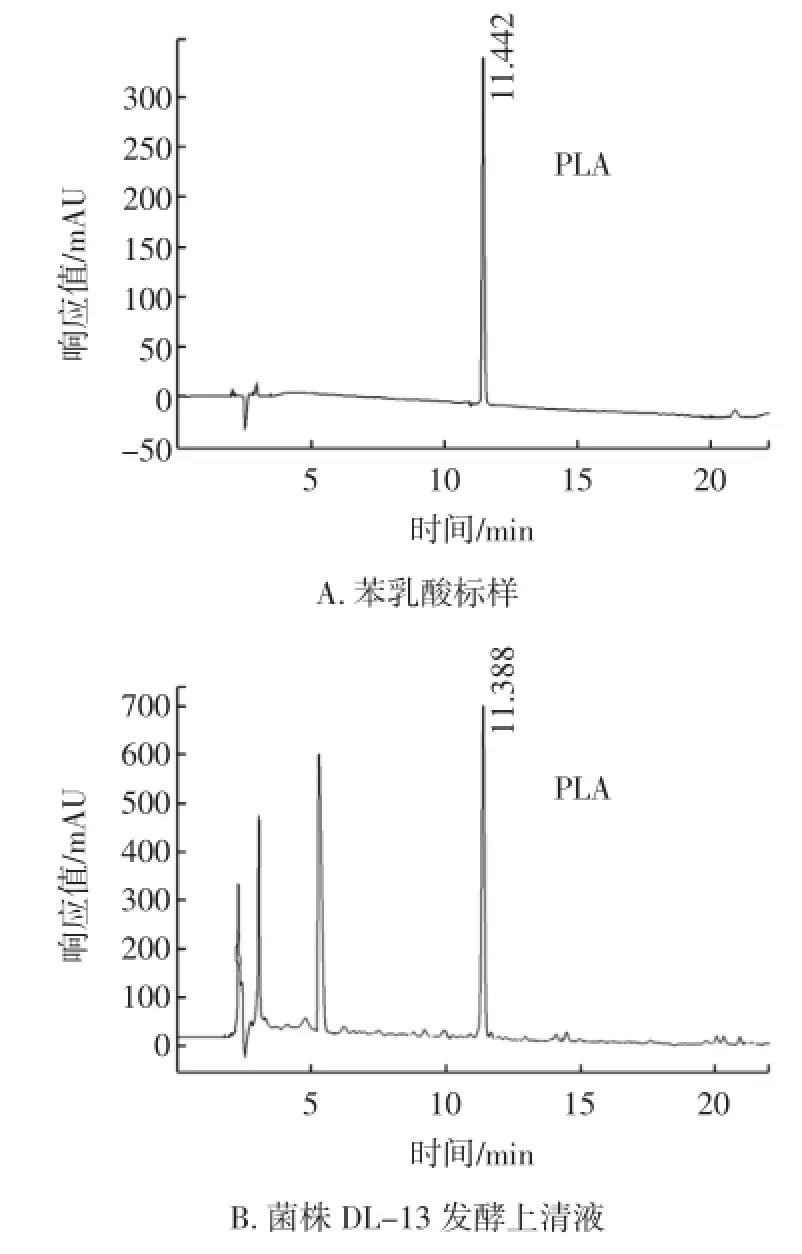
圖2 菌株DL-13發酵上清液的HPLC圖譜Fig.2 Chromatograms of strain DL-13 culture medium supernatant
2.3菌株DL-13的苯乳酸合成特性
2.3.1溫度對菌株DL-13合成苯乳酸的影響
培養溫度對菌株DL-13合成苯乳酸的影響見圖3。
由于乳酸菌為中溫菌,目前乳酸菌利用苯丙酮酸發酵合成苯乳酸的反應都選擇在30℃~37℃左右進行[11]。可以看出,菌株DL-13合成苯乳酸的最佳溫度為36℃左右,此時轉化率為38.0%,高于或低于此溫度,轉化率都有所降低,這與其他報道相符[11-12]。并且在高于37℃后,轉化率急速下降。說明苯丙酮酸的分解和苯乳酸的生成與溫度具有相關性。低于36℃時,隨著溫度的升高,相關酶的活性增強,有利于苯乳酸的生成;而過高的溫度又會導致酶的變性失活,使合成效率大大降低。因此確定最佳發酵溫度為36℃。
2.3.2初始培養pH對菌株DL-13合成苯乳酸的影響初始培養pH對菌株DL-13合成苯乳酸的影響見圖4。
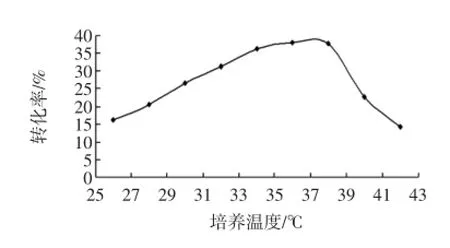
圖3 溫度對菌株DL-13合成苯乳酸的影響Fig.3 Effect of temperature on Phenyllactic acid production
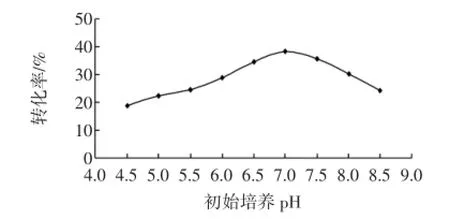
圖4 初始培養pH對菌株DL-13合成苯乳酸的影響Fig.4 Effect of initial pH on Phenyllactic acid production
由于乳酸菌的最適生長pH范圍為5.5~6.0,所以選取了pH 4.5~8.5進行培養。可以看出,菌株DL-13合成苯乳酸的最佳pH為7,此時轉化率為38.5%,高于或低于此pH,轉化率都有所降低,這與其他報道一致[12]。并且在4.5~7的pH范圍內,轉化率緩慢增加,說明菌株DL-13耐酸性較強。因此確定最佳初始培養pH為7.0。
2.3.3底物苯丙酮酸濃度對菌株DL-13合成苯乳酸的影響
在菌株DL-13合成苯乳酸的過程中,底物苯丙酮酸一方面可以通過轉氨反應生成苯丙氨酸,一方面又可以通過還原反應生成苯乳酸[13]。為了實現最大的苯乳酸得率,確定底物苯丙酮酸的最適添加濃度,在添加了不同苯丙酮酸濃度的MRS液體培養基中對菌株DL-13進行培養,24 h后檢測發酵液中苯乳酸的含量和轉化率,結果如圖5所示。
至10 g/L時,苯乳酸含量隨之增加至3.80 g/L,最大得率為38.0%。但隨后,雖然苯乳酸含量變化不明顯,由于底物苯丙酮酸濃度的增加,導致轉化率迅速降低。這可能由于參與相關反應的酶已經飽和,增加苯丙酮酸的濃度已無意義,因此確定苯丙酮酸在發酵培養基中的添加量為10 g/L。
2.3.4搖瓶轉速對菌株DL-13合成苯乳酸的影響
乳酸菌是一種兼性厭氧菌,在有氧或無氧環境中均能生長繁殖。可在有氧(O2)或缺氧條件下,可通過不同的氧化方式獲得能量,兼有需氧呼吸和無氧發酵兩種功能。故在研究兼性厭氧菌發酵時,可根據所需選擇通氧量以獲得相應結果[14]。搖瓶轉速對菌株DL-13合成苯乳酸的影響見圖6。
圖5 苯丙酮酸濃度對菌株DL-13合成苯乳酸的影響Fig.5 Effect of phenylpyruvic acid concentration on Phenyllactic acid production

圖6 搖瓶轉速對菌株DL-13合成苯乳酸的影響Fig.6 Effect of rotation speed on Phenyllactic acid production
可以看出,靜止培養也能獲得較大的生物量和苯乳酸含量,但是隨著搖瓶轉速的增加,50 r/min時,能獲得最大的生物量4.5 g/L,100 r/min時,能獲得最大的苯乳酸產量3.78 g/L。這可能是由于兼性厭氧菌在有氧的環境下進行有氧呼吸大量繁殖,在無氧的環境下進行無氧呼吸一般不繁殖而進行發酵。綜合分析,選擇100 r/min搖瓶轉速進行培養。
2.3.5DL-13轉化苯丙酮酸生成苯乳酸的過程
菌株DL-13于36℃,初始培養pH7.0,苯丙酮酸濃度10 g/L,搖瓶轉速為100 r/min條件下,轉化苯丙酮酸生成苯乳酸的過程見圖7。
從圖7可知,培養4 h左右即有苯乳酸產生,8 h后快速增加,至24 h時達到最大,含量為3.86 g/L,此后逐漸下降。為了獲得最大得率,應在24 h時停止培養并分離發酵產物。苯丙酮酸轉化為苯乳酸的得率為38.6%。此外,苯乳酸產生的過程中還有少量的苯丙氨酸生成,且在24 h左右達到最大值。可以看出,苯丙氨酸與苯乳酸的合成大致一致。
2.4菌株DL-13對其他底物的利用實驗
有文獻表明[15],乳桿菌可以以苯丙氨酸、苯丙酮酸、苯丙酮酸鈉、苯丙酮酸銨、苯丙酮酸鈣等作為底物,發酵代謝合成苯乳酸。在36℃、初始培養pH 6.4,搖瓶轉速為150 r/min條件下的條件下,選取了數種具有代表性的底物進行考察,研究菌株對這些化合物的利用情況。結果見表1。

圖7 菌株DL-13轉化苯丙酮酸生成苯乳酸的過程Fig.7 Phenyllactic acid production from phenylpyruvic acid by strain DL-13

表1 菌株DL-13對其他底物的利用Table 1 Utilization of other substrats by strain DL-13
可以看出,除了苯丙酮酸鈣外,其他形式的底物轉化率都達到了25%以上,且以苯丙酮酸銨的轉化率最高,為32.0%。這可能是由于鈣鹽的溶解性較差所致。
3 結論
通過對菌株DL-13的苯乳酸合成特性進行研究,發現苯丙酮酸在菌株DL-13的生長代謝過程中,通過合成苯乳酸的途徑進行分解。在發酵過程中,溫度、pH、底物苯丙酮酸的濃度及搖瓶轉速對苯丙酮酸轉化和苯乳酸的合成都具有較大影響。
菌株DL-13實驗室搖瓶條件下利用苯丙酮酸合成苯乳酸的最佳條件是溫度36℃,初始培養pH 7.0,苯丙酮酸濃度10 g/L,搖瓶轉速為100 r/min,在此條件下24 h時獲得最大苯乳酸含量,為3.86 g/L,苯丙酮酸轉化為苯乳酸的得率為38.6%。
研究還發現菌株DL-13對其他底物如苯丙氨酸、苯丙酮酸鈉、苯丙酮酸銨、苯丙酮酸鈣等都具有一定的發酵代謝能力,表明其在發酵生產苯乳酸方面具有很好的應用價值。
參考文獻:
[1]Dieuleveux V,Lemarinier S,Gueguen M.Antimicrobial spectrum and target site of D-3-pheyllactic acid[J].International Journal of Food Microbiology,1998,40(3):177-183
[2]Magnusson J,Strom K,Roos S,et al.Broad and complex antifungal activity among environmental isolates of lactic acid bacteria[J].FEMS Microbiology Letters,2003,219(1):129-135
[3]Dieuleveux V,der Van P,Chataud J,et al.Purification and characterization of anti-Listeria compounds produced by Geotrichum candidum[J].Applied and Environmental Microbology,1998,64(2):800-803
[4]Lavermicocca P,Valerio F,Evidente A,et al Purification and characterization of novel antifungal compounds from the sourdough Lactobacillus plantarum strain 21B[J].Applied and Environmental Microbology,2000,66(9):4084-4090
[5]Schnurer J,Magnusson J.Antifungal lactic acid bacteria as biopreservatives[J].Trends in Food Science and Technology,2005,16(1/3):70-78
[6]Strom K,Sjogren J,Broberg A,et al.Lactobacillus plantarum MiLAB 393 produceds the antifungal cycle dipeptides cyclo(L-Phe-L-Pro) and cyclo(L-Phe-trans-4-OH-L-Pro)and 3-phenyllactic acid[J]. Applied and Environmental Microbiology,2002,68(9):4322-4327
[7]錢存柔,黃儀秀微生物學實驗教程[M].北京:北京大學出版社, 1999
[8]諸葛健,王正祥.工業微生物實驗技術手冊[M].北京:中國輕工業出版社,1994
[9] 劉長建,劉秋,姜波,等.產苯乳酸乳酸菌的篩選鑒定[J].食品工業科技,2012,33(21):192-195
[10]李興峰.乳桿菌生物合成苯乳酸的研究[D].江蘇:江南大學,2008
[11]李世龍.傳統發酵食品中高產苯乳酸菌株的篩選及發酵工藝條件優化[D].大慶:黑龍江八一農墾大學,2012
[12]Brunhuber N M,Thoden J B,Blanchard J S,et al.Rhodococcus L-phenylalanine dehydrogenase:kinetics,mechanism,and structural basis for catalytic specificity[J].Biochemistry,2000,39(31):9174-9187
[13]Tanous C,Gori A,Rijnen L,et al.Pathways for alpha-ketoglutarate formation by Lactococcus lactis and their role in amino acid catabolism[J].International Dairy Journal,2005,15:759-770
[14]馬春麗,張蘭威.高產酸性能乳酸菌的誘變選育[J].中國乳品工業,2010,38(7):15-16
[15]Yong Leng,Pu Zheng,Zhihao Sun.Continuous production of L-phenylalanine from phenylpyruvic acid and L-aspartic acid by immobilized recombinant Escherichia coli SW0209-52[J].Process Biochemistry,2006,41:1669-1672
DOI:10.3969/j.issn.1005-6521.2015.20.043
收稿日期:2015-05-04
基金項目:四川省教育廳課題(13ZB0364)
作者簡介:鄧林(1977—),女(漢),副教授,碩士研究生,研究方向:食品生物技術。
Study on Phenyllactic Acid Production Characteristics of Lactobacillus Plantarum
DENG Lin,LIU Yan-ling
(Sichuan Technology and Business College,Dujiangyan 611830,Sichuan,China)
Abstract:Phenyllactic acid production characteristics of Lactobacillus plantarum DL-13 was studied.The production of fermentation was identified by HPLC.The results showed that phenylpyruvic acid was reduced by strainDL-13intophenyllacticacid3.86g/Lphenyllactic acid content was received after culturing DL-13 24 hours under the optimal fermentation condition:temperature 36℃,initial pH 7.0,phenylpyruvic acid content 10 g/L and shaking speed 100 r/min.The conversion rate was 38.6%.DL-13 could also ferment other substrates such as phenylalanine,sodium phenylpyruvate,phenylpyruvic acid ammoniumand calcium phenylpyruvate.
Key words:Lactobacillus plantarum;phenyllactic acid;phenylpyruvic acid;characteristic

