利用EBV轉化單板滑雪U型場地運動員外周B淋巴細胞建立永生化細胞株的研究
趙玉華++劉宇++趙晨瓊++朱寶峰++劉冬
摘要:運動基因資源作為人類遺傳資源的一部分,為優秀運動員的選拔提供遺傳證據。本研究以我國優秀單板滑雪U型場地運動員為實驗對象,通過轉化由B958細胞培養得到EBV,運用懸浮培養法,提取及保存優秀運動員基因組DNA,成功建立了運動員外周血B細胞永生細胞庫,永久保存了我國該項目優秀運動員遺傳資源,為以后該項目優秀運動員運動基因的相關研究提供實驗材料,為其它雪上項目優秀運動員的永生細胞庫的建立提供了理論支持。
關鍵詞:單板滑雪U型場地運動員;永生化;細胞體外培養
中圖分類號:G804 文獻標識碼:A 文章編號:1008-2808(2015) 02-0083-04Abstract:Movement of genetic resources is the part of the human genetic resources, geneticevidence for excellent athletes' selection. This study to our country outstanding athlete snow-boarding halfpipe ground as experimental object, through the transformation from EBV B958cell culture, using the method of suspension culture, extraction and preserve the genomicDNA of excellent athletes, athletes successfully established peripheral B cells immortality li-brary, permanent saved the project the genetic resources of excellent athletes in our country,for the project of excellent athletes sport gene related research provides experimental materi-als, excellent athletes for other snow project of building provides the theoretical support ofthe living cell bank.
Key words:Snowboarding halfpipe athletes; Immortalization, Cells invitro
隨著人類基因組計劃的完成和分子生物學技術的快速發展,人們越來越重視遺傳資源的保存,特別是人類遺傳資源的保存[1]。人類遺傳資源是指含有人體基因組、基因及其產物的器官、組織、細胞、血液、制備物、重組脫氧核糖核酸(DNA)構建體等遺傳材料及相關的信息資料。運動基因遺傳資源作為人類遺傳資源的一部分,為優秀運動員的選拔提供遺傳證據。運動基因遺傳資源與運動能力的開發有著密切的聯系[2],血管緊張素I轉化酶(ACE)是決定人體有氧耐力素質的關鍵因素之一,影響人體有氧耐力素質的最佳水平,同時影響人體對耐力訓練的敏感度[3]。對人體生理特性的研究顯示[4],部分運動相關基因如ACTN3基因多態性與肌肉質量和力量相關聯,隨著人類基因組計劃的完善,越來越多的運動基因被發現,對其功能的研究也將更加深入[5]。
運動員群體有別于普通大眾的群體,優秀運動員的運動基因更是非常珍貴。我國已經采集優秀運動員劉翔和姚明的遺傳資源,即便這些優秀運動員以后退役,科研人員還是可以根據他們保存下來的遺傳資源進行研究。隨著北京申辦2022年冬奧會,冬季項目在競技體育中地位將顯著提升,更多的科研力量將匯聚于冬季項目的研究。根據單板滑雪U型場地技巧(以下簡稱U型槽)在國際和國內的發展趨勢,該項目必然會成為我國冬季雪上項目的優勢項目,尤其該項目現役優秀運動員是這個項目發展的第一代運動員,如蔡雪桐、劉佳宇、李爽、史萬成等運動員先后在世界杯、世錦賽都獲得冠軍,也有望沖擊冬奧會的獎牌,將這些運動員的運動基因保存下來為未來研究該項目將具有重要意義。本研究將用EBV病毒轉化B淋巴細胞使之成為永生化細胞株,建立U型槽運動員的永生細胞庫,保存U型槽優秀運動員的運動基因,為該項目運動員的基因選材,運動能力的開發提供科學和現實依據,為我國其它雪上項目運動員保存和建立永生化細胞提供理論技術基礎,為構建我國冬季項目優秀運動員基因庫貢獻一份力量。
1 實驗對象與方法
1.1 實驗對象
我國優秀U型槽運動員20人,10名男運動員,10名女運動員,包括獲得世錦賽冠軍的女運動員蔡雪桐以及優秀運動員李爽、劉佳宇、史萬成等,所有運動員均為國家一級運動員。
1.2 主要試劑
1N NaOH(4℃保存備用),1N Hepes(4℃保存備用),0.2M L-Giutamine(-20℃保存備用),RP-MI1640基礎培養基(4℃保存備用),RPMI1640全培養基(4℃保存備用),95%FBS+5%DMSO凍存液,CyA的制備(-20℃保存備用),血清的滅活,PHA的制備(-20℃保存備用),含PHA的RP-MI1640全培養基(4℃保存備用),B958原代細胞株(中科院遺傳與發育所饋贈)。
1.3 主要的儀器及設備
DL-CJ-2N高性能無菌實驗臺(中國哈爾濱東聯電子技術開發有限公司),TDL-40B水平離心機,IX-71倒置相差顯微鏡,AR1530/C電子天平,37.5℃5%CO,培養箱(德國Heraeus公司),電熱恒溫水浴鍋,Pall超純水儀,血球計數板,液氮貯存器,超低溫冰箱,電動移液器,培養板。endprint
1.4 實驗方法
1.4.1 EBV的制備在40℃水浴鍋中解凍凍存的B958細胞。將解凍的B958細胞移至裝有6mlRPMI1640全培養基的25?培養瓶中,放在37.5℃、5%CO?,培養箱中培養。培養基顏色變成褐黃色時,補充等量的新鮮培養基,繼續培養。當細胞達到約3×105/瓶時,可進行傳代。將細胞充分搖勻后,等量分別裝于2個25?培養瓶內,并向瓶內添加適量新鮮培養基,繼續培養。凍存細胞前1天,向培養瓶中加入適量的新鮮培養基;用15ml離心管收集B958細胞,在常溫下離心(1500rpm)15min,去上清;用凍存液重懸細胞,調整細胞密度為1×106-3×106細胞/ml,以1ml/管將細胞懸液分裝于凍存管中;將凍存管置于冰箱(4℃)30min,放人裝有異丙醇的程序降溫盒中于-80℃冰箱過夜,投入液氮罐內長期保存。將EBV溶液置于- 80℃冰箱lOmin,隨后用37℃水浴凍融,反復操作3次。1800rpm離心15min,用0.22μm濾膜過濾,分裝后用-80℃保存備用。
1.4.2 轉化實驗 用帶有肝素鈉的一次性抽血管,抽取運動員靜脈血4ml/人(血樣常溫靜止放置1~2天)。用加1%的雙抗RPMI1640基礎培養基,稀釋運動員血液,淋巴細胞分離液預熱(37.5℃水浴鍋),沿管壁漸漸加入4ml淋巴細胞分離液,3000rpm離心10min,使血液分層。將血清下層、紅細胞上層的成楊絮狀的白膜層,用巴氏管移人裝有6ml RPMI1640培養基的離心管中,lOOOrpm離心10min。棄上清液,加入10ml RP-MI1640培養基,1000rm離心10min,棄上清液。重復一次后,棄去上清液,將細胞敲勻待用;將2ml含PHA的全培養基、1.4ml EB病毒、0.4ml CyA以及收集到的白細胞做成混合液,共約4ml;將混合液加入到24孔培養板中,每孔1ml,將24孔培養板置于37.5℃,5%CO,培養箱中培養。
1.4.3 永生化細胞系的培養及凍存永生化細胞從24孔板轉移到25m2的培養瓶中繼續培養;3~4天進行一次半量換液,每次半量換液就是一次細胞傳代。細胞的凍存,收集細胞懸液,1000rm離心lOmin,棄上清。在離心管中放人預定量的凍存液,將細胞輕輕打勻,調整細胞密度為1×106/ml~3×l06/ml,將凍存液分別放到凍存管中,每管1ml。將凍存管放在4℃冰箱30mim,然后于- 80℃的冰箱內過夜后,放人液氮罐中保存。
2 實驗結果
EBV轉化后的淋巴細胞體外培養穩定,成功建立U型槽運動員永生化細胞庫。傳代培養的淋巴細胞生長速度要快于轉化后原代培養的淋巴細胞,一般3~4天傳代。細胞呈形態個分散或者較小的細胞團狀,細胞密度底,在顯微鏡下細胞折光性強。培養3天左右,單個淋巴細胞或較小的淋巴細胞團能聚集生長成較大的淋巴細胞團,細胞密度達到70%~80%;肉眼能見到細沙粒狀物鋪滿培養瓶底部,輕輕搖動培養瓶,就會上浮,培養基的顏色從最初的粉色變為黃色,PH值基本不變;在顯微鏡下能看到細胞團有“長根”“長毛”“分刺叉”的現象,細胞團發育良好。在傳代培養過程中,細胞形態一致,各代次淋巴細胞增殖速度穩定,沒有發現隨著傳代次數的增加而出現淋巴細胞衰老、死亡等現象。
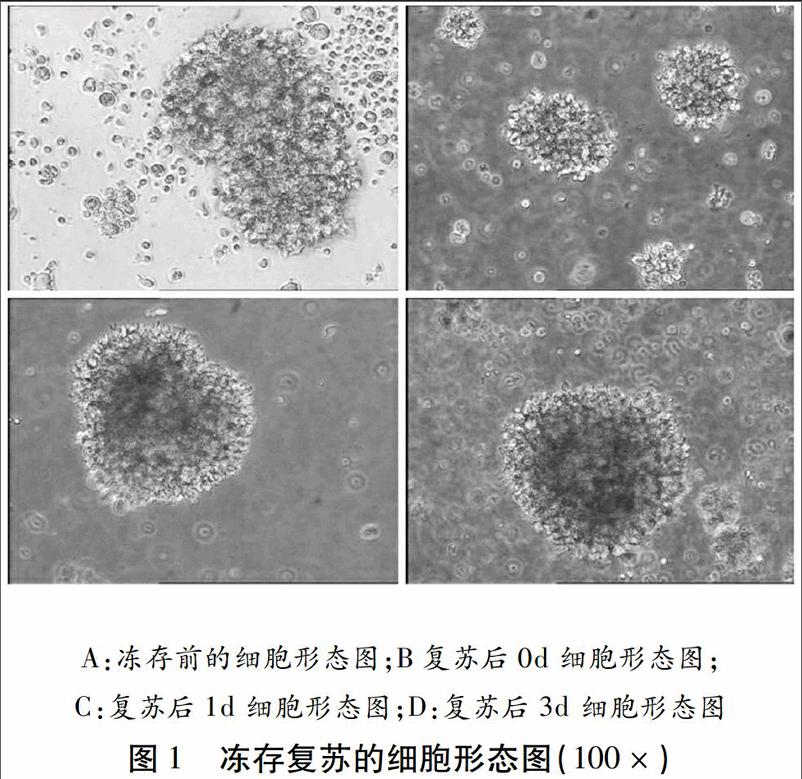
當淋巴細胞團體積增大,細胞的密度達到1×106/ml的時進行凍存(圖1A);剛復蘇的淋巴細胞部分呈較小的團狀,部分呈單個分散狀(圖1B);培養1天后,淋巴細胞增殖迅速,細胞團體積明顯增大(圖1C);培養3天后,形成的細胞團數量大量增加,體積較大,顯微鏡下能發現葡萄球串狀細胞團,折光性強,密度可達70%~80%,可進行傳代(圖1D)。
3 討論
在實踐中,EBV轉化B淋巴細胞使其永生化已有諸多應用,如楊靜[6]、褚嘉祐[7]等。永生細胞株的建立能永久保存優秀運動員的基因,討論各運動項群的同異點,在各運動項群中探索抑制運動能力基因的分布、特征學意義、及建立與耐力、力量、速度性相關的項群體系細胞庫[8]、基因探針、基因興奮劑等眾多體育科研領域提供大量的細胞和遺傳物質[9],所以從發展的角度來看,建立優秀運動員的永生細胞庫必將得到越來越多的關注。
EBV來源于EBV感染的絨猴外周血淋巴細胞所產生的B958細胞系,B958細胞的培養是決定EBV質量的關鍵[10]。因此,在培養B958細胞以及轉化后的永生細胞的培養過程中,應該特別注意。
3.1 細胞污染
為了保證細胞培養T作的順利進行,第一個極為重要的環節就是防止污染[11]。因此,必須清洗與消毒培養用具,以及培養用的各種玻璃器皿(離心管、培養瓶、吸管等)都需要用清水浸泡,刷洗、酸浸和沖洗,并用6. 81kg(15LBS)高壓消毒20min等。清洗器皿必須干凈透明,無油跡,沒有任何殘留物質,如某些化學物質僅1/104mg,也可能對細胞產生毒性。
在每次操作前都要用30W紫外線管燈消毒超凈臺20~30min,用0.2010新吉爾滅擦手以及相關器皿。最后當B958細胞釋放出的EBV后,仍然需要對EBV進行一次抽濾,濾器直徑選擇0.2μm,以達到除掉細菌和支原體,避免EBV的污染。
3.2 細胞換液
B958細胞和永生化細胞大多數會懸浮在培養液中,所以在每次換液過程中,細胞培養瓶從培養箱中轉移到無菌操作臺上一定要輕拿輕放,盡可能的使細胞沉淀在瓶底,減少在培養液中的懸浮。用移液管沿培養液液面吸出變黃的培養液;最后再將需要的新鮮培養液用移液管注入培養瓶中。細胞培養是系統化過程,根據細胞生長的情況來安排,一般每周對細胞進行2次換液,保證充足的營養。在凍存細胞的前一天,要進行少量換液,保證凍存時有足夠的營養物質消耗。
3.3 溫度
B958細胞和永生化細胞培養的最適溫度是37.5℃,溫度過高或過低都會影響細胞的代謝與生長,甚至導致細胞的死亡[12]。雖然細胞在5%CO2、37.5℃培養箱中培養,在由于在實驗過程中要進行培養箱外進行觀察、傳代、凍存等操作,因此要求培養箱內外溫差不能過大,細胞離開培養箱時間不能過久,如無菌操作臺,倒置顯微鏡等常用儀器和培養箱的距離盡量接近,可減少細胞污染的幾率。endprint
3.4 血清的使用
血清是B958細胞的培養的重要因素之一。在使用血清前先用56℃熱滅活30min,消除皿清中原有活性因子。一般血清過多對其生長沒有好處,因此用低濃度的血清培養液,盡量使培養條件標準化,實驗重復性提高,降低成本,減輕血清有害成分的影響。
在EBV對B淋巴細胞進行永生化時,須用高質量、高營養的血清為培養細胞提供營養,在多次預實驗后,GIBCO公司的美國血緣的特級胎牛血清符合要求。在成功轉化B淋巴細胞后,類淋巴母細胞數量培養到可以轉入培養瓶中,細胞降低對血清的依賴,考慮到實驗經費,采用BIOCHROMAG公司生產的德國血緣優級血清,培養效果不變。
3.5 pH值
培養液的pH值對B958細胞和EBV轉化后的淋巴細胞也是非常重要的[13],最佳生長環境是pH=7.0。在實驗中,細胞換液、傳代、凍存等過程中培養瓶會被打開,放出瓶內的C02,培養液pH值升高,一段時間后會導致細胞堿中毒。因此,實驗過程中,操作速度要快,操作完畢后最快的放人培養箱中,稍微擰開瓶蓋,繼續培養。我們用含有肝素鈉的采血管采血.也是因為肝素鈉的pH值與人類血液的pH值相近,不會影響血液中B淋巴細胞的轉化。
3.6 凍存
建立永生化基因庫的重要環節之一就是細胞凍存。細胞凍存的最佳溫度就是液氮溫度(-196℃)。因為在- 196℃時,細胞生命活動幾乎停止,而復蘇后細胞結構和功能完好。當細胞密度達到1×106/ml的時便可凍存,永生細胞株凍存與其它細胞相同,盡量在代次小時進行凍存。B958細胞與永生化細胞的凍存要慢凍速溶,先將細胞在一80 ℃冰箱中冷凍,然后移到液氮中長時間保存。
在凍存過程中,為減少二甲基亞砜對細胞的毒性,使其較快的滲入細胞內,使細胞內外產生一定的濃度差,降低細胞內外未結冰溶液中電解質的濃度,使細胞內外達到平衡起到保護作用[14]。應先將凍存管置于4℃冰箱30min,然后放人裝有異丙醇的程序降溫盒中于-80℃冰箱過夜,投入液氮罐內長期保存。
3.7 CyA的使用
在轉化細胞時CyA用量很小,但作用很大,它能夠有效地抑制T淋巴細胞自身免疫攻擊,安全轉化B細胞,同時配合PHA的使用能更好的促進B淋巴細胞的生長,切記不能過量使用,否則會對細胞造成傷害[15]。在試驗使用中,配置CyA的濃度為200μg/ml,且其物理性質呈油狀,在用槍頭吸取CyA母液時常常會附著在槍頭一部分,如果配置工作液少時就會出現CyA濃度過高的現象,影響B淋巴細胞的轉化。所以要盡可能避免槍頭附著試劑,并盡可能多的制備其工作液。
3.8 廢液的無害化處理
在從永生化細胞培養液中移出的廢液,以及接觸過永生化細胞、B958細胞和EBV病毒的儀器設備,都要經過1%濃度的PAA浸泡24h,避免留下有害物質[16]。
4 結論與建議
本研究成功的提取和保存了我國優秀的U型槽運動員基因組DNA,完成了B淋巴細胞進行轉化、培養、傳代的技術體系,永久保存了我國優秀U型槽運動員的遺傳資源,為優秀運動員基因相關研究提供實驗材料,為日后其它雪上項目優秀運動員運動基因的保存等提供理論技術基礎。對運動員的運動基因的研究將是未來發展的一個趨勢,建議盡早的建立和保存優秀運動員的運動基因,進一步補充和完善我國冬季項目優秀運動員的永生細胞庫,為冬季項目未來的發展貢獻力量。
參考文獻:
[1] 周旭東.基因保存技術研究進展[J].浙江預防醫學,2007,19(3):59-60.
[2] 常蕓,何子紅.運動能力相關基因研究進展[J].中國運動醫學雜志2002,21(2):173.
[3] 張翠蘋,張宏偉,基因工程與奧林匹克運動[J].體育學刊,2005,12(5):9-11.
[4] 李麗,趙玉華.遺傳因素在速度滑冰運動員選材中的應用[J].哈爾濱體育學院學報,2010,28 (5):20-22.
[5] 張明偉,于曉姚,郭子寬,等.體外長期培養對人骨髓間充質干細胞生物學特性的影響[J].組織工程與重建外科雜志,2005,2(1):51-53.
[6] 楊靜,唐發清.EB病毒介導的鼻咽上皮細胞永生化早期階段的生物學觀察[J].中國病理生理雜志,2000,16(10):1033.
[7] 褚嘉秸,徐玖瑾.中華民族永生細胞庫的建立[J].國際遺傳學雜志,2008,31(4):241 -247
[8] 史曉紅,楊澤,等.長壽老人永生細胞庫的建立與保存[J].中國老年學雜志,2003,2(23):74-76.
[9] 崔東紅,張偉.正常人體淋巴細cDNA文庫的構建[J].Hereditas( Beijing),2002,24(2):143-145.
[10] 楊彥春,賈駿,王捍國.細胞衰老和永生化[J].遵義醫學院學報,2002,25 (6):568-570.
[11] 王新文.人類細胞永生化的研究進展[J].牙體牙髓牙周病學雜志,2003,13 (4):233-236.
[12] 楊娜娜,王娟.細胞永生化的研究進展[J].中國畜牧獸醫,2004,32(1):37-39.
[13] Rickinson A B, Kieff E.Epstein-Barr Virus[M].In; Fields B N,Knipe D M,and HowleyP M, Fields Virology,3rd ed. Philadelphia;Lippincott-Raven Publishers,1996:2397-2446.
[14] 裴麗君.EB病毒轉化人類外周血B-淋巴細胞建立永生細胞系[J].中國生育健康雜志,2003 ,14(3):186-188.
[15] jagerM, PrangN, MittererM, et al. Pathogenesisof chronic Epstein-Barr virus infection: de-tection of a virus strain with a high rate of lyt-ic replication[J]. Br J Haematol, 1996, 95(4):626.
[16] Maruo S,Yang L,Takada K.[J].J Gen Vir-01,2001,82(Ptl0):2373-2383.endprint

