表沒食子兒茶素沒食子酸酯減輕LPS誘導新生大鼠原代神經膠質細胞損傷
龍 明,李 晶,封玉玲*,龔 明,董 志
(1.重慶三峽醫藥高等專科學校 附屬醫院 神經內科, 重慶 404120; 2.重慶醫科大學 藥學院, 重慶 400016)
?
表沒食子兒茶素沒食子酸酯減輕LPS誘導新生大鼠原代神經膠質細胞損傷
龍 明1,李 晶1,封玉玲1*,龔 明1,董 志2
(1.重慶三峽醫藥高等專科學校 附屬醫院 神經內科, 重慶 404120; 2.重慶醫科大學 藥學院, 重慶 400016)
目的觀察表沒食子兒茶素沒食子酸酯(EGCG)對細菌脂多糖 (LPS) 所致大鼠神經膠質細胞炎癥的保護作用。方法取新生乳鼠原代神經膠質細胞培養,用LPS激活小膠質細胞引起炎性反應。高效液相色譜檢測細胞興奮性/抑制氨基酸含量,用酶聯免疫吸附實驗 (ELISA) 和蛋白免疫印記試驗 (Western blot) 檢測炎性因子蛋白含量。結果LPS激活神經小膠質細胞,大幅上調TNF-α、IL- 1β及IL- 8炎性因子和升高iNOS蛋白質水平(P<0.05),EGCG明顯抑制這些炎性因子的過度產生(P<0.05),同時還顯著降低Glu和升高γ-GABA的濃度(P<0.05)。結論EGCG能減弱LPS引起的體外培養神經膠質細胞的炎性反應。
EGCG;脂多糖;炎性反應;氨基酸;神經保護
茶葉中兒茶素類化合物(catechins)表沒食子兒茶素沒食子酸酯也稱表兒茶素酸酯[(-)-epigallocatechin-3-gallate,EGCG]含量約50%~60%,具有保護神經系統、預防和治療心腦血管系統疾病等多種藥理作用[1- 2]。近年研究證實,EGCG具有抗感染等活性,如EGCG抑制脂多糖誘導人視網膜內皮細胞,發揮調節活化正常T細胞表達與分泌趨化因子的表達[3];EGCG影響了脊髓損傷大鼠炎性因子釋放及神經營養因子表達的產生,顯著降低血清IL- 6、IL- 8,增加脊髓組織NT- 3、BDNF表達[4];EGCG還能抑制TNF-α而減弱LPS誘導的肺損傷[5];EGCG還顯著減弱LPS誘導骨髓巨噬細胞促炎因子的表達[6]。EGCG對原代培養腦膠質細胞產生保護尚未見報道。本實驗利用細菌脂多糖(lipopolysaccharide,LPS)誘導大鼠神經膠質細胞急性炎性反應研究EGCG的作用機制,為進一步探討EGCG用于臨床建立理論基礎。
1 材料與方法
1.1 實驗動物
出生 1~2 d清潔級SD大鼠,[重慶醫科大學動物實驗中心,許可證號:SYXK(渝) 20022007]。
1.2 藥品及試劑
EGCG(重慶市卓諾生物技術有限公司);血清、LPS、氨基酸對照品及超氧化自由基檢測試劑盒(Sigma公司);酶聯免疫吸附試劑盒(R&D公司);一抗和二抗體(武漢博士德生物工程有限公司)。
1.3 原代膠質細胞培養及分組
乳鼠75%乙醇皮膚消毒5 min,斷頭取腦,游離皮質后剝離腦膜、血管,0.25%胰蛋白酶消化過濾,1 500 r/min離心3 min,無菌微孔濾膜過濾后10%胎牛血清培養,接種24孔板(1×105/孔)。5% CO2恒溫培養,48 h后換液,7~10 d長滿備用。實驗分組與給藥:1)空白對照組;2)LPS(10 μg/L)對照組;3)LPS(10 μg/L)+EGCG (20 μmol/L);4)LPS(10 μg/L)+EGCG(40 μmol/L);5)LPS(10 μg/L)+EGCG(80 μmol/L)。每組6孔,實驗重復5次。前期細胞培養證實DMSO濃度<0.05%對膠質細胞無明顯毒性反應,藥物EGCG采用二甲基亞砜(DMSO)溶解,所得混懸液再用DMEM培養液稀釋,配置成EGCG標準液。空白對照組細胞每孔分別加等量DMEM基礎培養基;3個給藥組培養皿加入EGCG作用24 h,對照組不加藥,最后4個組均加入LPS作用2 h。
1.4MTT比色法檢測細胞活力及胞內超氧化自由基的測定
膠質細胞以1×105/孔接種96孔板,加入MTT染色劑噻唑藍(6 mg/mL)孵育4 h,滴加DMSO,振蕩后用全自動酶標儀測定570 nm處A值并扣除空白A值;485、530 nm雙波長激發,按試劑盒操作檢測胞內超氧化自由基含量。
1.5 HPLC測定Glu/γ-GABA含量
用柱前衍生化高效液相色譜法檢測細胞外液Glu、GABA濃度的變化。精密量取細胞外液,經色譜純甲醇萃取后,10 000 r/min,離心10 min,取上清過濾。用0.22 μmol/L微孔濾膜濾過,收集,加入衍生化試劑鄰苯二甲醛、N-乙酰-L-半胱氨酸衍生化3 min后,采用高效液相色譜法進樣測定。HypersilC18色譜柱,流動相為甲醇-50 mmol/L醋酸銨緩沖液(pH 6.0),梯度洗脫,流速為1.0 mL/min,柱溫為室溫,進樣量為20 μL,熒光檢測波長為350 nm(激發波長)、450 nm(發射波長)。
1.6 炎性因子測定
酶聯免疫吸附實驗法(ELISA)按說明書操作測定細胞培養上清液TNF-α、IL- 1β和IL- 8含量變化。用裂解液處理加藥組,15 000 r/min離心20 min, 取上清,BCA法蛋白定量,蛋白免疫印跡試驗 (Western blot) 測定誘導型一氧化氮合酶(iNOS)蛋白表達情況。β-actin作為內參對照,以各組目的蛋白與內參照蛋白吸光度值的比值比較蛋白表達差異。
1.7 統計學分析
2 結果
2.1EGCG對細胞超氧化自由基和氨基酸Glu/γ-GABA含量的影響
與空白對照組比較,在LPS (10 μg/L)處理的膠質細胞培養模型中,超氧化自由基的產量顯著增加,A值明顯降低。與LPS誘導組比較,預先用EGCG (20、40和80 μmol/L)處理的細胞中超氧化自由基的產量明顯降低,抑制率逐漸增加,EGCG處理組A值與劑量呈正相關,細胞存活率顯著提高。此外,與LPS組相比,EGCG給藥組胞外液興奮性/抑制性氨基酸發生顯著變化。不同EGCG劑量給藥組均顯著降低胞外Glu水平,而胞外γ-GABA含量出現升高(表1)。
2.2不同劑量EGCG對膠質細胞炎性因子蛋白水平的影響
上清液炎性因子蛋白含量檢測結果顯示:LPS明顯刺激TNF-α、IL- 1β和IL- 8大量釋放;LPS組比較,不同濃度EGCG均能明顯減少炎性因子的表達,且這一抑制作用與EGCG濃度成正相關(表2)。
2.3 Western blot檢測蛋白表達
LPS誘導iNOS蛋白表達較對照組明顯增加;不同濃度EGCG均能夠抑制iNOS的蛋白表達(圖1)。
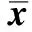
表1 EGCG對細胞超氧化自由基及氨基酸含量的影響
*P<0.05 compared with blank;#P<0.05 compared with LPS.
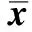
表2 EGCG對上清液中炎性因子表達水平的影響Table 2 Effect of EGCG on LPS-induced TNF-α、IL- 1β and IL- 8 expression in rat gliacyte neurons(±s, n=6)
*P<0.05 compared with blank;#P<0.05 compared with LPS.

1.blank; 2.LPS(0.01 mg/L); 3.EGCG(20 μmol/L); 4.EGCG(40 μmol/L); 5.EGCG(80 μmol/L); *P<0.05 compared with LPS
3 討論
膠質細胞的炎性反應、興奮性毒性與神經元凋亡具有很強的相關性,許多神經退行性疾病中神經膠質細胞活化及其介導的炎性反應導致了神經元凋亡和死亡。TNF-α是多種病理條件下最早產生的功能細胞因子,能刺激IL- 6、IL- 8和IL- 1β等炎性介質,增高的IL- 1β參與腦水腫的形成,血腦脊液屏障破壞并進一步誘導其他炎性介質造成神經細胞的毒性,如激活一氧化氮合酶mRNA表達增加,誘導iNOS水平及活性明顯增高,促進NO合成,血管內皮通透性增加,炎性反應加重導致細胞腫脹和死亡。大量合成釋放的TNF-α、IL- 1β及血栓素A2引起興奮性氨基酸(主要是Glu)暴發性釋放和氧自由基產生增加。重攝取是中樞神經系統減輕Glu興奮毒性主要機制,腦炎發生時腦內ATP降解,谷氨酸重吸收機制衰竭,影響其攝取功能甚至出現向胞外轉移,突觸間隙持續高濃度的谷氨酸加重神經興奮性毒性。病理情況下胞外間隙Glu濃度增高,過度刺激NMDA、AMPA等受體對中樞神經系統產生明顯毒性作用在神經細胞急性壞死和凋亡過程中具有重要作用。
本實驗用LPS誘導膠質細胞模擬人體內發生炎性反應誘發神經元細胞的凋亡,驗證EGCG的神經保護作用。研究結果顯示,不同濃度EGCG均能明顯抑制細菌脂多糖誘導的炎性因子如TNF-α、IL- 8、IL- 1β和iNOS的過度表達,從而保護膠質神經元耐受性,減輕炎性因子的不良反應;此外,EGCG在一定程度上可調節胞外氨基酸濃度,降低興奮性氨基酸Glu攝取,增加胞外抑制性氨基酸γ-GABA的含量。上述結果證實了EGCG通過多靶點機制[7]對中樞神經系統退行性疾病產生防治作用[8]。本實驗結果進一步證實了其他學者對EGCG體外抗炎作用的研究[9- 10],EGCG可以減輕損傷增加細胞存活率這一結果與國外研究一致[11]。
綜上所述,EGCG是茶多酚發揮抗感染作用的有效成分之一,兩種機制共同發揮保護作用。EGCG具有抑制炎性因子的過度表達,從而減輕損傷神經元的生化反應、基因表達等級聯反應的發生;調節興奮性氨基酸與抑制性氨基酸間動態平衡,這兩種機制對LPS誘導的體外培養膠質細胞起到保護作用。本研究結果增加了EGCG對抗感染作用、減輕興奮毒性作用的認識,拓寬了人們對EGCG用于心腦血管藥理保護作用機制的理解[12- 13]。
[1] Singh R, Akhtar N, Haqqi TM. Green tea polyphenol epigallocatechin- 3-gallate: inflammation and arthritis[J]. Life Sci,2010,86:907- 918.
[2] Singh BN,Shankar S,Srivastava RK,etal. Green tea catechin, epigallocatechin- 3-gallate (EGCG): mechanisms, perspectives and clinical applications[J]. Biochem Pharmacol, 2011,82:1807- 1821.
[3] 張惠燕,王劍勇,姚航平.表沒食子兒茶素沒食子酸酯抑制脂多糖誘導人視網膜內皮細胞中調節活化正常T細胞表達與分泌趨化因子的表達 [J].生理學報, 2014, 66: 145- 150.
[4] 鄧鳳君,楊迎暴,徐江平,等.表沒食子兒茶素沒食子酸酯對脊髓損傷大鼠炎癥因子釋放及神經營養因子表達的影響[J].中國實驗方劑學雜志,2010,16:195- 198.
[5] Bae HB, Li M, Kim JP,etal. The effect of epigallocatechin gallate on lipopolysaccharide-induced acute lung injury in a murine model[J].Inflammation, 2010,33:82- 91.
[6] Joo SY,Song YA,Park YL,etal. Epigallocatechin- 3-gallate Inhibits LPS-Induced NF-κB and MAPK Signaling Pathways in Bone Marrow-Derived Macrophages[J]. Gut Live, 2012,6:188- 196.
[7] Chen D,Milacic V, Chen MS,etal. Tea polyphenols, their biological effects and potential molecular targets[J].Histol Histopathol, 2008,23:487- 496.
[8] Hǜgel HM,Jackson N.Redox chemistry of green tea polyphenols:therapeutic benefits in neurodegenerative diseases[J].Mini Rev Med Chem,2012,12:380- 387.
[9] El-Mowafy AM, Al-Gayyar MM, Salem HA,etal. Novel chemotherapeutic and renal protective effects for the green tea (EGCG): Role of oxidative stress and inflammatory cytokine signaling[J].Phytomedicine, 2010, 17:1067- 1075.
[10] 張東芳,肖 鵬,韓晨露,等.表沒食子兒茶素- 3-沒食子酸酯抑制脂多糖誘導的巨噬細胞促炎因子TNF-α和IL- 1β基因表達[J].中國生物化學與分子生物學報,2014,30:402- 408.
[11] Itoh T,Imano M,Nishida S,etal. Epigallocatechin- 3-gallate increases the number of neural stem cells around the damaged area after rat traumatic brain injury[J].J Neural Transm,2012, 119:877- 890.
[12] Andrade JP,Assunc?o M.Protective effects of chronic green tea consumption on age-related neurodegeneration[J]. Curr Pharm Des,2012,18:4- 14.
[13] 葛建,林芳,李明揆,等.表沒食子兒茶素沒食子酸酯(EGCG)生物活性研究進展[J].安徽農業大學學報, 2011, 38:156- 163.
Epigallocatechin-3-gallate(EGCG) reduces the LPS-induced injury of newborn rat primary cultured glial cells
LONG Ming1, LI Jing1, FENG Yu-ling1*, GONG Ming1, DONG Zhi2
(1.Dept. of Neurology, the Affiliated Hospital, Chongqing Three Gorges Medical College,Chongqing 404120; 2.Dept. of Pharmacy, Chongqing Medical University, Chongqing 400016, China)
ObjectiveTo determine the effects of EGCG on lipopolysaccharide (LPS)-induced neuroinflammation and investigate the role of neuroprotection mediated by EGCG.MethodsPrimary cultures of rat gliacyte were used as aninvitromodel to examine the effects of EGCG on LPS-induced neuronal damage. The intracellular Glu and γ-GABA were quantified via HPLC.Then the protein level of TNF-α,IL- 1β and IL- 8 was determined by ELISA and Western blot assay.ResultsCompared with the control group, LPS apparently induced the production of intracellular ROS (P<0.05) and released the TNF-α, IL- 1β and IL- 8 in the primary cultures supernatant(P<0.05). Compared with the LPS group,EGCG significantly attenuated the release of TNF-α, IL- 1β and IL- 8(P<0.05) and the level of iNOS protein(P<0.05). LPS apparently induced the production of intracellular ROS(P<0.05) and released the TNF-α,IL- 1β and IL- 8 in the primary cultures supernatant (P<0.05).EGCG significantly attenuated the release of TNF-α, IL- 1β and IL- 8 (P<0.05) and the level of iNOS protein(P<0.05),and rugulated the concentration of Glu/γ-GABA(P<0.05).ConclusionsEGCG is effective
EGCG; lipopolysaccharide; neuroinflammation; amino acid; protection effect
2014- 06- 20
:2014- 09- 28
重慶市基礎與前沿研究計劃(cstc2014jcyjA10049);重慶市衛生局醫學科研項目(2012-1-096);重慶市高等教育教學改革研究重點項目(132128,133309);重慶市萬州區科技計劃(201203055)
*通信作者(correspondingauthor):mybestdorthy@hotmail.com
1001-6325(2015)02-0203-05
研究論文
R 9
:A
in protecting hosts against LPS-induced neuroinflammation through anti-inflammatory effects and regulating extracellular Amino acid levels.

