妊娠中期婦女超甲基化RASSF1A基因表達水平與子癇前期的關系
曠文佳 陳美華 董晨
子癇前期是妊娠期特有的疾病,是導致孕產(chǎn)婦及圍生兒患病及死亡的重要原因之一[1]。早期監(jiān)測該病的發(fā)生、發(fā)展,有助于及早發(fā)現(xiàn)子癇前期的高危孕婦,并及時給予監(jiān)護和處理,從而降低孕產(chǎn)婦及圍生兒病死率,但現(xiàn)今尚缺乏預測子癇前期發(fā)生的相對有效且無創(chuàng)的指標[2]。目前,多項研究發(fā)現(xiàn)子癇前期孕婦血漿中胎兒游離核酸的水平可在一定程度上預測子癇前期的發(fā)生。而超甲基化的Ras相關區(qū)域家族1A(RASSF1A)基因是胎兒特有的表觀遺傳學標志物,可能在預測子癇前期的發(fā)生中具有一定的價值,但尚需進一步的臨床研究[3-4]。為此,本研究檢測了孕中期孕婦血漿中超甲基化RASSF1A基因表達水平,旨在探討其在預測子癇前期發(fā)生中的應用價值,現(xiàn)報告如下。
對象與方法
一、研究對象
選擇2012年1月至2013年12月在我院規(guī)律產(chǎn)前檢查的506例孕婦,分別于孕15~19周及孕20~24周采外周血,同時監(jiān)測孕婦血壓、尿蛋白值,其中診斷為妊娠期高血壓疾病96例孕婦,包括子癇前期孕婦48例 (子癇前期組)、妊娠期高血壓孕婦48例 (妊娠期高血壓組)。入組標準:①單胎;②年齡18~45歲;③符合第7版《婦產(chǎn)科學》子癇前期或妊娠期高血壓的診斷標準[5]。選取同期18~45歲的96名單胎健康孕婦為對照組。各組孕婦年齡、產(chǎn)次、孕前BMI比較差異均無統(tǒng)計學意義 (P均>0.05),見表1。子癇前期組孕婦分娩孕周及新生兒出生體質量均低于妊娠期高血壓組及對照組,比較差異均有統(tǒng)計學意義 (P<0.05),見表1。本研究經(jīng)醫(yī)院倫理委員會批準,所有研究對象均簽署知情同意書。
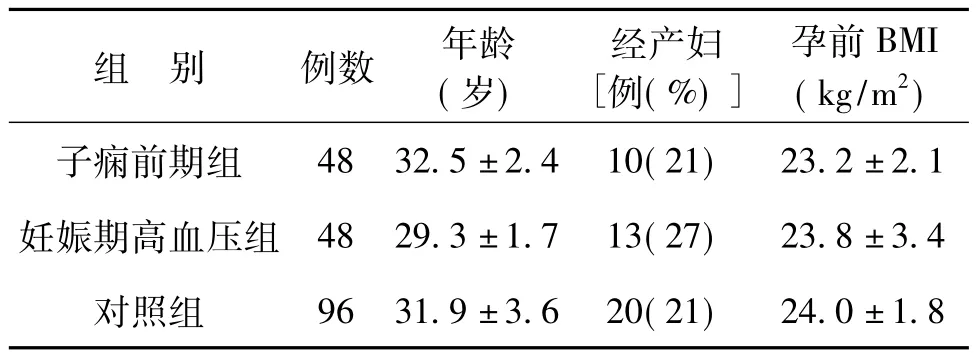
表1 各組孕婦一般情況比較
二、方 法
1.樣本采集
抽取研究對象空腹肘靜脈血4 ml放入依地酸二鈉抗凝管中,離心分離血漿,置-80°C冰箱凍存?zhèn)溆谩?/p>
2.血漿中胎兒游離DNA的提取
取待檢血漿1 ml,采用德國Qiagen公司提供的QIAamp Blood Mini kit試劑盒,按照說明書的操作步驟從血漿中提取游離DNA。
3.甲基化敏感的限制性內切酶消化
在0.5 ml的EP管中建立以下體系:模板DNA 25 μl,HinP1 I內切酶 20 U,Hha I內切酶 20 U(美國New England Biolabs公司),10倍稀釋的NE Buffer 5 μl加入雙蒸水至 50 μl,充分混勻,于37℃水浴16 h。
4.熒光定量PCR檢測
使用FTC-2000實時熒光定量PCR儀 (加拿大Funglyn Biotech公司),依次擴增酶切前后的RASSF1A基因及β-肌動蛋白 (β-actin) 基因。參考NCBI GenBank數(shù)據(jù)庫中RASSF1A基因序列,采用Primer 5.0軟件設計引物及探針。RASSF1A正向引物序列為 5'-GACCTCTGGCGACTTCATCTG-3',反向引物序列為 5'-GACCTAGTCCTCGGGAGC TGTC-3',探針序列為 5'-FAM-CCCTCTGCCGCGACTTGACCCGT TAMRA-3',擴增片段長度為 173 bp;內參照選用β-actin基因,正向引物序列為5'-TGGACATCTCTTGGGCA CTGA-3',反向引物序列為 5'-CAACACCACACTCTACCTCTCAA-3',探針序列為 5'-FAM-TCTCCCTAGTGACCCACCCAGCACATAMRA-3',擴增片段長度為262 bp。以上引物及探針均由上海生物工程公司合成。反應條件及體系如下:酶切后模板 DNA 20 μl(相當于酶切前 10 μl),Premix Ex TaqTM25 μl(日本 TaKaRa 公司),10 μmol/L 探針 1.0 μl,10 μmol/L 引物各 1.5 μl,加入雙蒸水至總體積達50 μl。RASSF1A基因:95℃ 3 min預變性;45個循環(huán) (94℃ 20 s;60℃20 s;72℃ 30 s),每個循環(huán)結束時PCR儀自動檢測1次熒光值;72℃ 4 min延伸。β-actin基因:95℃ 3 min預變性;45個循環(huán) (94℃ 30 s;60℃30 s;72℃ 30 s),每個循環(huán)結束時PCR儀自動檢測1 次熒光值;72°C 4 min 延伸。采用 2-△△ct法計算其表達水平。
三、統(tǒng)計學處理
應用SPSS 19.0統(tǒng)計軟件進行分析。正態(tài)分布的計量數(shù)據(jù)以表示,多組間均數(shù)比較采用方差分析,組間兩兩比較采用SNK-q檢驗;非正態(tài)分布的計量資料以中位數(shù)和上、下四分位數(shù) [M(P25~P75)]表示,多組間均數(shù)比較采用Kruskal-Wallis檢驗。計數(shù)資料的組間比較采用χ2檢驗。總體比較以P<0.05為差異有統(tǒng)計學意義;計數(shù)資料組間兩兩比較,以P<0.05/3=0.017為差異有統(tǒng)計學意義。
結 果
一、隨訪結果
剔除失訪及隨訪中出現(xiàn)各種異常不再適合入組的孕婦,共506例孕婦參與本研究。在妊娠20周后陸續(xù)發(fā)展為子癇前期的孕婦48例,其中在妊娠34周前發(fā)展為子癇前期的孕婦有20例,本次調查中子癇前期的發(fā)病率為9.4%,早發(fā)型子癇前期(孕34周前發(fā)病)的發(fā)病率為3.9%,其臨床癥狀出現(xiàn)在24~38周。子癇前期組孕婦的分娩孕周較短,新生兒體質量較輕 (P均<0.05),見表1。
表1 妊娠期高血壓疾病孕婦與對照組孕婦的分娩孕周及新生兒體質量比較 ()

表1 妊娠期高血壓疾病孕婦與對照組孕婦的分娩孕周及新生兒體質量比較 ()
注:與子癇前期組比較,aP<0.05,bP<0.01
組 別 例數(shù) 分娩孕周(周)新生兒體質量(g)48 34±6 2209±978妊娠期高血壓組 48 38±3a 3123±419a對照組 96 39±3b 3012±593b F值 7.778 10.06 P值子癇前期組0.001 <0.001
二、妊娠期高血壓疾病孕婦與對照組孕婦血漿中RASSF1A基因及β-actin的檢出情況
在甲基化敏感的限制性內切酶消化前,48例子癇前期組、48例妊娠期高血壓組及96例健康對照組在2個檢測階段均能檢測到RASSF1A基因及β-actin。酶切后在15~19周有4例受檢者未檢測到RASSF1A基因 (子癇前期組1例,妊娠期高血壓組1例,對照組2例),在20~24周有2例未檢測到RASSF1A基因 (妊娠期高血壓組、對照組各1例),所有孕婦均未檢測到β-actin。
三、妊娠期高血壓疾病孕婦與對照組孕婦不同階段外周血中超甲基化RASSF1A基因表達水平比較
孕15~19周時子癇前期組超甲基化RASSF1A基因水平高于對照組 (Z=2.614,P=0.009);妊娠期高血壓組超甲基化RASSF1A基因水平高于對照組 (Z=2.482,P=0.013);子癇前期組與妊娠期高血壓組比較差異無統(tǒng)計學意義 (Z=1.850,P=0.064)。孕20~24周時子癇前期組超甲基化RASSF1A基因表達水平高于對照組 (Z=3.093,P=0.002);妊娠期高血壓組超甲基化RASSF1A基因水平高于對照組 (Z=2.584,P=0.010);子癇前期組的超甲基化RASSF1A基因水平高于妊娠期高血壓組 (Z=2.753,P=0.006),見表2。
討 論
子癇前期是一種累及全身多器官的妊娠期特發(fā)性疾病,常發(fā)生于妊娠中晚期,其臨床表現(xiàn)主要為母體綜合征,包括高血壓病和蛋白尿伴或不伴有多系統(tǒng)的功能障礙[6]。目前預測其發(fā)病的常用方法有MAP測定、翻身試驗、血液流變學試驗、尿酸及某些生化指標測定,但效果均欠佳。因此,尋找一種能在子癇前期發(fā)病前即對其做出預測的有效、無創(chuàng)、特異的診斷方法顯得尤為重要。
多數(shù)學者認為子癇前期的病理變化開始于胎盤形成階段。其發(fā)病主要是由于孕早期胎盤滋養(yǎng)細胞侵入不足,導致胎盤缺血、缺氧,進入母血中的胎兒成分增加。1999年Lo等研究證實,子癇前期的發(fā)生與母血中胎兒游離DNA存在相關性,并推測此種DNA可作為子癇前期的早期預測指標。此后,多項研究也得出與Lo相似的結論。但其對胎兒游離DNA的檢測都是通過測定Y染色體特異性的序列 DYS14、SRY 實現(xiàn)[7-8]。因此,該方法對子癇前期的預測只局限于妊娠男胎的人群,限制了其應用。

表2 各組超甲基化RASSF1A基因水平的比較 [M(P25~P75)]
DNA甲基化為基因沉默的一種方式 ,是較早發(fā)現(xiàn)的基因表觀修飾方式之一,也是最常見的復制后調節(jié)方式[9]。近年來,隨著表觀遺傳學的發(fā)展,借助DNA甲基化檢測方法進行無創(chuàng)性產(chǎn)前診斷成為可能,且不受胎兒性別影響。Bellido等[10]研究發(fā)現(xiàn)位于3號染色體的RASSF1A基因在胎盤與母血間具有不同的甲基化狀態(tài),胎盤源性超甲基化RASSF1A具有胎兒DNA特點,可作為胎兒遺傳標志物應用于產(chǎn)前診斷領域。Kim等[11]研究發(fā)現(xiàn)包括胎兒宮內生長受限、子癇前期、前置胎盤在內的胎盤功能不全孕婦血漿中胎盤源性超甲基化RASSF1A表達水平明顯升高。Papantoniou等[12]研究發(fā)現(xiàn),子癇前期孕婦血漿中超甲基化RASSF1A基因表達水平明顯高于正常孕婦,且具有較高的敏感性及特異性。本研究顯示,子癇前期及妊娠期高血壓孕婦孕15~24周血漿中超甲基化RASSF1A水平高于正常孕婦,其結果的獲得早于孕24~38周臨床表現(xiàn)的出現(xiàn),提示其可能成為預測子癇前期發(fā)病的新指標,具有一定的臨床應用價值。子癇前期孕婦血漿中胎兒游離DNA增加可能源于以下兩方面,一是胎盤滋養(yǎng)細胞侵入不足,胎盤屏障受損,導致胎兒游離DNA進入母血中增加,二是子癇前期孕婦的肝臟及腎臟功能都不同程度受到損害,使其對DNA清除能力下降[13]。本研究顯示孕20~24周子癇前期孕婦血漿中超甲基化RASSF1A基因水平高于妊娠期高血壓孕婦,可能是因為妊娠期高血壓發(fā)展到子癇前期是疾病進展的過程,而子癇前期孕婦的胎盤屏障及肝腎功能的損害程度高于妊娠期高血壓孕婦。
子癇前期孕婦胎盤的病理改變發(fā)生在孕20周前,而其臨床癥狀多出現(xiàn)在孕24~38周,本研究應用表觀遺傳學方法檢測了孕15~24周子癇前期、妊娠期高血壓及正常孕婦血漿中超甲基化RASSF1A基因水平,提示其水平變化與子癇前期發(fā)病有關。跟蹤檢測其水平變化,或許有助于及早發(fā)現(xiàn)子癇前期高危孕婦,如給予相應的處理,可能在一定程度上改善妊娠結局。
[1]Duley L.The global impact of pre-eclampsia and eclapsia.Semin Perinatol,2009,33(3):130-137.
[2]Wald NJ,Bestwick JP,George LM,Wu T,Morris JK.Screening for preeclampsia using serum placental growth factor and endoglin with Down's syndrome Quadruple test markers.J Med Screen,2012,19(2):60-67.
[3]Hahn S,Huppertz B,Holzgreve W.Fetal cells and cell free fetal nucleic acids in maternal blood:new tools to study abnormal placentation.Placenta,2005,26(7):515-526.
[4]Orozco AF,Jorgez CJ,Ramos-Perez WD,Popek EJ,Yu X,Kozinetz CA,Bischoff FZ,Lewis DE.Placental release of distinct DNA-associated micro-particles into maternal circulation:reflective of gestation time and preeclampsia.Placenta,2009,30(10):891-897.
[5]樂杰.婦產(chǎn)科學.北京:人民衛(wèi)生出版社,2008:92-98.
[6]Redman CW,Sargent IL.Placental stress and preeclampsia:a revised view.Placenta,2009,30(SupplA):S38-S42.
[7]Sikora A,Zimmerman BG,Rusterholz C,Birri D,Kolla V,Lapaire O,Hoesli I,Kiefer V,Jackson L,Hahn S.Detection of increased amounts of cell-free fetal DNA with short PCR amplicons.Clin Chem,2010,56(1):136-138.
[8]Scheffer PG,van der Schoot CE,Page-Christiaens GC,Bossers B,van Erp F,de Haas M.Reliability of fetal sexdetermination using maternal plasma.Obstet Gynecol,2010,115(1):117-126.
[9]鄭伏甫,戴宇平,徐理華,鄧春華,鄭克立.腎癌組織中BHD、RASSF1A、SPINT2基因啟動子的甲基化研究.新醫(yī)學,2010,41(6):358-361.
[10]Bellido ML,Radpour R,Lapaire O,De Bie I,H?sli I,Bitzer J,Hmadcha A,Zhong XY,Holzgreve W.MALDI-TOF mass array analysis of RASSFIA and SERPINB5 methylation patterns in human placenta and plasma.Biol Reprod,2010,82(4):745-750.
[11]Kim MJ,Kim SY,Park SY,Ahn HK,Chung JH,Ryu HM. Association of fetal-derived hypermethylated RASSF1A concentration in placenta-mediated pregnancy complications.Placenta,2013,34(1):57-61.
[12]Papantoniou N,Bagiokos V,Aqiannitopoulos K,Kolialexi A,Destouni A,Tounta G,Kanavakis E,Antsaklis A,Mavrou A.RASSF1A in maternal plasma as a molecular marker of preeclampsia.Prenat Diagn,2013,33(7):682-687.
[13]Litton C,Stone J,Eddleman K,Lee MJ.Noninvasive prenatal diagnosis past,present,and future.Mt Sinaj J Med,2009,76(6):521-528.

