慢性高原病大鼠肺組織損傷加重及casepase- 3和相關因子的變化
關 巍,崔金霞,時瑩慶,王 晉,馮喜英,格日力
(1.青海大學 高原醫學研究中心, 青海 西寧 810001; 2.青海大學附屬醫院 呼吸科, 青海 西寧 810001;3.武警青海總隊醫院, 青海 西寧 810000)
?
慢性高原病大鼠肺組織損傷加重及casepase- 3和相關因子的變化
關 巍1,2,崔金霞2,時瑩慶2,王 晉3,馮喜英2,格日力1*
(1.青海大學 高原醫學研究中心, 青海 西寧 810001; 2.青海大學附屬醫院 呼吸科, 青海 西寧 810001;3.武警青海總隊醫院, 青海 西寧 810000)
慢性高原病(chronic mountain sickness,CMS)發病機制尚不清楚。有報道CMS患者肺彌散功能下降或通氣和彌散功能均下降[1]。目前對CMS肺組織結構的變化研究很少。本研究觀察CMS大鼠肺組織結構的病理改變、肺組織內半胱氨酸天冬氨酸蛋白酶-3(casepase- 3)及支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)內相關炎性因子的變化。
1 材料與方法
1.1 動物與試劑:清潔級雄性SD大鼠20只,體質量(148±5.2)g,鼠齡6周 [蘭州大學動物實驗室,合格證號:SCXK(甘)2011- 0001];casepase- 3多克隆抗體、抗兔二抗和免疫組化試劑盒(上海泛柯實業有限公司);大鼠腫瘤壞死因子(TNF-α)、白介素- 6(IL- 6)和IL- 10 ELISA試劑盒(武漢優爾生科技股份有限公司)。
1.2 方法
1.2.1 動物模型及分組:將大鼠隨機分為對照組和CMS組,每組10只。對照組飼養于青海大學醫學院動物房,海拔2 260 m;CMS組飼養于青海高原醫學研究中心低壓氧艙,模擬海拔5 500 m,常規喂食,31 d后用于實驗。
1.2.2 標本處理:取腹主動脈血液2 mL,測定血常規。分離氣管,夾閉左主支氣管,插導管至右主支氣管,0.9%氯化鈉溶液灌洗右肺,收集BALF,雙層紗布過濾,離心,上清液-20 ℃冰箱保存,沉淀物涂片,用于細胞計數。左、右心房各開1 cm小口,右房開口插入導管,0.9%氯化鈉溶液以20 cm H2O壓力,10 mL/分鐘的速度滴注至肺葉變白,4%甲醛溶液灌洗雙肺,至肺葉變硬、肺緣銳利,分離右肺制作石蠟切片,HE染色檢查組織學和免疫組化檢測casepase- 3。
1.2.3 標本的測定項目:
1)大鼠肺組織形態定量分析:平均內襯間隔(mean linear intercept,MLI)和肺泡破壞指數(destructive index,DI):Mshot Digital Imaging System V1.0軟件系統,光學顯微鏡(×100)計數。單個肺泡面積(area of pulmonary alveoli, APA)和單位面積肺泡數(density of pulmonary alveoli, DPA):江蘇省捷達科技8.0圖像分析系統得出結果。
2)免疫組化法測肺組織casepase- 3:肺組織石蠟切片常規脫蠟至水,按免疫組化試劑盒說明書進行操作。
3)ELISA法測BALF中TNF-α、IL- 6和IL- 10濃度:按ELISA試劑盒說明書進行操作。
4)計數BALF中白細胞及各組分: BALF沉淀物涂片巴氏染色,低倍鏡觀察,行白細胞總數及各組分計數。
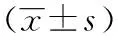
2 結果
2.1 血常規比較:CMS組的紅細胞數、血紅蛋白及紅細胞壓積顯著高于對照組(表1),CMS建模成功。
2.2 光鏡下肺組織病理及MLI、DI、APA和DAP的比較:光鏡下可見CMS組部分肺泡破裂及肺泡腔擴大。CMS組的MLI、DI和APA明顯高于對照組(P<0.001),DAP明顯低于對照組(P<0.001)(表1)。
2.3 BALF中白細胞計數及TNF-α、IL- 6和IL- 10水平比較: CMS組與對照組相比,BALF中白細胞總數及巨噬細胞比例明顯增高(均P<0.001),TNF-α、IL- 6顯著增高(均P<0.001),IL- 10無顯著變化(表2)。
2.4 肺組織casepase- 3表達及陽性率變化:CMS組casepase- 3細胞陽性率(10.75±0.96)%顯著高于對照組(3.79±1.09)% (P<0.001),casepase- 3陽性在CMS組明顯增加(圖1)。
3 討論
CMS以紅細胞增多及顯著低氧血癥為特征。目前認為環境低氧是CMS 低氧血癥的主要原因。但有報道CMS 患者的肺彌散功能、通氣功能有不同程度的下降[1]。高原紅細胞增多癥患者尸檢發現[2],肺臟散在性出血,肺毛細血管高度擴張淤血,肺泡壁增厚,彈力纖維增多,增粗,肺泡腔擴大或有間質性水腫,間質小血管彈力纖維明顯增多。
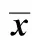
表1 CMS組和對照組血常規和MLI、DI、APA和DAP比較Table 1 The comparison of blood routine test and MLI, DI, APA and DAP in CMS group and control group (±s, n=10)
*P<0.001 compared with control group; RBC.red blood cell; HB.hemoglobin; HCT.hematokrit.
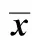
表2 CMS組和對照組BALF中白細胞計數和TNF-α、IL- 6和IL- 10水平比較Table 2 The comparison of white cell count and TNF-α, IL- 6 and IL- 10 in CMS group and control group(±s, n=10)
*P<0.001 compared with control group.
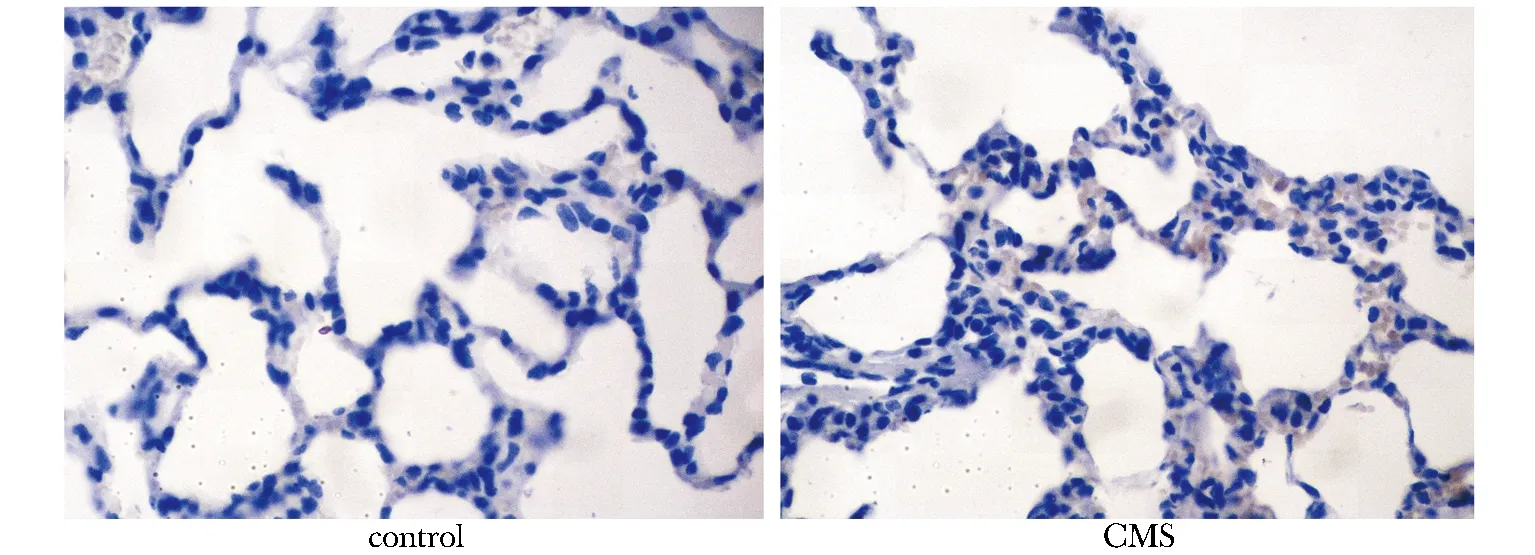
圖1 肺組織casepase- 3 表達Fig 1 Casepase- 3 expression in lung tissue(×400)
本研究發現,大鼠在模擬5 000 m的低壓氧艙30 d后,紅細胞及血紅蛋白明顯增加,肺泡破壞增加,肺泡腔增大,單位面積肺泡數減少。
肺泡巨噬細胞合成、分泌TNF-α、IL- 1、IL- 6和IL- 8等,在肺部防御和疾病發生過程中發揮重要作用[3]。TNF-α促進多形核白細胞的聚集、黏附和滲出,釋放溶酶體酶、 彈性蛋白酶以及活性氧、 超氧離子, 損害肺泡上皮細胞。IL- 6與全身性炎性反應和肺功能的下降程度有直接關系。IL- 10幾乎抑制所有促炎細胞因子的合成與釋放,因而具有抗感染作用?
本研究發現,BALF中白細胞總數、巨噬細胞數量以及TNF-α、IL- 6水平較對照組明顯升高,說明CMS大鼠肺組織炎性反應加重。
有研究顯示肺內皮細胞的凋亡與肺損傷相關[4]。本研究發現,CMS大鼠肺組織內促炎因子及凋亡增加,casepase- 3陽性率增高,肺組織破壞增加,提示CMS肺組織損傷,可能是加重CMS患者低氧的重要因素。
[1] 楊彩玲. 30例高原紅細胞增多癥患者肺功能變化及分析[J]. 高原醫學雜志, 2010, 20: 18- 19
[2] 鄒恂達, 王旺強, 王鹿朝. 高原紅細胞增多癥的病理觀察[J]. 高原醫學雜志, 1994, 2: 29- 32.
[3] Alber A, Howie SE, Wallace WA,etal. The role of macrophages in healing the wounded lung [J]. Int J Exp Pathol, 2012, 93: 243- 251.
[4] Perl M, Chung CS, Perl U,etal. Therapeutic accessibility of casepase- mediated cell death as a key pathomechanism in indirect acute lung injury [J]. Crit Care Med, 2010, 38: 1179- 1186.
2015- 03- 13
2015- 05- 27
1001-6325(2015)11-1542-02
R594.3
A
*通信作者(corresponding author):weiguan110@163.com

