樹鼩2型糖尿病模型的構建及其相關因素分析
黃霞,潘興華,龐榮清,蔡學敏,阮光萍
樹鼩2型糖尿病模型的構建及其相關因素分析
黃霞,潘興華,龐榮清,蔡學敏,阮光萍
目的為干細胞治療研究構建2型糖尿病(T2DM)樹鼩模型,并對相關因素進行分析。方法采用高糖、高脂飼喂聯合腹腔注射鏈脲佐菌素(STZ)100mg/kg方法構建樹鼩T2DM模型。造模后第6 w腹腔注射STZ,在注射STZ前和注射后的每2 w,測定空腹血糖(FBG)、胰島素(FINS)、C肽、胰島素抵抗指數(HOMA-IR)、總膽固醇(TC)、甘油三酯(TG)、糖化血紅蛋白(HbA1c)、口服葡萄糖耐量試驗(OGTT)等指標;自造模后的第8、16 w,觀察胰腺、肝、腎臟的病理組織形態變化,檢測血清TNF-α、IL-6表達水平。結果造模后,FBG持續升高,FINS、C肽先升高后下降,出現胰島素抵抗;TG和TC在造模后持續升高,12 w后穩定在較高水平;肝、腎、胰腺器官表現為特征性的病理變化,且血清中TNF-α和IL-6增高。結論飼喂高糖、高脂飼料+腹腔注射STZ成功構建樹鼩T2DM模型,出現T2DM特征性病理變化,炎癥細胞因子可能參與了T2DM的病理過程。
樹鼩;2型糖尿病;鏈脲佐菌素;模型
2型糖尿病(T2DM)是以胰島素抵抗、胰島素敏感性下降和糖、脂代謝紊亂為特征的代謝性疾病[1]。研究發現,鏈脲佐菌素(Streptozocin,STZ)有針對性地破壞胰島β細胞,可誘導糖尿病的產生[2]。目前對T2DM進行了大量的研究,但結果差異較大。樹鼩是靈長類動物的近親[3],易于模擬人類T2DM的病理過程。本研究擬通過注射STZ來創建樹鼩T2DM模型,并動態觀察模型樹鼩一般情況、生化、病理及細胞因子與臨床的符合程度,分析相關因素,以期為干細胞治療研究提供較穩定的樹鼩T2DM模型。
1 材料與方法
1.1 動物健康樹鼩48只,由中國科學院昆明動物研究所實驗動物中心提供,為中緬樹鼩滇西亞種,體重120~140 g。動物房內常年保持通風換氣、清潔。
1.2 材料與儀器STZ(Sigma公司);Human IL-6 ELISA Kit和Human TNF-αELISA Kit(聯科生物技術有限公司);微量血糖儀(羅氏公司G10592137型)。
1.3 試劑配制方法A液:檸檬酸4.2 g加水至200m l;B液:檸檬酸鈉5.88 g加水至200 ml;A液和B液按56%和44%的比例混合,調節pH值在4.2~4.3,0.22μm過濾器除菌,4℃冰箱儲存備用。基礎飼料和高糖、高脂飼料均由昆明醫科大學動物室研究配置。
1.4 T2DM模型制作動物適應性喂養2 w,檢測HbA1c、空腹血糖水平(FBG)、空腹胰島素水平(FINS)、C肽、TC、TG及胰島素抵抗指數(HOMAIR)正常后納入實驗。將48只動物隨機分為2組,對照組8只、實驗組40只。對照組以基礎飼料喂養;實驗組每天上午8點開始定時定量飼喂高糖、高脂飼。兩組均一日三餐,中間加喂1次蘋果,定量飲水。飼喂6 w后,實驗組禁食不禁水12 h,然后腹腔注射STZ 100mg/kg,對照組注射等量生理鹽水。注射后72 h測FBG,實驗組低于11.1mol/L者再腹腔注射STZ(100mg/kg)1次。自造模起觀察記錄樹鼩精神狀態、活動度、毛色、飲食、排泄等情況。
1.5 檢測指標
1.5.1 FBG自造模后第6 w開始,每隔2 w,動物禁食12 h,次日尾尖取血,羅氏微量血糖儀測量FBG。另外,采集1ml尾靜脈血,由本院檢驗科測定TC、TG、FINS、HbA1c、C肽水平。HOMA-IR=FBG(mmol/L)×FINS(m IU/L)/22.5。
1.5.2 口服葡萄糖耐量試驗(OGTT)自造模后第8、16 w,兩組均禁食12 h,測定FBG;稱體重后,用50%葡萄糖3.59 ml/kg灌胃,灌胃后15、30、60、90min樹鼩尾尖采血測定血糖水平。
1.5.3 IL-6、TNF-α兩組均于第8、16 w尾靜脈釆血1 ml,離心收集血清,按ELISA試劑盒說明書方法操作,測定IL-6、TNF-α水平。
1.6 病理組織學分析造模后16 w,兩組動物各脫頸處死2只,分別取胰腺、肝臟、腎臟組織,4%多聚甲醛固定,常規石蠟切片,HE染色,光鏡下觀察并照相。
1.7 統計學處理采用SPSS 17.0統計軟件進行統計學分析,結果以均數±標準差表示,組間比較采用兩獨立樣本t檢驗,組內采用單因素方差分析,P<0.05為差異具有統計學意義。
2 結果
2.1 T2DM模型制作情況在腹腔注射STZ 1~2次后,造模成功率90%。對照組8只動物狀態良好,無死亡;實驗組40只動物有4只死亡,并可見多飲、多食、多尿、消瘦,毛無光澤,晚期尾部、腿部有潰瘍形成。
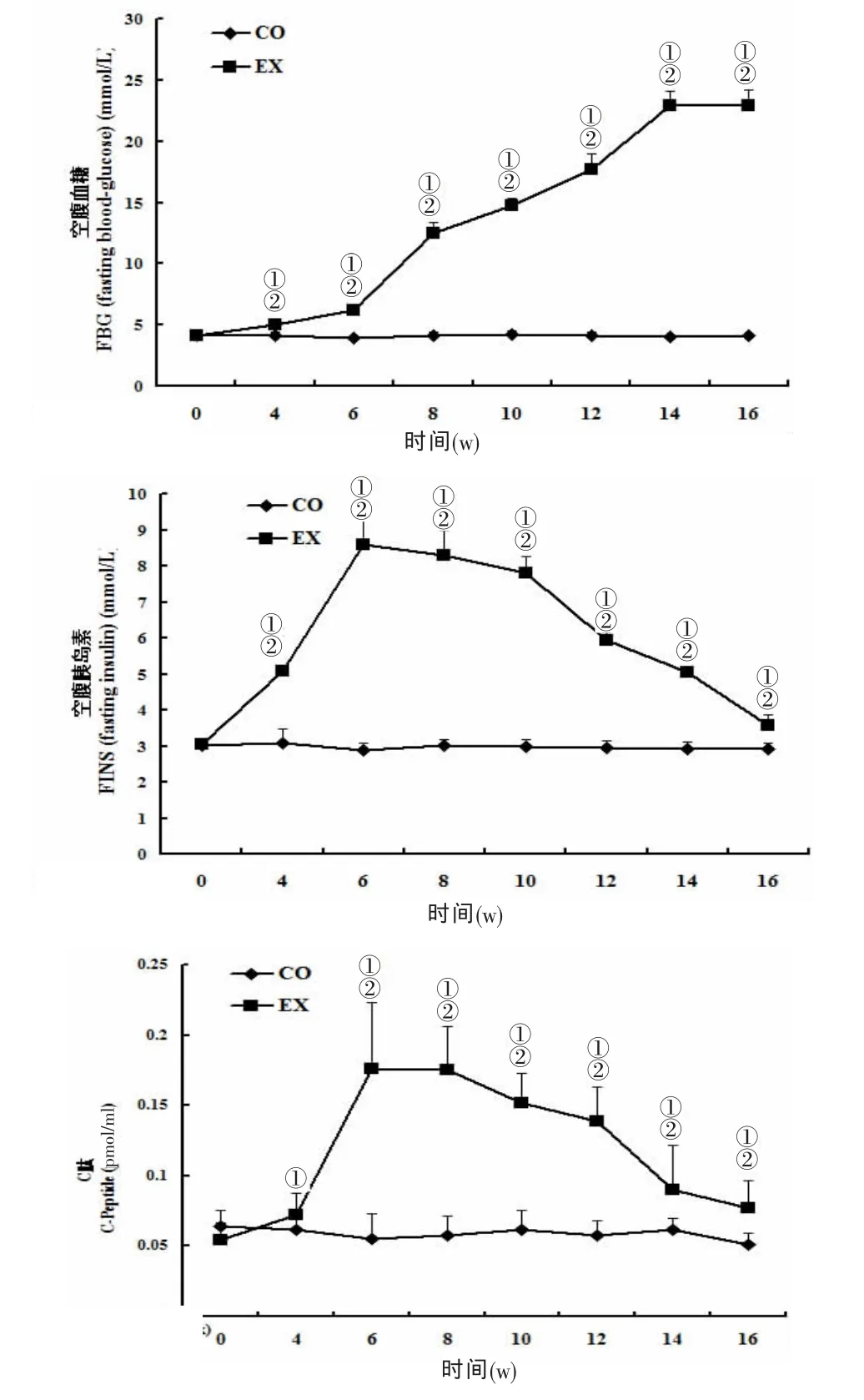
2.2 兩組FBG、FINS、C肽、HOMA-IR、TG、TC、體重、OGTT的變化實驗組FBG在注射STZ后持續升高(12.5~22.9 mmol/L),與對照組比較差異顯著(P﹤0.05),對照組整個研究過程中FBG變化不大(2.9~3.0mmol/L);FINS、C肽、HOMA-IR在實驗組顯著升高,第6 w時達到高峰,之后逐漸降至接近對照組水平(P﹤0.05);與對照組比較,實驗組TG和TC在造模后持續升高(P﹤0.05),12 w后穩定在較高水平;體重在造模后先上升(P﹤0.05)后下降,到16 w時低于對照組(P﹤0.05),符合T2DM模型的特點。見圖1。
高糖、高脂喂養8 w、16 w時檢測OGTT,實驗組血糖頂峰均在5 min出現,對照組血糖高峰在10 min出現,而后迅速下降,90min后降至正常水平;與對照組比較,實驗組8 w時血糖頂峰過后迅速下降,16 w血糖頂峰過后下降稍緩慢,90 min后兩組血糖均未下降到正常水平。見圖2。
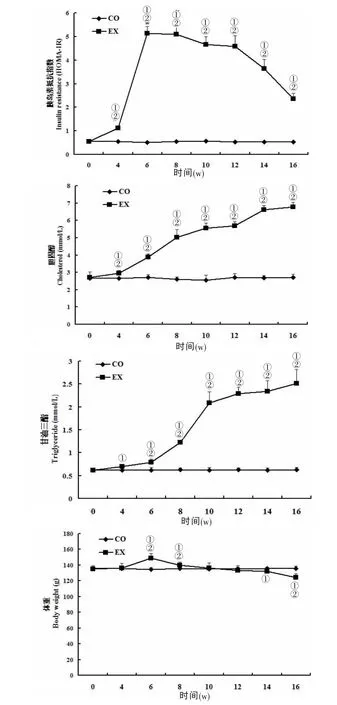
圖1 兩組FBG、FINS、C肽、HOMA-IR、TG、TC、體重的動態變化
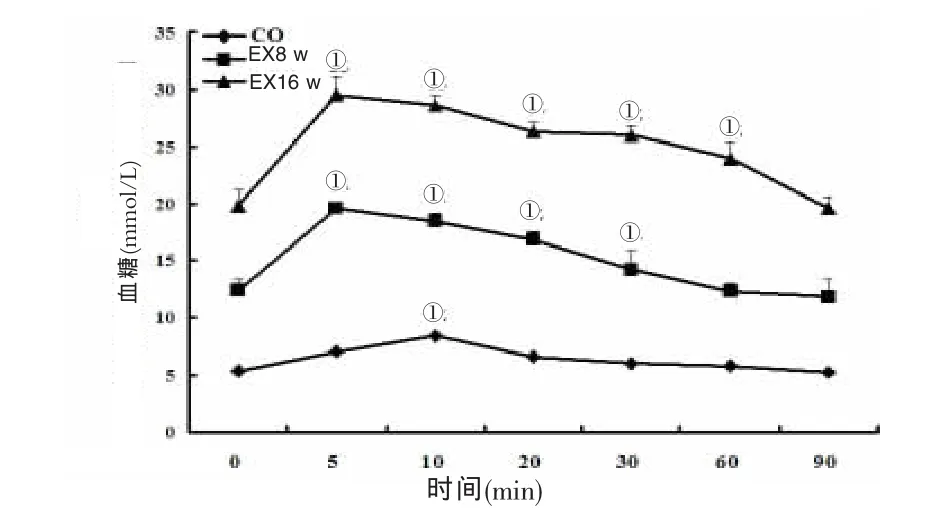
圖2 兩組OGTT的動態變化
2.3 T2DM樹鼩HbA1c的變化HbA1c在臨床實踐中被用作糖尿病患者血糖控制的金標準,其優勢在于可反映受檢者近2~3個月的平均血糖。在造模前0 w和造模后16 w,對照組HbA1c分別為(4.71±0.22 )mmol/L和(4.39±0.49)mmol/L,均<5mmol/L,實驗組HbA1c分別為(4.95±0.80)mmol/L和(8.01±0.50)mmol/L,均>7 mmol/L,說明實驗動物在造模前無自發性糖尿病存在,而實驗組16 w時,發生糖尿病。
2.4 T2DM樹鼩肝臟、腎臟及胰腺的病理學變化與對照組比較,實驗組樹鼩肝臟肝索混亂、腫脹、萎縮,呈脂肪變性和空泡變性,嵴斷裂,可見點狀壞死,匯管區有炎細胞浸潤。腎小球體積增大、髓袢腔擴張、系膜增生和硬化、基底膜增厚、內皮細胞泡沫樣變,出入球動脈透明樣變以及間質血管損傷,毛細血管基底膜增厚,腎小囊腔狹窄。實驗組胰島萎縮,形態極不規則,胰島細胞數目減少,周圍結締組織和基膜不完整,胰島細胞腫脹,空泡增多,細胞核固縮,染色質分布不均、部分細胞核缺失,細胞容積減低,胞漿變淺,胞核固縮,部分胰島細胞壞死。見圖3。
2.5 TNF-α及IL-6在T2DM樹鼩血清中的變化
實驗組8 w及16 w的TNF-α及IL-6的表達均較對照組升高(P﹤0.05,圖4)。
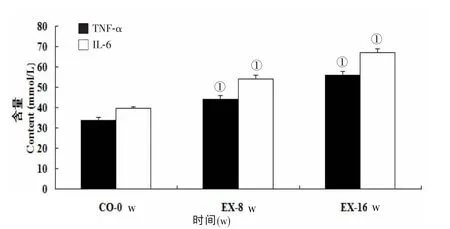
圖4 兩組不同時間血清TNF-α及IL-6的比較
3 討論
糖尿病與細胞免疫和體液免疫異常有很高的關聯度[4]。本研究所采用的高糖高脂飼料喂養聯合腹腔內注射STZ的方法,成模率高達90%,病程接近自然,病死率低,模型穩定,STZ腹腔注射保證了動物模型的成功率[5]。本研究實驗組動物喂養6 w后,已經出現明顯的胰島素抵抗,此時給予STZ腹腔注射,在后續的相關因素觀察中,未出現傾向于T1DM及病死率增加,這與之前的研究有所出入,可能是物種的不同對高糖、高脂飼料的反應不同所致[6]。另外,長期高糖、高脂能誘導動物產生胰島素抵抗,其機制可能是高脂、高膽固醇、高糖飲食導致體內葡萄糖和脂質代謝的紊亂,降低胰島素敏感性,聯合小劑量STZ腹腔內注射可導致胰腺分泌胰島素功能的進一步障礙,誘發高血糖,導致T2DM[7]。
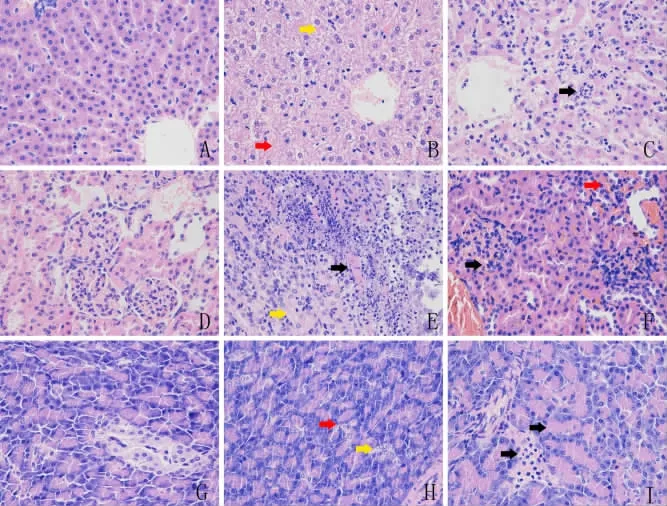
圖3 樹鼩肝臟、腎臟及胰腺的病理學變化(HE染色×400)
T2DM的特點包括胰島素抵抗和糖代謝紊亂,以及脂肪和蛋白質代謝紊亂。本研究發現,造模后,動物血糖顯著升高,而胰島素、C肽呈先升高后下降的變化,出現有明顯的胰島素抵抗。同時,總膽固醇、甘油三酯持續升高,12 w后穩定在一個較高的水平。另外,肝臟、腎、胰腺均出現較明顯的T2DM對靶器官的損傷。這些均提示T2DM造模成功。C肽可作為評定胰島功能的指標,彌補單獨應用血糖的不足,較胰島素更能準確反映β細胞的分泌能力,可作為檢測胰島素內源性分泌評價指標[8]。脂代謝紊亂是T2DM糖代謝異常的始動因素,機制可能是T2DM胰島素的降低及IR使脂蛋白脂肪酶活性低下,肝臟合成TG的速度大于釋放的速度,進入血液循環中的TG不能被及時消除,導致TG在肝內堆積而形成高甘油三酯血癥[9]。本研究也發現,血糖、總膽固醇及甘油三酯雖然高峰不在同一時間點上,但總體水平均隨T2DM的進展而不斷升高,它們之間存在相互促進、互為因果的關系。
近年來認為,T2DM是一種先天性免疫和低度慢性炎癥性疾病[10]。TNF-α與IL-6作為最具代表性的細胞因子,在炎癥和免疫反應中起核心調節作用。在DM的發病過程中,TNF-α與IL-6反應性升高可導致包括胰島在內的全身性炎癥反應和加速胰島β細胞的破壞。本實驗也發現,這兩個因子在實驗組較對照組顯著升高。
本研究建立的樹鼩T2DM模型的血液生化指標、細胞因子及肝、腎、胰腺結構變化與臨床T2DM的病變特點及病理過程相符合,與人類T2DM高度相似,可作為干細胞治療T2DM的動物模型。
[1]Halperin F,Lopez X,Manning R,et al.Insulin augmentation of glucose-stimulated insulin secretion is impaired in insulinresistant humans[J].Diabetes,2012,61(2):301-309.
[2]朱超,朱瑩瑩.Ⅱ型糖尿病動物模型的構建[J].中國實驗動物學報,2013,21(2):84-88.
[3]Schmelting B,Corbach-Sohle S,Kohlhause S,et al.Agomelatine in the tree shrew model of depression:effects on stress-induced nocturnal hyperthermia and hormonal status[J].Eur Neuropsychopharmacol,2014,24(3):437-447.
[4]Yang W,Lu J,Weng J,et al.Prevalence of diabetes amongmen and women in China[J].N Engl JMed,2010,362(12):1090-1101.
[5]De Oliveira AC,Andreotti S,Farias Tda S,et al.Metabolic disorders and adipose tissue insulin responsiveness in neonatally STZ-induced diabetic rats are improved by long-term melatonin treatment[J].Endocrinology,2012,153(5):2178-2188.
[6]吳曉云,李昀海,常青,等.鏈脲佐菌素誘導樹鼩2型糖尿病[J].動物學研究,2013,34(2):108-115.
[7]王春田,王莉,石巖.2型糖尿病動物模型制備方法探討[J].實用中醫內科雜志,2011,25(4):27-30.
[8]Fu F,Tian F,Zhou H,et al.Semen cassiae attenuatesmyocardial ischemia and reperfusion injury in high-fat diet streptozotocininduced type 2 diabetic rats[J].Am J Chin Med,2014,42(1): 95-108.
[9]Hussein AA,Abdel-Aziz A,Gabr M,et al.Myocardial and metabolic dysfunction in type 2 diabetic rats:impact of ghrelin [J].Can JPhysiol Pharmacol,2012,90(1):99-111.
[10]Donath MY,Shoelson SE.Type 2 diabetes as an inflammatory disease[J].Nature Reviews Immunology,2011,11(2):98-107.
Construction of type 2 diabetesmellitusmodel of tree shrews and analysis of related factors
Huang Xia,Pan Xinghua,Pang Rongqing,Cai Xuemin,Ruan Guangping Cell Biological Therapy Center of Kunming General Hospital of Chengdu Military Command/Clinical College of Kunming General Hospital,Kunming Medical University/The Nation and Region Integrated Engineering Laboratory of Stem Cell and Immunocyte Biological Technology/Key Laboratory of Cell Therapeutic Transforming Medicine of Yunnan Province/Stem Cell Engineering Laboratory of Yunnan Province/Kunming Key Laboratory of Stem Cell and Regenerative Medicine,Kunming,Yunnan,650032,China
Objective To establish tree shrew type 2 diabetesmellitus(T2DM)model for the research on stem cell therapy,and to analyze the related factors.Methods T2DM model was established by the feeding with high sugar and fat combined with intraperitoneal injection with 100mg/kg streptozotocin(STZ).The intraperitoneal injection with STZ was carried out at the 6th week after themodeling,and every two weeks before and after the injection,fasting blood glucose(FBG),FINS,C peptide,HOMA-IR,total cholesterol,triglyeride,glycosylated hemoglobin,and oral glucose tolerance were detected.Since the 8th and 16th week after the modeling,observation was made in the changes in the pathological tissues of pancreas,liver,and kidney,and TNF-αand IL-6 expression levelswere detected.Results After themodeling,FBG continuously increased,while FINSand C peptide firstly increased and then decreased.Insulin resistance occurred.Meanwhile,TG and TC continuously increased after themodeling and reached to a stable high level after 12 weeks.Liver,kidney,and pancreas all showed distinctive pathological changes,and TNF-αand IL-6 increased in serum.Conclusion T2DM model is successfully established by the feeding with high sugar and fat combined with intraperitoneal injection with STZ.T2DM distinctive pathological changes occur.Inflammatory factorsmay be involved in the T2DM pathological process.
tree shrew;type 2 diabetes;streptozotocin;model
R 587.1
A
1004-0188(2015)08-0834-04
10.3969/j.issn.1004-0188.2015.08.008
2015-03-26)
國家973計劃項目(2012CB5181060);國家自然科學基金項目(31172170);云南省科技計劃重點項目(2013CA005)
650032昆明,成都軍區昆明總醫院細胞生物治療中心,昆明醫科大學昆明總醫院臨床學院,干細胞與免疫細胞生物醫藥技術國家地方聯合工程實驗室,云南省細胞治療技術轉化醫學重點實驗室,云南省干細胞工程實驗室,昆明市干細胞與再生醫學研究重點實驗室
潘興華,E-mail:xinghuapan@sohu.com.cn

