高效液相色譜—三重四級桿/復合線性離子阱質譜測定鼠腦組織中神經甾體類化合物
劉佳等

摘 要 建立了高效液相色譜串聯質譜法(HPLCMS/MS)測定鼠腦組織中6種神經甾體類激素(別孕烯醇酮、孕烯醇酮、孕酮、脫氧皮質酮、四氫脫氧皮質酮、去氫表雄酮)的方法。采用Agilent XDBC18色譜柱,以5 mmol/L乙酸銨甲醇為流動相,梯度洗脫分離,在電噴霧正離子模式下,以多反應監測(MRM)掃描模式采集數據,基質匹配內標法定量。孕酮和脫氧皮質酮在0.10~10 ng/mL范圍內呈良好的線性關系,別孕烯醇酮、孕烯醇酮、四氫脫氧皮質酮、去氫表雄酮在0.50~10 ng/mL范圍內呈良好的線性關系,相關系數均大于0.99; 在0.4, 4.0和8.0 ng/mL加標水平下的平均回收率為91.2%~115.5%;相對標準偏差(RSD,n=6)為0.87%~8.8%;檢出限為0.04~0.20 ng/mL,定量限為0.10~0.50 ng/mL。
關鍵詞 神經甾體; 液相串聯質譜; 多重反應監測; 鼠腦
1 引 言
神經甾體是指在神經系統中合成的甾體和經血腦屏障進入神經系統發揮作用的外周甾體及其代謝衍生物[1]。這些神經甾體可以通過結合不同的神經受體(如GABAA,Sigma受體)調控神經功能。神經甾體的行為與中樞神經系統正常功能的行使密切相關。研究表明, 在不同的生理和病理條件下,神經甾體在各個腦區中的含量會顯著變化[2,3]。神經甾體還會參與焦慮和抑郁的調節過程。由于神經甾體在生物體內含量極低,基質干擾多,使得生物體內內源性神經甾體的測定十分困難,因而開發快速、準確檢測生物體內神經甾體含量的方法就顯得尤為重要。
傳統的神經甾體的檢測方法有放射免疫標記法(RIA)和氣相色譜質譜聯用法(GCMS)[4],但放射免疫標記法特異性差,且存在安全隱患;氣相色譜質譜聯用法雖然靈敏度高,但樣品前處理步驟復雜,不能實現高通量分析。液相色譜質譜聯用技術由于其選擇性好、靈敏度高、適用范圍廣等優點,近年被廣泛應用到神經甾體檢測領域[5~8]。但這些工作有的需要復雜的衍生化過程[9],有的使用多個同位素內標,增加了檢測成本[10];有的只檢測1~2種待測物,缺乏全面性[7,11]。
本研究以大鼠腦組織為基質,建立了高效液相色譜串聯質譜法(HPLCMS/MS)同時檢測腦組織中別孕烯醇酮(AP)、孕烯醇酮 (PREG)、孕酮(PROG)、脫氧皮質酮(DOC)、四氫脫氧皮質酮(THDOC)、去氫表雄酮(HEA)6種神經甾體類化合物的方法。本實驗采用的高效液相色譜三重四級桿/復合線性離子阱質譜是一種新型質譜儀,與普通的液相色譜三重四級桿串聯質譜相比,提高了MS/MS掃描能力。本研究以甲基睪酮為內標,較同位素標記物內標方便易得,內源性雜質不干擾測定,提高了方法的準確度和精密度[12]。本方法無需衍生化,操作簡便、快速,可同時測定大鼠不同腦區中神經甾體的含量,為建立其他生物樣本中神經甾體的檢測方法提供參考。
2 實驗部分
2.1 儀器與試劑
LC20ADXR高效液相色譜(日本島津公司);AB SCIEX QTRAP 6500質譜儀(美國AB公司);固相萃取儀(美國Supelco公司);固相萃取柱Strata C18E 50 mg/1 mL(美國菲羅門公司);離心濃縮儀(美國Thermo公司);0.22 μm聚丙烯(Polypropylene)膜過濾離心管(美國Corning公司);MilliQ超純水儀(美國Millipore公司)
標準品別孕烯醇酮(Allopregnanolone,AP,純度98%)、孕烯醇酮 (Pregnenolone,PREG,純度98%)、孕酮(Progesterone,PROG,純度99%)、脫氧皮質酮(11Deoxycorticosterone,DOC,純度97%)、四氫脫氧皮質酮(Allotetrahydrodoc,THDOC,純度99.5%)、甲基睪酮(Methyltestosterone,MT,純度99%)、去氫表雄酮(Dehydroepiandrosterone,DHEA,純度99%)均為美國Sigma公司試劑。
甲醇(色譜純,美國Fisher試劑);乙酸銨(純度99%,美國Sigma公司);甲酸(純度88%,美國Fisher公司);實驗用水為MilliQ超純水(電阻率18.2 MΩ cm)。
2.2 溶液配制
將各標準品用甲醇配制成質量濃度為1 mg/mL的標準儲備液,并根據需要用甲醇水(1∶1, V/V)稀釋成適當質量濃度的混合標準溶液,
Symbolm@@ 20℃保存。
2.3 樣品前處理
2.3.1 標準曲線的構建 配制5% BSA0.7% NaCl溶液,加入不同濃度的AP,PREG,DOC,THDOC,PROG,DHEA標準品,濃度范圍為0.1 ~ 10 ng/mL,再加入相同濃度(0.3 pg/mL)的內標物MT,振蕩混勻后進行液液萃取。加入1.2 mL乙酸乙酯正己烷(9∶1, V/V),渦旋5 min,于12000 r/min下離心5 min,將上層有機相轉入另一潔凈離心管中。氮氣吹干,100 μL甲醇水(1∶1, V/V,0.1% 甲酸)復溶。12000 r/min離心15 min,上清液供HPLCMS/MS分析。
2.3.2 鼠腦組織 大鼠采用異氟烷麻醉,斷頭取血,冰浴分離內側前額葉皮層(mPFC)、海馬(HF)和丘腦腹后核(VP),液氮保存,稱重(準確稱至0.1 mg)。每份組織中加入0.49 mL超純水,10 μL 15 pg/mL MT,電動勻漿機勻漿,超聲。采用液液萃取法(見2.3.1節)和固相萃取法(見2.3.3節)兩種方法處理。
2.3.3 固相萃取方法 預先以1 mL甲醇、1 mL水活化平衡Strata C18柱。將組織勻漿液于12000 r/min下離心5 min,然后將上清液加入Strata C18柱中; 以1 mL 5%甲醇作為淋洗液,淋洗Strata C18柱。抽至近干后,以1 mL甲醇洗脫。收集洗脫液,常溫下用N2吹干。100 μL甲醇水(1∶1, V/V,0.1% 甲酸)復溶。12000 r/min離心15 min,上清液供UFLCMS/MS分析。
2.4 色譜條件
Agilent XDBC18色譜柱( 50 mm×4.6 mm,1.8 μm,美國安捷倫公司)。流動相:5 mmol/L乙酸銨溶液(A)和甲醇(B);采用梯度洗脫模式:0~2.5 min,60% B;2.5~5.5 min,60%~95% B;5.5~7.0 min,95% B;7.0~7.1 min,95%~60% B;7.1~10.0 min,60% B。流速0.5 mL/min。進樣體積10 μL;樣品室溫度為室溫;柱溫45℃;采用內標法進行定量分析。
2.5 質譜條件
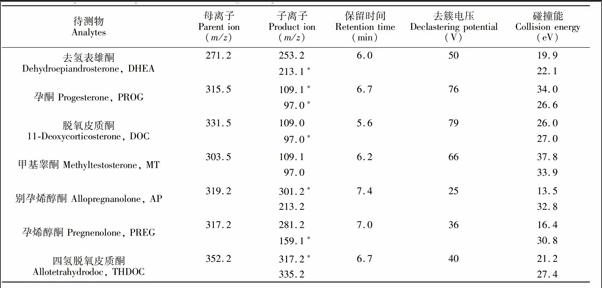
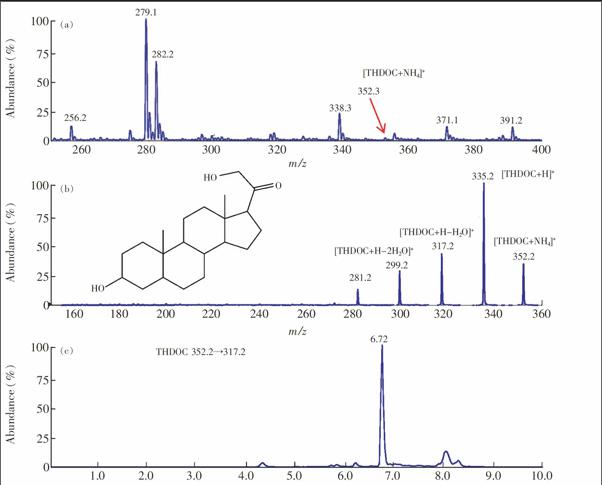
電噴霧離子源(ESI),正離子掃描方式,多反應監測掃描(MRM)模式。離子化電壓(IS):5500 V,氣簾氣(CUR):241.33 kPa,噴霧氣(GS1):413.7 kPa,輔助加熱氣(GS2):413.7 kPa,碰撞器(CAD): Medium。由于THDOC的氨加合物物受熱容易分解,離子源溫度(TEM)設為100℃。各物質離子對優化后參數見表1。
3 結果與討論
3.1 質譜條件的建立
神經甾體類化合物既可以用電噴霧離子源(ESI)電離,也可以用大氣壓化學電離源(APCI)分析[10],本研究采用ESI正離子模式作為其離子化方式。取濃度為1.0 mg/L的各神經甾體標準溶液,采用微量蠕動泵連續進樣,一級質譜全掃描,確定準分子離子。結果顯示,6種神經甾體均在正離子模式下獲得準分子離子峰。對除THDOC外, 其余5種神經甾體以母離子為準分子離子,對其進行二級質譜掃描,選豐度最高的兩個特征碎片離子作為定性定量離子,并優化相應離子對的去簇電壓(Declusteringpotential, DP)、碰撞能量(Collision energy, CE)、碰撞室出口電壓(Collision cell exit potential, CXP)和
3.2 液相色譜條件的選擇
3.2.1 色譜柱對分離的影響 6種甾體類激素化學結構相似,如別孕烯醇酮(AP)與孕烯醇酮(PREG)分子結構十分相近,盡管MRM方式不要求所有峰都基線分離,但分離不佳易引起共流出物之間的互相抑制。本研究分別比較了Shimpack XRODS(50 mm × 4.6 mm,2.2 μm, 島津公司)、Shimpack XRODS(100 mm×4.6 mm,2.2 μm, 島津公司)、XDBC18(50 mm×4.6 mm,1.8 μm, 安捷倫公司)、Synergi Hydro RP(150 mm×2.0 mm,4 μm, 菲羅門公司)和Venusil XBP C18( 150 mm×2.1 mm,5 μm, 安吉爾公司)5種色譜柱對6種甾體類化合物的分離效果。結果表明, XDBC18色譜柱對6種甾體類化合物的分離效果最好, 因此本研究以其為分離柱。6種甾體類化合物的保留時間見表1,相應的結構式和MRM色譜圖見圖2。
3.2.2 流動相對分離的影響 以XDBC18為色譜柱,考察不同流動相對6種甾體類化合物分離的影響。分別對比了在A相和B相中加入酸或緩沖鹽時的檢測結果。結果表明,A相為純水時對甾體類化合物色譜峰分離信號響應, 優于酸化純水(0.1% 甲酸),可能因為甲酸改變了流動相的pH值,進而影響了待測物在分析柱上的保留。在水中添加揮發性緩沖鹽乙酸銨,比較添加前后對甾體類物質的保留時間、分離度、色譜峰形、靈敏度等的影響情況。結果表明,A相為5 mmol/L乙酸銨溶液,B相為純甲醇時,分離效果最佳。
3.2.3 柱溫對的影響 考察了柱溫箱溫度為35℃和45℃時對信號的影響,樣品是1 ng/mL混合標樣。柱溫在45℃時待測物保留時間會縮短。對于AP,當柱溫為35℃時,其響應淹沒于本底噪音中;當柱溫為45℃時,可以看到明顯的AP峰。由于神經甾體在組織中濃度很低,儀器靈敏度是優先考慮的問題,因此柱溫選擇為45℃。
3.3 生物樣品前處理條件的優化
3.3.1 液液萃取(LLE)和固相萃取(SPE)的比較 液液萃取和固相萃取是生物樣品常用的兩種樣品前處理技術,兩者均有其各自的優勢與特點。液液萃取簡單、廉價,但背景干擾高于固相萃取。本研究以THDOC為例,比較了兩種萃取方法對于提取鼠腦組織中的神經甾體的效果。結果表明,液液萃取的效果明顯優于固相萃取。而且液液萃取1次后,THDOC的響應高于液液萃取3次,這可能是由于萃取的次數過多導致腦組織中的雜質也進入到萃取液中。圖3展示了不同萃取條件下,海馬組織中THDOC的響應情況。
3.3.2 內標物的選擇 本研究為了體現方法的通用性和簡便性,沒有采用昂貴的同位素內標,而是選擇甲基睪丸酮(MT)作為內標,其結構式見圖2。MT較同位素內標更為方便易得,內源性雜質不干擾測定,內標與樣品的提取回收率相近,提高了方法的精密度和準確度[12]。
3.4 方法驗證
3.4.1 線性范圍檢出限定量限 由于存在基質效應,標準品在甲醇/水溶液中的質譜響應與其在生物基質中的響應不同,所以應將不同濃度的標準品加入到空白基質中,以制作工作曲線。而神經甾體屬于內源性物質,無法得到空白基質,于是選用5%BSA0.7% NaCl作為空白基質[7]。配制濃度為0.1, 0.2, 0.5, 1, 2, 510 ng/mL的6種神經甾體類化合物的溶液,按2.3節的方法處理并測定,平行測定3次。以目標組分峰面積/內標峰面積為縱坐標,響應的添加含量為橫坐標,繪制標準曲線。依據特征離子MRM色譜峰的信噪比大于3為檢出限,信噪比大于10為定量限,結果見表2。6種神經甾體激素的LODs為0.04~0.20 ng/mL,定量限LOQs確定為0.10~0.50 ng/mL。DOC和PROG在0.1~10 ng/mL范圍內呈良好的線性關系,PREG,THDOC,AP和DHEA在0.5~10 ng/mL范圍內呈良好的線性關系。
[KH*4D][HT5”SS][HJ*4]表2 6種神經甾體類化合物的線性方程、相關系數、檢出限和定量限
去氫表雄酮 DHEAy=0.0106x+0.007460.99770.50~10 0.20[]0.50
孕酮 PROGy=0.644x+0.03690.99870.10~10 0.04[]0.10
脫氧皮質酮 DOCy=0.402x+0.0004740.99470.10~10 0.04[]0.10
別孕烯醇酮 APy=0.365x+0.09350.99930.50~10 0.10[]0.50
孕烯醇酮 PREGy=0.0406x+0.006650.99100.50~10 0.10[]0.50
四氫脫氧皮質酮 THDOCy=0.236x-0.01390.99930.50~10 0.20[]0.50
[BHDFG1*2,WKZQ0W][BG)W][HT5][HJ] 以5% BSA0.7% NaCl作為空白基質, 考察方法的可靠性[14]。即在鼠腦組織中加入不同濃度的標準品,比較以鼠腦組織作為基質和溶液作為空白基質時工作曲線的斜率,發現兩者基本一致。實驗表明,以5%BSA0.7% NaCl溶液作為空白基質測定神經甾體是可靠的。
3.4.2 方法的回收率與精密度 在線性范圍內選擇3個添加水平,分別為0.4,4.0和8.0 ng/mL,按照2.3~2.5節方法平行測定6次,各化合物的平均回收率為91.2%~115.5%,RSD為0.9%~8.8%,具體數據見表3。
3.5 實際樣品分析
利用本方法測定了成年大鼠腦組織不同分區中的6種神經甾體的濃度,結果見表4。
4 結 論
本研究建立了高效液相色譜串聯質譜(HPLCMS/MS)測定鼠腦組織中6種神經甾體類激素的檢測方法。在樣品前處理過程中,發現乙酸乙酯正己烷萃取1次效果良好;優化了高效液相色譜串聯質譜法同時檢測多種內源性神經甾體類激素的儀器條件;采用內標法同時對6種激素進行定量分析,均獲得了較好的效果。該方法樣品前處理簡單、靈敏度高、選擇性好,有望廣泛地應用于生物組織中痕量甾體類激素的檢測。
References
1 Robel P, Baulieu E E. Trends Endocrinol. Metab., 1994, 5(1): 1-8
2 Luchetti S, Huitinga I, Swaab D F. Neuroscience, 2011, 191: 6-21
3 Reddy D S, Rogawski M A. J. Neurosci., 2002, 22(9): 3795-3805
4 Liere P, Akwa Y, WeillEngerer S, Eychenne B, Pianos A, Robel P, Sjovall J, Schumacher M, Baulieu E E. J. Chromatogr. B, 2000, 739(2): 301-312
5 Caruso D, Scurati S, Maschi O, de Angelis L, Roglio I, Giatti S, GarciaSegura L M, Melcangi R C. Neurochem. Int., 2008, 52(45): 560-568
6 Keevil B G. Best Pract. Res. Clin. Endoc. Metab., 2013, 27(5): 663-674
7 Rustichelli C, Pinetti D, Lucchi C, Ravazzini F, Puia G. J. Chromatogr. B, 2013, 930: 62-69
8 Wang Y Q, Karu K, Griffiths W J. Biochimie, 2007, 89(2): 182-191
9 Ahonen L, KeskiRahkonen P, Saarelainen T, Paviala J, Ketola R A, Auriola S, Poutanen M, Kostiainen R. Anal. Chim. Acta, 2012, 721: 115-121
10 Galuska C E, Hartmann M F, SanchezGuijo A, Bakhaus K, Geyer J, Schuler G, Zimmer K P, Wudy S A. Analyst, 2013, 138(13): 3792-3801
11 KeskiRahkonen P, Huhtinen K, Desai R, Harwood D T, Handelsman D J, Poutanen M, Auriola S. J. Mass Spectrom., 2013, 48(9): 1050-1058
12 REN JinMin, HOU YanNing. Acta Phamaceutica Sinica, 2005, 40(3): 262-266
任進民, 侯艷寧. 藥學學報, 2005, 40(3): 262-266
13 Jantti S E, Tammimaki A, Raattamaa H, Piepponen P, Kostiainen R, Ketola R A. Anal. Chem., 2010, 82(8): 3168-3175
14 Minkler P E, Stoll M S K, Ingalls S T, Yang S M, Kerner J, Hoppel C L. Clin. Chem., 2008, 54(9): 1451-1462
act An analytical method based on high performance liquid chromatography tandem mass spectrometry was developed for the simultaneous determination of 6 neurosteroids in rat brain tissues. The neurosteroids were separated on an Agilent XDBC18 column (50 mm×4.6 mm, 1.8 μm), using methanol5 mmol/L ammonium acetate as the mobile phase. A gradient elution program with a cycle time of 10 min was used. The neurosteroids were detected by electrospray ionization mass spectrometry in positive mode with multiple reaction monitoring (MRM) scan mode. For 11deoxycorticosterone (DOC) and progesterone (PROG), the linear range of calibration curve was from 0.10 ng/mL to 10 ng/mL, and for allopregnanolone (AP), pregnenolone (PREG), dehydroepiandrosterone (DHEA) and allotetrahydrodoc (THDOC), the linear range calibration curve was from 0.50 ng/mL to 10 ng/mL, both with the correlation coefficient more than 0.99. The mean recoveries at spiked levels of 0.4, 4.0 and 8.0 ng/mL were in the range of 91.2%-115.5%, and the RSDs were 0.9%-8.8% (n=6). The limits of detection and quantification were 0.04-0.20 ng/mL and 0.10-0.50 ng/mL, respectively.endprint

