藻源型溶解性有機氮的產生及不同時期藻類有機物的特性
古 勵,郭顯強,丁昌龍,何 強,單志俊(.重慶大學,三峽庫區生態環境教育部重點實驗室,重慶400045;.中國海誠工程科技股份有限公司,上海 0003)
藻源型溶解性有機氮的產生及不同時期藻類有機物的特性
古 勵1*,郭顯強1,丁昌龍1,何 強1,單志俊2(1.重慶大學,三峽庫區生態環境教育部重點實驗室,重慶400045;2.中國海誠工程科技股份有限公司,上海 200031)
研究了銅綠微囊藻藻細胞全生命周期中氮的轉化過程以及藻類有機物的性質,結果表明:溶解性有機氮(DON)在藻類生長周期中總體呈現上升趨勢,藻細胞在其生長初期釋放量小于 0.05mgDON/107cells,衰亡期釋放能力約為 0.40mgDON/107cells;胞外有機物(EOM)中分子量分布在對數期和衰亡期以<1kDa和>100kDa為主,穩定期以<30kDa為主;胞內有機物(IOM)的分子量分布隨藻的生長變化較小,集中在<1kDa和>100kDa范圍內.三維熒光光譜分析表明,EOM中熒光物質主要為類腐植酸和溶解性微生物代謝產物;而IOM主要由類芳香蛋白和溶解性微生物代謝產物組成.
銅綠微囊藻;氮轉化;溶解性有機氮
水體富營養化會導致藻細胞的大量繁殖,爆發藻華事件.藻的大量繁殖會釋放大量的代謝產物,對水處理過程造成干擾,如影響混凝效果[1-3],加速膜污染[4],生成消毒副產物[5-6]等,且干擾程度受藻類代謝產物的性質影響.藻類有機物(AOM)由胞外有機物(EOM)和胞內有機物(IOM)組成.EOM由藻細胞生長代謝釋放形成,IOM多源自藻細胞破裂釋放出來的內含物.通常認為藻類有機物包含低聚糖類物質、多糖、蛋白質、多肽、氨基酸以及少量的有機酸,其中蛋白質、多肽、氨酸均為典型的有機氮類物質(DON)[1,5-8].
DON是水中含氮有機物的總稱,是水中溶解性有機物(DOM)的重要組成部分,是含氮消毒副產物的重要前體物[9-10].在氯(胺)消毒過程中,DON中的某些組分可以與消毒劑發生反應生成比含碳消毒副產物(C-DBPs)毒性更高的含氮消毒副產物(N-DBPs),如鹵乙酰胺(HAcAms)、鹵代硝基甲烷(HNMs)、鹵乙腈(HANs)等[11-12].有研究表明[13-14],含氮消毒副產物的生成特性不僅與DON的濃度水平有關,其理化性質對其生成特性也有很重要的影響.
藻類有機物因其藻所處生長周期、環境及藻種類差異呈現出不同的性質[2,8,15],在研究藻源型消毒副產物時,學者多以對數期或者穩定期的藻類為對象,分析該階段藻類有機物性質及消毒副產物的生成特性,缺乏對不同生長周期藻的藻類有機物性質的系統分析.而水處理過程中消毒副產物的生成量與藻類有機物的性質密切相關.基于此,本文選擇銅綠微囊藻為典型代表,研究藻類全生命周期中的氮的轉化過程以及DON的產生及變化規律,對不同生長階段藻的AOM的性質進行分析比較,以期為藻華爆發水體中氮元素的轉化規律,以及高藻水處理過程中含氮消毒副產物前體物的控制提供參考.
1 材料與方法
1.1藻的培養
銅 綠 微 囊 藻 (Microcystis aeruginosa, FACHB-905)購自中國科學院水生生物研究所.采用序批式培養,向裝有750mL培養基的1L三角瓶中接種少量處于對數生長期純藻種,置于恒溫光照培養箱中培養,期間不再補充培養液,培養基采用BG-11培養基.恒溫培養箱中光照強度為1500~2000lx,溫度為(25±1)℃,光暗比為 12h/12h.藻密度采用血球計數板計數.
1.2藻類有機物的分離
EOM 采用藻類懸浮液離心法,選取藻類懸濁液,離心機(TDL-4A,菲恰爾)4000r/min,離心20min,取上清液過濾,濾出液即為 EOM.向離心管中加入等體積的超純水,將沉淀于離心管底部的藻重新混合均勻,置于離心機按照 EOM分離步驟清洗3次,確保不含 EOM,然后采用凍融法反復凍融 3次,顯微鏡下觀察藻細胞數目,確保80%以上的藻細胞被破壞釋放 IOM,最后用濾膜過濾獲取IOM.
1.3測試方法
溶解性有機碳(DOC)采用 TOC測試儀(TOC-VCPH,島津,日本)測定;UV254采用紫外-可見分光光度計(DR5000,HACH,美國)測定;分別采用紫外分光光度法、N-(1-萘基)-乙二胺分光光度法以及納氏試劑分光光度法測試 NO3--N、NO2--N和NH4+-N,采用堿性-過硫酸鉀消解分光光度法測定TN[16],DON的質量濃度采用總氮減去無機氮的差減法獲得,其分析誤差為TN、NO3--N、NO2--N、NH4+-N的方差總和[16-17].
采用超濾法進行分子量切割,過濾方式為平行過濾[18-20],超濾膜的孔徑分別為 100,30,10,5, 1K;三維熒光光譜(3DEEM)采用熒光分光光度計(F-7000,Hitachi,日本),參數設置:激發波波長掃描范圍為 200~550nm,發射波波長掃描范圍為220~650nm,掃描間隔均為5nm,狹縫寬度為5nm,光電倍增管(PMT)電壓為 600V,掃描速度為60000nm/min,響應時間為0.002s.EEM譜圖均扣除超純水空白,運用origin 8.5.1繪制三維熒光光譜譜圖.熒光區域積分定量分析前將瑞利散射上方的數據置為零,消除瑞利散射的影響;以超純水做空白參比,消除拉曼散射影響[21-24].
2 結果與討論
2.1藻細胞的生長周期的確定
實驗條件下銅綠微囊藻的生長曲線如圖1所示,其生長周期可被劃分為 4個階段,即適應期0~5d,對數生長期6~33d,穩定生長期34~131d,衰亡期>132d.適應期藻類數量沒有明顯變化;在對數生長期,藻密度急劇增長,此階段藻生長代謝旺盛;進入穩定期后,藻密度在較長時間內維持在一定濃度水平,持續 90多天,此階段部分藻細胞增殖-衰敗交互生長,藻細胞數目基本穩定,但胞內有機物釋放至胞外造成會大量胞外有機物的積累;衰亡期,藻細胞衰敗速率加快,增殖速率放緩,藻密度逐漸減小,藻液由暗綠色變為黃綠色,繼而變為黃色,最終成為白色.此外,藻液由黃綠色變為淡黃色的過程持續時間僅為幾天.
Yang等[15]通過胞外有機物的TOC、藻細胞的TOC以及藻密度3個指標繪制了銅綠微囊藻的生長曲線,確定適應期0~3d,對數生長期4~22d,又是穩定期持續時間長,穩定期與衰亡期的界限沒有得出.Pivokonsky等[1]以葉綠素a以及EOM 的 DOC繪制了銅綠微囊藻的生長曲線,通過葉綠素a的監測確定適應期為0~2d,對數生長期為3~6d,穩定生長期為 7~16d,16d便進入衰亡期;EOM中DOC呈現相對一致的趨勢,適應期DOC增長緩慢,對數期由于代謝旺盛增速加快,穩定期呈現緩慢的增長,衰亡期 DOC迅速增大.本實驗所得銅綠微囊藻生長周期相對較長,與吳劍、方晶云等[25-26]所得生長曲線較為一致,不同學者得出的藻生長曲線存在較大的差異與所用的培養基及接種量的不同等因素直接相關.
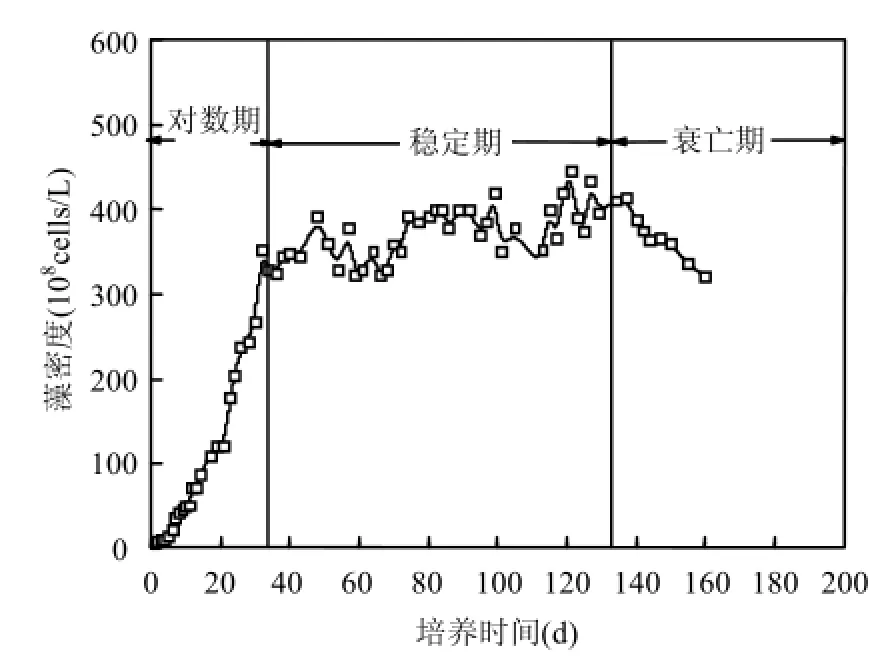
圖1 銅綠微囊藻生長曲線Fig.4 The growth curve for Microcystis aeruginous cultivated in batch
2.2生長周期中氮的轉化
2.2.1無機氮 由圖2可以看出,NO3--N在整個生長周期中持續下降,NO2--N和NH4+-N呈現先增加后降低的趨勢,這與吳劍等[25]研究結論相似.適應期,并未出現藻的大量增殖對 NO3--N進行消耗;對數生長期,藻細胞迅速增殖值,大量的營養元素被利用,NO3--N濃度幾乎呈線性降低;穩定生長期初期,藻細胞仍保持著較高的活性,且藻細胞的體積較之前有所增加,部分營養物質被藻細胞作為能量儲存在體內,穩定生長期亦存在藻細胞的衰敗,其衰敗速率隨著藻的生長逐漸增大,初期衰敗速率增長緩慢,NO3--N被消耗的速率遠大于衰敗釋放質環境中的速度,NO3--N下降速率依然較大;穩定期中后期,衰敗速率與增長速率持平,藻密度呈現穩定狀態,NO3--N下降速率減緩;進入衰亡期,初期NO3--N濃度仍有所降低,至末期NO3--N略有上升,可能的原因是:末期藻密度減小,活性降低,光合作用產生的氧氣很少,胞內物質隨著藻細胞大量衰敗釋放到水體,DON存在少量分解,從而導致NO3--N略微上升.
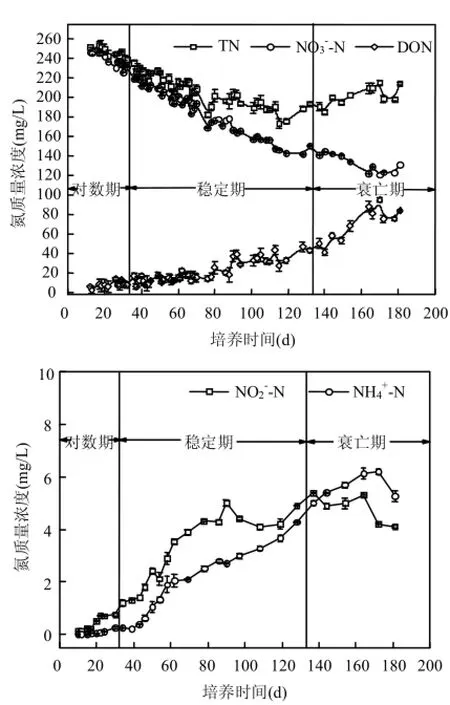
圖2 銅綠微囊藻EOM中不同氮形態質量濃度變化曲線Fig.4 Transformation for different nitrogen during the growth of Microcystis aeruginous
NO2--N濃度隨著藻密度的增加,呈現先增大隨后略微降低的趨勢,但均在10mg/L以內,相對于NO3--N變化微弱.關于NO2--N的變化趨勢,可能存在以下兩方面原因:(1)NO3--N被藻細胞吸收過程中首先被硝酸還原酶還原成亞硝酸鹽,然后通過亞硝酸鹽還原酶和谷氨酸合成酶最后合成胞內有機物質,硝酸鹽氮和亞硝酸鹽氮均可以作為藻的碳源被利用,但當細胞活性降低時,部分亞硝酸鹽隨藻代謝產物被釋放到胞外[27];(2)銅綠微囊藻在光照條件下光合作用產生氧氣,黑暗條件下呼吸作用耗氧造成氧化還原電位較低,可能存在自養反硝化作用,產生中間產物 NO2--N釋放至胞外[25].NH4+-N呈現緩慢的上升趨勢,但最高濃度小于10mg/L.藻細胞內及釋放至胞外的有機氮可能被藻細胞利用或部分分解,產生了中間產物 NH4+-N,隨著有機氮的累積,中間產物NH4+-N濃度也逐漸增加.
2.2.2總氮及有機氮 如圖2所示,藻液中的總氮濃度在適應生長期、對數生長期以及穩定生長期與NO3--N的變化趨勢一致,但在衰亡期,由于藻細胞的大量衰敗致使藻細胞內儲存的含氮有機物釋放至胞外環境中,使得 TN濃度呈現較明顯的上升趨勢.對于 DON,適應生長期幾乎沒有釋放;對數生長期細胞代謝旺盛,且少有藻細胞的衰敗,因此僅有少量DON的釋放;穩定生長期初期 DON的濃度上升速度依然緩慢,進入穩定期中后期 DON濃度上升速度明顯加快,可能的原因是:穩定期初期,藻細胞衰敗數量較少,隨著培養基中營養物質逐漸消耗殆盡,藻細胞死亡數量增加,致使含氮豐富的內含物(如氨基酸、藻青蛋白、脂肪胺等)釋放進入環境中,DON濃度迅速增加;衰亡期,藻細胞衰亡速度進一步加快,更多的胞內有機物釋放,DON出現累積.
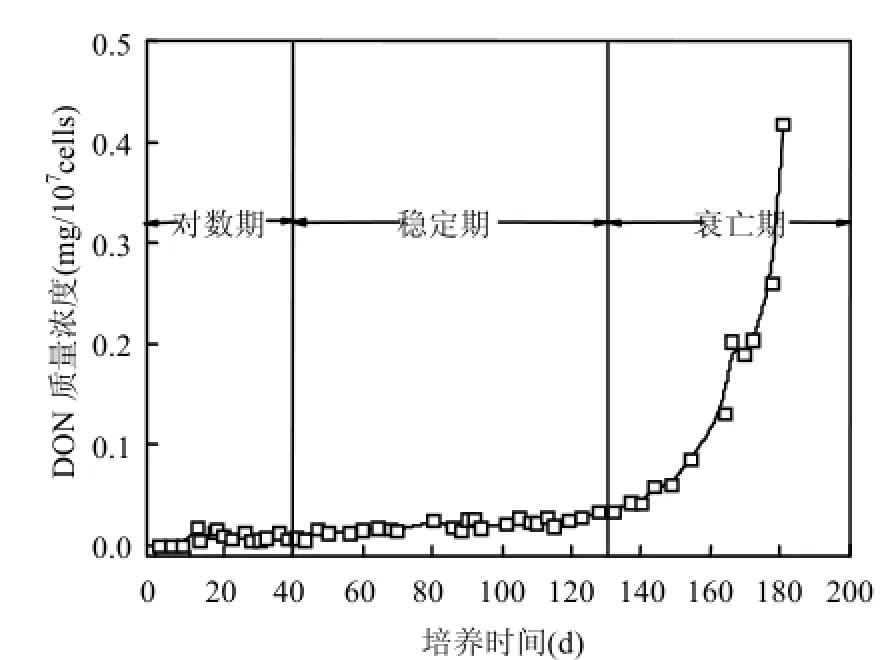
圖3 單位藻細胞(107cells)產生的DON隨生長周期的變化Fig.4 DON mass concentration per 107cells during the growth period
胞內物質的釋放使得EOM中有機物濃度升高,可能會對混凝起到抑制作用,難以去除[1,3].此外,研究表明 DON的濃度與含氮消毒副產物呈一定正相關[28],而穩定期中后期以及衰亡期EOM中的DON濃度非常高,最高接近100mg/L,因此當水源水爆發藻華時,應該特別注意對藻EOM 性質進行表征,根據水質情況慎重選擇應急處理措施,避免消毒中N-DBPs產率過高引發用水安全風險.
從圖 3可看出,處于對數生長期以及穩定生長期的銅綠微囊藻釋放 DON的能力小于0.05mg/107cells,進入衰亡期藻細胞釋放 DON的能力急劇上升,升至 0.4mg/107cells,盡管這主要是由于藻細胞EOM中DON的積累以及藻密度的逐漸減小所致,但以上數據提供了藻華爆發期間液相 DON濃度的基本參考,可通過藻細胞的數量,初步了解所釋放含氮有機物的數量.
2.3不同生長周期的藻類有機物性質表征
2.3.1不同生長周期基本水質參數的變化 從表 1可以看出,AOM在各個時期的特征紫外吸光度值(SUVA值)均較低,為0.87~2.34L/(m?mg). SUVA值與物質的芳香度以及疏水性物質的數量呈正相關關系[29],SUVA值低表明AOM的芳香性較低以及親水性有機物含量較高.另一方面,SUVA值低還表明藻類有機物中腐植酸和富里酸類物質、高分子質量有機物、不飽和雙鍵及芳香族類有機物含量少,不易被混凝沉淀工藝去除[30].IOM的SUVA值隨著藻細胞生長周期的延長逐漸增大,由0.87增至1.79,最終高達2.34,說明IOM隨著藻的生長,其芳香性、疏水性物質逐漸增加;EOM 的 SUVA值為 0.88~1.34L/ (m?mg),隨生長周期不同變化較小,表明EOM中親水性物質較多,不易被去除.IOM中DOC/DON質量濃度比可以看出,穩定期的 IOM中含有的有機氮成分最高,而對數期的 IOM中有機氮成分比例最低,衰亡期的 IOM中有機氮可能作為能量物質被藻細胞消耗,致使比例相對較低.可能的原因:對數期營養物質充足,藻細胞增殖速度快,儲存的能量物質較少,穩定期出現營養物質的競爭,蛋白質作為藍藻的重要的儲能物質貯存于胞內[1],表現為有機氮組分的增加,而衰亡期營養物質嚴重缺乏,胞內能源物質被藻細胞消耗,DON/DOC下降.
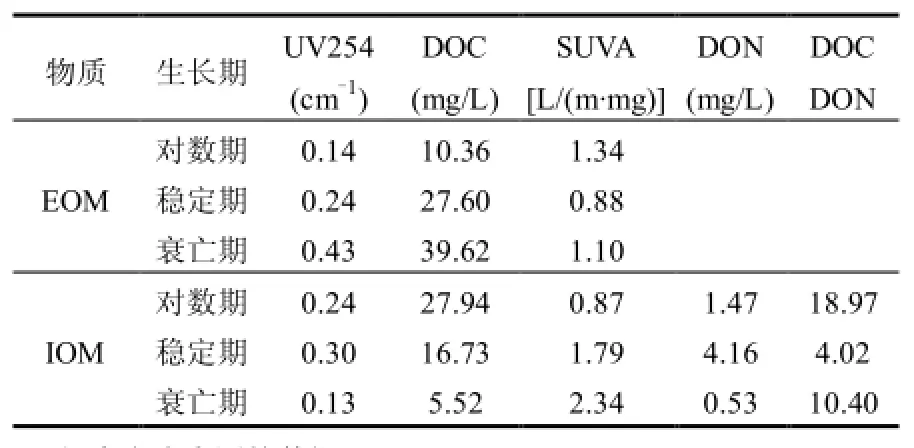
表1 不同生長周期的EOM/IOM的基本水質參數Table 1 Characteristics of EOM/IOM extracted from different growth phases
2.3.2不同時期藻類有機物分子量分布特性如圖4所示,3個時期IOM分子量分布均為雙峰型,主要集中在<1kDa的和>100kDa兩個范圍內.對數生長期、穩定生長期、衰亡期的銅綠微囊藻的IOM的分子量在<1kDa和>100kDa的范圍內所占的比例分別為16%、25%、44%和76%、61%、54%,表明隨著藻細胞的生長,藻細胞內含物中小分子有機物所占的比重在增加,大分子的物質所占的比重減小.IOM中小于1kDa的物質包括葉綠素、藻毒素、嗅味化合物、氨基酸等,大于100kDa的有機物主要包含藻藍蛋白和碳水化合物等[31].出現上述情況可能的原因:環境中營養元素逐漸減少,藻細胞之間對營養物質的競爭逐漸增強,使得穩定期儲存的部分胞內物質被藻細胞自身降解利用轉化為小分子有機物[1].
相比之下,EOM的分子量分布在對數期和衰亡期大致相同,分子量分布集中在<1kDa和>100kDa 2個區域,其中對數期兩個分子量區域所占的比例為41%、45%,衰亡期為24%和58%.穩定生長期EOM的分子量分布與對數期和衰亡期存在較大差異,主要集中在<30kDa的范圍內(約占 EOM 的 93%),其中<1kDa、1~5kDa、5~10kDa、10~30kDa的EOM所占總EOM的比例分別為24%、26%、31%、12%.實驗中所取對數期藻處于對數期后期,因此 EOM分子量分布情況與 Henderson[8]研究的穩定生長期初期的EOM分子量分布較為相似.衰亡期EOM中大分子有機物的增加主要是由細胞死亡裂解后釋放出大量大分子胞內有機物造成的.
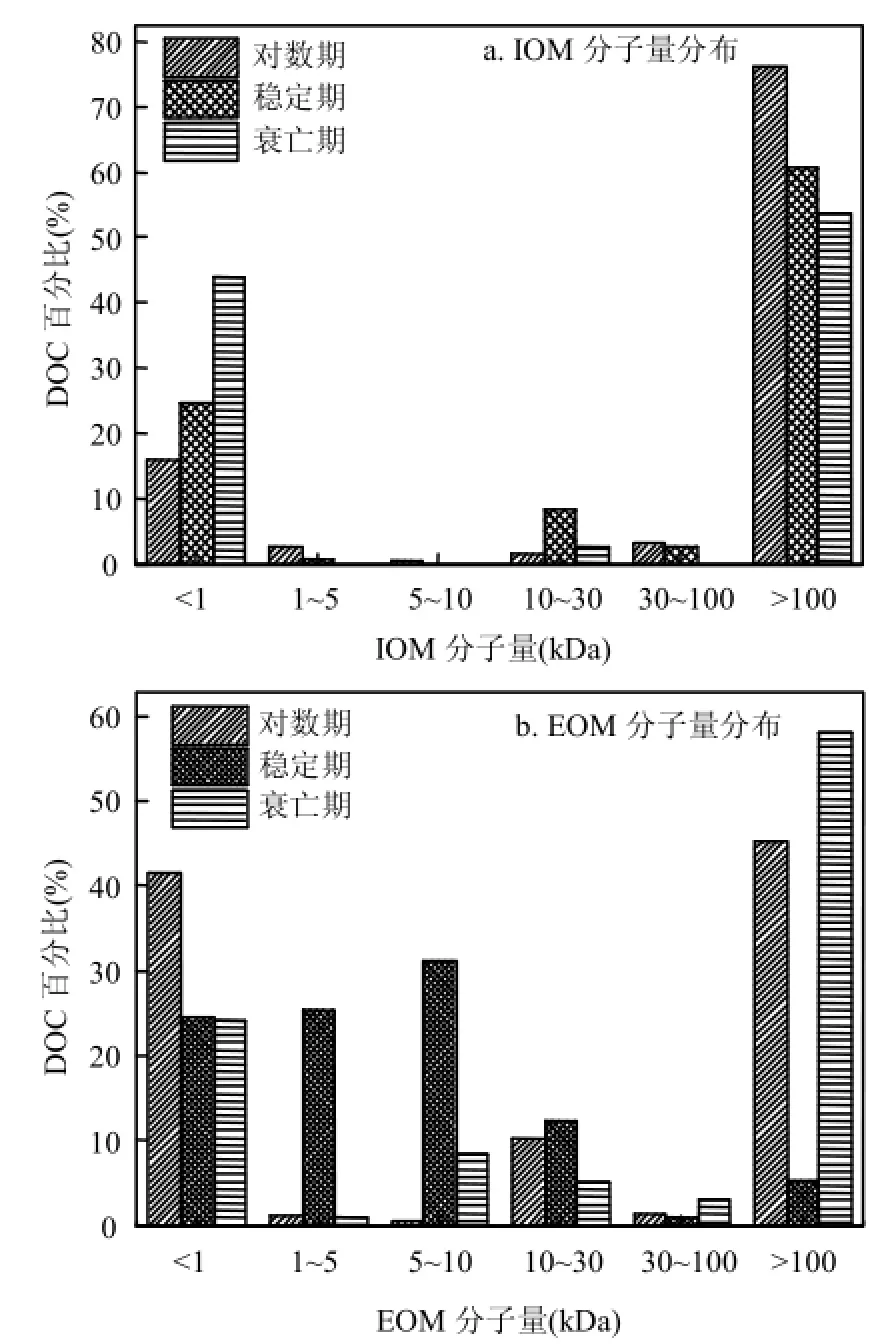
圖4 不同生長周期的藻類有機物分子量分布Fig.4 Transformation of MW fractions of AOM under different growth stages
由圖5可以看出,對數期與衰亡期的EOM和IOM的分子量分布相似,穩定期的EOM和IOM分子量分布有較大差異.分析其原因可能是:對數期的藻細胞所處環境營養物質充足,且代謝旺盛,使得藻細胞胞內胞外有機物性質相似;而穩定期有內含物的釋放,同時新的藻細胞生長對內含物進行利用和代謝,從而使得大分子細胞降解,形成1~100kDa的中等分子量結構的有機物;衰亡期,藻細胞的衰亡破裂向EOM中釋放大量胞內物質,致使衰亡期的IOM和EOM分子量分布相似.
2.3.3不同生長周期藻類有機物三維熒光表征 相比其他表征方法,三維熒光光譜的選擇性更強以及靈敏度更高,并且操作簡單,被廣泛用于有機物性質的表征過程.根據 Chen等[21]的研究,將熒光區域劃分為5個區域:區域I和II(芳香蛋白類,λex<250nm, λem<380nm),區域 III(富里酸類,λex<250nm, λem>380nm),區域 IV(溶解性微生物代謝物類,λex>250nm, λem<380nm)及區域V(腐殖酸類,λex>250nm, λem>380nm).區域I、II 和IV代表有機氮類物質,區域III和V代表有機碳化合物[26].
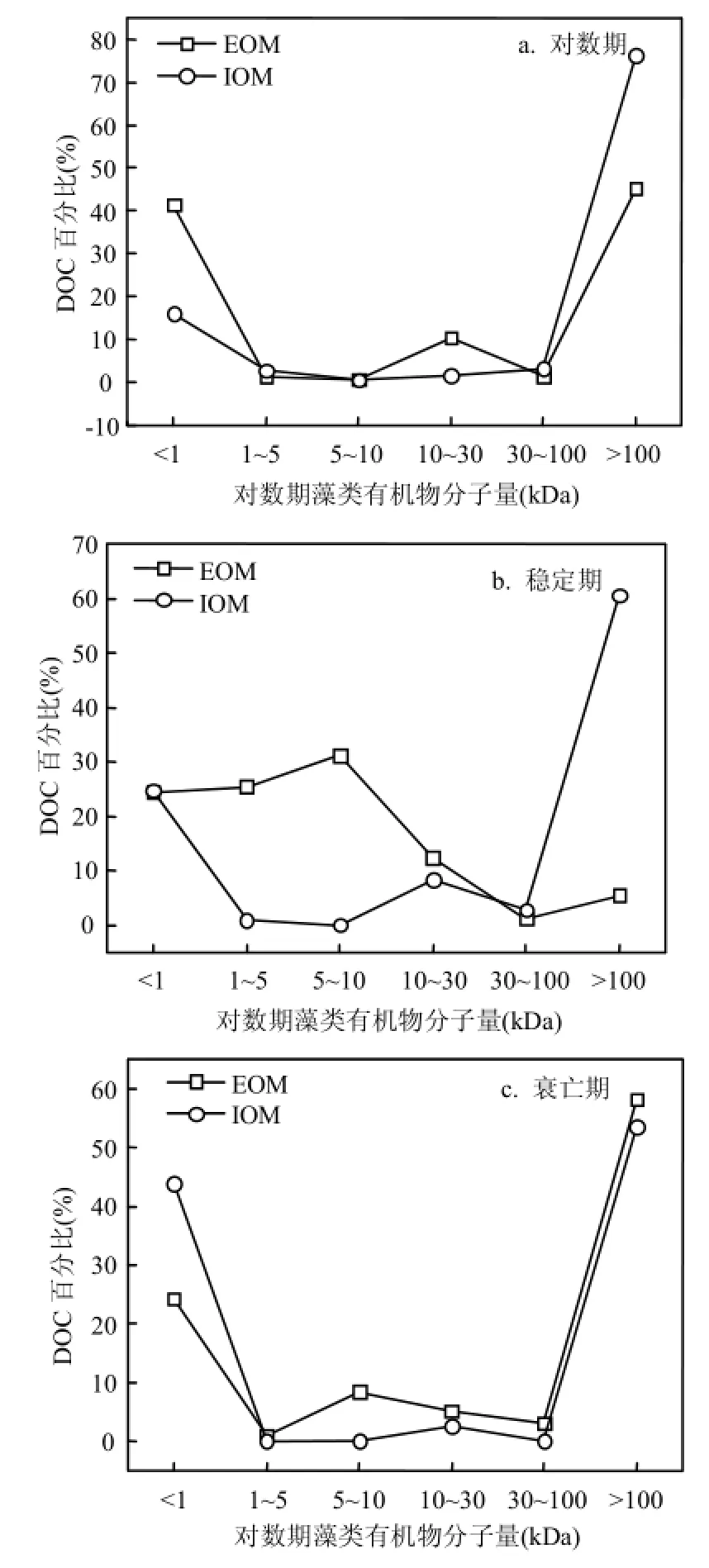
圖5 不同生長周期的藻類有機物分子量分布對比Fig.4 Molecular weight (MW) distributions of AOM under different phases
如圖6所示,EOM熒光特征峰主要集中在區域 IV和 V,且區域 IV所在的峰強度更大,表明EOM 中含有大量的腐植酸類物質和溶解性微生物代謝產物.溶解性微生物代謝產物(SMPs)由酪氨酸、色氨酸、蛋白類等富含有機氮的物質組成,因此 EOM中有機氮類物質占較大比重,這與 Li等[6]研究一致.區域 IV內的熒光峰位置隨著生長周期的延長沒有發生偏移,峰強有所增加(表2),這主要是由微生物代謝產物的累積所造成的.區域V內的熒光峰位置隨著生長周期的延長發生了偏移,表明EOM中腐植酸類物質的結構發生了一定的變化.相比之下,藻類IOM隨著生長周期的延長,熒光峰有較大的變化.如圖6所示,d、e、f分別代表對數期、穩定期和衰亡期的IOM的三維熒光光譜譜圖,IOM中熒光物質主要集中在類蛋白物質和溶解性微生物代謝產物兩個富含有機氮的區域內,主要包括芳香蛋白類物質、酪氨酸、色氨酸、蛋白類化合物等,表明IOM中的有機物以有機氮類化合物為主,這與王昊等[32]研究結果相似.另外兩個比較明顯的峰出現在區域III和V,這兩個區域代表有機碳類化合物.隨著藻生長周期的延長,熒光峰(Ex/Em,275~280/330nm)和(Ex/Em,225/ 330~335nm)峰強逐漸減小,可能的原因是:穩定期和衰亡期的藻細胞,尤其是在衰亡期,由于營養物質減少,藻細胞競爭激烈,致使胞內蛋白類儲能物質被消耗分解為腐植酸和富里酸等物質[33].
為進一步分析不同生長周期 AOM中藻類有機物的熒光物質組成,對不同時期的藻類有機物的熒光光譜進行了熒光區域積分,并且將積分結果轉化為單位 DOC時對應的值,降低濃度不同帶來的差異,結果見表3.各個區域單位DOC質量濃度下熒光體積占五個熒光區域總體積的百分比(Pi)如圖7.可以看出,對數期、衰亡期的IOM中的單位 DOC質量濃度中含有的熒光物質較EOM要多.穩定期的EOM中單位DOC質量濃度中含有的熒光物質比例較IOM中高.從圖7可以看出,EOM中熒光物質主要集中在熒光區域為IV和V,對數期、穩定期和衰亡期EOM中區域為IV和V的Pi分別為50%和42%、19%和73%、38%和54%;對數期與穩定期的IOM中含有較大比重的蛋白類(區域I與II)熒光物質,而衰亡期中蛋白類熒光物質Pi減小,與之相對應的是腐植酸類物質(區域 V)的急劇增加.出現上述結果可能的原因:穩定期的藻儲存蛋白類物質作為能源物質,因此IOM中富含有機氮的熒光區域(區域 I、II與 IV)所占比重為整個生命周期中最大的;衰亡期作為儲能物質的蛋白質被利用分解為富里酸、胡敏酸等有機物,因此出現了有機氮熒光區域所占比例的減小以及類腐殖酸和富里酸這類有機碳物質熒光區域比重的增加.
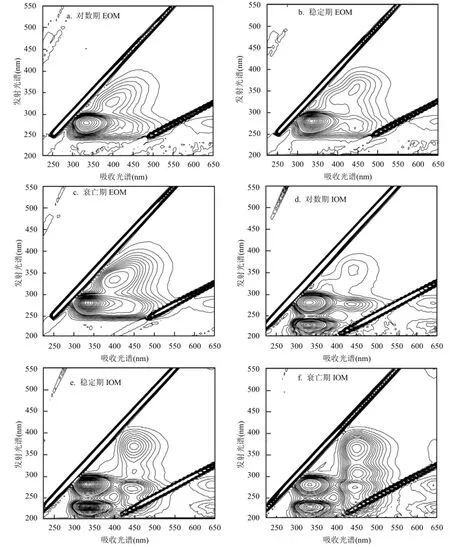
圖6 不同生長周期AOM的EEM譜圖Fig.4 Fluorescence EEMs of AOM under different phases
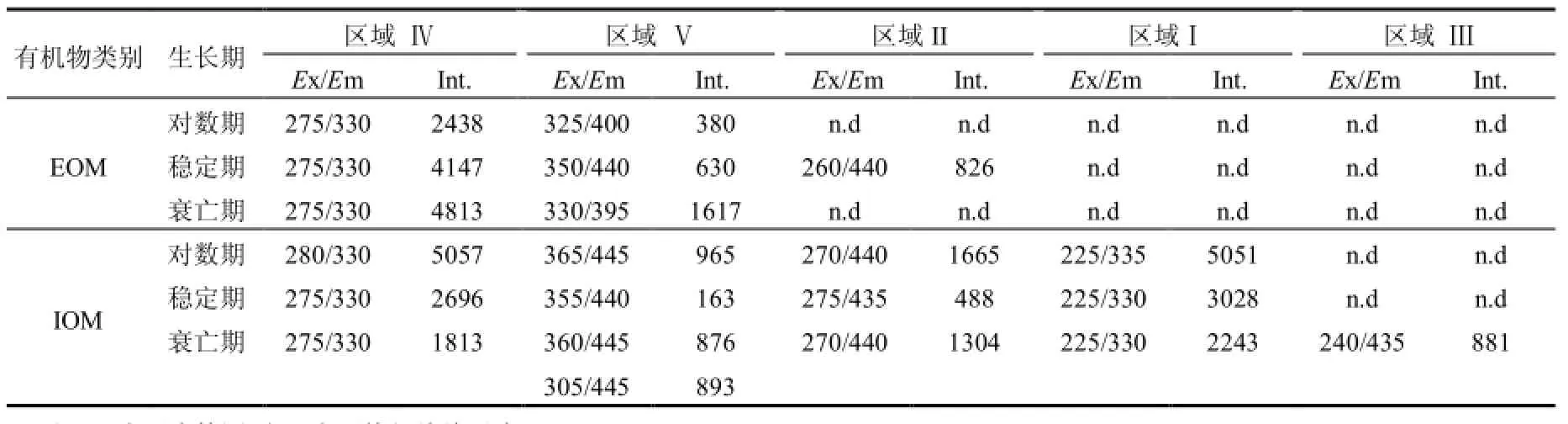
表2 不同樣品的EEM特征峰峰強Table 1 Fluorescence spectral parameters of different samples
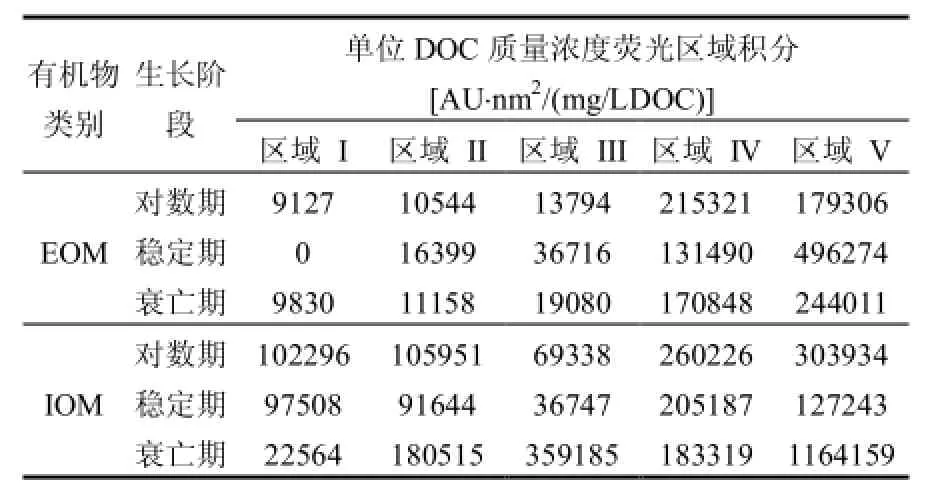
表3 不同時期AOM的單位DOC質量濃度的區域熒光體積Table 1 Excitation-emission area volumes per DOC mass concentration in specific regions of AOM during different growth phases
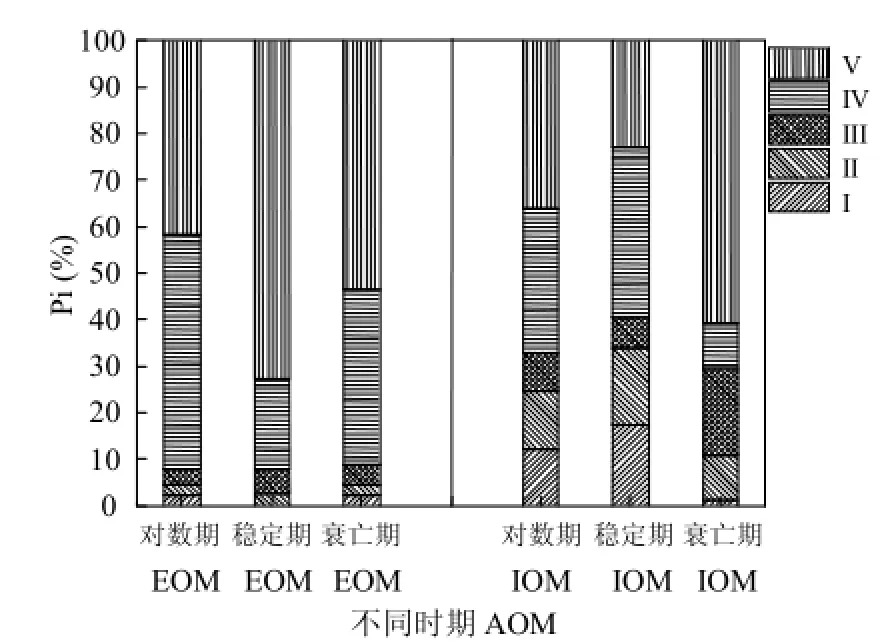
圖7 不同時期AOM (EOM/IOM)的EEM光譜Pi百分比分布Fig.4 Pi (%) distributions in EEM spectra of AOM (EOM/IOM) under different growth phases
3 結論
3.1微囊藻生長過程中,水體中 TN存在下降,說明藻華爆發過程存在一定脫氮作用.
3.2進入穩定期后期,藻細胞衰亡速率增大,釋放大量有機氮內含物,液相中 DON濃度急劇升高;生長初期藻細胞 DON的釋放能力小于0.05mg/107cells,衰亡期釋放能力約為 0.40mg/ 107cells.
3.3對數期和衰亡期的藻 EOM 分子量呈雙峰分布,穩定期的EOM以小分子有機物為主;IOM在整個生長周期中分子量均呈現雙峰分布,主要集中在<1kDa和>100kDa內,隨藻的生長胞內的大分子物質逐漸被分解為小分子物質.
3.4EOM中熒光物質種類在整個生長周期內變化較小,主要為腐植酸類物質和溶解性微生物代謝產物,熒光物質結構略有變化;IOM中熒光物質主要為芳香蛋白類和溶解性微生物代謝產物,穩定期藻的IOM中有機氮類物質所占比重最大.
[1] Pivokonsky M, Kloucek O, Pivokonska L. Evaluation of the production, composition and aluminum and iron complexation of algogenic organic matter [J]. Water Research, 2006,40(16):3045-3052.
[2] 喬俊蓮,雷 青,藻類不同生長周期對其混凝去除的影響[C]//2011年環境污染與大眾健康學術會議,武漢, 2011:5.
[3] 喬俊蓮,董 磊,徐 冉,等.胞外分泌物對銅綠微囊藻混凝去除的影響 [J]. 同濟大學學報(自然科學版), 2011,39(6):879-883.
[4] 李 甜,董秉直,劉 錚.藻類有機物的特性以及對超濾膜的污染 [J]. 環境科學, 2010,31(2):318-323.
[5] Fang J Y, Yang X, Ma J,et al. Characterization of algal organic matter and formation of DBPs from chlor(am)ination [J]. Water Research, 2010,44(20):5897-5906.
[6] Li L, Gao N, Deng Y, et al. Characterization of intracellular & extracellular algae organic matters (AOM) of Microcystic aeruginosa and formation of AOM-associated disinfection byproducts and odor & taste compounds [J]. Water Research, 2012,46(4):1233-1240.
[7] Her N, Amy G, Park H R, et al. Characterizing algogenic organic matter (AOM) and evaluating associated NF membrane fouling [J]. Water Research, 2004,38(6):1427-1438.
[8] Henderson R K, Baker A, Parsons S A,et al.Characterisation of algogenic organic matter extracted from cyanobacteria, green algae and diatoms [J]. Water Research, 2008,42(13):3435-3445.
[9] Lee W, Westerhoff P, Croue J P. Dissolved organic nitrogen as a precursor for chloroform, dichloroacetonitrile, N-nitrosodimethylamine, and trichloronitromethane [J]. Environmental science and technology, 2007,41(15):5485-5490.
[10] Chuang Y H, Lin A Y C, Wang X H, et al. The contribution of dissolved organic nitrogen and chloramines to nitrogenous disinfection byproduct formation from natural organic matter [J]. Water Research, 2013,47(3):1308-1316.
[11] Richardson S D, Plewa M J, Wagner E D, et al. Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfection by-products in drinking water: a review and roadmap for research [J]. Mutation Research, 2007,636(1-3):178-242.
[12] Bond T, Templeton M R, Graham N. Precursors of nitrogenous disinfection by-products in drinking water--a critical review and analysis [J]. J Hazard Mater, 2012,235-236:1-16.
[13] Chang H, Chen C Y, Wang G. Characteristics of C-, N-DBPs formation from nitrogen-enriched dissolved organic matter in raw water and treated wastewater effluent [J]. Water Research, 2013, 47(8):2729-2741.
[14] 高乃云,朱明秋,周石慶,等.藻源型有機物氯化消毒副產物的生成特性 [J]. 華南理工大學學報(自然科學版), 2014,42(5):48-53.
[15] Yang X, Guo W H, Shen Q Q. Formation of disinfection byproducts from chlor (am) ination of algal organic matter [J]. Journal of Hazardous Materials, 2011,197:378-388.
[16] Vandenbruwane J, De Neve S, Qualls R G, et al. Optimization of dissolved organic nitrogen (DON) measurements in aqueous samples with high inorganic nitrogen concentrations [J]. Science of the Total Environment, 2007,386(1-3):103-113.
[17] Lee W T, Westerhoff P. Dissolved organic nitrogen measurement using dialysis pretreatment [J]. Environ. Sci. Technol., 2005,39(3):879-884.
[18] Plummer J D, Edzwald J K. Effect of ozone on algae as precursors for trihalomethane and haloacetic acid production [J]. Environ. Sci. Technol., 2001,35(18):3661-3668.
[19] 劉 佩.城市污水二級出水有機物性狀及超濾分離過程研究[D]. 西安:西安建筑科技大學, 2013.
[20] 岳尚超.預臭氧化工藝對微污染原水消毒副產物影響的試驗研究 [D]. 天津:南開大學, 2012.
[21] Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence excitation - Emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environ. Sci. Technol., 2003,37(24):5701-5710.
[22] 姚璐璐,涂 響,于會彬,等.三維熒光區域積分評估城市污水中溶解性有機物去除 [J]. 環境工程學報, 2013,(2):411-416.
[23] 高連敬,杜爾登,崔旭峰,等.三維熒光結合熒光區域積分法評估凈水廠有機物去除效果 [J]. 給水排水, 2012,(10):51-56.
[24] 蒲韻竹.藻類的氧化效果和消毒副產物熒光特征研究 [D]. 上海:上海大學, 2013.
[25] 吳 劍,孔 倩,楊柳燕,等.銅綠微囊藻生長對培養液pH值和氮轉化的影響 [J]. 湖泊科學, 2009,(1):123-127.
[26] 方晶云.藍藻細胞及藻類有機物在氯化消毒中副產物的形成機理與控制 [D]. 哈爾濱:哈爾濱工業大學, 2009.
[27] 陳衛民,張清敏,戴樹桂.銅綠微囊藻對亞硝態氮的利用 [J]. 農業環境科學學報, 2009,(5):989-992.
[28] Chu W H, Gao N Y, Deng Y, et al. Impacts of drinking water pretreatments on the formation of nitrogenous disinfection by-products [J]. Bioresource Technology, 2011,102(24):11161-11166.
[29] Leloup M, Nicolau R, Pallier V, et al. Organic matter produced by algae and cyanobacteria: Quantitative and qualitative characterization [J].J. Environ. Sci.-China, 2013,25(6):1089-1097.
[30] 高乃云,朱明秋,周石慶,等.藻源型有機物氯化消毒副產物的生成特性 [J]. 華南理工大學學報(自然科學版), 2014,(5):48-53.
[31] 高乃云,王 昊,黎 雷,等.銅綠微囊藻細胞內外有機物特性及氯消毒副產物 [J]. 同濟大學學報, 2010,(9):1314-1318.
[32] 王 昊,高乃云,歐樺瑟,等.三維熒光分析O3和UV-C處理銅綠微囊藻過程 [J]. 中南大學學報(自然科學版), 2012,(2):763-768.
[33] 歐樺瑟,高乃云,郭建偉,等.氯化和UVC滅活銅綠微囊藻的機理[J]. 華南理工大學學報(自然科學版), 2011,(6):100-105.
Formation of algae-derived DON and characterization of algae organic matter (AOM) from different stages.
GU Li1*, GUO Xian-qiang1, DING Chang-long1, HE Qiang1, SHAN Zhi-jun2(1.Key Laboratory of Eco-Environment of Three Gorges Region of Ministry of Education, Chongqing University, Chongqing 400045, China;2.China Haisum Engineering Co. Ltd., Shanghai 200031, China).
China Environmental Science, 2015,35(9):2745~2753
Formation rules of dissolved organic nitrogen (DON), as well as characteristics of extracellular oganic matter (EOM) & intracellular organic matter (IOM) during the growth of Microcystis aeruginous have been studied. The results show as follows: DON concentration of EOM shows a growing tendency during the growth of Microcystis aeruginous, the yield of which is less than 0.05mg DON per 107cells in the early growth phase, around 0.40mg DON per 107cells in the late growth phase, respectively; molecular weight distributions of EOM during exponential phase and decline phase mainly concentrate in range of less than 1kDa and more than 100kDa, while organic matter less than 30kDa dominating EOM in stationary phase;molecular weight distributions of IOM concentrate in range of more than 1kDa and less than 100kDa in the three phases. The main fluorescence regions of EOM occur at the fluorescence region of humic acid-like materials and soluble microbial products. By contrast, the region of aromatic proteins and soluble microbial products dominate the main region of EEM spectra of IOM.
Microcystis aeruginous;transformation of nitrogen forms;dissolved organic nitrogen (DON)
X524
A
1000-6923(2015)09-2745-09
2015-01-22
國家自然科學基金青年基金項目(51208531)
*責任作者, 副教授, guli@cqu.edu.cn
古 勵(1982-),男,副教授,研究方向為安全飲用水水質保障理論與技術,城市固廢處理處置及資源化技術研究.發表論文20余篇.

