質譜技術在DNA甲基化研究中的應用
黃新鳳 葉金波 劉建軍
DNA 甲基化是DNA 甲基轉移酶(DNA methyltransferase,DNMTs)將S-2腺苷蛋氨酸(S-2 adenosine methionine,SAM)上活化的甲基基團轉移到DNA鏈中,是哺乳動物中最常見和研究得最為深入的表觀遺傳修飾。而胞嘧啶C-5位點的甲基化(5-甲基-脫氧胞苷,5mdC)是最主要的DNA甲基化形式[1],主要發生在CpG核苷酸序列中。人類基因組中絕大多數散在分布的CpG位點為甲基化修飾,而CpG島(定義為長度大約1 kb,G+C含量大于55%并以二核苷酸CpG形式出現)通常為非甲基化狀態(尤其與啟動子區相關的CpG島區域),并與基因的表達密切相關[2]。DNA 甲基化異常主要包括整體基因組和基因啟動子區甲基化水平的改變,基因組甲基化改變導致染色質穩定性降低,基因啟動子區甲基化改變則會干擾基因轉錄,使基因正常表達受損,可引起細胞的異常增殖和癌變[3]。此外,DNA 甲基化還與機體衰老、轉座子沉默、X 染色體失活及基因印記的形成有關[1-3]。
近年來,DNA甲基化成為了生命科學的研究熱點,研究方法不斷發展,而以往建立在常規分子生物學技術基礎之上的研究方法存在某些缺陷,如克隆和PCR擴增缺乏甲基轉移酶,5mdC不能保存下來,且此修飾存在于DNA雙鏈的大溝中而雜交技術難以識別等。此外,基于親和富集/剔除、甲基化敏感的核酸內切酶消化或亞硫酸氫鹽修飾的DNA預處理方法,已建立了一系列分析技術,它們能與其他的研究方法聯合檢測5mdC標記的存在和位點,例如測序、雜交、質譜檢測、凝膠電泳和PCR等,它們在靈敏度、分辨率、重復性、誤差、通量、成本和定量的程度上存在差異[4,5]。質譜(Mass spectrometry)以高敏感性、高通量、高準確率、高分辨率、快速且重復性好而成為該領域研究的關鍵技術,尤其在檢測大樣本的微量甲基化時,高靈敏度、高通量和定量DNA甲基化分析方法是必需的,質譜聯合液相色譜(Liquid chromatogram)等技術在這方面顯示了巨大潛力。本文將分別闡述利用質譜和色譜聯合質譜技術研究DNA甲基化的方法。
1 啟動子區的甲基化檢測
基質輔助激光解析電離飛行時間質譜(Matrixassisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)在遺傳學、表觀遺傳學和核酸研究領域應用廣泛,如單核苷酸多態性基因分型、突變檢測、基因拷貝數變異和剪接變異檢測等[6]。結合堿基特異性酶切反應與MALDITOF-MS檢測原理,Sequenom公司的MassARRAY檢測系統,是用于單核苷酸多態性分型和DNA甲基化定量檢測的技術體系,具備高通量的檢測性能,實現多重CpG位點的分析檢測,可量化<5%的甲基化改變[7],能用于基因組任何區域(如啟動子區)或候選基因的DNA甲基化定量分析[8]。
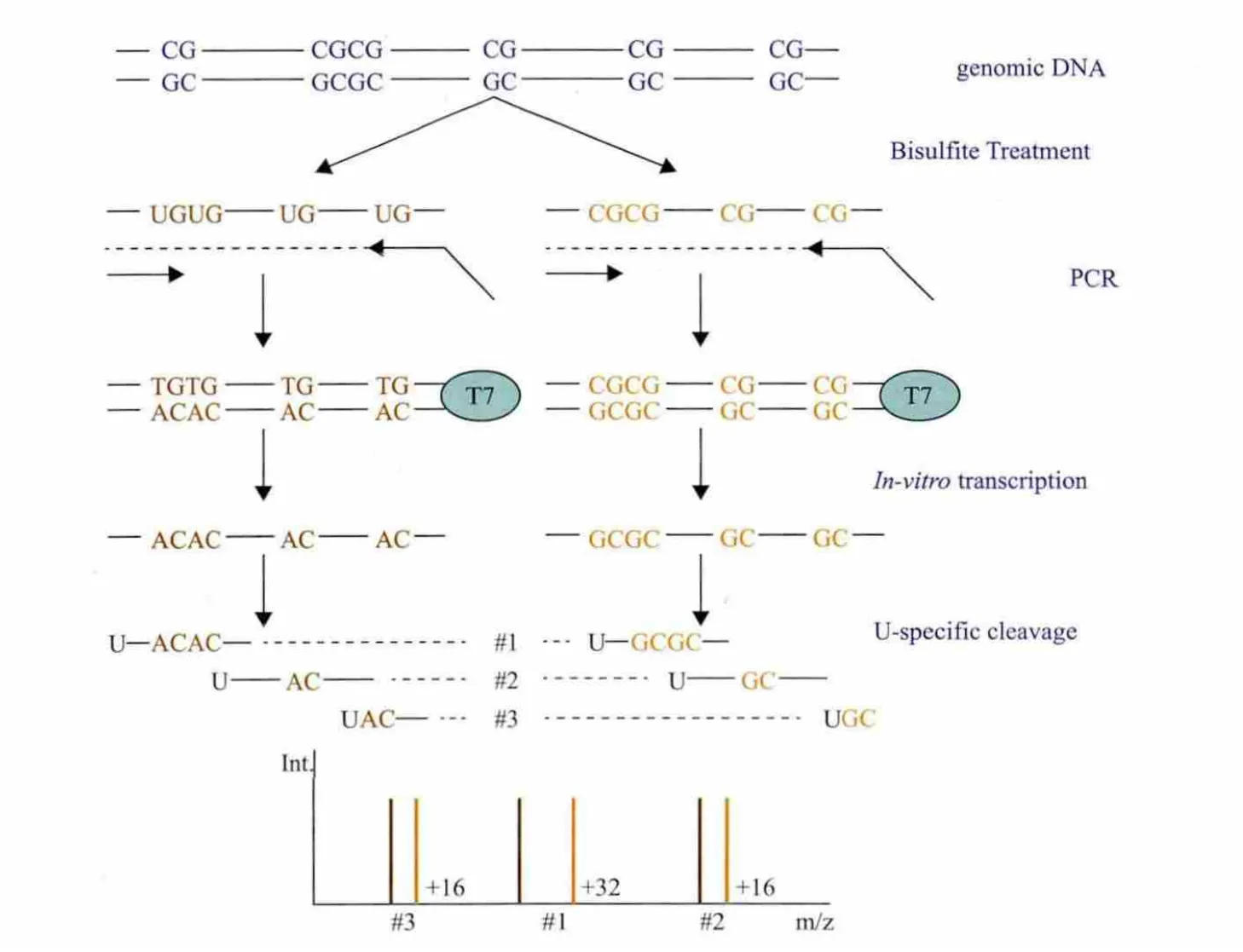
圖1 MassARRAY檢測啟動子甲基化的基本原理[9]
如圖1所示,基因組DNA 經亞硫酸氫鹽處理后,未甲基化的胞嘧啶轉化為尿嘧啶(C→U),而甲基化的胞嘧啶保持不變;設計5'-端含T7啟動子的引物擴增DNA雙鏈,擴增片段長度一般為200-600bp,堿性磷酸酶混合液去除反應體系中游離的核苷酸;再加入T7 RNA聚合酶等進行體外轉錄和堿基特異性的酶切反應;Nanodispenser從384孔板裂解反應液中取微量溶液轉入基質芯片上,質譜儀收集質譜圖[9]。
擴增產物完全的堿基特異性裂解可產生適合MALDI-TOF-MS檢測范圍的短小核苷酸片段,該系統所配備的數據庫含參考序列的信息,由特定的算法計算序列的分子量改變并搜索相應的參考序列,從而發現序列的變化。由于C→T變化致使反義鏈中G→A變化,含有甲基化CpG 位點的片段與不含甲基化CpG位點的片段每個CpG 位點之間分子量相差16 Da。計算獲得核苷酸片段中每個CpG單位的相對甲基化率(單個CpG 單位可含有多個CpG位點),EpiTYPER軟件對各CpG 位點或CpG 單位進行甲基化定量分析。EpiTYPER系統提供先進方便的DNA甲基化定量分析手段,提供數字和圖像注釋工具并將實驗數據與檢測的核苷酸序列相匹配[9,10](圖2和圖3)。
MassARRAY系統突出特點是能以極高的精確度快速進行基因型識別,直接獲得序列的甲基化信息。研究者們對該技術平臺不斷優化,例如,采用不同堿基特異性的酶切反應,得到不同組合的核苷酸片段,目的序列的覆蓋率增加,95%以上的序列能夠被檢測出[11]。Thomson設計了統計分析軟件分析來自EpiTYPER數據以檢驗亞硫酸氫鹽處理的效率的高低[12]。Wong等[13]用干燥的血樣提取高純度的DNA并進行高效的亞硫酸氫鹽修飾,降低了樣本要求,使該技術應用范圍擴大。
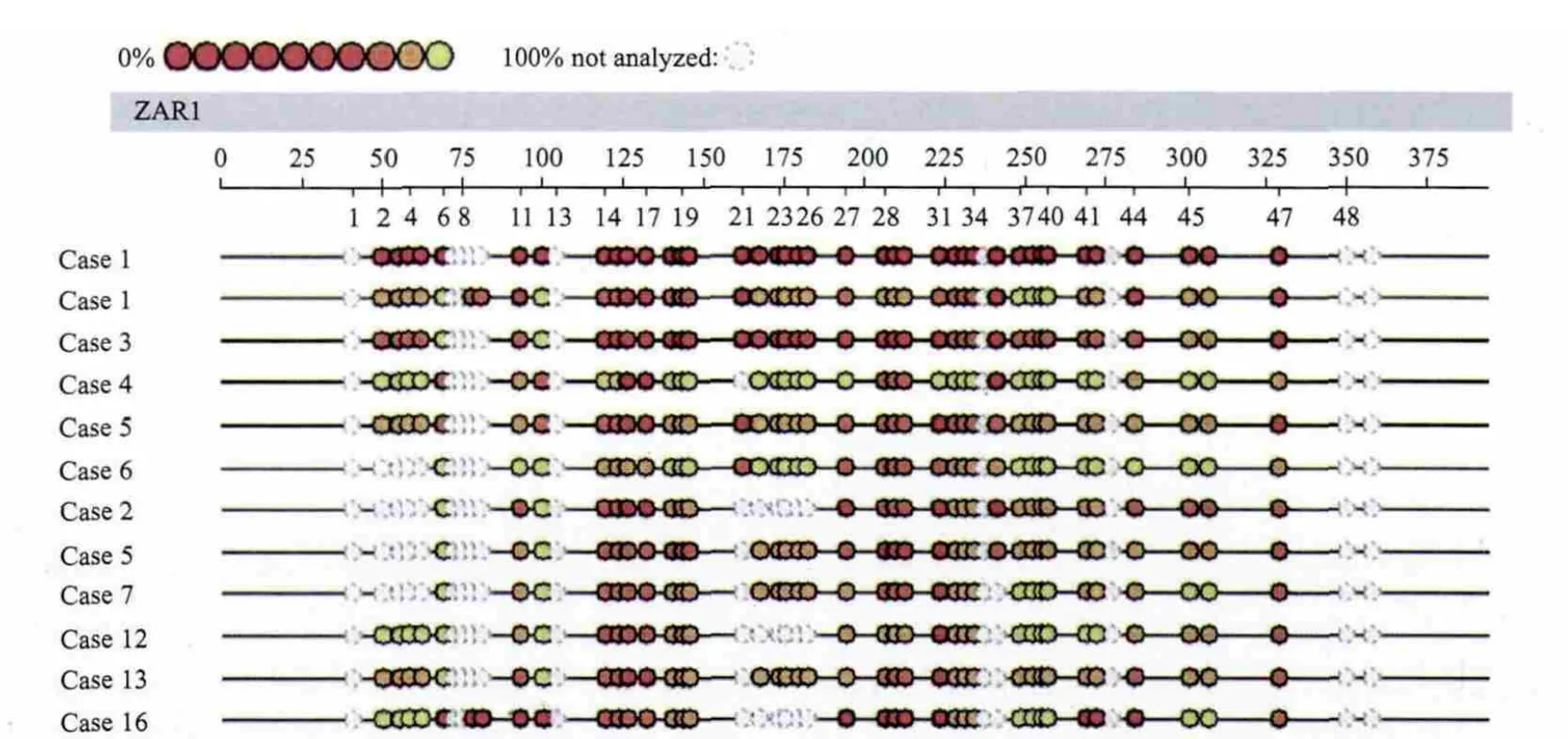
圖2 MassARRAY系統檢測結果[10]
該方法也存在一定不足,如碎裂的核苷酸片段中,只有單個堿基對的改變能夠被軟件推測出,更加復雜的突變和多態性則難以檢出[14]。CG位點是常見的突變位點,甲基化的胞嘧啶經過脫氨基變成胸腺嘧啶,此多態性不能被亞硫酸氫鹽處理所辨別,會導致DNA甲基化檢測的錯誤[15]。SNP的存在會改變核苷酸片段斷裂的模式和分子量,而EpiTYPER不能分辨出,會導致結果不準確。當核苷酸片段的分子量超出軟件分析(1.5-7kD)范圍時,此核苷酸片段上一系列CG位點的信息難以獲得;多個CG位點同時出現在同一核苷酸片段上且需要同時分析時,導致分辨率下降。PCR和亞硫酸氫鹽處理也是實驗誤差的重要來源,獲得純凈的PCR產物對于檢測和分析至關重要。復雜組織中細胞類型的異質性或同質細胞表觀遺傳性狀的不一致使得分析變得復雜,結果可靠性也會下降[16]。
Agrawal等[17]利 用 MassARRAY 技 術 平 臺 對80例急性骨髓性白血病病人骨髓樣本的腫瘤抑制基因C/EBP基因啟動子區分析,發現該基因啟動子發生高甲基化且基因表達水平下降,說明該病的發生可能與此基因啟動子高甲基化有關。Raval[8]發現,因啟動子高甲基化導致死亡相關蛋白激酶1(DAPK1)基因沉默幾乎發生在所有的慢性B淋巴細胞白血病病例中。在乳腺癌危險性評價[18],神經管缺陷的危險因素研究[19],慢性B淋巴細胞白血病[8]、結直腸癌[20]和孕婦產前無創性診斷[21]等方面,MassARRAY技術平臺都已有研究成果。
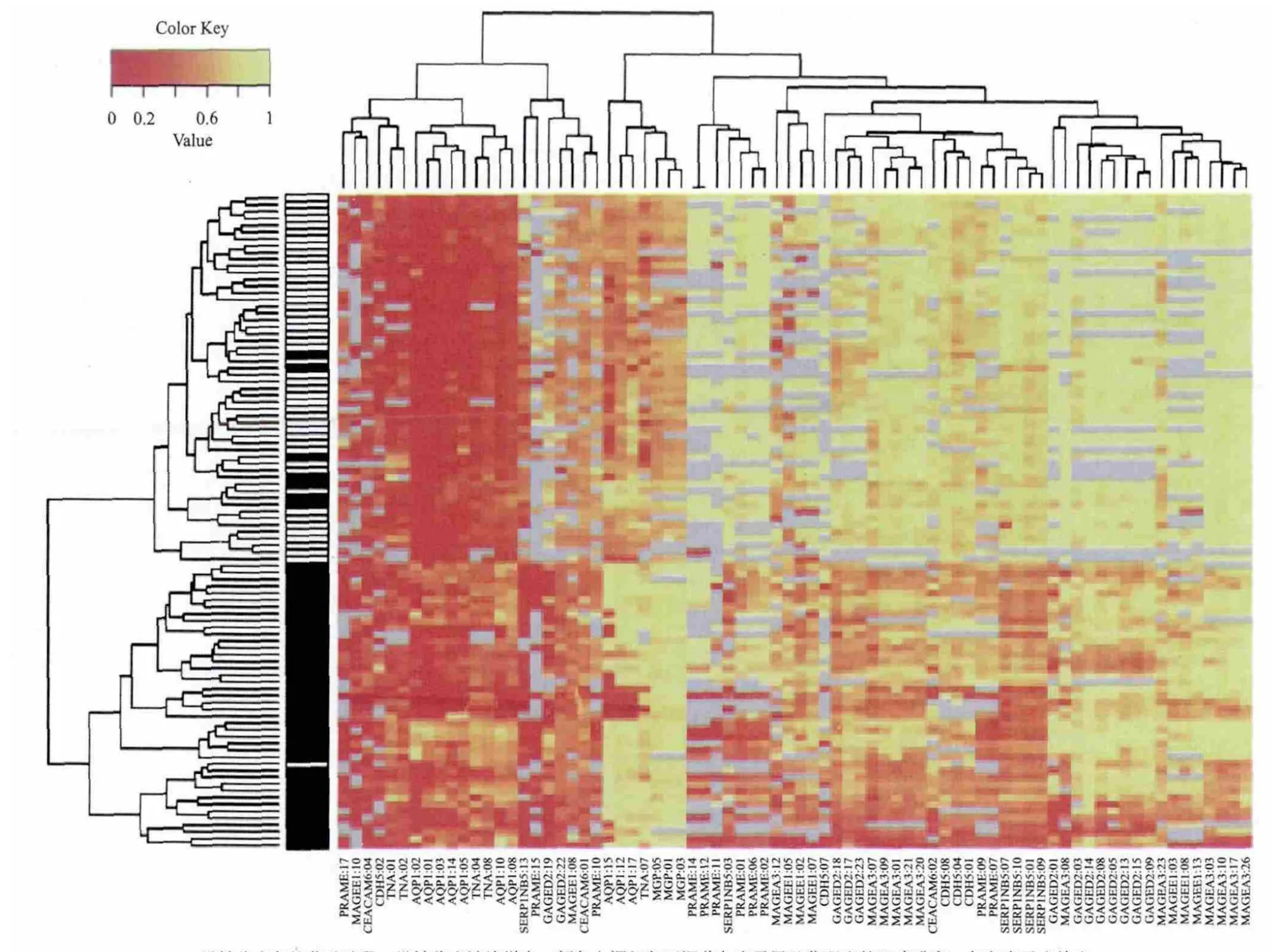
圖3 MassARRAY檢測結果統計學分析[9]
除MassARRAY技術平臺外,根據質譜對核苷酸的分析依賴其電荷狀態的特性,Tost等[22]開發了一種稱作GOOD assay分析樣品的準備方法。亞硫酸氫鹽處理樣品和甲基化PCR 擴增目的片段后,堿性磷酸酶消化未反應的底物。因為引物3'-末端堿基有磷硫橋,底物為α-S-dNTP,延伸產物為磷硫骨架,而用磷酸二酯酶只能消化正常的磷酸骨架,磷硫骨架卻能抗消化。烷基化中和磷硫骨架鏈后用MALDITOF-MS分析。該方法只需少量樣品,可實現多通路檢測,但實驗步驟較多,并利用酶消化會致檢測樣品純度降低、雜質多,還需建立標準曲線,不利于推廣應用。基于肽核酸(Peptide nucleic acid,PNA)與DNA結合的特異性高、不易被核酸酶降解、雜交后熱穩定性好并能在低鹽狀態下穩定存在等優點,Schatz等[23]建立了一種PNA探針雜交結合MALDITOF檢測研究CpG島甲基化的技術,亞硫酸氫鹽處理DNA樣品后,擴增目的片段,并固定于固相介質上,與含有甲基化位點的PNA探針雜交,去除非特異性結合后,洗脫下來的探針直接進行MALDITOF-MS分析,分子量的大小與序列文庫進行比對,獲得序列的甲基化信息。該方法能多重平行分析多個甲基化位點,所需樣品量小,但需設計探針,并建立標準曲線,實驗步驟較多,限制了該技術的推廣。
2 全基因組DNA甲基化檢測
研究基因組DNA甲基化水平的思路主要有:3H標記的甲基供體S-腺苷甲硫氨酸(3H-SAM)與DNA反應后,檢測結合于DNA上的同位素標記的甲基基團[24],該方法需要的DNA樣品量大,結果不能直接反映DNA雙鏈中5mdC的比率;基于DNA甲基化限制性內切酶的5mdC含量檢測[25],實驗步驟繁瑣且效率較低;應用特異性的抗5mdC抗體進行間接免疫熒光法檢測,所需樣品量大且精確性較低[26];酶解或酸解DNA雙鏈為單個核苷,以色譜技術分離檢測,或在色譜分離的基礎上質譜檢測。以色譜技術檢測基因組DNA甲基化水平的方法主要有薄層色譜(TLC)[27]、氣相色譜(GC)[28]、液相色譜(HPLC)[29,30]、毛細管電泳(CE)[31]等,此類方法可提供準確且重復性較好的結果,但也有不足。薄層色譜實驗的花費較少,但準確度不高且需大量的DNA樣品;氣相色譜實驗數據準確,但核苷是強極性的化合物,進樣前需進行衍生化處理;液相色譜能彌補氣相色譜方法的缺陷,但紫外檢測器不能選擇性地檢測化合物,這要求將DNA水解后所有的核苷達到全部分離,或至少使目標化合物與其他核苷完全分離,且紫外檢測器靈敏度有限,DNA樣品量要求大;毛細管電泳的分離效率較高,但DNA水解樣品中的基質對實驗的重復性影響很大。
色譜串聯質譜法分析基因組DNA甲基化的基本原理是用酶或酸分解DNA鏈為單個核苷,色譜分離的基礎上采用質譜檢測器測定核苷含量,樣本需要量少,靈敏度高,質譜技術的發展使大規模、高通量、全自動檢測分析成為可能。Rossella等[32]報道的基于色譜串聯質譜技術分析全基因組DNA甲基化水平的方法主要有氣相色譜串聯質譜(GC-MS)和液相色譜串聯質譜(HPLC-MS/MS),Zhang等[33]報道采用親水相互作用色譜串聯質譜(HILIC-MS),但此方法使用很少。由于DNA核苷為強極性化合物,因此采用GC-MS方法分析全基因組DNA甲基化時需要對核苷進行衍生化處理,衍生化步驟不僅繁瑣,而且衍生化不充分會給結果帶來極大誤差。HPLCMS/MS方法具有高靈敏性和選擇性,且不需對核苷進行衍生化處理,給全基因組DNA甲基化定量分析帶來了新的解決思路,實驗步驟也相對簡單(主要包括:優化色譜條件和質譜參數,用脫氧胞苷和5-甲基脫氧胞苷梯度標準溶液建立標準曲線,再將水解并超濾去蛋白的DNA樣品上樣檢測,參照標準曲線獲得甲基化率的大小)。現對HPLC-MS/MS檢測全基因組DNA甲基化的方法概括,見表1。
采用不同的色譜儀、色譜柱及質譜儀可建立不同的檢測方法,各種方法各具特點。表1中的方法強調提高敏感度(減少分析所需的DNA量,降低檢出限)和通量,新方法的建立也以高通量、快速準確、價廉為目標。近年來,由于超高效液相色譜大幅度改善了液相色譜的分離度、樣品通量和靈敏度,速度和分離度分別是傳統HPLC的9倍和1.7倍,在低流速下,增加了峰濃度,提高離子源的效率,使靈敏度至少提高了3倍[33],并在液相色譜和質譜聯用領域得到廣泛發展。擔負分離作用的色譜柱是色譜系統的關鍵,對色譜柱的要求是柱效高、選擇性好、分析速度快,為提高分析的靈敏度并與質譜聯用,發展了窄徑柱、毛細管柱和內徑<0.2 mm的微徑柱,能增加靈敏度,減少樣品量,通過使用長柱達到高分離度,容易控制柱溫。質譜檢測器方面,Yang等[34]報道,三重四極桿質譜檢測器比離子阱質譜檢測器靈敏度更高,可避免連續分析中離子喪失的影響。
DNA甲基化定量也是該技術的關鍵之一,有文獻報道直接采用外標法定量并建立標準曲線來度量甲基化率,另一些文獻則采用昂貴的同位素內標15N3-dC 和15N5-dG[36]、[15N3]2-dc 和[methyl-d3,ring-6-d1]-5-methyl-2-dc[29],及生物合成的穩定同位素[U-15N]-dc和[U-15N]- 5mdC[43],它們分別代表 2dC和 5mdC。Bagnyukova等[44]報道,HPLCICP-MS(電感耦合等離子體質譜)檢測同位素31P和189Os(分別代表dC和5mdC)的量來定量甲基化比率。此外,有學者[34-45]采用5mdC和2-脫氧鳥苷(dG)物質的量比值法([5mdC]/[dG]比值法)進行定量,這種方法的原理是假設DNA雙鏈中[5mdC]+[dC]=[dG],DNA分子中5mdC與dG物質的量的比值便可作為全基因組DNA甲基化計算公式的替代,不需考慮檢測和分析中物質的損失,因為分子和分母比值分析會以相同的方式相互影響和抵消,可避免高成本同位素內部標準。但該方法在原理上也存在缺陷,即由于DNA分子中部分dG堿基會發生修飾,形成如O6-甲基化、C8-羥基化等修飾鳥苷,使得DNA分子中[5-mdC]+[dC]≈[dG],給準確性帶來誤差。總體來說,目前報道的HPLC-MS/MS技術分析全基因組DNA甲基化水平的方法幾乎都未找到合適的內標來校正儀器誤差并進行準確定量[36]。因此,還需進一步發展新型的基于液相色譜串聯質譜檢測全基因組DNA甲基化的方法。
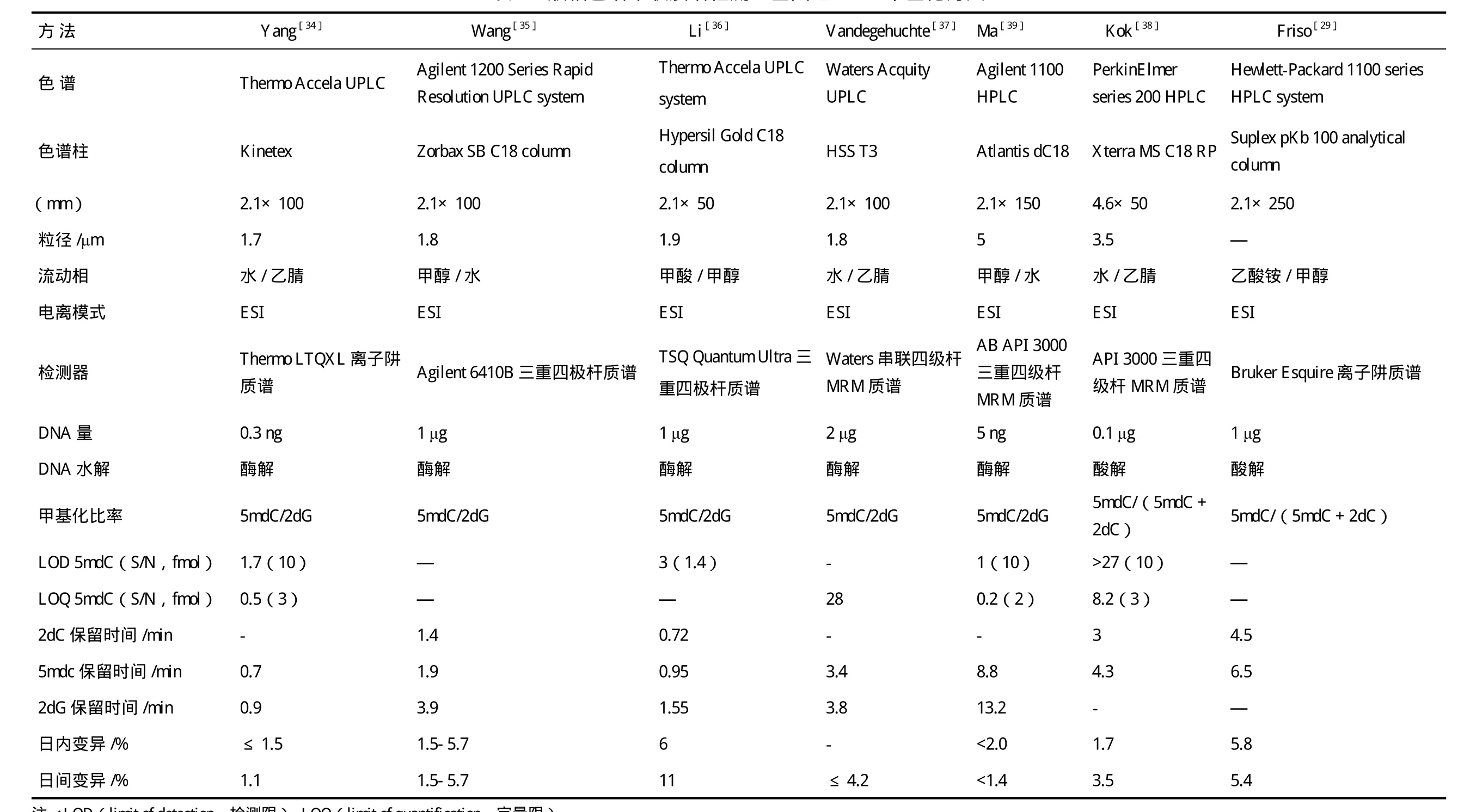
表1 液相色譜串聯質譜檢測全基因組DNA 甲基化方法
現階段,已有學者采用HPLC-MS/MS研究疾病與全基因組DNA甲基化的關聯,例如,Lim等[43]用HPLC-ESI/MS研究無癥狀的大腸腺癌患者外周血白細胞全基因組DNA甲基化狀況,發現全基因組DNA甲基化可能是大腸腺癌早期的致病因子。Bagnyukova等[44]研究發現,遺傳毒性致肝癌物二乙基氨基芴致雄性SD大鼠肝臟組織全基因組DNA甲基化水平大幅度下降,但未在雌性小鼠的肝臟組織中發現此特征,而且雄性和雌性SD大鼠的腎臟中也不存在此特征。Choi等[45]用HPLC-ESI/MS檢測Vitamin B-12缺乏致SD大鼠結腸DNA甲基化水平改變,初步認為這可能是腫瘤的誘因。
3 結語
DNA甲基化作為重要的基因表達調控機制,不僅是當前生命科學和醫學的研究熱點,也在毒物的安全性評價中具有廣闊的應用前景,其改變在許多毒物的毒理學機制中起著重要作用。近年來,已有學者研究毒物引起的DNA甲基化狀態改變來探討其可能的毒理學機制。例如,Tao等[46]研究發現,飲用水氯化消毒副產物(DBPs)引起的全基因組DNA和c-myc基因低甲基化的能力與它們致小鼠和大鼠腎臟和肝臟腫瘤及促進腫瘤發展的能力相關聯。Pereira等[47]的研究表明,蛋氨酸作為甲基供體可抑制二氯乙酸(DCA)誘導的B6C3F1小鼠全基因組DNA甲基化水平下降,并抑制肝臟腫瘤進展,但未改變DCA所誘導的肝臟/體重比值和過氧化物酶增加,說明蛋氨酸對肝癌的抑制與其對DNA低甲基化的抑制有關,也說明了DNA低甲基化對于DCA誘導的腫瘤發生是至關重要的。DNA甲基化研究對毒物早期潛在毒效應的探測、實驗濃度組的設置、劑量-反應曲線的有效定義和種屬之間合適的濃度外推具有重大意義,將促進對毒物毒理學機制的研究,加快毒理學的發展[48]。在大規模基因組方面探索DNA甲基化特征,質譜以其高通量、高準確性和高靈敏度的特點將發揮著重要作用。熟悉其優勢和不足是利用該技術平臺的基礎,隨著自動化、微型化技術的發展和軟件算法的改進,質譜技術將在高靈敏度、高精確性和低成本的基礎上開展高通量的研究。
[1]Suzuki MM, Bird A. DNA methylation landscapes:provocative insights from epigenomics[J]. Nat Rev Genet, 2008, 9(6):465-476.
[2]Tate P, Bird A. Effects of DNA methylation on DNA-binding proteins and gene expression[J]. Curr Opin Genet Dev, 1993, 3(2):226-231.
[3]Clouaire T, Stancheva I. Methyl CpG binding proteins:specialized transcrip- tional repressors or structural components of chromatin[J]. Cell Mol Life Sci, 2008, 65(10):1509-1522.
[4]Lister R, Pelizzola M, Dowen RH, et al. Human DNA methylomes at base resolution show widespread epigenomic differences[J].Nature, 2009, 462(727 1):315-322.
[5]Ammerpohl O, Martín-Subero JI, Richter J, et al. Hunting for the 5th base:Techniques for analyzing DNA methylation[J]. Biochim Biophys Acta(BBA)-Gen Subj, 2009, 1790(9):847-862.
[6]Ragoussis J, Elvidge GP, Kaur K, et al. Matrix-assisted laser desorption/ ionis ation, time-of-flight mass spectrometry in genomics research[J]. PLoS Genet, 2006, 2(7):e100.
[7]CoolenMW, StathamAL, Clark SJ, et al. Genomic profiling of CpG methylation and allelic specificity using quantitative high-throughput mass spectrometry:critical evaluation and improvements[J].Nucleic Acids Res, 2007, 35:e119
[8]Raval A, Tanner SM, Byrd JC, et al. Downregulation of deathassociated protein kinase 1(DAPK1)in chronic lymphocytic leukemia[J]. Cell, 2007, 129(5):879-890.
[9]Ehrich M, Nelson MR, Stanssens P, et al. Quantitative highthroughput analysis of DNA methylation patterns by base-specific cleavage and mass spectrometry[J]. Proc Natl Acad Sci, 2005,102(44):15785-15790.
[10]Watanabe T, Yachi K, Ohta T, et al. Aberrant hypermethylation of non-promoter zygote arrest 1(ZAR1)in human brain tumors[J]. Neurol Med Chir(Tokyo), 2010, 50(12):1062-1089.
[11]Ehrich M, Hillenkamp F, Boom DVD. Perspectives in bioanalysis[M]. Elsevier, 2007.
[12]Thompson RF, Suzuki M, Lau KW, et al. A pipeline for the quantitative analysis of CG dinucleotide methylation using mass spectrometry[J]. Bioinform Atics, 2009, 25(17):2164-2170.
[13]Wong N, Morley R, Saffery R, et al. Archived Guthrie blood spots as a novel source for quantitative DNA methylation analysis[J].Biotechniques, 2008, 45(4):423-424, 426, 428 .
[14]Fryxell KJ, Moon WJ. CpG mutation values in the human genome are highly dependent on local GC content[J]. Mol Biol Evol,2005, 22(3):650-658.
[15]Ehrich M, Zoll S, Sur S, et al. A new method for accurate assessment of DNA quality after bisulfite treatment[J]. Nucleic Acids Res, 2007, 35(5):e29.
[16]Mikeska T, Candiloro IL, Dobrovic A. The implications of heterogeneous DNA methylation for the accurate quantification of methylation[J]. Epigenomics, 2010, 2(4):561-573.
[17]Agrawal S, Hofmann WK, Tidow N, et al. The C/EBP delta tumor suppressor is silenced by hypermethylation in acute myeloid leukemia[J]. Blood, 2007, 109(9):3895-3905.
[18]Radpour R, Kohler C, Haghighi MM, et al. Methylation profiles of 22 candidate genes in breast cancer using high-throughput MALDITOF mass array[J]. Oncogene, 2009, 28(33):2969-2678.
[19]Wang L, Wang F, Guan J, et al. Relation between hypomethylation of long interspersed nucleotide elements and risk of neural tube defects[J]. Am J Clin Nutr, 2010, 91(5):1359-1367.
[20]Kaneda A, Yagi K. Two groups of DNA methylation markers to classify colorectal cancer into three epigenotypes[J]. Cancer Sci,2011, 102(1):18-24.
[21]Bellido ML, Radpour R, Lapaire O, et al. MALDI-TOF mass array analysis of RASSF1A and SERPINB5 methylation patterns in human placenta and plasma[J]. Biol Reprod, 2010, 82(4):745-750.
[22]Tost J, Schatz P, Schuster M, et al. Analysis and accurate quantification of CpG methylation by MALDI mass spectrometry[J]. Nucleic Acids Res, 2003, 31(9):e50.
[23]Schatz P, Distler J, Berlin K, et al. Novel method for high throughput DNA methylation marker evaluation using PNA-probe library hybridization and MALDI-TOF detection[J]. Nucleic Acids Res, 2006, 34(8):e59.
[24]Rampersaud GC, Kauwell GP, Hutson AD, et al. Genomic DNA methylation decreases in response to moderate folate depletion in elderly women[J]. Am J Clin Nutr, 2000, 72(4):998-1003.
[25]Yi P, Melnyk S, Pogribna M, et al. Increase in plasma homocysteine associated with parallel increases in plasma S-adenosylhomocysteine and lymphocyte DNA hypomethylation[J]. J Biol Chem,2000, 275(38):29318 -29323.
[26]Santos F, Hendrich B, Reik W, et al. Dynamic reprogramming of DNA methyla tion in the early mouse embryo[J]. Dev Biol,2002, 241(1):172-182.
[27]Leonard GA, Hunter WN. Crystal and molecular structure of d(CGTAGATCTACG)at 2. 25 A resolution[J]. J Mol Biol, 1993,234(1):198-208.
[28]Gambari R, Barbieri R, Piva R, et al. Regulation of the expression of class II genes of the human major histocompatibility complex in tumor cells[J]. Ann N Y Acad Sci, 1987, 511:292-307.
[29]Friso S, Choi SW, Dolnikowski GG, et al. A method to assess genomic DNA methylation using High-Performance Liquid Chromatogr- aphy/Electrospray Ionization Mass Spectrometry[J].Anal Chem, 2002, 74(17):4526-4531.
[30]白樺, 鄧大君. 引物延伸-變性高效液相色譜法檢測去甲基化活化16型乳頭狀瘤病毒[J]. 中華預防醫學雜志, 2007, 41(z1):81-83.
[31]Wirtz M, Stach D, Kliem HC, et al. Determination of the DNA methylation level in tumor cells by capillary electrophoresis and laser-induced fluorescence detection[J]. Electrophoresis, 2004,25(6):839-845.
[32]Rossella F, Polledri E, Bollati V, et al. Development and validation of a gas chromatography/mass spectrometry method for the assessment of genomic DNA methylation[J]. Rapid Commun Mass Spectrom, 2009, 23(17):2637-2646.
[33]Zhang JJ, Zhang LJ, Zhou KY, et al. Analysis of global DNA methylation by hydrophilic interaction ultra high-pressure liquid chromatography tandem mass spectrometry[J]. Analytical Biochemistry, 2011, 413(2):164-170.
[34]Yang I, Fortin MC, Richardson JR, et al. Fused-core silica column ultra-performance liquid chromatographyion trap tandem mass spectrometry for determination of global DNA methylation status[J]. Nal Biochem, 2011, 409(1):138-143.
[35]Wang X, Suo Y, Yin R, et al.Ultra-performance liquid chromatography /tand -em mass spectrometry for accurate quantification of global DNA methylation in human sperms[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2011, 879(19):1647-1652.
[36]Li XN, Franke AA. High-throughput and cost-effective global DNA methylation assay by liquid chromatography-mass spectrometry[J]. Anal Chim Acta, 2011, 703(1):58-63.
[37]Vandegehuchte MB, Lemiere F, Janssen CR. Quantitative DNA-methylation in Daphnia magna and effects of multigeneration Zn exposure[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2009,150(3):343-348.
[38]Kok RM, Smith DE, Barto R, et al. Global DNA methylation measured by liquid chromatography tandem mass spectrometry:analytical technique, reference values, and determinants in healthy subjects[J]. Clin Chem Lab Med, 2007, 45(7):903-911.
[39]Ma H, Zhang W, Hu J, et al. Analysis of global DNA methylation levels in human blood using high-performance liquid chromatography/tandem electrospray ionization mass spectrometry[J]. Eur J Mass Spectrom, 2009, 15(4):555-561.
[40]Wang JB, Li HF, Jin C. Development and validation of aUPLC method for quality control of rhubarbbased medicine:Fast simultaneous determination of five anthraquinone derivatives[J].Journal of Pharm aceutical and Biomedical Analysis, 2008, 47(4-5):765-770.
[41]Quinlivan EP, Gregory III JF. DNA methylation determination by liquid chromatography-tandem mass spectrometry using novel biosynthetic[U-15N]deoxycytidine and[U-15N]methyldeoxycytidine internal standards[J]. Nucleic Acids Research, 2008, 36(18):e119.
[42]Wrobel K, Landero Figueroa JA, Zaina S, et al. Phosphorus and osmium as elemental tags for the determination of global DNA methylation-a novel application of high performance liquid chromatography inductively coupled plasma mass spectrometry in epigenetic studies[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2010, 878(5-6):609-614.
[43]LimU, Flood A, Choi SW, et al. Genomic methylation of leukocyte DNA in relation to colorectal adenoma among asymptomatic women[J]. Gastroenterology, 2008, 134(1):47-55.
[44]Bagnyukova TV, Tryndyak VP, Montgomery B, et al. Genetic and epigenetic changes in rat preneoplastic liver tissue induced by 2-acetylaminofluoren e[J]. Carcinogenesis, 2008, 29(3):638-646.
[45]Choi SW, Friso S, Ghandour H, et al. Vitamin B-12 deficiency induces anomalies of base substitution and methylation in the DNA of rat colonic epithelium[J]. J Nutr, 2004, 134(4):750-755.
[46]Tao LH, Wang W, Li L, et al. DNA hypomethylation induced by drinking water disinfection by-products in mouse and rat kidney[J]. Toxicol Sci, 2005, 87(2):344-352.
[47]Pereira MA, Wang W, Kramer PM, et al. Prevention by methionine of dichloroacetic acid-induced liver cancer and DNA hypomethylation in mice[J]. Toxicol Sci, 2004, 77:243-248.
[48]楊建平, 朱志良, 袁建輝. DNA甲基化在毒理學中的應用前景[J]. 環境與職業醫學雜志, 2007, 10(5):546-549.

