一種點雜交膜預處理方法的建立及應用
姜超 蘇小琴 張學文 潘映紅
點雜交是一種快速檢測DNA、RNA和蛋白等生物分子種類和含量的簡便方法,廣泛應用于分子生物學、生物化學、免疫遺傳學和醫藥、農業、食品等領域[1-3]。在點雜交實驗中,先將樣品點到介質上,然后用特異性探針進行雜交,最終依據檢測到的雜交信號強弱判斷樣品中目標物的種類和含量。目前高通量和自動化的基因和蛋白芯片技術已成為高效、快速和大規模獲取相關生物信息的重要手段[4],但芯片技術并不適合普通實驗室使用,手工點雜交仍然是最常使用的點雜交技術。手工點雜交常用的雜交膜有NC膜、PVDF膜和尼龍膜,這類膜在實際使用時普遍存在點樣點排列不整齊、上樣體積受限制、單位面積樣品數量較少、樣品在雜交膜上容易擴散導致點樣點的大小和形狀不一致等問題[5,6],限制了該技術的應用,有必要對點樣環節加以改進。本研究針對手工點樣斑點雜交實驗中存在的樣品點密度小、點樣體積受限制和點樣點不規整等問題,通過對雜交膜的預處理,使樣品富集和吸附在點樣點部位,以期提高手工點樣的通量和規范性。
1 材料與方法
1.1 材料
1.1.1 植物材料和試劑 水稻、小麥和大豆均為常規品種,葉片采自中國農業科學院作物科學研究所實驗溫室,-80℃保存待用。鼠抗水稻看家蛋白抗體Anti-HSP購自北京華大蛋白公司;IRDye800標記的山羊抗鼠抗體購自寶生物工程有限公司。硝酸纖維素膜(nitrocellulose membrane,NC膜)和聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF膜)均為頗爾公司產品。低熔點石蠟(48-50℃)和其他試劑購自國藥集團化學試劑公司。
1.1.2 主要儀器 Odyssey CLX雙色紅外熒光成像儀為美國LI-COR公司產品。
1.1.3 緩沖液 提取液:7mol/L尿素,2mol/L硫脲,4%(W/V)CHAPS,2μg/μL DTT。洗脫液:0.01mol TBST :10mmol Tris,100mmol NaCl,用 0.1mol HCl調pH為7.5,加入0.1% Tween-20。
1.2 方法
1.2.1 蛋白提取方法 蛋白質提取參考Herman等[7]方法改進。植物葉片液氮研磨,取0.2 g溶于1.5mL提取液,置于冰上靜置1h;離心(12000×g,4℃,15min),上清液重復離心后加4倍體積預冷丙酮,-20℃放置過夜;離心(12000×g,4℃,15min),沉淀即為蛋白提取物。蛋白定量參照Bradford方法[8]。
1.2.2 膜預處理方法 根據預設點樣點的孔徑、排列方式和密度,先制作塑料材質的柱狀凸起模具。制作模具時需保證柱狀凸起的直徑和間距與預設點樣點對應,且凸起部位平整。還可使用底面平整的V型底384孔深孔板等商品化的塑料孔板,以孔板的V型底作為模具的柱狀凸起部位。預處理雜交膜前,將模具平放在用支撐平板托起的雜交膜上,再用固定夾固定模具和支撐平板,使模具的凸起部位與雜交膜緊密接觸。然后將熔化的石蠟涂布于膜上非模具接觸部位,待石蠟凝固后小心移走模具,確保預留的點樣點無蠟質污染,同時使非點樣部位具有疏水性。
1.2.3 點雜交方法 點雜交實驗參考Cheley等[9]方法,封閉和抗體孵育后用洗脫液清洗3次,每次10min。
1.2.4 檢測方法 用LI-COR Odyssey CLX雙色紅外熒光成像儀直接掃描成像,選擇800nm綠光通道,膜成像分辨率設置為80 μm。
2 結果
2.1 雜交膜的預處理

圖1 預處理后的雜交膜
點雜交實驗常用的雜交膜是NC膜和PVDF膜,這兩種雜交膜均可以用柱狀凸起模具和低熔點石蠟進行預處理。圖1為采用孔距4.5 mm,凸起部位直徑1.2-2.4 mm的模具制備的預處理雜交膜,膜上淺色部分是保留了雜交膜原有特性的點樣孔,深色部分則為被石蠟覆蓋的疏水區域。經過預處理的雜交膜的點樣點位置、大小和形狀規范統一,使用時可根據需要選擇不同孔徑的膜。
2.2 預處理膜的特性
將熒光染料IRDye800標記的山羊抗鼠抗體直接點在普通PVDF膜和經預處理的PVDF膜上,待膜干后用Odyssey CLX成像儀檢測。結果(圖2)顯示,經過預處理的膜上樣品點形狀整齊規范,且隨著點樣體積的增加熒光信號增強,而普通雜交膜上樣品點大小明顯隨點樣體積變化,并呈現不規則的形狀。
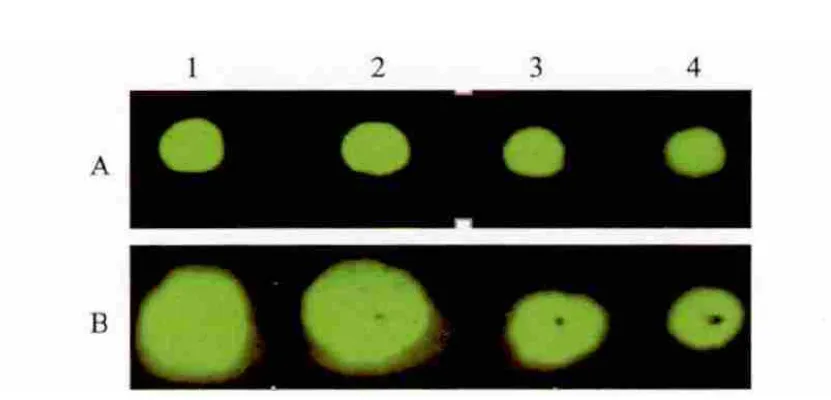
圖2 預處理膜(A)和常規膜(B)手工點樣結果的比較
2.3 蛋白質樣品的制備
采用尿素硫脲法進行了水稻、小麥和大豆葉片蛋白質樣品制備,SDS-PAGE分析(圖3)顯示蛋白質提取物條帶多,得率高。結果說明,尿素硫脲法提取的3種植物葉片蛋白較完整,可以用于點雜交預處理膜的進一步實驗驗證。

圖3 水稻、小麥和大豆葉片全蛋白的SDS-PAGE分析
2.4 預處理膜的應用
將多次提取的水稻、小麥和大豆蛋白分別點在經過預處理的NC膜和PVDF膜上,與水稻看家蛋白抗體Anti-HSP雜交,結果(圖4)顯示在預處理PVDF膜上的水稻和小麥點樣點均有較強信號,而在預處理NC膜的雜交信號較弱,其中大豆的信號幾乎檢測不到。

圖4 水稻、小麥和大豆葉片蛋白與Anti-HSP的預處理膜點雜交
3 討論
目前文獻報道的手工點雜交實驗普遍存在通量低和可視性較差等問題[5,6],主要原因是樣品在雜交膜上容易擴散和難以保證點樣點規整一致。基于自動點樣和掃描技術的高通量芯片分析技術解決了上述問題,在生物學和醫藥研究中發揮著重要的作用[10-13],但芯片技術在便捷性和成本方面并無優勢可言。
利用模具和石蠟對NC膜和PVDF膜進行預處理,使膜上除點樣點外的區域具有疏水性,確保樣品富集和吸附在點樣部位,避免了手工點樣時樣品容易擴散和點樣點不統一規范等問題。模具的孔徑和孔間距可依據實際需要調整,以制備15×20cm的預處理膜為例,采用孔距4.5 mm,孔徑2.4 mm的柱狀凸起模具,可得到1452個點樣孔,若孔距3.0 mm,孔徑1.0 mm,則可制作出有3 300個點樣孔的膜。采用更簡單的方法,即使用底面平整的V底384孔深孔板做模具,則在7×14cm的膜上可點384個樣品。需要注意的是,石蠟加熱熔化后,宜保持石蠟液體的溫度高于熔點5℃左右,溫度太高或太低均可能導致處理失敗。涂布石蠟液時,還必須確保模具和膜的緊密接觸,防止石蠟液滲入模具凸起部位和雜交膜之間。雜交膜經預處理后,僅在點樣部位保留了雜交膜原有特性,可根據樣品數裁剪所需要的預處理膜,實驗成本低廉,操作簡便。
直接點樣檢測和實際樣品的點雜交實驗證明,使用預處理NC膜和PVDF膜能保證點樣點的位置、大小和形狀統一規范,還能增加點樣密度和點樣體積。提取水稻、小麥和大豆葉片全蛋白進行的點雜交驗證中,重復樣品在預處理NC膜和PVDF膜上均得到類似的結果,其中水稻和小麥點樣點的信號明顯強于大豆信號,說明這種改進的手工點雜交實驗流程可用于實際樣品分析。驗證結果還顯示,經預處理的NC膜與普通膜的蛋白結合特性相似,檢測靈敏度相對較低。
4 結論
通過柱狀凸起模具限定點樣點的大小、排列方式和密度,利用石蠟的疏水特性防止非點樣部位吸附樣品,使預處理雜交膜的后續使用更方便。利用本方法獲得的預處理雜交膜適用于手工點雜交實驗,為解決點雜交實驗過程中存在的問題提供了新的選擇。
[1]夏佩瑩, 李鳳云, 汪萬英, 等. HPV核酸探針斑點雜交技術在診斷尖銳濕疣中的應用[J]. 蚌埠醫學院學報, 2000(3):163-164.
[2]Wang X, Teng D, Guan Q, et al. Detection of genetically modified crops using multiplex asymmetric polymerase chain reaction and asymmetric hyperbranched rolling circle amplification coupled with reverse dot blot[J]. Food Chemistry, 2015, 173:1022-1029.
[3]Lin M, Zhu J, Wang Q, et al. Development and evaluation of a reverse dot blot assay for the simultaneous detection of common alpha and beta thalassemia in Chinese[J]. Blood Cells, Molecules, and Diseases, 2012, 48(2):86-90.
[4]Chang HJ, Huang MY, Yeh CS, et al. Rapid diagnosis of tuberculosis directly from clinical specimens using a gene chip[J]. Clinical Microbiology and Infection, 2010, 16(8):1090-1096.
[5]Shi J, Birnbaumer L, Large WA, et al. Myristoylated alanine-rich C kinase substrate coordinates native TRPC1 channel activation by phosphatidylinositol 4, 5-bisphosphate and protein kinase C in vascular smooth muscle[J]. The FASEB Journal, 2014, 28(1):244-255.
[6]Zhang CY, Chen GF, Liu Y, et al. Simultaneous detection of harmful algae by multiple polymerase chain reaction coupled with reverse dot blot hybridization[J]. Harmful Algae, 2014, 35:9-19.
[7]Herman EM. Genetic modification removes an immunodominant allergen from soybean[J]. Plant Physiology, 2003, 132(1):36-43.
[8]Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1):248-254.
[9]Cheley S, Anderson R. A reproducible microanalytical method for the detection of specific RNA sequences by dot-blot hybridization[J].Analytical Biochemistry, 1984, 137(1):15-19.
[10]蔡錦達, 齊建虹, 顧豪. 基于ARM9的滾筒式生物芯片點樣儀的研發[J]. 儀器儀表學報, 2013(10):2198-2204.
[11]張潤香. 中低密度生物芯片點樣儀研制及親疏水基底研究[D]. 廈門:廈門大學, 2007.
[12]Li Y, Yu X, Guo X, et al. Gene chip analysis of the retrotransposons in rice implanted by the N+ion beam[J]. Procedia Environmental Sciences, 2012, 12:1197-1202.
[13]Liang Z, Dong M, Cheng Q, et al. Gestational diabetes mellitus screening based on the gene chip technique[J]. Diabetes Research and Clinical Practice, 2010, 89(2):167-173.

