替莫唑胺膠囊的溶出曲線和穩定性比較
李勇陳勇 杜斌 鄭雙雙(華東理工大學藥學院 上海 200237)
替莫唑胺膠囊的溶出曲線和穩定性比較
李勇*陳勇 杜斌 鄭雙雙
(華東理工大學藥學院 上海 200237)
比較替莫唑胺國產膠囊與原研膠囊的溶出曲線和穩定性。在4種溶出介質中考察溶出曲線相似性,裝置采用轉籃法,轉速100 r/min。替莫唑胺國產膠囊與原研膠囊在四種溶出介質中的溶出曲線均相似。穩定性影響因素實驗表明,國產膠囊在高溫(60 ℃)和高濕(相對濕度 92.5%)條件下不穩定,有關物質量增加,而原研膠囊的穩定性良好。
替莫唑胺膠囊 溶出曲線 相似性 穩定性
替莫唑胺(temozolomide)是一種新型烷化劑類抗腫瘤藥物,口服吸收完全,生物利用度高,并可透過血腦屏障[1],對腦部腫瘤的效果較好,能有效治療新診斷及復發的膠質母細胞瘤和間變性星形細胞瘤,延長患者生存期[2],而且安全性和耐受性較好[3]。國內的上市制劑出自三個廠家,劑型均為膠囊劑。本文對國產膠囊與原研膠囊的穩定性和溶出曲線相似性進行研究,評估兩者之間可能存在的質量差異,為替莫唑胺國產膠囊的品質提升提供參考。
1 試藥與儀器
1.1 試藥
原研替莫唑胺膠囊(A廠,規格20 mg,批號3CAPA21002);國產替莫唑胺膠囊(B廠,規格5 mg,批號20140808);替莫唑胺對照品(Merck Sharp & Dohme Ltd,英國,批號4DZAA04001);甲醇為色譜純(北京百靈威科技有限公司);鹽酸、冰醋酸、醋酸鈉、磷酸二氫鉀、氫氧化鈉均為分析純。
1.2 儀器
LC-10AD島津高效液相色譜系統(日本島津,SPD-10Avp紫外檢測器,LC-10ADvp泵,SCL-10Avp系統控制器);AL104分析天平(Mettler Toledo);ZRS-8GD智能溶出試驗儀(天津市天大天發科技有限公司);UV-5100B紫外/可見分光光度計(上海元析儀器有限公司);KBF-250藥品穩定性試驗箱(上海一恒科學儀器有限公司);MGC-30F光照試驗箱(上海康勵儀器設備有限公司)。
2 方法
2.1 溶出曲線相似性比較
1)溶出介質 分別以水、0.1 mol/L鹽酸溶液、pH4.5醋酸-醋酸鈉緩沖液 、pH 6.8磷酸鹽緩沖液[4])為溶出介質。其中,水為法定標準規定的溶出介質。
2)溶出曲線測定 取本品6粒,照溶出度測定第一法[4]附錄XC,溶出介質500 ml(國產膠囊)、900 ml(原研膠囊),轉速為100 r/min,依法操作,在5、10、15、20、30 min時,取溶液10 ml,濾過,同時補充37 ℃相應溶出介質10 ml。國產膠囊以續濾液作為供試品溶液;原研膠囊取續濾液5 ml,置10 ml量瓶中,用相應溶出介質稀釋至刻度,搖勻,作為供試品溶液。另精密稱取替莫唑胺對照品10 mg,置50 ml量瓶中,加水溶解并稀釋至刻度,得濃度為200 mg/ml的貯備液。精密量取貯備液,用相應溶出介質稀釋成濃度為10 mg/ml的對照品溶液,照紫外-可見分光光度法[4]附錄IVA,在330 nm的波長處測定吸光度,計算各時間點的溶出量,繪制溶出曲線,采用相似因子(f2)進行溶出曲線相似性比較。
2.2 穩定性比較
以穩定性影響因素實驗評估國產膠囊和原研膠囊的穩定性。取本品除去外包裝,分別置高溫(60 ℃、40 ℃)、高濕(相對濕度 92.5%、75%)和強光(4 500 Lx)條件下放置10 d,于第10天取樣測定質量、有關物質、替莫唑胺含量和溶出度,并與0 d數據比較。
1)有關物質檢查 取本品10粒,精密稱定,倒出內容物,將膠囊中殘余粉末擦干凈后,稱定空膠囊重量,計算內容物平均裝量,精密稱定適量內容物(約相當于替莫唑胺10 mg),置50 ml量瓶中,加流動相適量,冰浴中超聲處理(約10 min)使替莫唑胺溶解并稀釋至刻度,搖勻,濾過,取續濾液作為供試品溶液。照高效液相色譜法測定[4]附錄VD。固定相為Gemini C18色譜柱(4.60 mm×250 mm,5 mm);流動相為甲醇-0.5%冰醋酸溶液(10∶90);檢測波長為254 nm。理論板數按替莫唑胺峰計算不低于9 000,替莫唑胺峰與相鄰雜質峰的分離度應符合要求。精密量取2.1中的替莫唑胺貯備液1 ml,置100 ml量瓶中,用流動相稀釋至刻度,搖勻,作為對照溶液。取對照溶液20 m1注入液相色譜儀,調節檢測靈敏度,使替莫唑胺色譜峰的峰高約為滿量程的40%。精密量取供試品溶液20 μ1,注入液相色譜儀,記錄色譜圖至替莫唑胺峰保留時間的2.5倍。按不加校正因子的主成分自身對照法計算單一雜質與總雜質含量。
2)含量測定 照有關物質項下的方法,取供試品溶液及對照品溶液(200 mg/ml)分別進樣,記錄色譜圖,按外標法以峰面積計算,即得。
3)溶出度測定 按2.1中方法,以水為溶出介質,測定國產膠囊和原研膠囊的溶出度。取樣時間為10、20和30 min,限度為30 min溶出量為標示量的80%。
3 結果
3.1 溶出曲線相似性
國產膠囊與原研膠囊在四種溶出介質中的溶出曲線見圖1。兩制劑在四種溶出介質中,15 min的溶出度均大于85%,無需進行f2比較,可直接判定為溶出曲線相似。但國產制劑在5 min時的溶出度均明顯小于原研制劑。
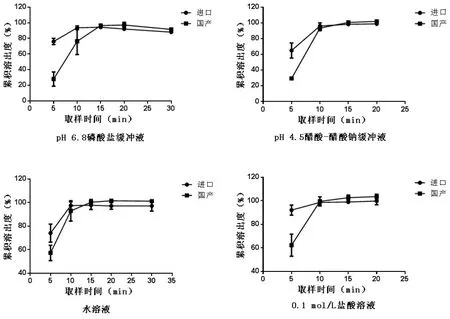
圖1 四種介質中的溶出曲線
3.2 國產膠囊與原研膠囊的穩定性
有關物質、含量和溶出度數據見表1。結果表明,在去除外包裝的情況下,原研膠囊的穩定性優于國產膠囊。具體表現為:原研膠囊在穩定性影響因素實驗的各項考核中,有關物質、含量、溶出度指標均未見明顯改變,均符合質量標準的規定。國產膠囊在高溫60 ℃和高濕92.5%的條件下,有關物質已明顯超標;溶出度雖然均在限度范圍內,但在高溫60 ℃和高濕92.5%的條件下,10 min的溶出量明顯降低。
4 討論
本文中替莫唑胺膠囊劑溶出度測定參照FDA dissolution methods database中的方法[5];有關物質檢查參照2010年版中國藥典第二增補本收載的替莫唑胺膠囊中的相關方法[6];含量測定參照2010年版印度藥典中的相關方法[7]。
溶出曲線是反映固體制劑品質的一項重要指標[8]。仿制制劑與原研制劑的體外溶出曲線相似性是保證兩制劑體內生物等效的前提之一。自1999年美國FDA頒布采用f2因子比較法以來,該法已被普遍用于溶出曲線相似性的比較。計算f2因子時要求取樣時間點應不少于3個,在溶出率85%以上的時間點應不多于一個。對于普通制劑的取樣時間通常安排為5、10、15、30 min……,當連續兩點溶出率均達85%以上且差值在5%以內時,試驗結束[9]。若制劑釋藥非常迅速,如替莫唑胺膠囊在10 min時溶出度已大于90%,則不滿足上述f2因子法的計算要求。故本文參照日本厚生勞動省頒布的《仿制藥生物等效性試驗指導原則》與《固體制劑處方變更后生物等效性試驗指導原則》,當參比制劑與仿制制劑在15 min內平均溶出率均達85%以上,即判定溶出曲線相似[9]。根據這一判定標準,國產替莫唑胺膠囊與原研制劑溶出曲線相似,但國產膠囊在初始時間點的溶出明顯較慢。
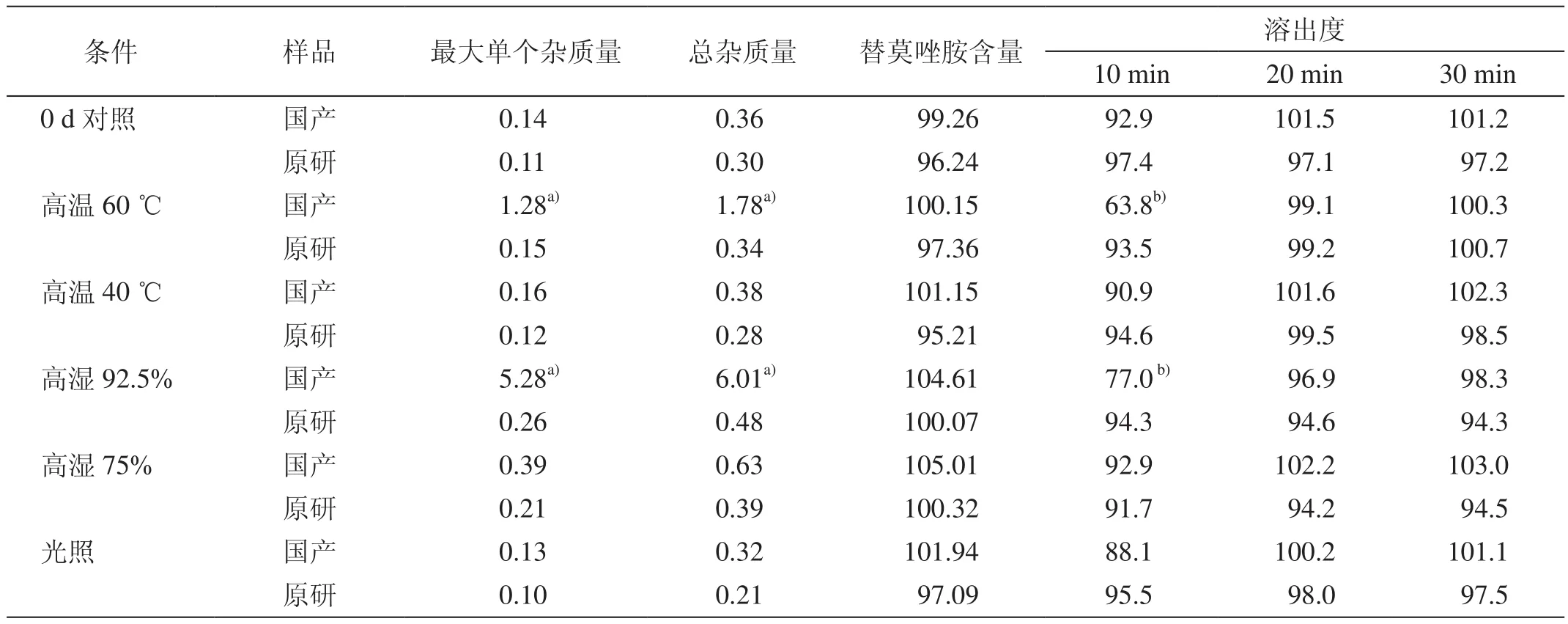
表1 穩定性考核10 d后的有關物質、替莫唑胺含量和溶出度(%)
采用pH 6.8磷酸鹽緩沖液作為溶出介質時,發現替莫唑胺在達到最大溶出量后,介質中的藥量隨時間逐漸減少。造成這一現象的原因是由于替莫唑胺在中性或堿性條件下穩定性較差,藥物發生降解所致[10]。
穩定性研究是藥品質量控制研究的主要內容之一。本文采用影響因素實驗是為了研究影響替莫唑胺膠囊穩定性的因素,為國產制劑的質量提升提供依據。文獻報道,替莫唑胺溶液對溫度敏感[10]。本文結果提示,國產膠囊對高溫(60 ℃)、高濕(相對濕度92.5%)敏感,有關物質超標。相對而言,原研制劑的穩定性良好。造成這種差異的原因可能是兩者選用的原料、輔料或制備工藝不同所致。
[1] Reyderman L, Statkevich P, Thonoor CM, et al. Disposition and pharmacokinetics of temozolomide in rat[J]. Xenobiotica, 2004, 34(5): 487-500.
[2] Hirst TC, Vesterinen HM, Sena ES, et al. Systematic review and meta-analysis of temozolomide in animal models of glioma: was clinical efficacy predicted?[J]. Br J Cancer, 2013, 108(1): 64-71.
[3] Dixit S, Baker L, Walmsley V, et al. Temozolomide-related idiosyncratic and other uncommon toxicities: a systematic review[J]. Anticancer Drugs, 2012, 23(10): 1099-106.
[4] 國家藥典委員會. 中華人民共和國藥典2010年版二部[M]. 北京: 中國醫藥科技出版社, 2010: 附錄175-177.
[5] U.S. Food and Drug Administration. Dissolution Methods [EB/OL]. (2008-08-11)[2015-05-08]. http://www.accessdata. fda.gov/scripts/cder/dissolution/dsp_SearchResults_ Dissolutions.cfm?PrintAll=1.
[6] 國家藥典委員會. 中華人民共和國藥典2010版第二增補本[M]. 北京: 中國醫藥科技出版社, 2013: 318.
[7] The Indian Pharmacopoeia Commission. Indian Pharmacopoeia 2010[M]. New Delhi: National Institute of Science Communication and Information Resources (NISCAIR) Council of Scientific & Industrial Research, 2193-2194.
[8] 謝沐風. 改善溶出度評價方法,提高固體藥物制劑水平[J]. 中國醫藥工業雜志, 2005, 36(7): 447-451.
[9] 謝沐風. 溶出曲線相似性的評價方法[J]. 中國醫藥工業雜志, 2009, 40(4): 308-311.
[10] 鄭蓉, 蔣德錫, 廖心丹, 等. 溫度及pH對替莫唑胺溶液穩定性的影響[J]. 華西藥學雜志, 2012, 27(5): 550-551.
Comparative study on the dissolution and stability of temozolomide capsules from different pharmaceutical manufactures
LI Yong*, CHEN Yong, DU Bin, ZHENG Shuangshuang
(East China University of Science and Technology, Shanghai 200237, China)
To compare the dissolution profile and stability between domestic and original preparations of temozolomide capsules. Similarity of dissolution curve of two preparations in four different types of dissolution media was evaluated by the basket method at 100 r/min. The dissolution profiles of domestic preparation were similar to those of original preparation in all 4 dissolution media. The study of the stability-influencing factors showed that domestic preparation was unstable with the significant increase in the amount of related substances under high temperature (60℃) and high humidity (RH 92.5%) while original preparation was stable under the same conditions.
temozolomide capsules; dissolution profiles; similarity; stability
R979.11; R927.11
A
1006-1533(2015)19-0076-04
李勇(1990-),男,碩士研究生,主要從事藥物制劑研究。 E-mail :1073513420@qq.com
2015-06-08)

