蓮房多酚提取工藝優化及其抗氧化活性研究
鐘怡平,夏道宗,黃 嵐,王思為,方月娟
(浙江中醫藥大學藥學院,浙江杭州310053)
蓮房多酚提取工藝優化及其抗氧化活性研究
鐘怡平,夏道宗*,黃嵐,王思為,方月娟
(浙江中醫藥大學藥學院,浙江杭州310053)
在單因素實驗的基礎上,通過正交實驗優化了熱回流提取蓮房多酚的工藝,并通過測定其清除ABTS+自由基、DPPH自由基、OH自由基的能力,還原力,亞鐵離子螯合活性及對大鼠腦勻漿脂質過氧化的影響,對蓮房多酚的抗氧化活性進行綜合研究。結果表明,熱回流提取蓮房多酚的最佳工藝參數為:乙醇濃度50%,料液比1∶25,提取溫度80℃,提取時間為2h,最優條件下的得率是5.23%。蓮房多酚的體外抗氧化實驗表明蓮房多酚對DPPH自由基、ABTS+自由基、OH自由基有很強的清除能力,對亞鐵離子的螯合活性和還原力均較強,并能顯著抑制大鼠腦勻漿脂質過氧化。本研究表明在該優化工藝下提取的蓮房多酚具有較強的抗氧化活性。
蓮房,多酚,提取,抗氧化
蓮為睡蓮科蓮屬多年生水生草本植物,是一種常見的藥食兩用經濟作物[1]。蓮類藥材(荷葉、蓮房、蓮子、蓮子心、藕節等)均可作為藥物用來治療多種疾病[2-3]。我國蓮資源充足,而作為蓮非可食部分的蓮房卻一直被視為廢棄物丟棄,利用價值不高。目前關于蓮房的研究還處于起步階段,開發蓮房不僅具有一定的科學價值,還會帶來不錯的經濟效益。有報道稱,蓮房中富含多酚,對蓮房多酚的開發研究空間很大,值得深入考察[4-6]。此外,華中農業大學在蓮源花青素領域的研究也成果頗豐。植物多酚可以通過減少自由基的產生而削弱自由基對機體的損傷,因此該類化合物在醫藥和保健方面必將有廣泛的應用[7-8]。本文采用正交實驗優化了熱回流提取蓮房多酚的工藝,并通過測定其清除ABTS+自由基、DPPH自由基和OH自由基的能力,結合亞鐵離子螯合活性和還原力測定,以及對大鼠腦勻漿脂質過氧化的影響,從化學、生物學角度對蓮房多酚的抗氧化活性進行綜合研究,為進一步利用和研究蓮房提供實驗依據。
1 材料與方法
1.1材料與儀器
蓮房采自浙江中醫藥大學中藥飲片有限公司,產地湖南;1,1-二苯基-2-苦基苯肼(DPPH)、二銨鹽自由基(ABTS)、2,4,6-Tris(2-pyridyl)-s-triazine(TPTZ) 美國Sigma-A ldrich公司;乙醇、福林酚試劑、無水碳酸鈉、沒食子酸、抗壞血酸、無水乙酸鈉、冰乙酸、鹽酸、FeCl3、FeSO4、H2O2、KH2PO4、三氯乙酸、硫代巴比妥酸、Ferrozine、D-脫氧核糖、EDTA-2Na等。
FA2004電子分析天平上海菁海儀器有限公司;R201旋轉蒸發儀上海申勝生物技術有限公司;低溫冷卻液循環泵鄭州長城科工貿有限公司;UV-2600紫外可見分光光度計上海尤尼柯儀器有限公司;GZX-9140 MBE恒溫干燥箱上海博訊實業有限公司醫療設備廠。
1.2實驗方法
1.2.1多酚含量的測定沒食子酸標準曲線的繪制:準確吸取濃度為100μg/m L的沒食子酸標準溶液0、0.1、0.2、0.4、0.6、0.8m L于10m L比色管中,加入5m L福林酚試劑、4m L 75g/L的Na2CO3溶液。旋渦混勻15s后,用蒸餾水定容至刻度,40℃放置30m in,顯色。用分光光度計測定775nm的吸光值,繪制標準曲線,計算回歸方程。
蓮房多酚含量測定:準確稱取已過20目篩的蓮房粉末2g,加入一定量一定濃度乙醇,于一定溫度下提取,提取一定時間后進行抽濾,旋轉蒸發,蒸餾水定容至50m L,取1m L定容至100m L,取1m L待測液,按照標準曲線的方法測定總酚含量。
蓮房多酚得率(%)=(樣液中多酚含量(mg/L)×樣液體積(L)×稀釋倍數)÷蓮房質量(mg)×100
1.2.2單因素提取實驗為研究乙醇濃度、料液比、提取時間、提取溫度四個因素對蓮房多酚得率的影響,分別進行單因素實驗。
1.2.2.1乙醇濃度對蓮房多酚提取效果的影響采用0、30%、40%、50%、60%、70%、80%、100%八個水平,料液比1∶20,在水浴溫度60℃條件下提取1h。
1.2.2.2提取溫度對蓮房多酚提取效果的影響采用40、50、60、70、80、90℃六個水平。以60%乙醇溶液為溶劑,料液比1∶20提取1h。
1.2.2.3提取時間對蓮房多酚提取效果的影響采用0.5、1、1.5、2、2.5、3h六個水平,以60%乙醇溶液為溶劑,料液比1∶20,在水浴溫度80℃條件下提取。
1.2.2.4料液比對蓮房多酚提取效果的影響采用1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40七個水平,以60%乙醇溶液為溶劑,在水浴溫度80℃條件下提取1h。
1.2.3正交實驗根據單因素實驗的結果,以乙醇濃度、料液比、提取時間、提取溫度作為正交實驗的四個因素,每個因素取三個水平進行優化,因素水平表見表1。

表1 正交實驗因素水平表Table 1 Factors and levels design of orthogonal experiment
1.2.4體外抗氧化實驗將蓮房多酚配制成八個濃度500、250、100、50、25、10、5、2.5μg/m L。配制陽性對照抗壞血酸(1mg/m L):稱取10.0mg抗壞血酸,用蒸餾水定容至10m L。即1000μg/m L,然后稀釋成500、250、 100、50、25、10、5μg/m L系列濃度。
1.2.4.1清除DPPH自由基能力的測定[9-10]準確稱取20mg DPPH自由基,用無水乙醇溶解配制成2× 10-4mol/L的溶液(253.6m L)。取等體積(2m L)待測液及2×10-4mol/L DPPH溶液加入同一具塞試管中,搖勻。室溫下避光放置30m in后用無水乙醇做參比在517nm下測定其吸光度Ai,同時測定2×10-4mol/L DPPH溶液與等體積無水乙醇(2m L)混合液的吸光度Ac,以及待測液(2m L)與等體積無水乙醇混合液的吸光度Aj。根據式(1)計算樣品對DPPH自由基的清除率,求取試樣清除DPPH自由基的IC50。
DPPH自由基清除率(%)=[1-(Ai-Aj)]/Ac×100
1.2.4.2清除ABTS+自由基的能力測定[11]取0.4m L不同濃度的樣品溶液,加入3.6m L 0.0875mmol/L ABTS溶液,漩渦混合后于暗處靜置10m in,測定734nm的吸光值。對照管以0.4m L 70%乙醇替代樣品。根據式(2)計算清除率,并求取試樣清除ABTS+自由基的IC50。
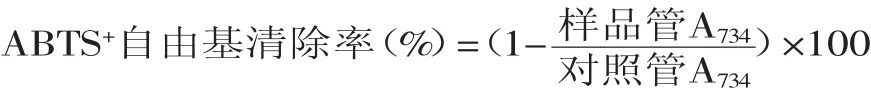
1.2.4.3還原力的測定—鐵離子還原法[12]吸取系列濃度FeSO4溶液繪制標準曲線。吸取100μL待測樣品,與3m L FRAP溶液混合,再加300μL體積蒸餾水,在37℃水浴中反應4m in,于593nm波長下讀取吸光值,并在標準曲線上獲得待測樣品相應的FeSO4濃度,定義為當量濃度(FRAP值)。結果表示為每mg樣品中相當于的FeSO4的量。
1.2.4.4清除OH自由基能力的測定[13]取0.1m L不同濃度的樣品水溶液,加入0.690m L 20mmol/L pH7.4的KH2PO4-KOH緩沖液(含2.5mmol/L 2-脫氧核糖),然后加入0.1m L預先混合的1.0mmol/L硫酸亞鐵和1.04mmol/L EDTA(1∶1體積混合)。(反應液保持37℃溫浴,常溫放置)加入0.1m L 1.0mmol/L的抗壞血酸和0.01m L 0.1mol/L H2O2啟動反應,37℃下溫浴30m in。取出后加入1%硫代巴比妥酸1m L和2.8%三氯乙酸1.0m L,95℃下反應15m in以產生顏色。取出立即冷卻,532nm測吸光值。對照管以0.1m L蒸餾水代替樣品。
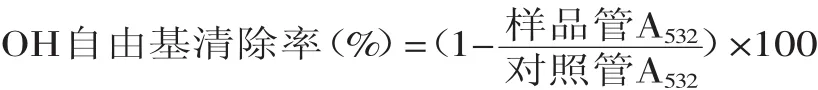
1.2.4.5亞鐵離子螯合活性測定[12]0.2m L不同濃度的樣品溶液中加入0.2m L 50μmol/L FeSO4和1.4m L 0.15mol/L NaCl溶液,加入0.2m L 300μmol/L菲咯嗪啟動反應,劇烈振搖后(漩渦混合5s),室溫下放置10m in。測定562nm的吸光值,若吸光值越低,表示對鐵離子的螯合能力越強。空白管用0.2m L 0.15mol/LNaCl代替菲咯嗪。
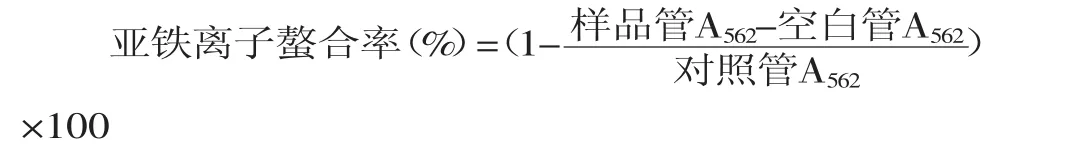
1.2.4.6對大鼠腦勻漿脂質過氧化的影響(丙二醛含量及抑制率的測定)[13]大鼠處死后,在冰臺上快速取腦,稱重,加10倍量生理鹽水勻漿,制備10%腦勻漿液。取10%新鮮腦勻漿0.6m L,加0.4m L生理鹽水,漩渦混勻,加入0.3m L不同濃度的樣品溶液,加入0.3m L 1mmol/L Fe2SO4,加入0.3m L 10mmol/L H2O2,在37℃下水浴1h后,加入1m L 15%三氯乙酸(TCA)終止反應,3000r/m in離心15m in,得上清液,取1.5m L上清液,加入1.0m L 1%的硫代巴比妥酸,100℃反應15m in。冷卻(固定冷卻時間),用分光光度計測定532nm的吸光值。對照管以0.3m L蒸餾水代替樣品。根據TBA-MDA產物(TBARS)的摩爾消光系數1.56× 105(mol/L)-1·cm-1計算MDA的濃度。
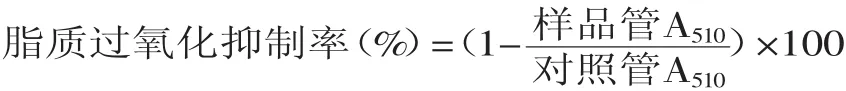
1.2.4.7數據處理所有數據均測定三次,取平均值;采用SPSS 13.0軟件進行數據處理。
2 結果與分析
2.1回歸方程確立
以沒食子酸標準溶液濃度為橫坐標,以其吸光度為縱坐標,繪制標準曲線,計算得沒食子酸標準曲線回歸方程為:Y=0.0147X+0.0190(R2=0.9993)
2.2單因素實驗結果與分析
2.2.1乙醇濃度對蓮房多酚提取效果的影響由圖1可見,隨著乙醇濃度增大,蓮房多酚得率呈先上升后下降趨勢,這可能是因為蓮房多酚結構復雜,極性跨度范圍較大,溶劑極性過大或過小對總多酚提取均有一定的影響,從本實驗結果來看,當乙醇濃度為60%左右時,提取率達最大值。
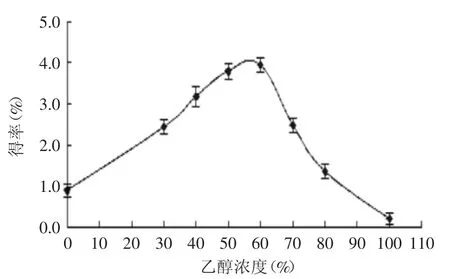
圖1 不同乙醇濃度對蓮房多酚得率的影響Fig.1 Effect of ethanol concentration on extraction yield
2.2.2溫度對蓮房多酚提取效果的影響由圖2可見,隨著溫度升高,蓮房多酚得率升高,當提取溫度為80℃時,蓮房多酚得率最高,溫度升高加快分子運動速度,有利于細胞中多酚物質的溶出。但當溫度再度升高,得率反而下降,這可能是由于高溫導致了部分蓮房多酚的氧化。
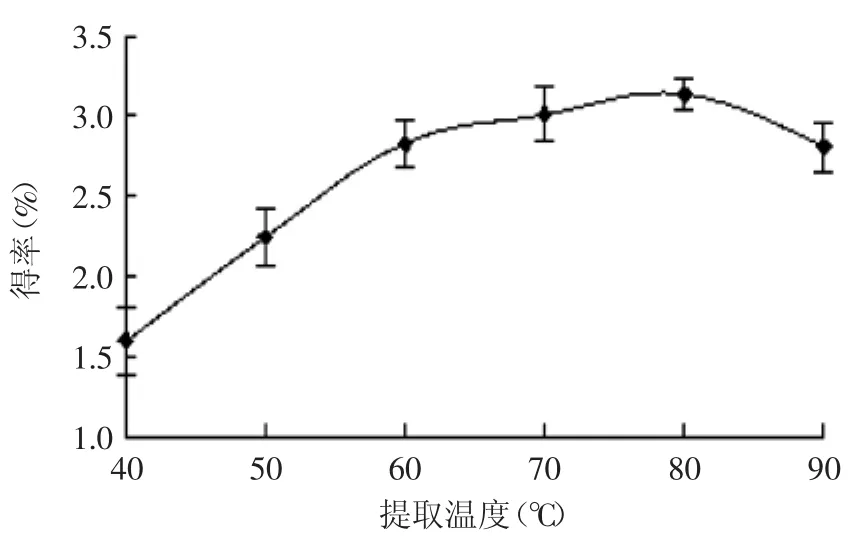
圖2 不同提取溫度對蓮房多酚得率的影響Fig.2 Effectof extraction temperature on extraction yield
2.2.3提取時間對蓮房多酚提取效果的影響由圖3可見,提取時間越長,蓮房多酚提取越充分,效率越高,但時間過長可能會導致多酚的氧化損耗,最佳提取時間在1h左右。
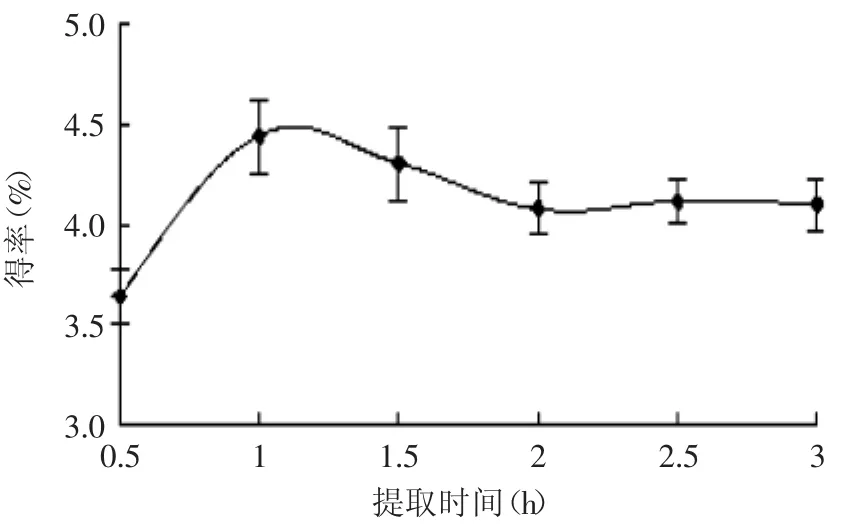
圖3 不同提取時間對蓮房多酚得率的影響Fig.3 Effectof extraction time on extraction yield
2.2.4料液比對蓮房多酚提取效果的影響由圖4可見,多酚得率隨著料液比加大而增大,當料液比達1∶25時,趨勢不再顯著,趨于穩定,這可能是因為料液比達到1∶25時,溶劑對多酚的溶解基本達到飽和,考慮到成本,可選1∶25為最佳料液比。
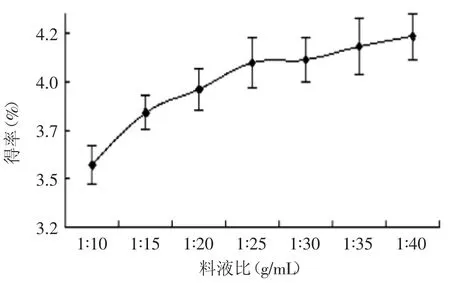
圖4 不同料液比對蓮房多酚得率的影響Fig.4 Effectof solid-liquid ratio on extraction yield
2.3正交實驗結果
根據單因素實驗的結果,以乙醇濃度、液料比、提取時間、提取溫度四個因素,每個因素取三個水平進行優化。
由表可知,四個因素對蓮房多酚物質得率的影響順序為:乙醇濃度>溫度>料液比>時間,由于因素B料液比的第2、3個水平的k值相等,考慮到經濟性,故選擇B2作為其優水平。因此,最佳提取工藝為A1B2C3D2,即用50%的乙醇,以1∶25的料液比于80℃提取2h,所得蓮房多酚的得率最高,為5.23%。
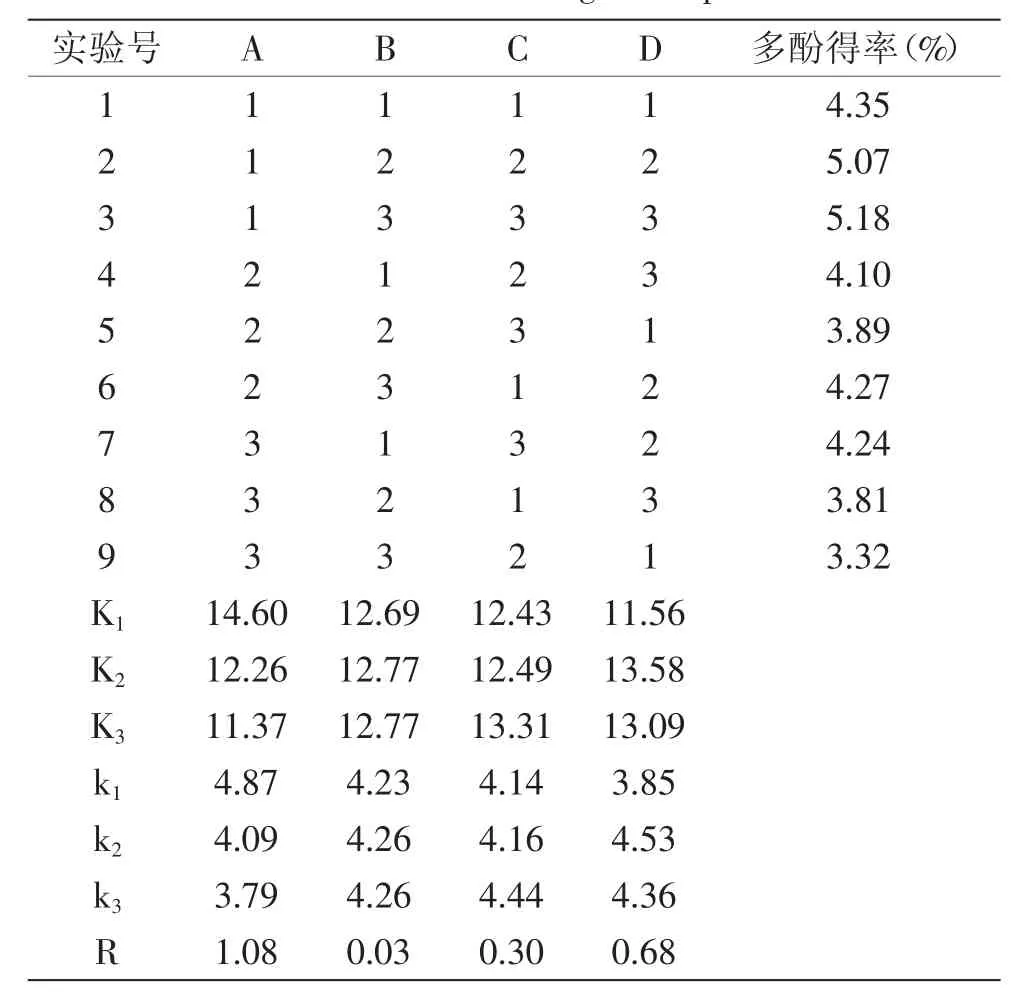
表2 正交實驗結果Table 2 Results of orthogonal experiment
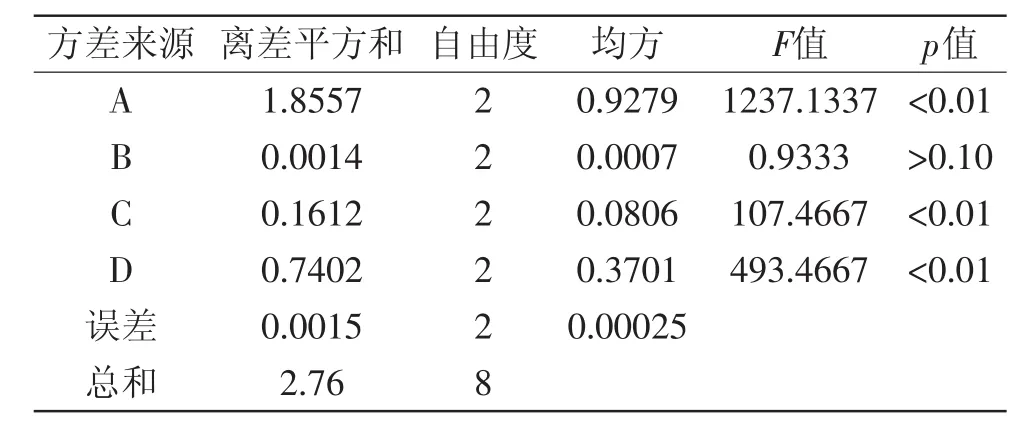
表3 方差分析表Table 3 Analysis of variance
2.4驗證實驗結果
稱取2g蓮房多酚,按最佳工藝A1B2C3D2進行提取,進行3次驗證實驗,實驗結果分別為5.19%、5.21%、5.30%,其平均提取率為5.23%,比正交實驗中含量最高的一組高出0.05%,表明通過正交實驗選擇出的最佳提取工藝科學合理,重現性好。
2.5體外抗氧化實驗
2.5.1清除DPPH自由基能力如圖5所示,蓮房多酚(TPNU)可以顯著抑制DPPH自由基的產生,且在一定范圍內具有量效關系,其IC50=9.03μg/m L,而陽性對照VC的IC50=12.44μg/m L。TPNU清除DPPH自由基能力略大于VC。鄭麗鋆等[14]研究了蓮房不同溶劑提取物對DPPH自由基的清除作用,其中乙醇提取物的IC50值為12.94μg/m L,分析其造成差異的主要原因可能與不同品種和不同產地的蓮房總多酚含量不同有關。
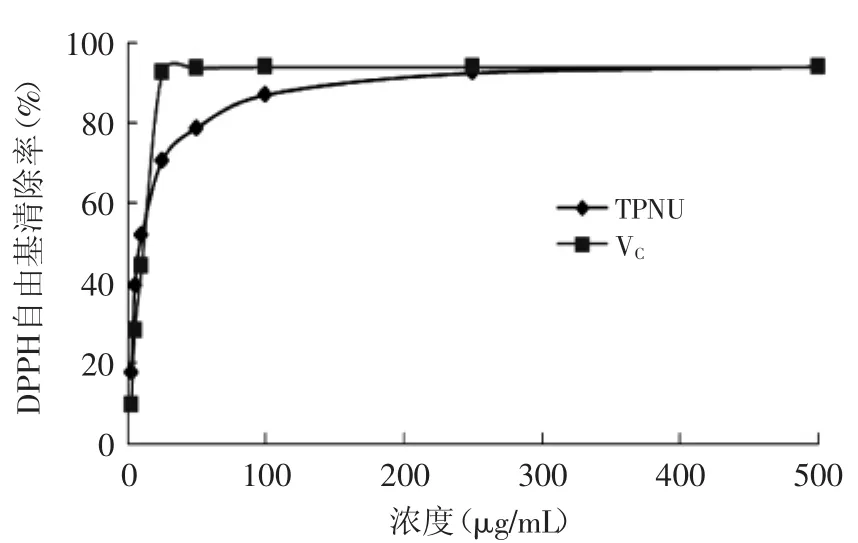
圖5 蓮房多酚對DPPH自由基的清除能力Fig.5 Capacity of DPPH free radical scavenging by TPNU
2.5.2清除ABTS+自由基的能力如圖6所示,TPNU可有效抑制ABTS+自由基的產生,且在一定范圍內具有量效關系,其IC50=26.38μg/m L,而陽性對照VC的IC50=17.29μg/m L。TPNU清除ABTS+自由基能力比VC略小,但仍有較強的清除ABTS+自由基的能力。
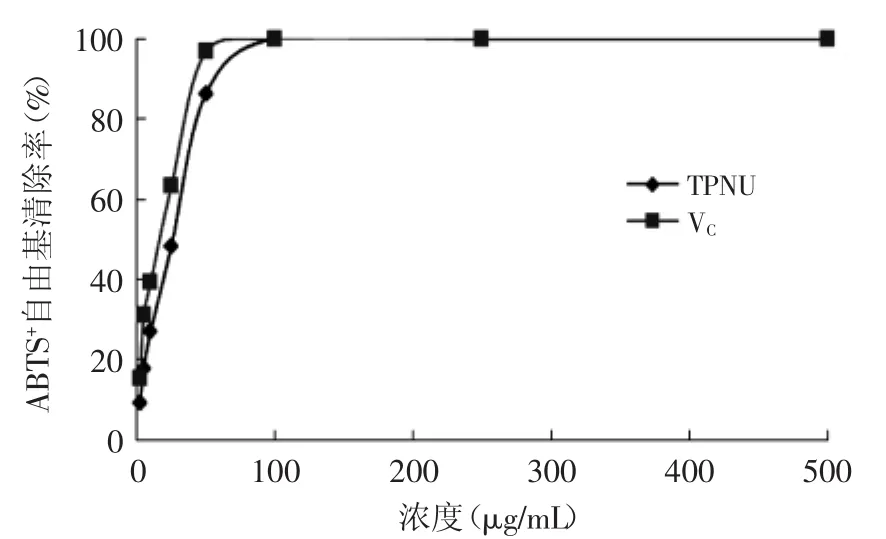
圖6 蓮房多酚對ABTS+自由基的清除能力Fig.6 Capacity of ABTS+free radical scavenging by TPNU
2.5.3還原力由圖7可知,TPNU具有一定的還原力,但比陽性對照VC較小,分別為5.27、9.33μmol/mg。
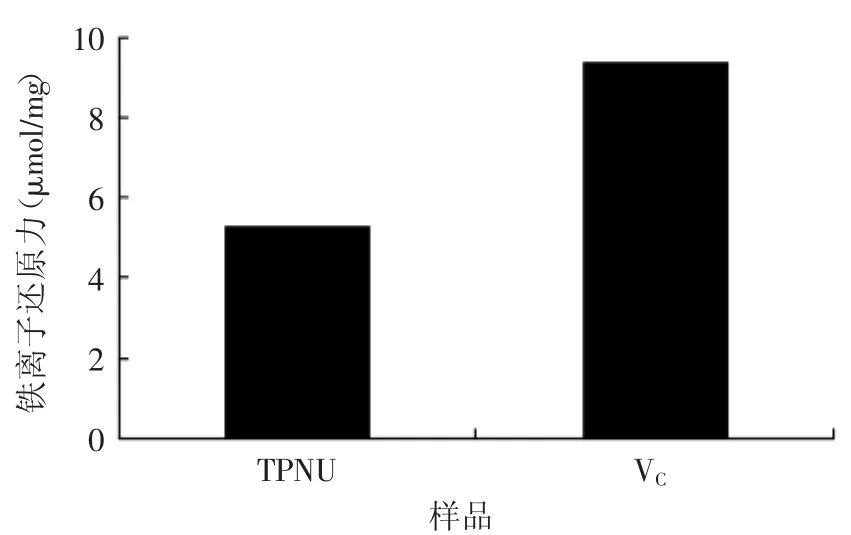
圖7 蓮房多酚的還原力Fig.7 Reducing power of TPNU
2.5.4清除OH自由基能力OH自由基是已知的最活潑的活性氧自由基,也是毒性最大的氧自由基,會引起脂質過氧化作用及造成生物損傷[15-16]。由圖8可知,蓮房多酚濃度為100μg/m L時,清除率達到了50%,稍低于VC。
2.5.5亞鐵離子螯合活性鐵被認為是脂質氧化的重要促進劑。對亞鐵離子的螯合,可以保護鐵誘導的氧化損傷[17]。由圖9可知,蓮房多酚對亞鐵離子的螯合小于EDTA,但仍具有較強螯合性,濃度為50mg/L時,螯合率達43.2%。
2.5.6對大鼠腦勻漿脂質過氧化的影響由圖10可知,蓮房多酚對大鼠腦勻漿脂質過氧化抵抗能力與VC相當(最高清除率相等),具有很強的抗脂質過氧化作用。

圖8 蓮房多酚對OH自由基的清除能力Fig.8 Capacity of hydroxy free radical scavenging by TPNU
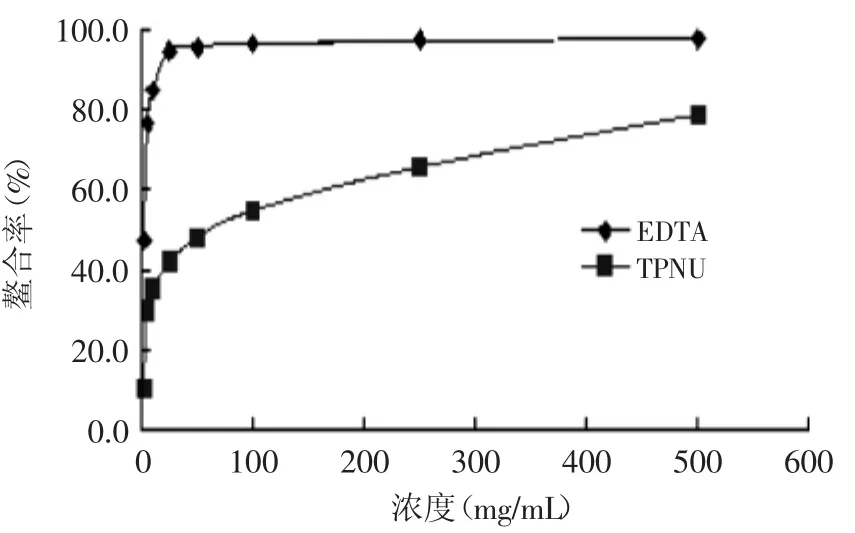
圖9 蓮房多酚對亞鐵離子螯合活性Fig.9 Ferrous ion-chelating capacity by TPNU
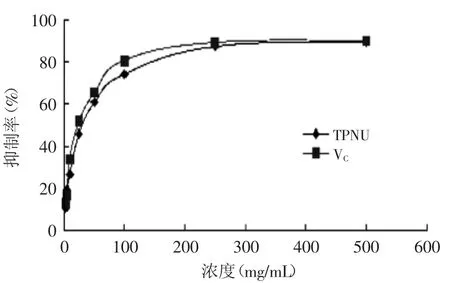
圖10 蓮房多酚對大鼠腦勻漿脂質過氧化的影響Fig.10 Influence on lipid peroxidation in rats of TPNU
3 結論
在單因素實驗的基礎上,采用正交實驗對蓮房多酚提取工藝參數進行優化,水浴回流提取蓮房多酚的最佳工藝參數為:乙醇濃度50%,料液比1∶25,提取溫度80℃,提取時間為2h,得率最高為5.23%。蓮房多酚的體外抗氧化實驗表明蓮房多酚對DPPH自由基、ABTS+自由基和OH自由基均具有良好清除作用,清除DPPH自由基能力略大于VC,具有很強的抗脂質過氧化作用且具有一定的還原力和亞鐵離子螯合活性。表明蓮房多酚是一種良好的天然抗氧化劑。本研究為工業化利用豐富的蓮房資源提取蓮房多酚提供了依據。
[1]廖立,舒展,李笑然,等.蓮類藥材的化學成分和藥理作用研究進展[J].上海中醫藥雜志,2010,44(12):82-84.
[2]Ling ZQ,Xie BJ,Yang EL.Isolation,characterization,and determination of antioxidative activity of oligomeric procyanidins from the seedpod of Nelumbo nucifera Gaertn[J].Journal of Agricultural and Food Chemistry,2005,53(7):2441-2445.
[3]曹楊,徐虹,王靜,等.蓮天然產物及其生物活性研究進展[J].食品工業科技,2012,33(8):402-405.
[4]段玉清,閆永勝,張海暉,等.蓮房多酚的微波輔助提取技術[J].江蘇大學學報,2009,30(5):437-440.
[5]黃素英.蓮子多酚提取及其抗氧化抑菌活性研究[D].福州:福建農林大學,2010.
[6]嚴守雷,王清章,彭光華.蓮藕多酚抗氧化作用研究[J].中國糧油學報,2005,20(4):77-81.
[7]鄭麗鋆,吳巖斌,王亞賢,等.蓮房多酚的超聲提取工藝研究[J].福建中醫藥大學學報,2011,21(3):39-41.
[8]邵芳芳,尹衛平,梁菊.重要的植物多酚及其抗氧化性能的研究概況[J].西北藥學雜志,2010,25(1):66-68.
[9]劉瓊,夏道宗,葉曉萍,等.安吉白茶含片的制作及其抗氧化活性評價[J].食品工業科技,2012,33(18):245-252.
[10]夏道宗,陳佳,鄒莊丹,等.馬齒莧、車前草復合保健飲料的研制及其抗氧化活性評價[J].食品科學,2009,30(4):118-122.
[11]鄭小薇,夏道宗,張英,等.梅花總黃酮對黃嘌呤氧化鎂的抑制作用及其抗氧化活性評價[J].食品工業科技,2011,32(11):168-170,173.
[12]Xia DZ,Yu XH,Zhu ZY,et al.Antioxidantand antibacterial activity of six edible wild plant(Sonchus spp.)in China[J]. Natural Product Research,2011,25(20):1893-1901.
[13]夏道宗,勵建榮,劉杰爾,等.高良姜總黃酮的超聲萃取及其體外抗氧化作用研究[J].中國食品學報,2009,9(3):63-68.
[14]鄭麗鑾,吳巖斌,吳建國,等.蓮房不同溶劑提取物對DPPH自由基的清除作用[J].福建中醫藥,2012,43(1):54-56.
[15]Sasaki S,Ohta T,Decker EA.Antioxidant activity of watersoluble fractions of salmon spermary tissue[J].Journal of Agricultural and Food Chemistry,1996,44(7):1682-1686.
[16]Aurand LW,Boone NH,Giddings GG.Superoxide and singlet oxygen in milk lipid peroxidation[J].Journal of Dairy Science,1977,60(3):363-369.
[17]Kehrer JP.The Haber-Weiss reaction and mechanisms of toxicity[J].Toxicology,2000,149(1):43-50.
Study on the extraction and antioxidant activity of total phenolic com pounds from the seedpod of Nelumbo Nucifera Gaertn
ZHONG Yi-ping,XIA Dao-zong*,HUANG Lan,WANG Si-wei,FANG Yue-juan
(College of Pharmaceutical Sciences,Zhejiang Chinese Medical University,Hangzhou 310053,China)
The extraction technology of total phenolic com pounds from the seedpod of Nelumbo nucifera Gaertn(TPNU)was studied by sing le-fac tor experiments and orthogonal test design.Furthermore,the antioxidant activities of TPNU were evaluated,using various antioxidant assays inc luded the scavenging on DPPH,ABTS+,OH free rad icals,reducing power determ ination,ferrous ion-chelating capacity and influence on lip id peroxidation in rats.The results showed that the op timum extrac tion cond itions were determ ined by orthogonal experiment as follows:ethanol concentration 50%,solid-liquid ratio 1∶25,extraction tem perature 80℃ and extraction time 2h,and the extrac tion yield was 5.23%in these conditions.TPNU had strong scavenging activity on DPPH,ABTS+and OH free rad icals,also had strong reducing power and ferrous ion-chelating capacity.In addition,TPNU could significantly inhibit the b rain lipid peroxidation in rats.These findings showed that TPNU had strong antioxidantactivity under the op timalextraction technology.
seedpod of Nelumbo nucifera Gaertn;totalphenolic com pounds;extraction;antioxidantactivity
TS201.1
B
1002-0306(2015)06-0235-05
10.13386/j.issn1002-0306.2015.06.044
2014-07-07
鐘怡平(1992-),女,本科,研究方向:功能性食品。
夏道宗(1978-),男,博士,副教授,研究方向:天然產物與功能性食品。
國家自然科學基金(81374048,81102861);國家級大學生創新創業訓練計劃項目暨浙江省新苗人才計劃(2013R410018,2014R410003)。

