重金屬富集對生物體Homesis效應的研究進展
孫倩倩等
摘要
總結了重金屬Homesis現象的分子生物學機理和生物學意義,并且對Homesis劑量-效應模型在重金屬風險評估中的價值進行探討,旨在評價重金屬對生物的影響、重金屬污染和食用安全監測、環境毒理學、環境污染診斷,同時為制定重金屬限量標準等提供借鑒與參考。
關鍵詞Hormesis效應;重金屬;劑量-效應模型;風險評估;環境毒理學
中圖分類號S-03文獻標識碼A文章編號0517-6611(2015)21-005-02
在16世紀,Paracelsus提出“劑量決定毒物”理論,即自然界物質都是有毒的,而劑量決定物質是否為毒物。在19世紀,Schulz[1]觀察到汞和苯酚等對酵母有促進生長作用,并且提出AmdtSchul定律,即當生物體受到某種微弱的刺激(如很小劑量的物質)時,可激發和加強生物體的生命活力,表現為興奮效應;但,當刺激或劑量增加到一定程度時,生物體活力減弱,表現出抑制效應。這是雙相-劑量效應順勢療法的實踐基礎。由于低劑量興奮效應不易被檢測,而且重復性較差等,這個理論被擱置下來。在1943年,Southam在研究紅雪松提取物對真菌的作用時,發現其效應為雙相-劑量效應關系,以此命名為“Hormesis”,發表在《Phytopathology》雜志上。這是Hormesis首次出現在學術刊物上。“Hormesis”效應又稱毒物興奮效應,是以雙相劑量-反應曲線為特征的適應性反應,表現為在致毒物質不同的劑量或強度下,生物體表現不同的劑量-反應關系,在高劑量時表現為負面影響,在低劑量時表現為有益作用的現象[2]。Hormesis現象出現在各類生物,各類有毒物質(包括氰化物、重金屬化合物、除草劑、多環芳烴、植物生長激素、抗生素等)及各類生命現象(包括生殖、壽命、生長、細胞分裂及腫瘤形成等)中。
重金屬通常是指密度大于5 g/cm3的金屬,約有45種。有些重金屬是生命活動必需微量元素(如鐵、銅、鋅等),在較高濃度時致毒,但是大部分重金屬是非必需元素,并且對生物體有很強的毒性(如汞、鉛、鎘等)。自然界中的重金屬有2個來源。一是巖石風化、火山活動等自然活動釋放的重金屬等。據統計,全球每年排放鉛、鋅、鎘、銅、鉻等重金屬的量分別約為1.2×103、4.5×103、1.4×103、2.8×103、4.3×103 t[3]。另一類則是釆礦業、冶金業、工業廢水、生活污水等人類生產、生活排放的重金屬。重金屬可被自然界生物體富集,通過食物鏈對人體健康構成嚴重威脅。對于采礦、冶金、電鍍和染料等行業排放的含鎘的廢水,經水生物富集可達相當高的濃度,如甲殼類、藻類、魚類的富集系數分別為150、400、5 000。當重金屬進入體內后,可與動植物體內的蛋白質、無機元素、化合物等結合,使得體內許多重要物質的結構發生改變,影響其生理功能、新陳代謝和生命活動等。
隨著經濟的發展,重金屬污染問題已成為威脅生物體安全的非常重要的食品安全問題和水產生態環境問題。環境中有毒物質的低劑量興奮效應正越來越受到人們的廣泛關注。
1重金屬富集引起的Hormesis效應
1.1 Hormesis效應在重金屬研究中的應用
重金屬影響生物體的Hormesis效應,主要表現在促進其生長發育能力和免疫力功能等。研究表明,低劑量鎘離子處理苜蓿可提高其株高、主根長、干質量,而隨著鎘濃度的不斷增加,上述指標呈明顯降低的趨勢[4] ;銅離子處理紫背萍呈現低濃度促進生長、高濃度抑制效應[5],即低劑量刺激植物細胞分裂,其間期縮短,分裂速度加快,高劑量時細胞分裂間期延長,使其分裂延滯[6]。在低劑量時,汞離子、鎘離子可使葉綠素含量增加;在高劑量時,葉綠素含量降低[7]。刺參體腔細胞在鋅離子、鉛離子、鎘離子單一污染作用下呈現Homesis效應,且其劑量-效應關系呈“拋物線”[8]。文獻報道,鎘離子對黑花蠅(Phormia regina)、水蚤(Daphnias)、黑呆頭魚(Fathead minnow)、多毛目環節動物(Polychaetes)等生物體中都表現出Hormesis效應[9-10]。
1.2重金屬引起Hormesis效應的分子生物學機理
重金屬引起的低劑量效應可能與機體抗氧化酶消除自由基有關,即生物體抗氧化應激機制。植物中的抗氧化酶如超氧化物岐化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)等在植物中發揮著不可替代的作用[11]。研究發現,鎘可增加植物細胞內活性氧物質的表達,而活性氧對細胞內的氧化平衡有破壞作用[12],對植物細胞產生損傷。葉亞新等[13]研究表明, 隨著鎘離子刺激濃度的增加,蘿卜幼苗SOD活性呈上升趨勢,但是隨著鎘離子刺激時間的增加,SOD活性又逐漸降低;莖和根的POD活性隨鎘離子刺激濃度的增加而上升,而葉中POD活性則表現為下降趨勢,甚至低于空白組,說明植物不同部位發揮作用的抗氧化酶種類不同。另有研究提出,Hormesis效應是由于低劑量刺激影響其分子靶位TIP/NOX蛋白質[14]。NOX可影響機體表達生物學效應,是細胞生長的Hormesis效應分子的靶位[15],促進細胞分裂,影響植物細胞生長速度;當植物體內的NADH(煙酰胺腺嘌呤二核苷酸)氧化酶(NOX)活性被抑制后細胞生長受阻,低濃度的刺激作用能夠增加NOX活性,從而解釋Hormesis效應。葉小明等[16]研究表明,低濃度的鎘離子可以刺激DNA的復制,誘導合成應激蛋白,上調原癌基因和轉錄因子等多種細胞因子的表達。這些都表現出Hormesis的劑量-反應關系特點。郝長付等[17]研究表明,當鎘離子誘導HEK293細胞增殖時,ERK信號傳導通路中轉錄因子cfos蛋白在低劑量興奮效應中發揮重要作用。
1.3Hormesis效應的生物學意義
Hormesis效應是自然界生物體長期進化過程中順應自然選擇的結果,可使生物體自穩狀態被破壞后能盡快修復損傷,促使生物體自我保護,以抵御環境中不利因素的影響。有毒物質低劑量刺激造成生物體輕微損傷,可激活發揮其體內Hormesis效應機制,使得機體盡快恢復到原來的狀態[18]。當在植物受到外界因素的不良刺激時,可啟動其自身保護機制,清除由于脅迫作用而產生的過氧化氫等自由基,以保護機體免受損傷[19]。水生沉水植物菹草和金魚藻在鎘離子作用下可促進其內源保護系統的表達,但隨著鎘離子毒害劑量作用的加重,植物體的自我防衛能力降低。丁磊等[20]研究發現,低濃度鎘脅迫對鯽魚溶菌酶(LSZ)和過氧化物酶(POD)有時間-效應關系、劑量-效應關系以及Hormesis現象;鎘對LSZ和POD激活作用是鯽魚對鎘污染的適應性反應,以增強其機體的免疫力,高濃度鎘脅迫對LSZ和POD的抑制作用可能是由于鎘污染對鯽魚的作用已超過機體的適應能力。
2Hormesis效應在環境毒理學中的應用
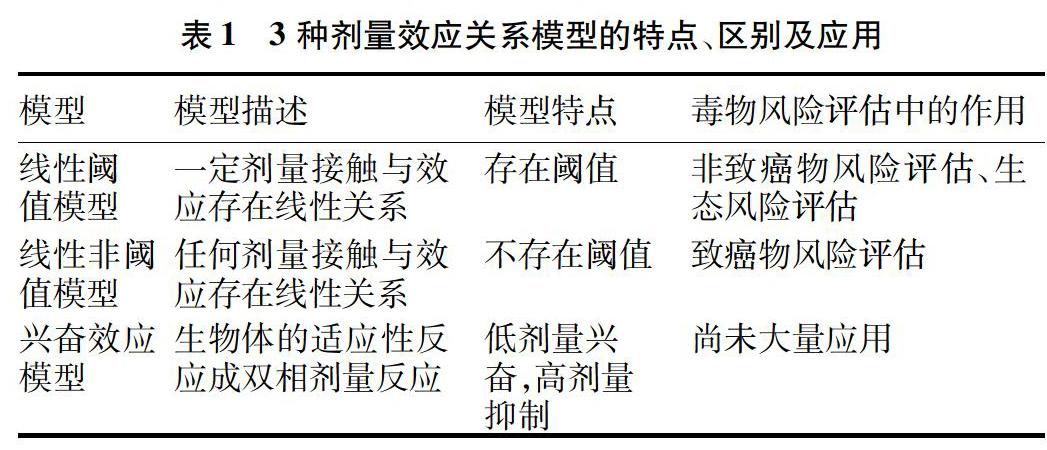
2.1 Hormesis劑量-效應關系模型
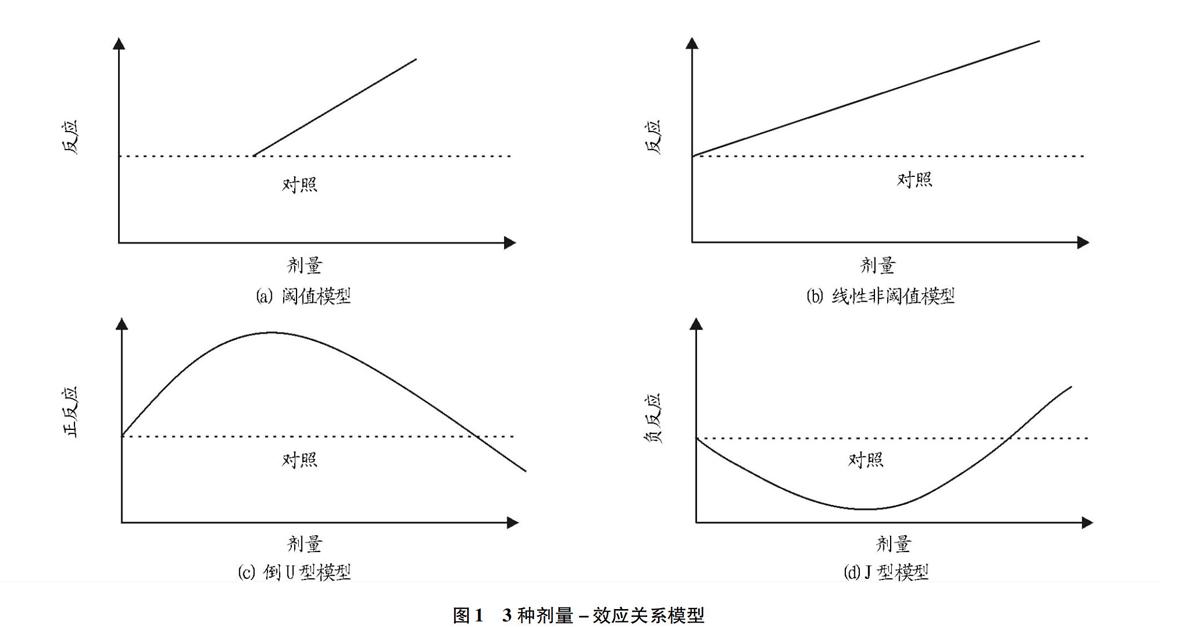
公共衛生管理部在對有害因素進行危險評估時,以劑量-效應關系為毒理學風險評估與制定相關條例的基本依據,并且制定管理法規和控制措施。毒理學中有3種劑量-效應曲線模型,分別為線性非閾值模型(Linear nonthreshold model,LNT Model)、閾值模型(Threshold model)、興奮效應模型(Hormetic model)(圖1)。大多有毒物質的安全閾值是根據線性模型時對物質高劑量檢測的結果,并且經過線性推導出安全濃度,認為當劑量低于其未觀察到有害作用量(Nonobserved adverse effect level,NOAEL)時不會引起生物學效應。當大量有毒物質低于NOAEL時,其引起的劑量反應并不僅僅呈現劑量-效應關系,而且具有Hormesis效應的特征[21]。
Hormesis劑量-效應關系曲線分為低劑量刺激和高劑量抑制2個區段。當刺激劑量或強度高于NOAEL時,其生物學效應與線性閾值或非閾值模型相同;當刺激劑量或強度低于NOAEL時,其引起的生物學效應符合倒U型模型或J型模型。有毒物質的倒U型曲線表明在低劑量時可誘導促進生物體生長發育,J型曲線表現為在低劑量時抑制生物體生長發育[22]。3種劑量-效應關系模型的特點、區別和應用見表1。
2.2Hormesis劑量-反應模型在重金屬風險評估中的應用
Hormesis效應在毒物風險評估中具有重要的應用價值,被應用于致癌物質和非致癌物質的風險評估領域。高劑量
重金屬對生物體的不良效應備受關注,如抑制生長發育、致畸性、致癌性等行為,卻很少注意低于未觀察到NOAEL 劑量
對生物體的影響,導致人們不能對重金屬的毒理學效應做出全面、客觀的評價。美國環保總署(Environmental Protection Agency,EPA)在評估有毒物質的致癌性時,將Hormesis效應納入參考范圍,以此解釋致癌物質“How clean is clean?”,對化學物質危險度評價的影響受到廣泛的關注。
Homesis的劑量-反應模型較符合實際情況,而不是在低劑量下總呈現線性關系,因此Hormesis模型較傳統毒理學線性閾值或線性非閾值法更具科學性、合理性。將Hormesis效應作為危險物質風險評估的影響因素。它涵蓋劑量-反應曲線的整個階段,且考慮各種影響因素[23] 。Hormesis效應考慮了實際可能接觸劑量或強度,包括可能接觸劑量或強度的上限和下限;在低劑量危險度分析中,還應考慮年齡、時間等參數對效應的影響,不能只考慮終生日平均劑量或短期內日平均劑量,且風險必須以毒物的總體作用效果來表示[24]。
Hormesis現象不易被觀測到,其刺激作用發生的低劑量閾值通常在NOAEL的5%~10%范圍內。統計分析表明,僅有5%~7%的Hormesis發生刺激作用的劑量閾低于NOAEL的1%,偶爾也有當劑量低于NOAEL的1/1 000時仍可發生刺激作用[25-28]。因此,將Hormesis模型應用在重金屬風險評估中仍需要進行更深入的研究。
3結語
重金屬對生物體的低劑量興奮效應已被實踐所證實,對其分子生物學機理已有諸多研究,但尚未得到一致的結論。Hormesis劑量-效應模型較傳統閾值或非閾值模型更具靈活性,但將Hormesis劑量-效應模型應用于重金屬風險評估中仍有諸多問題亟待解決。
參考文獻
[1] CHAPMAN P M.The implications of hormesis to ecotoxicology and ecological risk assessment[J].Hum Exp Toxicol,2001,20:499-505.
[2] CALABRESE E J.Hormesis:Changing views of the dose response[J].Mutat Res,2002,511:181-189.
[3] NRIAGU J.Global metal pollution[J]. Environment,1990,32:7-33.
[4] 許蘇凌,邢承華,方勇.鎘脅迫對紫花苜蓿生長及植株鎘含量的影響[J].廣東微量元素科學,2008,15(3):23.
[5] 涂俊芳,王興明,劉登義,等.不同濃度銅對紫背萍和青萍色素含量及抗氧化酶系統的影響[J].應用生態學報,2006,17(3):502.
[6] 韓善華.汞離子脅迫對植物細胞結構的影響及其機制[J].中國微生態學雜志,2009(5):480.
[7] 王澤港,駱劍鋒,劉沖.單一重金屬污染對水稻葉片光合特性的影響[J].上海環境科學,2004,23(6):240.
[8] 張峰,劉洪偉,宋志東.幾種重金屬對刺參體腔細胞超氧陰離子(O2-)產生的影響[J].農業環境科學學報,2006,25(z1):100.
[9] 王東紅,彭安,千子健.有毒物質低劑量刺激作用的研究進展[J]. 安全與環境學報,2004,4(1):18-21.
[10] LIU S Z.On radiation hormesis expressed in the immune system[J].Critical Reviews in Toxicology,2003,33:431-442.
[11] 汪洪,趙士誠,夏文建,等.不同濃度鎘脅迫對玉米幼苗光合作用、脂質過氧化和抗氧化酶活性的影響[J].植物營養與肥料學報,2008,14(1):36-42.
[12] 趙胡,鄭文教,陳杰.土壤鎘污染對大蒜幼苗生長及根系抗氧化系統的影響[J].生態學雜志,2008,27(5):771-775.
[13] 葉亞新,金琎,陳佳佳,等.鎘脅迫下蘿卜幼苗根、莖、葉保護酶活性的比較[J].江蘇農業科學,2008(3):131-135.
[14] MORRE D J.A protein disulfidethiol interchange protein with NADH:Protein disulfide reductase (NADH oxidase) activity as a molecular target for low levels of exposure to organic solvents in plant growth[J].Human & Experimental Toxicology,1998,17:272-277.
[15] MORRE D J.Chemical hormesis in cell growth:a molecular target at the cell surface[J].J Appl Toxicol,2000,20:157-163.
[16] 葉小明,庾蕾,莊志雄,等.TaqManMGB探針檢檢測人REV3L基因的毒物興奮效應[J]. 深圳大學學報:理工版,2005,22(4):358-362.
[17] 郝長付,郝衛東. ERK信號轉導通路在CdCl2誘導HEK293細胞低劑量興奮效應中的作用[J].衛生研究,2011,40(4):517-522.
[18] 讓歐艷,讓蔚清.低劑量興奮效應及其醫學應用[J].實用預防醫學,2009(1): 329.
[19] 付世景,宗良綱,張麗娜,等.鎘、鉛對板藍根種子發芽及抗氧化系統的影響[J].種子,2007,26(3):14-17.
[20] 丁磊,吳萍,蔡春芬,等.Cd2+對鯽血清溶菌酶和過氧化物酶的影響[J].農業環境科學學報,2004,23(2): 10.
[21] CALABRESE E J,BALDWIN L A.Hormesis:A biological hypothesis[J].Environmental Health Perspectives,1998,106(S1):357-362.
[22] DAVIS J M,SVENDSGAARD D J.Ushaped doseresponse curves:Their occurance and implications for risk assessment[J].BELLE Newslett,1992,1:4-15.
[23] XIA S J,ZHANG J F,WANG Z Z.Environmental risk assessment of chemical pollutants in the "benchmark dose method"[J]. Journal of Environmental & Occupational Medicine,2005,22(2):178-180,186.
[24] SIELKEN R,STEVENSON D.Some implications for quantitative risk assessment if hormesis exists[J].Hum Exp Toxicol,1998,17:259-262.
[25] CALABRESE E J,BALDWIN L A.A quantitativelybased methodology for the evaluation of chemical Hormesis[J].Human and Ecological Risk Assessment,1997,3(4):545-554.
[26] CALABRESE E J,BALDWIN L A.Hormesis as a default parameter in derivation[J].Human & Experimental Toxicology,1998,17:444-447.
[27] CALABRESE E J,BALDWIN L A,HOLLAND C.Hormesis:A highly generalizable and reproducible phenomenon with important implications for risk assessment[J].Risk Analysis,1999,19(2):261-281.
[28] CALABRESE E J,BALDWIN L A.Hormesis:Ushaped dose responses and their centrality in toxicology[J].Trends in Pharmacological Sciences,2001,22(6):285-291.

