水曲柳CBF1基因的克隆及表達分析
何之龍 詹亞光

摘要 [目的]探討水曲柳CBF基因的表達及與生物鐘調控的關系。[方法] 利用cDNA 末端快速克隆(RACE)技術克隆水曲柳CBF1基因的全長序列,并對三年生水曲柳幼苗葉片中FmCBF1基因的時間表達特征進行初步研究。[結果]利用RNA末端快速擴增(RACE)的方法從水曲柳中克隆得到1個CBF基因家族成員FmCBF1 (GenBank: KJ541508.1),該基因ORF 669bp,推測編碼蛋白質含有222個氨基酸殘基,相對分子質量24.5 kD,理論等電點為5.11,在DNA序列內不含內含子。氨基酸序列同源性比較發現,水曲柳FmCBF1基因與白樺BpCBF1同源性最高,相似性達79.4%,在系統進化樹中處于同一分支上。實時熒光定量PCR表達特性分析顯示, FmCBF1基因的表達具有一個大約以24 h為周期的節律性,最大值約出現在9:00,而夜間卻處于較低的表達水平。在4 ℃低溫處理1、3、6、12、24、72和120 h后FmCBF1的qRTPCR分析表明,該基因受到低溫誘導,并在4 ℃條件下隨低溫時間的延長,該基因的誘導表達特性呈先升后降的趨勢,最大值出現在12h時,達對照的25.5倍。[結論]為進一步研究水曲柳抗旱耐寒性及分子育種奠定基礎。
關鍵詞 水曲柳 ;基因克隆;CBF;晝夜節律
中圖分類號 S718.46 文獻標識碼 A 文章編號 0517-6611(2015)05-015-06
Cloning and Expression Analysis of FmCBF1 Genes from Fraxinus mandschurica
HE Zhilong1, ZHAN Yaguang1,2*, ZENG Fansuo1,2
(1. Life Science College, Northeast Forestry University, Harbin, Heilongjiang 150040;2. National Key Laboratory of Forest Genetics and Breeding, Northeast Forestry University, Harbin, Heilongjiang 150040)
Abstract [Objective] The aim was to investigate the relationship between expression of FmCBF1 Genes from Fraxinus mandschurica
and clock control.[Method] FmCBF1 was cloned from Fraxinus mandschurica seedlings by rapid amplification of cDNA ends (RACE). [Result] FmCBF1 contained a 669 bp complete open reading frame (ORF) which encoded a peptide of 222 amino acids. The predicted molecular weight and isoelctric point of FmCBF1 were 25.5 kD and 5.11, respectively. There was no intron in the DNA sequence of FmCBF1. The results of homology comparison showed that FmCBF1 protein shared 79.4% homology with Betula platyphylla BpCBF1, they were in the same branch in the phylogenetic tree. Expression analysis showed that the transcript level of CBF1 oscillated with a peak occurring at about 9 oclock in the morning followed by a second peak about 24 h later. Time course of the genes expressions at 4 ℃ for 1, 3, 6 12, 24, 72 and 120 h showed that its expression increased at the first and then decreased, and its peak occurring at 12 h after the callus was moved to 4℃ stress, and its expression was 25.5 times higher than CK.[Conclusion] The study laid foundation for study on drought cold and molecular breeding of Fraxinus mandschurica.
Key words Fraxinus mandschurica; Cloning; CBF; Circadian
基金項目 國家林業科技支撐項目(2011BAD0213);國家自然科學基金項目(31270697)。
作者簡介 何之龍(1988- ),男,湖南株洲人,博士研究生,研究方向:植物基因工程。
*通訊作者。
收稿日期 20141222
干旱響應元件(Crepeat/dehydration responsive element,CRT/DRE)是一種植物中DNA調控的順式作用元件,它位于COR(coldregulated)以及其他一些受低溫誘導基因的啟動子上,能刺激低溫和水分缺失下的轉錄起始[1]。CBF/DREB1蛋白是DNA結合蛋白AP/EREBP家族中的一種轉錄激活因子,研究發現,在逆境條件下CBF/DREB1轉錄因子能有效地與CRT/DRE結合,并激活其下游COR基因的轉錄,從而提高植物抵抗低溫、干旱以及高鹽等非生物脅迫的能力[2]。CBF1、CBF2和CBF3基因也稱為干旱響應元件結合因子1B(DREB1B),DREB1C和DREB1A是CBF/DREB1基因家族中被研究較多的成員,研究表明CBF1、CBF2和CBF3基因受生物鐘調控,且它們受低溫的誘導作用也受生物鐘的限制[3]。為探討水曲柳CBF基因的表達及與生物鐘調控的關系,筆者利用cDNA 末端快速克隆(RACE)技術克隆水曲柳CBF1基因的全長序列,并對三年生水曲柳幼苗葉片中FmCBF1基因的時間表達特征進行初步研究,為進一步研究水曲柳抗旱耐寒性及分子育種奠定基礎。
1 材料與方法
1.1 試驗材料
1.1.1 植物材料。
供試材料為三年生水曲柳幼苗,取自東北林業大學帽兒山實驗林場。
1.1.2 菌株和質粒。
所用大腸桿菌菌株為E.Coli JM109,克隆載體為pMD18T vector(購自大連寶生物工程公司)。
1.1.3 酶和生化試劑。
DNase I、DNA Marker DL2000、DNA連接試劑盒、IPTG、XGal以及rTaq聚合酶等購自大連寶生物工程公司,CTAB、DEPC、TrisBase、氯仿以及無水乙醇等購自哈爾濱伊事達生物工程公司,cDNA 末端快速克隆(RACE)試劑盒為Clontech 產品。
1.1.4 PCR引物。
以水曲柳轉錄組測序結果中獲得的CBF1基因cDNA的部分片段,設計PCR引物,由上海生工生物工程股份有限公司合成,引物序列:
水曲柳FmCBF1 5′RACE:CBF15r1:CATCAACCCTTCAGCCATATCG;
及巢式PCR引物:CBF15r2:AAATCTGGTAAGTGGGTGTGTG;
水曲柳FmCBF1 3′RACE:CBF13f1:GGCATTAGCAGAGCCAATTTTT;
及巢式PCR引物:CBF13f2:TGAATGTCCTTAGCATCAGTGG;
水曲柳FmCBF1基因全長引物:FmCBF1F:GATTAATGGATATTTTAACAAATC,
FmCBF1R:ATGGCTAAGAAGAACCCTAA;
水曲柳FmCBF1熒光定量PCR引物:
qCBF1F:AAATCTGGTAAGTGGGTGTGTG,
qCBF1R:TGAATGTCCTTAGCATCAGTGG;
水曲柳Tubulin(Tu)內參引物:FmTuF:AGGACGCTGCCAACAACTTT,
FmTuR:TTGAGGGGAAGGGTAAATAGTG。
1.2 試驗方法
1.2.1 水曲柳FmCBF1基因的克隆、連接轉化及測序。
1.2.1.1 植物基因組DNA和總RNA的提取。
用CTAB法[4]提取水曲柳基因組DNA和總RNA,水曲柳總RNA經過DNase I 消化DNA后測定RNA濃度,保存于-20 ℃冰箱備用。
1.2.1.2 水曲柳FmCBF1基因5′RACE和3′RACE的克隆。
使用SMARTerTM RACE cDNA Amplification Kit(Clontech)試劑盒合成5′RACEReady cDNA和3′ RACEReady cDNA,操作參照說明書。PCR反應體系見表1。
注:PCR反應液包含10×PCR反應緩沖液(Mg2+ Plus)2 ul,2.5 mmol/L dNTPs 1.6 ul,Taq酶 0.2 ul,ddH2O 11.8 ul。
反應條件:94 ℃預變性4 min,然后以94 ℃ 30 s,56 ℃ 30 s,72 ℃ 90 s進行35個循環,72 ℃延伸7 min。將PCR產物稀釋100倍進行巢式PCR,PCR反應體系見表2。
注:巢式PCR反應液包含10×PCR反應緩沖液(Mg2+ Plus)2 ul,2.5 mmol/L dNTPs 1.6 ul,Taq酶 0.2 ul,ddH2O 13.4 ul。
反應條件:94 ℃預變性4 min,然后以94 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s進行35個循環,72 ℃延伸7 min。將PCR產物進行膠回收,并取4 ul膠回收產物與pMD18T vector進行連接,構建重組質粒,操作參照說明書。將重組質粒轉化JM109感受態,涂布在含有Amp、IPTG和XGal的LB培養基上,倒置37 ℃暗培養過夜,藍白斑篩選重組子。用M1347/RVM通用引物進行PCR檢測,最后將陽性克隆送至上海生工生物工程股份有限公司測序。將測序所得的5′RACE和3′RACE進行拼接,獲得水曲柳CBF1基因的全長。
1.2.1.3 水曲柳CBF1基因cDNA全長的克隆。
根據拼接所得的水曲柳CBF1基因序列設計全長引物FmCBF1F:5′ GATTAATGGATATTTTAACAAATC3′;FmCBF1R:5′ ATGGCTAAGAAGAACCCTAA3′。用水曲柳基因組DNA作為模板進行PCR,反應體系:10× PCR反應緩沖液(Mg2+ Plus)2 ul,2.5 mmol/L dNTPs 1.6 ul,上下游引物各 1 ul,模板 2 ul,Taq酶 0.2 ul,ddH2O 12.2 ul。反應條件:94 ℃預變性4 min,然后以94 ℃ 30 s,48 ℃ 30 s,72 ℃ 90 s進行35個循環,72 ℃延伸7 min。回收PCR產物,構建重組質粒并轉化JM109感受態,藍白斑篩選陽性克隆進行測序。
1.2.2 水曲柳FmCBF1基因cDNA的序列分析。
通過NCBI數據庫在線進行比對(http://blast.ncbi.nlm.nih.gov/Blast.cgi),找出與該基因同源性較高的其他物種的氨基酸序列,然后用MEGA5軟件進行同源性比較,并構建系統進化樹;利用NCBI(http://blast.ncbi.nlm.nih.gov)中的ORFfinder軟件找出水曲柳FmCBF1基因的開放讀碼框,然后利用Expasy工具(http://au.expasy.org/tools/)中提供的ProtParam軟件和ProtScale軟件分別進行氨基酸殘基數目、組成、蛋白質相對分子質量、理論等電點和親/疏水性的預測分析[5];利用Expasy工具中的SOPMA 軟件在線預測分析α螺旋、β轉角、無規則卷曲及延伸鏈等,然后利用網站Expasy工具中的PSORT 軟件預測該蛋白質的亞細胞定位;利用CBS TMHMM2.0(http://www.cbs.dtu.dk/services/TMHMM/)預測該基因編碼的蛋白質跨膜域;并利用SWISSMODEL同源建模服務器(http://swissmodel.expasy.org)在線預測分析蛋白的三級結構[6-9]。
1.2.3 水曲柳FmCBF1基因的晝夜表達特征。
對三年生水曲柳幼苗葉片中FmCBF1基因的時間表達特征進行初步研究,從3:00開始對三年生水曲柳幼苗的葉片進行取樣,并用液氮速凍保存,每隔3 h重復取樣,持續48 h。將所取植物樣品的cDNA作為模板,以Tubulin作為內參基因,用FmCBF1熒光定量引物qCBF1F/R進行熒光定量PCR檢測,產物大小203 bp。參照TAKARA公司SYBR Premix Ex TaqTM(Perfect Real Time)說明書建立20 ul反應體系,在ABI 7500實時熒光定量PCR儀上進行操作。用2-ΔΔCT法[10]分析水曲柳FmCBF1基因的表達情況。
1.2.4 低溫脅迫對水曲柳FmCBF1基因表達的影響。
將一組長勢相同的水曲柳無性系愈傷組織放于4 ℃黑暗條件下(控溫冰箱)分別處理1、3、6、12、24、72和120 h。處理后將愈傷組織用液氮速凍,提取總RNA,消化,并進行逆轉錄、待用。每一處理均重復3 次。按“1.2.3”方法進行熒光定量PCR檢測,分析低溫脅迫下FmCBF1基因的表達情況。
2 結果與分析
2.1 水曲柳CBF1基因的克隆
進行5′RACE和3′RACE的克隆后分別獲得648 bp和664 bp的兩段序列(圖1)。將5′RACE和3′RACE測序結果進行拼接后獲得的水曲柳CBF1基因片段大小為898 bp,根據該序列設計全長引物FmCBF1F/R(表1)進行DNA水平水曲柳FmCBF1基因的全長序列克隆,結果獲得長度為717 bp的核酸序列,與5′RACE和3′RACE測序后拼接成的序列進行比對,結果表明該基因編碼區不含有內含子,用ORF Finder預測編碼區為669 bp,編碼222個氨基酸(圖2)。經Blast比對,結果表明,該基因與毛果楊CBF1基因同源性為79%,證明該基因屬于CBF家族,將其命名為FmCBF1。
注:A.5′RACE產物;B.3′RACE產物;C.FmCBF1全長擴增產物;D.FmCBF1定量PCR產物。
2.2 水曲柳FmCBF1基因的生物信息學分析
2.2.1 水曲柳FmCBF1基因的氨基酸序列比對以及進化樹分析。
將FmCBF1基因的核酸序列提交NCBI進行在線比對,選擇與其同源性較高的9個物種的CBF1/DREB1B氨基酸序列,大豆(gi|169668007|gb|ACA64423.1| CRT binding factor 1 Glycine max)、毛果楊(gi|134038590|gb|ABO48363.1| Crepeat binding facor 1 Populus trichocarpa)、巨桉(gi|376372833|gb|AFB35599.1| trancription factor CBF1 Eucalyptus grandis)、白樺(gi|325512537|gb|ADZ23479.1| CBF transcription factor 1 Betula platyphylla)、擬南芥(gi|2980801|emb|CAA18177.1| transcriptional activator CBF1/ CRT/CRE binding factor 1 Arabidopsis thaliana)、葡萄(gi|674267993|gb|AIL00520.1| Crepeat binding factor 1 Vitis vinifera)、馬鈴薯(gi|114432126|gb|ABI74671.1| Crepeat binding factor 1 Solanum tuberosum)、大麥(gi|347949839|gb|AEP32124.1| CBF protein 1 Hordeum vulgare)和水稻(gi|32966057|gb|AAP92125.1| transcription factor CBF1 Oryza sativa)進行同源比對(圖3)。結果顯示,FmCBF1基因編碼的氨基酸序列與這些物種相似序列的同源性在71.8%~78.9%,其與白樺同源性最高,達78.9%;其與水稻同源性最低,為71.8%。蛋白分析結果表明,該蛋白與其他植物的CBF蛋白一樣也具有AP結構域,并含有2個被稱為PKKPAGRKKFRETRHP和FADSAWR的蛋白簽名序列(Signature Sequences),它們分別位于AP結構域的上游和下游。將上述9個氨基酸與水曲柳FmCBF1氨基酸序列用MEGA5構建系統進化樹,從圖4可以看出,水曲柳FmCBF1與白樺CBF1處于同一分支上,具有較高的同源性。
2.2.2 水曲柳FmCBF1基因的氨基酸組成、理化性質以及親/疏水性分析。
用ExPaSy Protparam對FmCBF1基因所編碼的氨基酸組成進行分析,結果表明,該基因預測編碼222個氨基酸,相對分子質量為24 572.3,分子式為C1076H1671N299O345S8,等電點為5.11;其中帶負電荷的氨基酸(Asp + Glu)、帶正電荷的氨基酸(Arg + Lys)比例分別為14.4%和11.7%;不穩定指數(II)為55.14,分類為不穩定蛋白質。
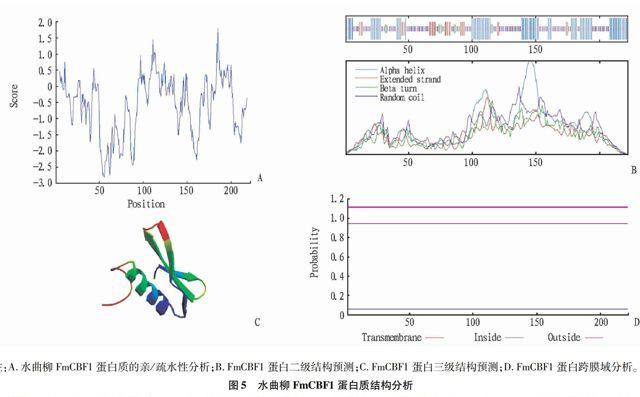
用ExPaSy ProtScale對FmCBF1基因所編碼的氨基酸序列進行親/疏水性分析,結果(圖5A)顯示,疏水性最高的位于185位的甲硫氨酸(M),親水性最高的位于56位的丙氨酸(A),水曲柳FmCBF1基因屬于親水性蛋白。
2.2.3 水曲柳FmCBF1基因的蛋白質結構預測及亞細胞結構定位分析。
利用CBS TMHMM2.0預測FmCBF1基因編碼的蛋白質跨膜域,結果顯示,不存在跨膜螺旋,且無信號肽,由此可以推測該基因編碼的蛋白質為膜內蛋白。FmCBF1基因的亞細胞定位預測顯示,該基因可能定位于細胞核內。FmCBF1基因編碼的蛋白質二級結構預測分析結果表明,該蛋白結構中α螺旋結構占36.49%,β轉角結構占4.05%,無規則卷曲結構占48.65%,延伸鏈占10.81%。
利用SWISSMODEL同源建模服務器進行蛋白質結構的三維建模,預測水曲柳FmCBF1基因所編碼蛋白質的三維結構
注:A.水曲柳FmCBF1蛋白質的親/疏水性分析;B.FmCBF1蛋白二級結構預測;C.FmCBF1蛋白三級結構預測;D.FmCBF1蛋白跨膜域分析。
圖5 水曲柳FmCBF1蛋白質結構分析
利用ExPaSy PSORT軟件對FmCBF1基因編碼的蛋白質進行亞細胞定位預測,結果表明,該基因編碼的蛋白質定位于細胞核、葉綠體基質、葉綠體類囊體膜、葉綠體類囊體空間中的幾率不同(細胞核98.0%,葉綠體基質55.4%,葉綠體類囊體膜25.7%,葉綠體類囊體空間25.7%。),其中以定位于細胞核中的可能性最大。將白樺、毛果楊及毛白楊的CBF1蛋白序列按相同的方法進行預測,結果均與水曲柳FmCBF1蛋白的預測結果相似,說明CBF1蛋白在高等木本植物中的亞細胞定位可能較為一致。
2.3 水曲柳FmCBF1基因的表達分析
2.3.1 水曲柳FmCBF1基因的晝夜表達特征。
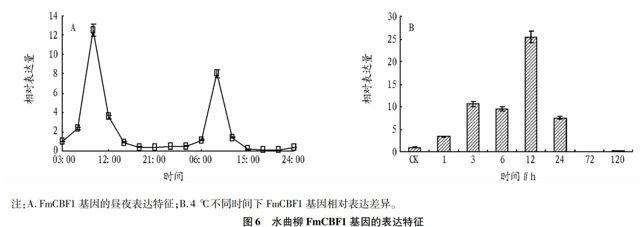
將第1天3:00的FmCBF1基因表達量作為對照(即相對表達量為1)。晝夜表達結果顯示(圖6A),FmCBF1基因的表達具有一定的周期性,且周期約為24 h。FmCBF1基因周期性表達的最大值約出現在9:00,第1天及第2天9:00的FmCBF1表達量分別為對照的12.5倍和8.0倍,均為當天的最大值;而夜間卻處于較低的表達水平。
2.3.2 低溫脅迫對水曲柳FmCBF1基因表達的影響。
在低溫脅迫下,CBF基因都具有瞬時表達特性。受低溫脅迫誘導后,短時間內即被強烈誘導并表達,但隨著時間推移,誘導作用逐漸減弱。FmCBF1基因也具有這種特性(圖6B),FmCBF1基因在4 ℃下短時間內即被誘導,直到12 h相對表達量達到最大,為CK的25.5倍;而后FmCBF1基因的表達開始下降,直到4 ℃下第3天和第5天,相對表達量分別為CK的0.09倍和0.14倍。這可能與長時間的4 ℃暗培養條件下對植物的生理活動產生了抑制作用有關。
注:A.FmCBF1基因的晝夜表達特征;B.4 ℃不同時間下FmCBF1基因相對表達差異。
圖6 水曲柳FmCBF1基因的表達特征
3 討論
植物中CBF基因家族參與眾多的非生物脅迫的響應,如低溫、干旱和鹽堿等,尤其在低溫脅迫響應中是一個重要的轉錄因子[11]。自1997年,Stockinger等[12]首次從擬南芥中克隆到CBF1轉錄因子依賴,大量研究中,許多其他物種CBF基因家族成員陸續被鑒定出來,并分析了其表達特征。該試驗通過RACE技術首次從水曲柳中克隆得到CBF基因家族的成員FmCBF1基因的全長序列,該基因與其他木本植物中已知的CBF1基因所編碼的蛋白質比對,具有較高的同源性,而且該蛋白具有明確的CBF蛋白序列和結構特征,蛋白序列上含有與低溫誘導的下游基因COR等啟動子上CRT/DRE元件結合的AP結構域,表明該基因屬于CBF家族。
2011年,Malia等[3]提出在擬南芥中,CBF1、CBF2和CBF3可能直接受到植物生物鐘元件CCA1/LHY基因的調控,且其轉錄水平以一個峰值出現在ZT8(Zeitgeber Time,晝夜時點),而下一個峰值出現在約24 h后的周期發生振蕩。該試驗對該基因晝夜表達特征進行了初步研究,結果表明,FmCBF1基因的表達具有一個約以24 h為周期的節律性,最大值約出現在9:00,而夜間卻處于較低的表達水平。
在4 ℃低溫不同時間的處理下,FmCBF1基因表現出隨著處理時間的延長,表達量在短時間內升高,12 h達到最大值,然后呈降低趨勢。此種受到低溫誘導后,隨時間的延長誘導水平呈先升高后降低的趨勢,與大部分植物中CBF基因的表達模式相符,擬南芥中除AtCBF4外,AtCBF1、AtCBF2和AtCBF3都有此種現象[13-15]。
該研究結果表明FmCBF1基因是水曲柳CBF低溫響應通路中的重要成員,具有傳遞低溫脅迫信號到下游基因的重要作用,對其進行研究為培育抗逆性強的水曲柳新品種奠定了基礎。然而為了培育新品種,FmCBF1基因啟動子的克隆,以及FmCBF1植物表達載體構建將是下一步研究的方向。
利用植物基因工程是增強植物抗逆性的一種重要方式,然而由于植物的抗逆性是受眾多基因調控的,單基因的引入只能增強植物部分抗逆性,所以近年來,逆境響應的轉錄因子的克隆和鑒定成為研究熱點。由于CBF基因家族在植物抗逆性中的重要作用,成功克隆得到水曲柳CBF基因家族的成員FmCBF1基因的全長序列,對于培育抗逆性強的水曲柳新品種奠定了基礎。
參考文獻
[1] SARAH J G,SARAH G F,MICHAEL F T.Arabidopsis transcriptional activators CBF1,CBF2,and CBF3 have matching functional activities[J].Plant Molecular Biology,2004,54:767-781.
[2] MICHAEL F T.Role of cold responsive genes in plant freezing tolerance[J].Plant Physiology,1998,118:5.
[3] MALIA A D,EVA M F,MICHAEL F T.CIRCADIAN CLOCKASSOCIATED 1 and LATE ELONGATED HYPOCOTYL regulate expression of the CREPEAT BINDING FACTOR(CBF)pathway in Arabidopsis[J].PNAS,2011,108(17):7241-7246.
[4] 曾凡鎖,南楠,詹亞光.富含多糖和次生代謝產物的白樺成熟葉中總RNA的提取[J].植物生理學通訊,2007,43(5):913-916.
[5] 范阿棋,毛娟,劉思妍,等.馬鈴薯StSnRK2.2基因克隆與生物信息學分析[J].植物研究,2013,33(3):294-301.
[6] BENKERT P,BIASINI M,SCHWEDE T.Toward the estimation of the absolute quality of individual protein structure models[J].Bioinformatics,2011,27(3):343-350.
[7] ARNOLD K,BORDOLI L,KOPP J,et al.The SWISSMODEL Workspace:A webbased environment for protein structure homology modeling[J].Bioinformatics,2006,22:195-201.
[8] SCHWEDE T,KOPP J,GUEX N,et al.SWISSMODEL:an automated protein homologymodeling server[J].Nucleic Acids Research,2003 31:3381-3385.
[9] GUEX N,PEITSCH M C.SWISSMODEL and the SwissPdbViewer:An environment for comparative protein modeling[J].Electrophoresis,1997,18:2714-2723.
[10] KENNETH J L,THOMAS D S.Analysis of Relative Gene Expression Data Using RealTime Quantitative PCR and the 2-ΔΔCT Method[J].Methods,2001,25(4):402-408.
[11] 王京京,童再康,黃程前,等.巨桉EgrCBF1和EgrCBF2基因的克隆和脅迫響應表達分析[J].林業科學,2012,48(10):41-48.
[12] STOCKINGER E J,GILMOUR S J,THOMASHOW M F.Arabidopsis thaliana CBF1 encodes an AP2 domaincontaining transcriptional activator that binds to the Crepeat/DRE,a cisacting DNA regulatory element that stimulates transcription in response to low temperature and water deficit[J].Proc Natl Acad Sci USA,1997,94:1035-1040.
[13] GILMOUR S J,ZARKA D G,STOCKINGER E J,et al.Low temperature regulation of the Arabidopsis CBF family of AP2 transcriptional activators as an early step in coldinduced COR gene expression[J].Plant J,1998,16(4):433-442.
[14] MEDINA J,BARGUES M,TEROL J,et al.The Arabidopsis CBF gene family is composed of three genes encoding AP2 domaincontaining proteins whose expression is regulated by low temperature but not by abscisic acid or dehydration[J].Plant Physiol,1999,119(2):463-470.
[15] HAAKE V,COOK D,RIECHMANN J L,et al.Transcription factor CBF4 is a regulator of drought adaptation in Arabidopsis[J].Plant Physio,2002,130(2):639-648.
責任編輯 李占東 責任校對 李巖

