農藥多抗性哈茨木霉的常壓室溫等離子體誘變
周文臣詹曉北,朱莉鄭志永吳劍榮
(1.江南大學生物工程學院 糖化學與生物技術教育部重點實驗室,無錫 214122;2.江蘇瑞光生物科技有限公司,無錫 214125)
農藥多抗性哈茨木霉的常壓室溫等離子體誘變
周文臣1詹曉北1,2朱莉2鄭志永1吳劍榮1
(1.江南大學生物工程學院糖化學與生物技術教育部重點實驗室,無錫214122;2.江蘇瑞光生物科技有限公司,無錫214125)
旨在為提高生防木霉菌對田間除草劑、殺蟲劑以及殺菌劑共存的復雜環境的適應性,以生防菌哈茨木霉(Trichoderma harzianum,GIM 3.442)為出發菌株,采用常壓室溫等離子體的方法對出發菌株進行誘變。結果顯示,以殺菌劑代森錳鋅和殺蟲劑呋蟲胺為篩子,選育出對復合農藥有良好抗性的誘變菌株。從中挑選雙抗性最好的菌株Th-36,以含有殺菌劑代森錳鋅、殺蟲劑呋蟲胺和除草劑乙氧氟草醚的PDA為誘變篩選培養基,再次進行誘變篩選,獲得兩株具有三抗特性菌株(Th-3-36和Th-4-B)。毒力測試表明,抗性菌株Th-3-36和Th-4-B對代森錳鋅、呋蟲胺和乙氧氟草醚的EC50分別達到5 089.2 μg a.i.·mL-1和5 498.2 μg a.i.·mL-1、758.5 μg a.i.·mL-1和785.9 μg a.i.·mL-1、198.2 μg a.i.·mL-1和200.3 μg a.i.·mL-1,均高于各農藥的市售平均推薦使用濃度。篩選到的突變株對農藥抗性明顯增強、遺傳了親本的廣譜抗菌性并具有良好的遺傳穩定性,生長繁殖能力和酶學性質優于親本菌株。
常壓室溫等離子體誘變(ARTP);哈茨木霉;農藥抗性;馴化選育
傳統化學農藥由于操作簡單、見效迅速、能快速大規模生產而在農業生產中廣泛使用,但其泛濫使用會導致“3R”(抗性Resistance、殘留Residue、再猖獗Resurgence)問題和生態環境惡化[1,2]。生物防治(biological control)是利用天然產物,生物體如細菌、真菌、線蟲、昆蟲或其代謝產物等對植物病害進行有效防治的技術與方法[3],而生防制劑(biological control agents,BCAs),即生物殺菌劑是利用天然產物、微生物活體及其代謝產物所生產的、對植物病害起防治作用的制劑。它不僅可以減少傳統農藥對環境的危害、在動植物體中的殘留,還可以避免病菌對農藥產生抗性而導致的農藥失效[4]。典型的生防菌,如木霉菌(Thchoderma spp.),由于其生存范圍廣泛、拮抗病原菌廣譜(至少對18個屬,29種病原真菌具有拮抗性)[5,6],對溫度、pH、氧濃度和紫外照射等不利環境條件耐受性強[7],防病機制多樣,低毒且對環境友好,已經應用于許多大田作物和園藝作物的土傳真菌病害的防治[8]。目前全球已經約有50多種木霉制劑在售[9]。根據最新報道,許多生防木霉菌還能起到改善土壤環境[10],降解殘留農藥的作用[11]。
哈茨木霉是目前使用最多的生防木霉菌,可以用于防治如絲核菌、疫霉菌、腐霉菌等植物病原真菌[12]。早在1981年,哈茨木霉防治李屬果栩銀葉病(Chondrostereum purpureum)的木霉生防制劑已經在西歐商品化生產[13],近年來,以色列、美國拜耳公司也推出哈茨木霉生防制劑產品[14]。但是,在實際農業生產過程中,植物病原菌、雜草、蟲害等有害生物共存于農田生態環境之中,某些殺蟲劑、除草劑以及其他化學殺菌劑的使用和殘留會對生防木霉的生長、產孢量產生不良的影響,也導致木霉生防作用下降,限制了其田間單獨使用的效果和范圍。因此,生防木霉菌與農藥的關系[15],通過誘變育種、原生質體融合、遺傳改造等手段改良野生生防菌的特性[16-18]、提高其耐藥性和與其他殺菌劑的混用[19-22],已經引起人們的興趣與重視。但是,目前的研究多集中在生防菌對殺菌劑的抗性提高,有關木霉菌對除草劑和殺蟲劑的抗性提高的報道很少,還未有對除草劑和殺蟲劑抗性菌株的選育的報道。由清華大學開發的常壓室溫等離子體誘變系統(ARTP)能夠在大氣壓下產生溫度在25-40℃之間、具有高活性粒子(包括處于激發態的氦原子、氧原子、氮原子、OH自由基等)濃度的等離子體射流,改變細胞膜或者細胞壁通透性、DNA和蛋白質等大分子結構,造成基因損傷從而引起微生物發生突變[23]。近年來,該項突變技術已經被成功應用于突變細菌、微藻、酵母等微生物[24-26]。生防木霉菌對農藥的敏感性與細胞骨架的重要組成成分微管有關,微管的主要成分為微管蛋白,微管蛋白和農藥的親和力下降,造成真菌耐藥[27]。ARTP對蛋白質等大分子的結構影響以及前人應用該項技術突變微生物的成功案例使得ARTP在改造生防菌耐藥性能方面潛力巨大,但目前為止還未見到有應用此項技術改良生防木霉菌性能的報道。本研究以哈茨木霉(Trichoderma harzianum GIM 3.44)為出發菌株,采用常壓室溫等離子體誘變(ARTP)和含復合農藥培養基相結合的方法篩選對農藥有交叉抗性的生防木霉菌,挑選出兩株對殺蟲劑呋蟲胺、除草劑乙氧氟草醚和殺菌劑代森錳鋅具有綜合抗性的抗藥性菌株,并檢測其各項生理指標,旨在為提高生防木霉菌對田間除草劑、殺蟲劑及殺菌劑共存的復雜環境適應性提供參考。
1 材料與方法
1.1 材料
1.1.1 菌種 哈茨木霉(Trichoderma harzianum Rifai)GIM 3.442,購于中國廣東省微生物菌種保藏中心。棉花枯萎病菌(Fusarium oxysporum f. Sp)ACCC 36882、棉花黃萎病菌(Verticillium dahliae Kleb)ACCC 36211、核盤菌(Sclerotinia sclerotiorum)ACCC 36908,購于中國農業科學院植物保護研究所。馬鈴薯早疫病菌(Alternaria solani),由江南大學生化工程與生物反應器實驗室活化并保藏。
1.1.2 培養基 保藏和孢子制備:馬鈴薯綜合培養基(PDA)(g/L):馬鈴薯汁200,葡萄糖20,KH2PO43,MgSO4·7H2O 1.5,硫胺素0.008,瓊脂20,pH6.0,于121℃滅菌20 min。
含藥PDA培養基的制備:先把農藥用無菌水配制成母液,再用滅菌水稀釋成一定倍數,添加到40-50℃的綜合PDA培養基中。
液體培養基(g/L):葡萄糖 20,酵母浸粉 15,(NH4)2SO42.5,KH2PO46.0,MgSO4·7H2O 0.8,pH6.0,25℃。
1.1.3 試劑 除草劑:果兒(乙氧氟草醚23.5%乳油),上海惠光有限公司;鋤當家(30%草甘膦水型),深圳諾普信農化有限公司;蓋能草(高效氟吡甲禾靈,108 g/L乳油),美國陶氏益農。
殺菌劑:75%百菌清可濕性粉劑,利民化工股份有限公司;80%代森錳鋅可濕性粉劑,印度聯合磷化有限公司;99%噁霉靈可濕性粉劑,山東天達股份有限公司。
殺蟲劑:20%呋蟲胺可濕性粉劑,日本三井化學AGRO株式會社;快絕特(0.3%苦參堿水型),南通新華農藥有限公司。
N-乙酰-氨基葡萄糖和海帶多糖購于Sigma公司,其余試劑均為國藥生產。
1.1.4 誘變系統 ARTP(常壓室溫等離子體)誘變育種儀,江南大學生物工程學院購于清華大學無錫應用技術研究院生物育種研究中心,產品型號:ARTP-Ⅱ。
1.2 方法
1.2.1 ARTP誘變哈茨木霉 將保存在斜面的哈茨木霉菌株經過液體培養基25℃,110 r/min震蕩培養活化后涂布到PDA培養基上,25℃恒溫培養5-7 d至孢子成熟。用30 mL左右的無菌生理鹽水沖洗孢子,沖洗液經滅菌紗布(4層)過濾除去菌絲體,用無菌生理鹽水稀釋成OD500的值在0.54-0.88(孢子濃度在108cfu/mL)之間的孢子懸浮液。誘變方法參照邱雯雯等[24]的誘變處理,稍加改動,分別取20 μL孢子懸浮液至7個載片涂抹均勻,載片置于滅菌平板內,分別經ARTP誘變系統(室溫常壓,氦氣流量為10 SLM,功率為100 W)處理0、30、60、100、140、180和220 s。處理后的載片經滅菌生理鹽水沖洗稀釋至合適倍數后涂布到含有代森錳鋅16 μg a.i.·mL-1,呋蟲胺4.5 μg a.i.·mL-1的復合誘變培養基上,25℃恒溫培養5-6 d后菌落計數,計算致死率,選取致死率95%以上的誘變劑量為處理劑量。在選定誘變劑量下,將處理后的孢子懸浮液分別稀釋的合適倍數后涂布到含有兩種目標農藥的梯度復合含藥培養基上,25℃恒溫培養箱內黑暗培養5-6 d后將形成的菌落邊緣用8 mm打孔器切取菌餅轉接到復合含藥PDA上,25℃恒溫培養,生長勢法挑選生長較快的菌株,轉接到PDA斜面上保存待分析。挑選雙抗菌株后,按照雙抗菌株的篩選方法篩選對3種農藥(呋蟲胺、代森錳鋅、乙氧氟草醚)抗性均提高顯著的目標菌株。
1.2.2 農藥對突變株室內毒力的測定 采用含毒介質培養法[28],梯度稀釋。
用無菌打孔器從培養3 d的哈茨木霉突變株和原始菌株菌落邊緣截取直徑8 mm的菌塊,將其移植到含不同濃度的代森錳鋅(300、1 000、2 000、3 000和5 000 μg a.i.·mL-1)、呋蟲胺(165、500、1 000、1 650和1 900 μg a.i.·mL-1)、乙氧氟草醚(60、120、240、480和700 μg a.i.·mL-1)的PDA平板中央,每個培養皿接1個菌餅,每個濃度3次重復,設空白平板為對照,置于25℃恒溫培養箱培養。
農藥對突變株菌絲生長速率的室內毒力測定:供試菌株在上述條件下培養2 d,用十字交叉法測量菌落直徑。并按式(1)計算其生長抑制率。
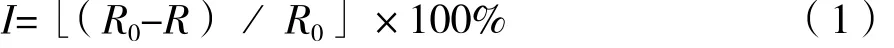
式中:I為抑制率,R0為對照菌落直徑,R為處理菌落直徑。
將各抑制率換算成抑制率概率值,以各處理中農藥濃度對數值作為自變量x值,以相應處理對菌絲的抑制率概率值為依變量y值,用線性回歸法求出供試殺菌劑的毒力曲線方程y=a+bx,計算EC50(抑制中濃度)。
農藥對突變株產孢子能力的室內毒力測定:供試菌株在上述條件下培養6 d,用30 mL無菌生理鹽水沖洗,玻璃珠打散,光電比濁法測定各農藥梯度下的產孢子能力,按照測定農藥對菌株菌絲生長EC50的方法測定各農藥對菌株產孢子能力的EC50。
農藥對突變株孢子萌發的室內毒力測定[29]:將供試菌株和親本菌株將在PDA生長5-6 d用30 mL滅菌生理鹽水沖洗打散,經滅菌紗布過濾除去菌絲體,稀釋到合適倍數吸取200 μL,以6×106cfu/mL的接種量接種到含有1.3 mL的含有梯度農藥的液體PDA的24 孔培養板中。混勻后用酶標儀測定初始OD500,25℃恒溫培養箱培養培養12 h后酶標儀測定OD500,用空白PDA作對照,按照公式(2)計算孢子萌發抑制率,并按照上述方法計算各農藥對供試菌株的EC50。
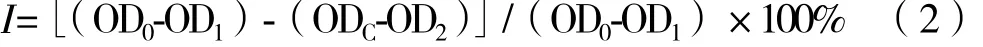
式中:I為孢子萌發抑制率,OD1為對照0 h的OD500,OD2為處理0 h的OD500,OD0為對照12 h的OD500,ODC為處理12 h的OD500。
1.2.3 突變株生長繁殖能力
1.2.3.1 菌絲平均生長速率 將抗性突變體菌株和親本菌株在 25℃下培養 3-4 d,用直徑8 mm的打孔器沿菌落邊緣截取菌塊接種于PDA培養基上,在25℃恒溫黑暗條件下培養,每6 d測定菌落直徑。選取12 h的直徑D1和36 h的直徑D2,按照式(3)計算菌絲平均生長速率,每處理3次重復。

式中:v為菌絲平均生長速率(mm/h),D1為12 h菌落直徑,D2為36 h菌落直徑。
1.2.3.2 產孢子能力 采用光電比濁法。
1.2.3.3 標準曲線繪制 將在PDA生長5-6 d的哈茨木霉用30 mL滅菌生理鹽水沖洗打散,經滅菌紗布過濾除去菌絲體,稀釋10、20、30、40、50和60倍,血球計數板準確計數孢子個數,用分光光度計測定各個梯度的OD500值。以OD500為橫坐標,孢子濃度為縱坐標制作標準曲線。
哈茨木霉和突變株在PDA平板上生長6 d后,按上述方法,測定產孢子能力。
1.2.3.4 分生孢子萌發率 將各突變株和原始菌株培養5-6 d后用30 mL液體PDA沖洗打散,稀釋到107cfu/mL,各吸取50 μL,滴加于凹玻片上,25℃保濕培養,每隔一段時間顯微鏡下鏡檢,計算孢子萌發率。
1.2.3.5 種子生長曲線測定 刮取PDA培養基上的孢子接入到裝有無菌水的150 mL三角瓶(帶無菌玻璃珠)中,25℃,搖床振蕩培養2 h,使其混合均勻。
吸取5 mL孢子懸浮液接種到裝有50 mL液體培養基的250 mL三角瓶中培養(接種量10%),25℃,往復式搖床110 r/min培養。每隔6 h取5 mL發酵液,8 000 r/min,離心10 min,倒掉上清液取沉淀,水洗滌2-3次,105℃烘箱烘干至恒重。以搖床培養時間(h)為橫坐標、菌體干重(g/L)為縱坐標繪制種子生長曲線。
1.2.4 突變株酶學性質 反應體系總體積600 μL包括:200 μL底物,200 μL pH6.0、0.025 mol/L磷酸鈉緩沖液,200 μL粗酶液(pH6.0,50℃),恒溫水浴反應2 h。反應結束后,沸水浴10 min終止反應。
幾丁質酶酶活力定義:在上述反應條件下,每分鐘水解生成1 μg N-乙酰-氨基葡萄糖為一個酶活力單位U。
β-1,3葡聚糖酶酶活力定義:在上述反應條件下,每分鐘水解生成1 μg葡萄糖為一個酶活力單位U。
1.2.5 突變株拮抗性 采用對峙培養法,將親本木霉菌株和耐藥性木霉菌株分別與核盤菌、馬鈴薯早疫病菌、棉花枯萎病菌和棉花黃萎病菌,對峙接種在PDA平板上,兩接菌點相距30 mm,菌塊直徑8 mm。同時單獨接種作對照。每處理重復3次,在25℃恒溫培養。逐日觀察各菌落的生長和木霉菌對灰霉菌的抑制作用情況,連續觀察6 d,記錄R1和R2數據并拍照計算木霉菌平板覆蓋率。按照式(4)計算各木霉菌株對病原菌的抑制率。

式中:I為木霉的抑制率,R1為對照病菌落直徑,R2為病菌菌落中心到木霉菌落邊緣的距離。
木霉覆蓋植物病原菌的分級標準為:I:木霉菌絲占據培養皿100%;Ⅱ:木霉菌絲占據培養皿>2/3;Ⅲ:木霉菌絲占據培養皿1/3-2/3;IV:木霉菌絲占據培養皿<1/3;V:病原菌菌絲占據培養皿100%。
1.2.6 突變株遺傳穩定性 突變型木霉菌株接種在PDA平板上,在25℃恒溫培養箱中培養。每5 d轉接1次,連續轉接10次。觀察這些菌株每次轉接后的生長特性,測定突變株對抗性農藥的EC50,每處理重復3次。將其與親本相比較。
1.2.7 突變株對其他農藥的抗性 配制分別含有300 μg a.i.·mL-1的快絕特、百菌清、蓋能草和草甘膦配的含藥PDA,切取培養2-3 d的供試菌株8 mm菌塊轉接到含藥PDA中,25℃恒溫培養2 d,按照(1)式計算各農藥對各突變株的菌絲生長抑制率。
1.2.8 數據統計分析 用SPSS Statistics軟件和Duncan’s新復極差法比較Th和各突變株以及各突變株之間在各指標上的顯著性差異(P=0.05)。用Image Optimizer軟件分析木霉菌拮抗各病原真菌的平板覆蓋率,用EXCEL計算毒力回歸方程和EC[30]。
50
2 結果
2.1 哈茨木霉的ARTP誘變及復合農藥抗性菌株篩選通過ARTP誘變和藥劑反復馴化,選取致死率在95%以上的100 s為誘變劑量,以T. harzianum為出發株,以農藥對菌株的菌絲生長EC50為目標,從200株疑似株中挑選得到5株雙抗菌株(Th-17、Th-36、Th-37、Th-41和Th-60,對代森錳鋅和呋蟲胺有抗性),結果如圖1所示。其中,Th-36號菌株的代森錳鋅和呋蟲胺EC50分別比出發菌株提高6.95倍和4.40倍。以雙抗菌株Th-36為誘變突發株,選取致死率為90%以上的90 s為處理劑量,在梯度綜合含藥平板上篩選,從180株疑似菌株中挑選得到兩株三抗(Th-3-36和Th-4-B,對代森錳鋅、呋蟲胺和乙氧氟草醚有綜合抗性)菌株,結果如圖2所示。代森錳鋅對三抗菌株Th-3-36和Th-4-B的菌絲生長EC50相比Th-36略有提高,分別達到5 089.2 μg a.i.·mL-1和5 498.2 μg a.i.·mL-1,是市售平均推薦使用濃度的5倍左右。相比Th-36,呋蟲胺對兩株三抗突變株的菌絲生長EC50的變化不大。經過誘變后,突變株對乙氧氟草醚抗性明顯提高,乙氧氟草醚對Th-3-36和Th-4-B菌絲生長EC50分別達到198.2 μg a.i.·mL-1和200.3 μg a.i.·mL-1,達到市售使用濃度(表1)。
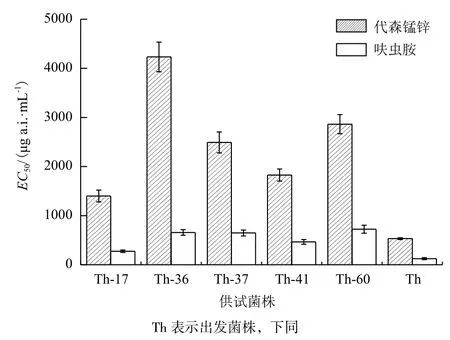
圖1 雙抗性菌株篩選結果
2.2 抗藥性菌株遺傳穩定性
將傳代前和傳代后菌株進行室內毒力測定,結果如表1、表2所示。相比親本菌株,殺菌劑代森錳鋅、除草劑乙氧氟草醚和殺蟲劑呋蟲胺對突變株的菌絲生長EC50、孢子產量EC50和孢子萌發 EC50都比出發菌株有顯著提高,并且沒有隨傳代次數發生太大的改變,性狀遺傳穩定。
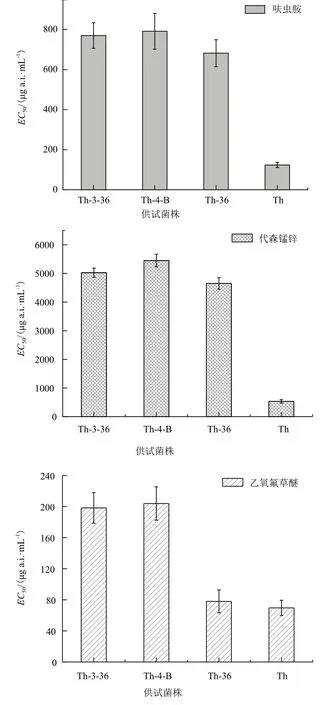
圖2 供試菌株的菌絲生長對抗性藥物的敏感性
2.3 突變株和出發菌株生長特性比較
將突變株和親本菌株在PDA平板上培養,比較其菌絲生長和產孢能力,結果如表3所示。抗性突變株的菌絲生長速率相對Th略有提高,變化較小。Th-3-36、Th-4-B和Th-36產孢子能力分別比出發菌株提高45%、39%和33%左右。在液體PDA培養基上培養6 h后,三抗性突變株的萌發率高于出發菌株,均在20%左右,Th為15%,但在培養12 h和24 h后突變株和出發株無顯著性差異。
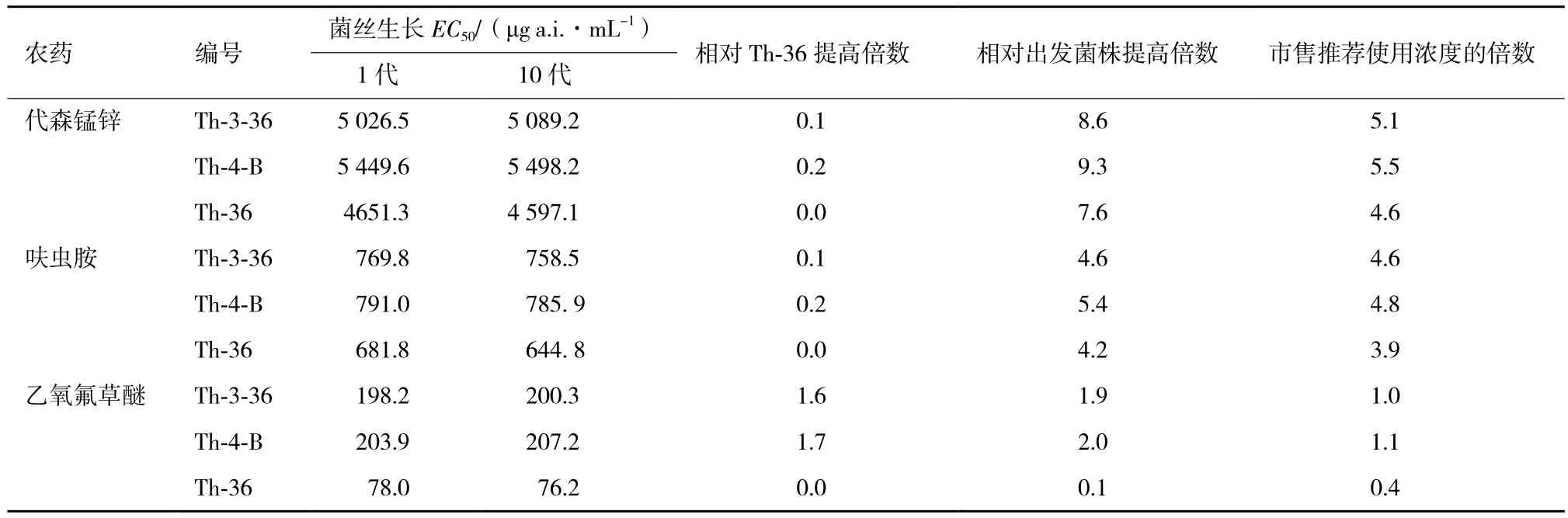
表1 突變株的菌絲抑制EC50遺傳穩定性
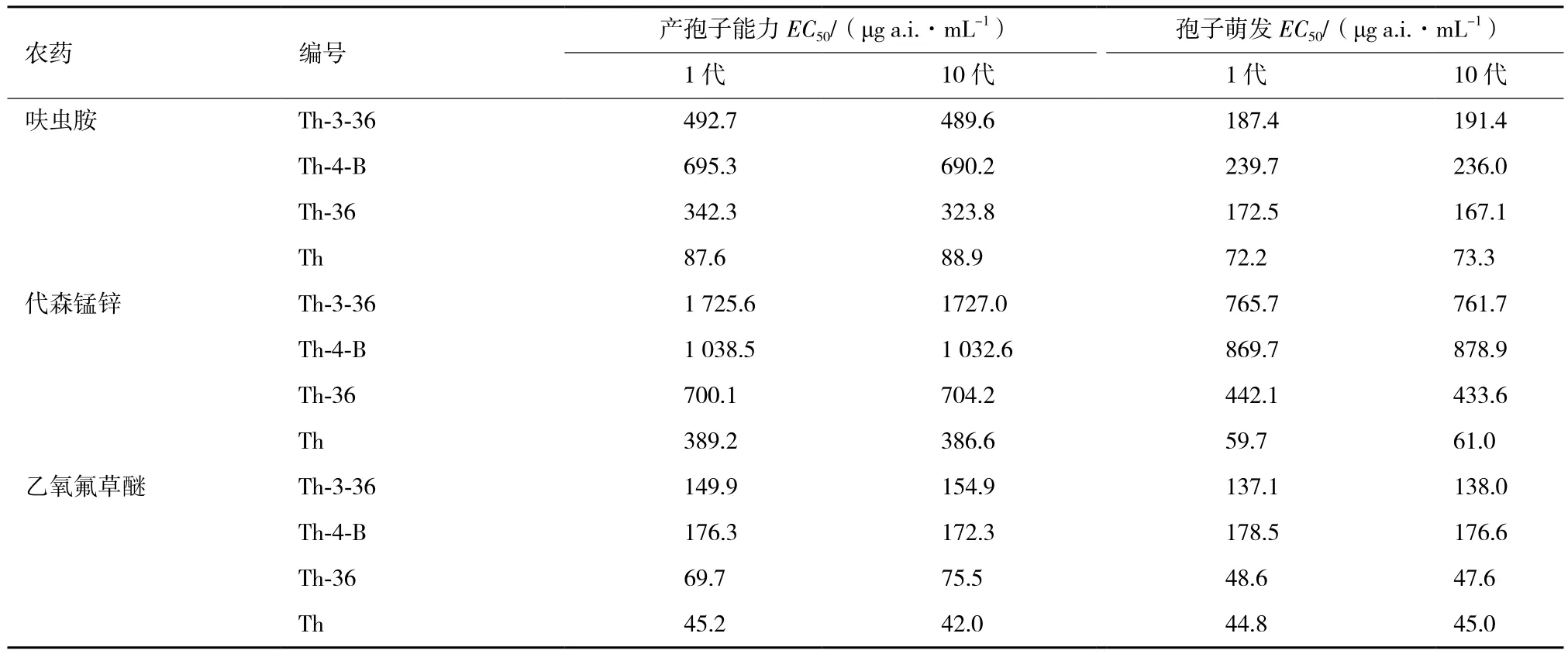
表2 突變株和出發菌株產孢子量和孢子萌發EC50
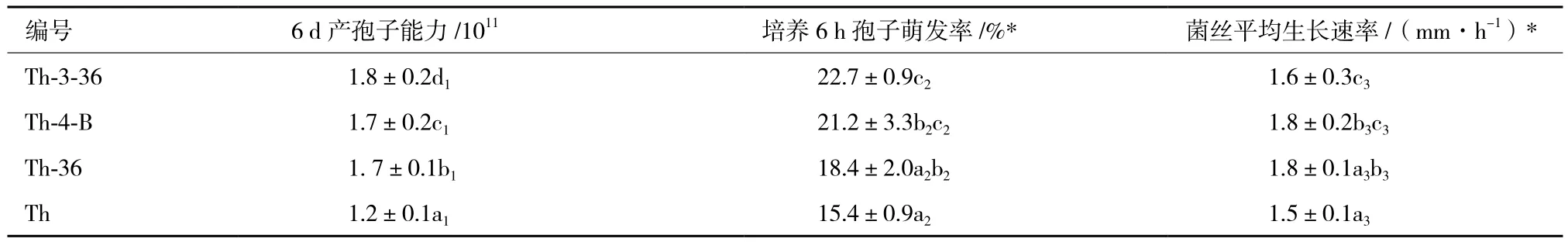
表3 突變株和親本菌株Th生長特性比較
對比突變株和親本菌株的種子液生長曲線(圖3),突變株進入穩定期相對親本菌株明顯縮短(突變株為24 h,Th為48 h),保持穩定期的時間明顯延長(突變株為36 h以上,Th為24 h)。此外,突變株最大生物量也高于出發菌株,三抗菌株可以達到16 g/L,雙抗菌株可以達到15 g/L以上,而親本菌株只有不到12 g/L。突變株更為旺盛的生命力可能與其更強的抗藥性之間存在某種關系。
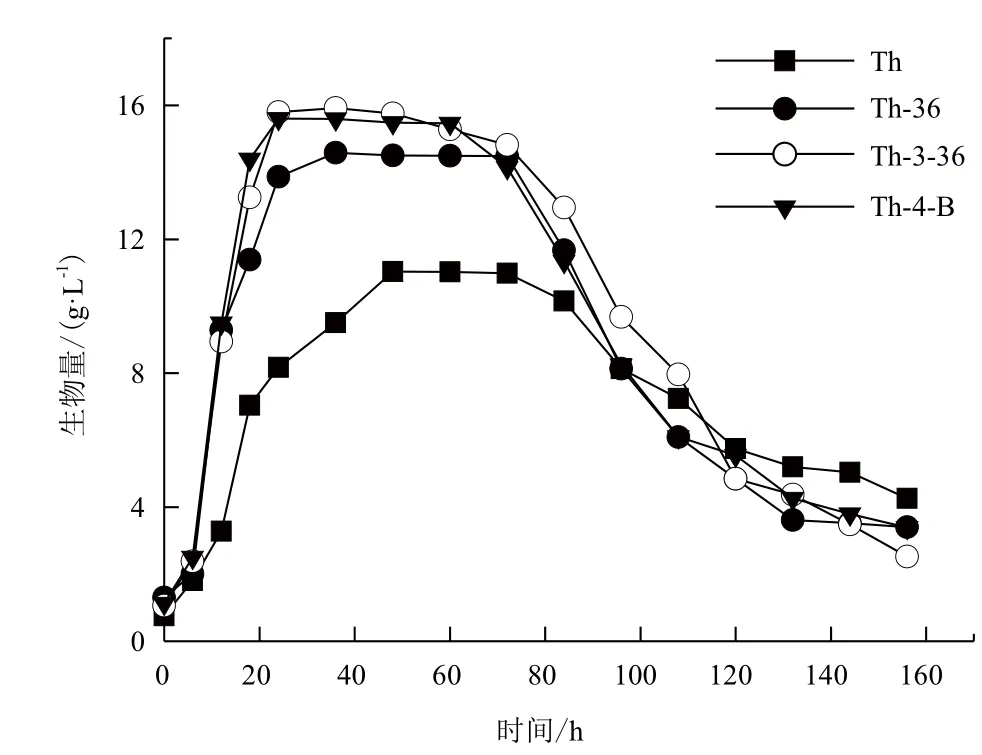
圖3 突變株和Th生長曲線比較
2.4 突變株和Th的酶學性質比較
幾丁質酶和β-1,3葡聚糖酶能夠降解病原真菌的細胞壁的主要成分幾丁質和β-1,3葡聚糖,在生防菌拮抗病原真菌中作用重大。對突變株和出發菌株進行上述兩種酶產酶能力測定,結果如表4所示。突變株和Th均在培養60 h后開始產酶,但抗性突變株的β-1,3葡聚糖酶最大酶活力比親本菌株有所提高,Th-3-36是親本菌株的1.87倍左右,Th-4-B和Th-36菌株是Th的1.71倍左右。抗性突變株產幾丁質酶的能力和發酵液總蛋白含量相對出發株稍有提高,但相差較小。

表4 突變株和親本菌株(Th)發酵產幾丁質酶和β-1,3葡聚糖酶總結
2.5 非抗性農藥對突變株和Th的菌絲生長抑制率比較
通常農業生產中會使用各種不同的農藥,因此選擇了其他5種農作物種植中常用農藥,測試突變株對其耐受性。在劑量為300 μg a.i.·mL-1條件下測定菌絲生長抑制率,結果如表5所示。其中,突變株對噁霉靈的敏感性降低最大:三抗菌株Th-3-36和Th-4-B分別比親本菌株降低74.76%和96.35%左右,雙抗菌株比親本菌株降低88.93%左右,而且噁霉靈對Th-4-B的菌絲生長抑制率僅為1.03%。突變株對草甘膦、蓋能草的敏感性比親本菌株降低程度沒有噁霉靈顯著,平均只比親本菌株降低19%(Th-36除外)和30%左右。兩株三抗突變株對草甘膦、百菌清和快絕特的敏感性和親本菌株差異較小,且這3種農藥對木霉菌株抑制作用較大,300 μg a.i.·mL-1的濃度對木霉的抑制率就可以達到80%以上。
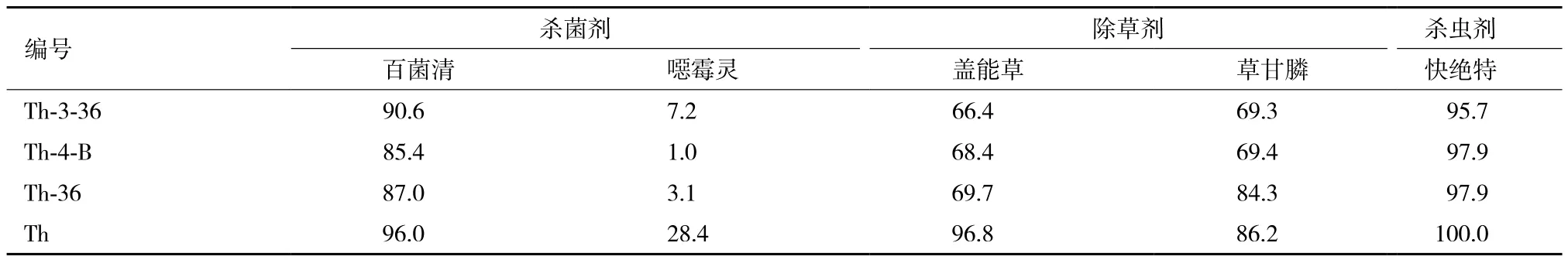
表5 非抗性農藥對突變株和親本菌株(Th)的菌絲生長抑制率(%)
2.6 突變株的拮抗作用為了進一步驗證所獲得的多抗性木霉菌株的生防抗菌能力,將病菌和木霉菌株進行對峙培養。對峙培養過程中,木霉菌株和植物病菌先分居平板兩側各自生長,2 d左右,棉花黃萎病菌基本停止生長,并在與木霉菌的接觸處出現抑菌帶,之后菌落逐漸萎縮消亡。棉花枯萎病菌、核盤菌和土豆早疫病菌在對峙培養3 d左右后,菌落停止生長,之后逐漸萎縮。木霉菌迅速占領生長空間,對病原真菌起到競爭性抑制作用。對峙培養6 d后,平板上生長空間大部分被綠色木霉菌覆蓋,以Th-4-B突變株和棉花枯萎病菌的對峙效果為例,如圖4-A所示。4種病菌的菌絲生長抑制率結果(圖4-B)顯示,原始菌株和突變株對土豆早疫病菌和棉花黃萎病菌的抑制率達到90%以上,抗病等級為I級;對棉花枯萎病菌和核盤菌的抑制率達到70%以上,抗病等級為Ⅱ。突變菌穩定遺傳原始菌株對植物病菌的拮抗性并對植物病原菌表現出良好的拮抗能力。
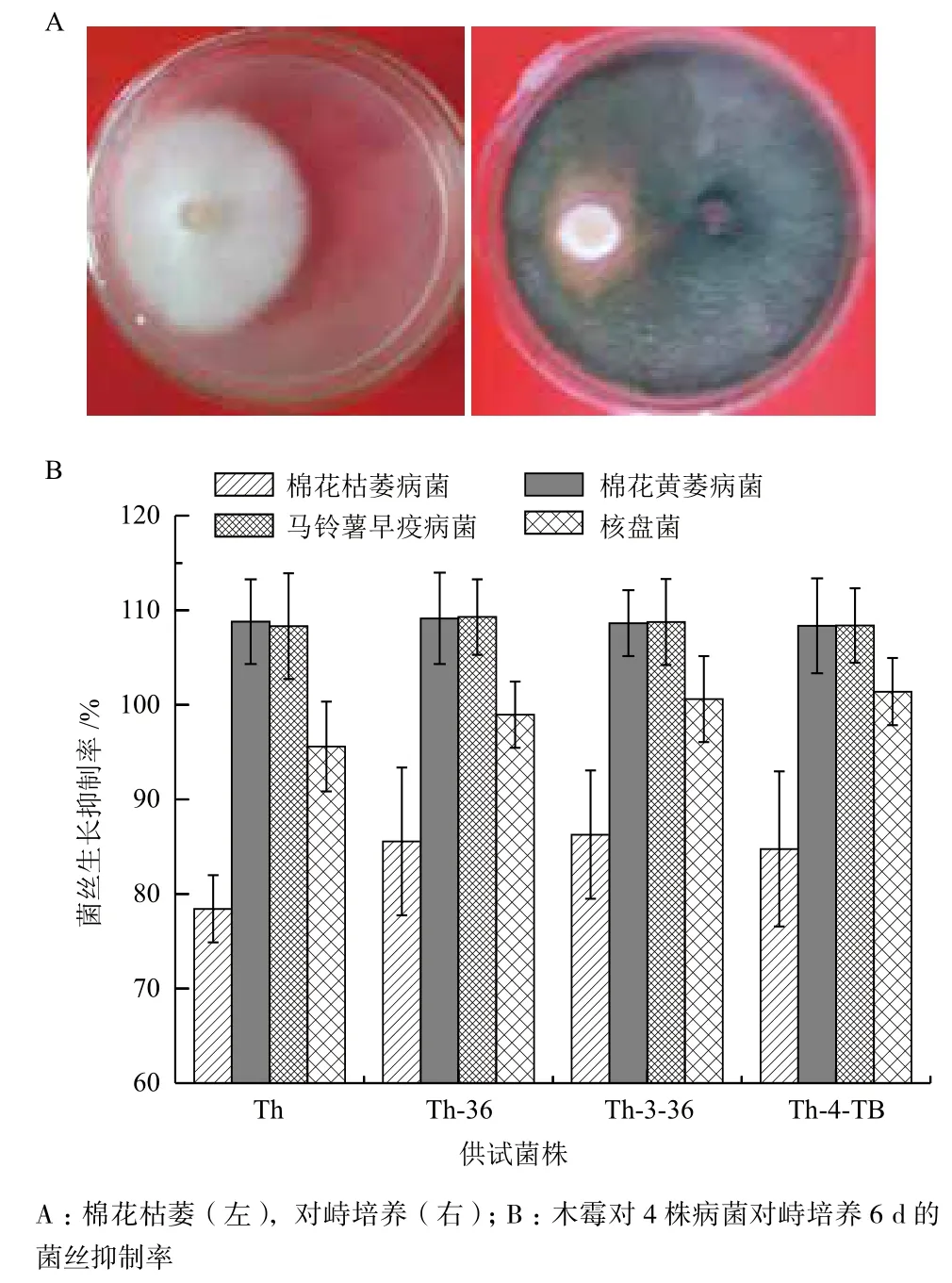
圖4 木霉菌對植物病菌的拮抗能力
3 討論
木霉菌作為生防因子作用于植物病蟲害,相比化學農藥具有顯著的優勢,并已經被許多學者在中藥[31]、小麥[32]等田間防治病害試驗中證明。但在國內傳統作物栽培中,殺蟲劑、殺菌劑和除草劑等化學農藥的常年大量使用使得木霉菌在實際使用和商業化中受到限制。不同種類的殺菌劑對不同的生防木霉具有不同的抑制作用,從19世紀末20年代初起,常用農藥對木霉的抑制作用已經引起學者的興趣[33];殺蟲劑和土壤處理除草劑對生防木霉也有不同程度的影響,但近幾年才有少數相關報道[34],并且并未見到采用誘變措施提高木霉對除草劑、殺蟲劑的耐藥性,降低其敏感性的報道。
與前人誘變篩選提高木霉耐藥性相比,本研究首次嘗試采用常壓室溫等離子體誘變的方法提高木霉耐除草劑、殺蟲劑和殺菌劑的綜合能力。以含有殺蟲劑(呋蟲胺)、殺菌劑(代森錳鋅)和除草劑(乙氧氟草醚)的復合含藥培養基為篩子,成功篩選出對上述3種農藥有高度耐受性的突變型木霉菌株Th-3-36和Th-4-B。殺菌劑和木霉生防菌聯用可以降低殺菌劑的使用濃度,并提高木霉菌的防效。牛勝芳等[19]發現啶酰菌胺和哈茨木霉聯用可以防治番茄灰霉病菌且協同效果良好;Nallathambi等[35]將木霉菌T.v-CIAH240和多種殺菌劑聯用以防治果腐病,可降低化學農藥的使用濃度,其中代森錳鋅的使用濃度降低到100 μg/g。本實驗中代森錳鋅對突變株Th-3-36和Th-4-B的菌絲生長EC50分別達到5 089.2 μg a.i.·mL-1和5 498.2 μg a.i.·mL-1,是市售平均推薦使用濃度的5倍左右,是尹婷等[16]誘變得到的耐藥性木霉T2對代森錳鋅的耐受性的20倍以上(EC50值為221 μg a.i.·mL-1),為突變木霉菌和代森錳鋅聯用奠定了基礎;呋蟲胺對兩株突變株的菌絲生長EC50分別達到758.5 μg a.i.·mL-1和785.9 μg a.i.·mL-1,是市售推薦使用濃度的4倍以上;乙氧氟草醚對兩株突變株的菌絲生長EC50分別達到198.2 μg a.i.·mL-1和200.3 μg a.i.·mL-1,達到市售推薦使用濃度。篩選結果表明,通過ARTP和藥劑馴化培養的手段可以顯著提高木霉菌對農藥的抗性,在使用誘變木霉菌作為生防農藥的農田,可以相應使用呋蟲胺和乙氧氟草醚除蟲除草。
對其他農藥的耐藥性測定表明,300 μg a.i.·mL-1的使用濃度下,噁霉靈對突變株的抑制率很小,木霉菌可以和噁霉靈混用防治植物病原真菌;在除草劑蓋能草和草甘膦存在的環境中,木霉菌可以生長但生長速度受到明顯的影響,生物拮抗能力可能被削弱;殺菌劑百菌清和殺蟲劑快絕特對木霉菌株強烈抑制。對峙培養實驗表明突變株穩定遺傳親本對植物病原菌的生物拮抗性,能使病菌菌絲停止生長,菌落消亡,培養6 d后木霉菌落覆蓋的抗病等級均在Ⅰ、Ⅱ級。突變株較出發菌株對棉花黃萎病菌和馬鈴薯早疫病菌的差別不大,對峙培養6 d后木霉長滿病菌菌落,但對核盤菌和棉花枯萎病菌的抑制率提高,同時突變株的生長繁殖能力和產β-1,3葡聚糖酶和幾丁質酶的能力均高于出發菌株。生長速率快可以更快地占領生長空間、木霉產生的細胞壁降解酶可以降解病菌的細胞壁從而導致病原真菌不能正常生長,試驗結果很好地說明了突變株拮抗能力提高的原因與其更高的生長速率和更強的產胞壁降解酶能力有關。突變株更優的抗藥性和菌種特性使其比T. harzianum更能適應田間復雜的環境,具有良好的應用前景。但本試驗的研究只處于初試階段,并未對突變株活體植物拮抗能力以及菌藥協同對植物抗病能力作用的影響進行探究。
4 結論
本研究采用常壓室溫等離子體誘變的方法,以含有殺蟲劑(呋蟲胺)、殺菌劑(代森錳鋅)和除草劑(乙氧氟草醚)的復合含藥培養基為篩子,成功篩選出上述3種農藥有高度耐受性的突變型木霉菌株Th-3-36和Th-4-B,其對代森錳鋅、呋蟲胺和乙氧氟草醚的EC50分別達到5 000 μg a.i.·mL-1以上、750 μg a.i.·mL-1以上和190 μg a.i.·mL-1以上。抗藥性菌株的生長繁殖能力與β-1,3葡聚糖酶、幾丁質酶生產能力均優于出發菌株;對峙培養試驗表明突變株穩定遺傳親本對植物病原菌的生物拮抗性,能使病菌菌絲停止生長,菌落消亡,菌落覆蓋抗病等級均在I、Ⅱ級。
[1]韓俊艷, 張立竹, 紀明山. 植物源殺蟲劑的研究進展[J]. 中國農學通報, 2011, 27(21):229-233.
[2]Pundir C, Chauhan N. Acetylcholinesterase inhibition-based biosensors for pesticide determination:A review[J]. Analytical Biochemistry, 2012, 429(1):19-31.
[3] Ehlers RU. Regulation of biological control agents[M]. Springer,2011:4-21.
[4] 王進強, 吳剛, 許文耀, 等. 植物病害生防制劑的研究進展[J].福建農林大學學報:自然科學版, 2004, 33(4):448-452.
[5] Pan S, Mukherji R, Bhagat S. Evaluation of Trichoderma spp. against soil borne plant pathogens[J]. Annals of Plant Protection Sciences, 2013, 21(1):197-198.
[6] Biljana G, Jugoslav Z. The influence of Trichoderma harzianum on reducing root rot disease in tobacco seedings caused by Rhizoctonia solani[J]. Int J Pure Appl Sci Tech, 2011, 2(2):1-11.
[7] Saili NS, Shafiquzzaman S. Composting of oil palm fibres and Trichoderma spp. as the biological control agent:A review[J]. International Biodeterioration & Biodegradation, 2013, 85(5):243-253.
[8] Hermosa R, Rubio M, Cardoza R, et al. The contribution of Trichoderma to balancing the costs of plant growth and defense[J]. International Microbiology, 2013, 16(2):69-80.
[9] Woo SL, Scala F, Ruocco M, et al. The molecular biology of the interactions between Trichoderma spp. , phytopathogic fungi and plants[J]. Phytopathol, 2006, 96(2):181-185.
[10] 陳建愛, 杜方嶺. 黃綠木霉 T1010 對櫻桃番茄橫向土壤環境性狀改良效果研究[J]. 農學學報, 2011, 1(6):36-41.
[11] Jayaraman P, Kumar TN, Maheswaran P, et al. In vitro studies on biodegradation of chlorpyrifos by Trichoderma viride and T. harzianum[J]. Journal of Pure and Applied Microbiology, 2012,6(3):1465-1474.
[12] Singh BN, Singh BR, Singh HB. Trichoderma harzianum elicits induced resistance in sunflower challenged by Rhizoctonia solani[J]. Journal of Applied Microbiology, 2013, 116(3):654-666.
[13] 徐同. 木霉分子生物學研究進展[J]. 真菌學報, 1996, 15(2):143-148.
[14] 拜沃公司. 哈茨木霉菌應用技術[J]. 農藥市場信息, 2011,19(1):36-36.
[15] 胡瓊, 商世能. 木霉菌與化學農藥相互關系的研究進展[J].農藥, 2011, 50(2):87-89, 96.
[16] 尹婷, 徐秉良, 梁巧蘭, 等. 耐藥性木霉T2菌株的篩選、紫外誘變與藥劑馴化[J]. 草業學報, 2013, 22(2):117-122.
[17] 楊春林, 席亞東, 謝華蓉, 等. 耐福美雙的哈茨木霉菌株誘導及其幾丁質酶生防特性研究[J]. 云南農業大學學報:自然科學版, 2010, 25(2):183-188.
[18] Li M, Zhang H, Liang B. Novel mutations in β-tubulin gene in Trichoderma harzianum mutants resistant to methyl benzimidazol-2-YL carbamate[J]. Applied Biochemistry & Microbiology,2013, 49(5):502-506.
[19] 牛芳勝, 馬志強, 畢秋艷. 哈茨木霉與啶酰菌胺互作對番茄灰霉病的增效作用評價[J]. 中國農學通報, 2013, 29(12):201-205.
[20] 牛芳勝, 馬志強, 畢秋艷, 等. 哈茨木霉菌與5種殺菌劑對番茄灰霉病菌的協同作用[J]. 農藥學學報, 2013, 15(2):165-170.
[21] Aguiar D, Renata A, Cunha D, et al. Management of white mold in processing tomatoes by Trichoderma spp. and chemical fungicides applied by drip irrigation[J]. Biological Control, 2014, 74(3):1-5.
[22] Banani H, Roatti B, Ezzahi B, et al. Characterization of resistance mechanisms activated by Trichoderma harzianum T39 and benzothiadiazole to downy mildew in different grapevine cultivars[J]. Plant Pathol, 2014, 63(2):334-343.
[23] 張雪, 張曉菲, 王立言, 等. 常壓室溫等離子體生物誘變育種及其應用研究進展[J]. 化工學報, 2014, 7:2676-2684.
[24] 邱雯雯, 任雅琳, 陳存社, 等. 常壓室溫等離子體誘變篩選高乳糖酶活力酵母的研究[J]. 中國食品學報, 2014, 14(2):132-137.
[25] 喬長晟, 趙男, 石漫漫, 等. 基于核糖體工程理論的常壓室溫等離子體誘變篩選多殺菌素高產菌[J]. 中國生物工程雜志,2014, 34(1):71-78.
[26] 劉瓊, 鄭璞. 常壓室溫等離子體誘變選育高產香蘭素擬無枝酸菌(Amycolatopsis sp. )[J]. 食品與發酵工業, 2013, 39(10):40-44.
[27] Bennett JW, Lasure LL. More gene manipulations in Fungi[M]. San Diego, New York:Academic Press, 1991:107-125.
[28] Gorgolous SG, Dekker J. Detection and measurement of fungicide resistance general principles[J]. FAO PI Port Bull, 1982, 30(2):39-49.
[29] 張曉, 王滿意, 于淑晶, 等. 抑制番茄早疫病菌活性化合物的高通量篩選方法研究[J]. 農藥學學報, 2010, 12(4):468-471.
[30] 張志祥, 徐漢虹, 程東美. EXCEL在毒力回歸計算中的應用[J]. 昆蟲知識, 2002, 39(1):67-70.
[31] 李瓊芳, 曾華蘭, 葉鵬盛, 等. 哈茨木霉(Trichoerma harzianum)T23生防茵篩選及防治中藥材根腐病的研究[J]. 西南大學學報:自然科學版, 2007, 29(1):119-121.
[32] 管懷驥, 陳莉. 哈茨木霉TH-1菌株對小麥紋枯病的控制效果研究[J]. 安徽農業科學, 2011, 39(16):9664-9665.
[33] 吳大椿, 吳小剛. 六種殺菌劑對綠色木霉的毒力測定[J]. 湖北植保, 2000(5):15-16.
[34] 程東美, 李松濤, 張志樣, 等. 常用土壤處理除草劑對哈茨木霉的影響[J]. 江蘇農業學報, 2009, 25(1):216-218.
[35] Nallathambi P, Umamaheswari C, Thakore BBL, More TA. Postharvest management of ber(Ziziphus mauritiana Lamk)fruit rot(Alternaria alternata Fr. Keissler)using Trichoderma species,fungicides and their combinations[J]. Crop Protection, 2009, 28(6):525-532.
(責任編輯 馬鑫)
Mutagenesis of Trichoderma harzianum with Pesticide Mutipleresistance by Atmospheric and Room Temperature Plasma
Zhou Wenchen1Zhan Xiaobei1,2Zhu Li2Zheng Zhiyong1Wu Jianrong1
(1. Key Laboratory of Carbohydrate Chemistry and Biotechnology of Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi214122;2. Jiangsu Rayguang Biotechnology Co.,Ltd. Wuxi214125)
This study aimed to improve the adaptability of biocontrol Trichoderma in the complicated agricultural environment in where herbicides, insecticides, and fungicides co-exist. Trichoderma harzianum was used as initial strain and induced by atmospheric and room temperature plasma(ARTP). The Trichoderma harzianum mutants resistant to both fungicides mancozeb and insecticide dinotefuran were obtained and one with the most double-resistance was named as Th-36. The mutant was subject to further mutation by ARTP and screened on the medium with mancozeb, dinotefuran and herbicide oxyfluorfen. Two mutants with triple-resistance were obtained and named as Th-3-36 and Th-4-B. The toxicity resistance test showed that EC50s of mancozeb for Th-3-36 and Th-4-B were up to 5089.2 μg a.i.·mL-1and 5498.2 μg a.i.·mL-1;for dinotefuran up to 758.5 μg a.i.·mL-1and 785.9 μg a.i.·mL-1;for oxyfluorfen up to 198.2 μg a.i.·mL-1and 200.3 μg a.i.·mL-1respectively. The above values were all higher than the average commercially recommended doses of these pesticides. The screened mutants showed the significant increasing resistance to pesticide, inherited parental broad-spectrum antibacterial property, and presented genetic stability. Furthermore growth capacity and enzyme characteristics of the mutants were better than those of the parental strains.
atmospheric and room temperature plasma(ARTP); Trichoderma harzianum; pesticide resistance; domestication.
10.13560/j.cnki.biotech.bull.1985.2015.05.033
2014-10-18
國家自然科學基金項目(31171640,31271888),無錫市科技項目(CLE01N1208),無錫中小企業創新基金項目(CBE01G1344)
周文臣,女,碩士研究生,研究方向:發酵工程與農業生物技術;E-mail:717244030@qq.com
詹曉北,男,教授,博士生導師,研究方向:生化工程與反應器等研究;E-mail:xbzhan@yahoo.com

