磁性納米材料載體固定纖維素酶技術研究進展
邢朝暉蘇躍龍張琦阮馨怡林燕王欣澤孔海南
(1.上海交通大學環境科學與工程學院,上海 200240;2.云龍縣環境監測站,大理 672700)
磁性納米材料載體固定纖維素酶技術研究進展
邢朝暉1蘇躍龍2張琦1阮馨怡1林燕1王欣澤1孔海南1
(1.上海交通大學環境科學與工程學院,上海200240;2.云龍縣環境監測站,大理672700)
生物質原料轉化為還原性糖,從而為生物質燃料乙醇的生產提供基礎原料。針對現在游離酶生產工藝中的不足,研究者提出了纖維素酶固定化技術,其中以磁性納米材料作為纖維素酶的固定化載體,不僅可提高纖維素酶的催化性能,增強酶的穩定性,而且以外加磁場代替傳統的機械攪拌方式可充分發揮載體材料的磁響應性,從而使制備的固定化酶從反應體系中易于分離,高效且具有重復性。研究者們提出了很多優秀的纖維素酶固定化方案,綜述了近年來磁性納米材料固定纖維素酶的不同方法,并對其做了較為詳細的闡述,在此基礎上進一步對其優缺點和發展前景進行了討論。
生物乙醇;纖維素酶;酶固定化;磁性納米載體
木質纖維素是地球上已知的最為豐富的可再生有機物質,利用纖維素酶的生物催化能力可將大量未被利用的廢棄木質纖維素轉化為生物乙醇[1],具有可觀的經濟效益和環境效益。酶的水解過程是木質纖維素轉化為生物乙醇的關鍵步驟,但游離纖維素酶在工業上的應用并不理想:游離的纖維素酶在高溫、強酸、強堿、高離子濃度及存在部分有機溶劑等條件下不夠穩定,容易失活而降低其催化能力,難以實現回收和重復利用,造成了在工業應用上的很大限制。采用固定化技術對纖維素酶進行固定,可提高其穩定性和抗抑制性,使其能重復使用,在一定程度上提高其催化活性和選擇性[2-4]。但是酶的固定化技術中酶使用后的分離限制了酶固定化技術的進一步應用,其中載體材料的選擇影響著酶的活性以及后續工藝的開展,是現今研究的關鍵之一[5]。在多種載體材料中,磁性納米載體除可有效固定化纖維素酶外,還可利用外加磁場替代工業生產中的傳統攪拌方式;與其他載體材料相比,磁性納米載體無毒、比表面積大、機械強度優良。復合型的納米磁性材料是將納米磁性材料與特定的載體材料相結合設計的新型載體材料,目前這方面的技術具有很大的發展潛力。
本文介紹了纖維素酶的固定化技術發展進程,就近年來的研究熱點——磁性納米材料載體,總結歸納了建立在磁性納米材料載體上的纖維素酶固定化方法研究,著重分析了以殼聚糖—磁性納米材料為代表的復合載體的優缺點以及進一步開發的方向,旨在為后續的纖維素酶固定化研究提供一定的參考。
1 纖維素酶固定化發展過程
酶的固定化技術最早由Nelson和Griffin[6]在1916年提出,他們發現將蔗糖酶與氧化鋁和焦炭結合以后,蔗糖酶仍具有催化活性。至20世紀80年代這一意外的發現才被接受為近代酶固定化技術的基石,隨后固定化酶的技術得到了長足的發展[7]。現階段,酶的固定化(Immobilization of enzymes)主要是指利用物理或化學的方法將酶束縛在一定區域內,使得酶分子仍能進行其特有的催化反應并能有效回收重復使用的技術[8,9]。傳統意義上用來固定化酶的載體也可以特異性地用來固定纖維素酶[10],其中最為常見的種類包括:無機載體、合成高分子載體、天然高分子載體以及復合載體等[11],各類載體都有廣泛的應用。
無機載體是最早應用于固定化酶的載體材料,之后載體除了充當酶的固定化支持物以外,在實際應用中還可以用于改造酶的性質、提高酶的催化活性、穩定性與選擇性[12,13]。高分子載體(天然及合成載體)相對于無機載體,可供修飾的官能團增多,其表面性質、電荷分布和尺寸大小都可以預先設計以滿足實際要求[14]。復合載體兼具了組合材料的優良性質,不再單一選擇載體材料,具有更加自由的開發空間。各類固定化載體在實際研究中并沒有嚴格的時間先后順序和絕對的優劣性,這是由于纖維素酶分子結構的復雜性和多樣性,不可能有一種固定化方法和固定化載體是適用于每一種工業應用的。因此,針對需要研究的酶的使用狀況開發及選擇新的固定化方法和固定化載體顯得尤為重要。
近年來,納米材料的優良性能逐漸顯現[15],研究者們逐漸把目光投向開發納米材料作為酶的固定化載體研究[16]。從實際應用的層面出發,納米材料也是一類特殊的無機載體,因此兼具了無機載體的優良性質,納米材料是指廣義上三維空間中至少有一維處于納米尺度范圍或者由該尺度范圍的物質為基本結構單元所構成的材料,同時納米尺寸的物質因具有與宏觀物質所迥異的表面效應、小尺寸效應、宏觀量子隧道效應等,可以構建不同的形狀[17,18],應用于制備固定化纖維素酶[19]。在實驗室階段,納米粒子作為纖維素酶固定化載體時表現出了優良的性質[20],但是實際工業生產中仍然存在不易分離、酶固載率偏低和酶活力回收率較低等問題。為了有效的解決上述問題,研究者們通過固定化策略的改進[21],包括結合不同的固定化技術、設計開發新的固定化載體以及固定化條件,來提高固定化酶的催化活性、選擇性和穩定性,磁性納米材料的應用是其中一個有效方法[22]。當固定化酶載體具有磁性時,制備得到的固定化酶易于從反應體系中分離回收,操作簡單;同時可以利用外加磁場代替傳統的攪拌方式。
2 磁性納米材料固定纖維素酶研究進展
傳統使用的磁性材料是四氧化三鐵,一般而言,鐵的氧化物及羥基氧化物,按價態、晶型和結構的不同可分為(α-,β-,γ-)Fe2O3、Fe3O4、FeO和(α-、β-、γ-和δ-)FeOOH,其中研究較多和具有實用價值的鐵的氧化物主要有Fe3O4、γ-Fe2O3及α-Fe2O3等[23]。現階段由于纖維素酶結構的復雜性,研究者一直在尋找合適的固定化方法,基于磁性納米粒子與固定的纖維素酶的結合方式,本文將固定化方案大致分為3類,即直接固定、修飾固定及復合載體進行固定。
2.1 直接固定
將纖維素酶直接固定在磁性納米顆粒表面可以克服有孔載體普遍存在的擴散阻力,單一的磁性納米粒子具有更高的磁響應性和更大的比表面積。有關酶直接固定在磁性納米粒子表面的固定化機理一般認為:通過化學共沉淀法制備的磁性納米粒子屬于“巨型離子”,其表面會在特定的溶液體系中吸附氫氧根離子從而帶有正(負)電荷(粒子表面在吸附氫氧根后還會因為氫氧根的電荷效應結合其他陽離子,因此其所處的離子環境決定了粒子吸附后的電荷表現)從而導致粒子在堿性環境中表面帶有負電荷,而在酸性環境中表面帶有正電荷。有研究指出在pH7.5時OH-在粒子表面的電荷效應為零,這時粒子表面電荷密度很小并且極易團聚[24]。Bacri等指出-OH在pH6-10的范圍內都會被吸附保留在粒子表面。因此直接固定化主要是使粒子表面自由的羥基和酶的氨基結合使得其固定在粒子表面[25]。由于使用磁性納米材料進行纖維素酶固定化的簡易性引起了人們廣泛的興趣,表1從載體制備到固定化效果梳理了常見的纖維素酶固定化方案。
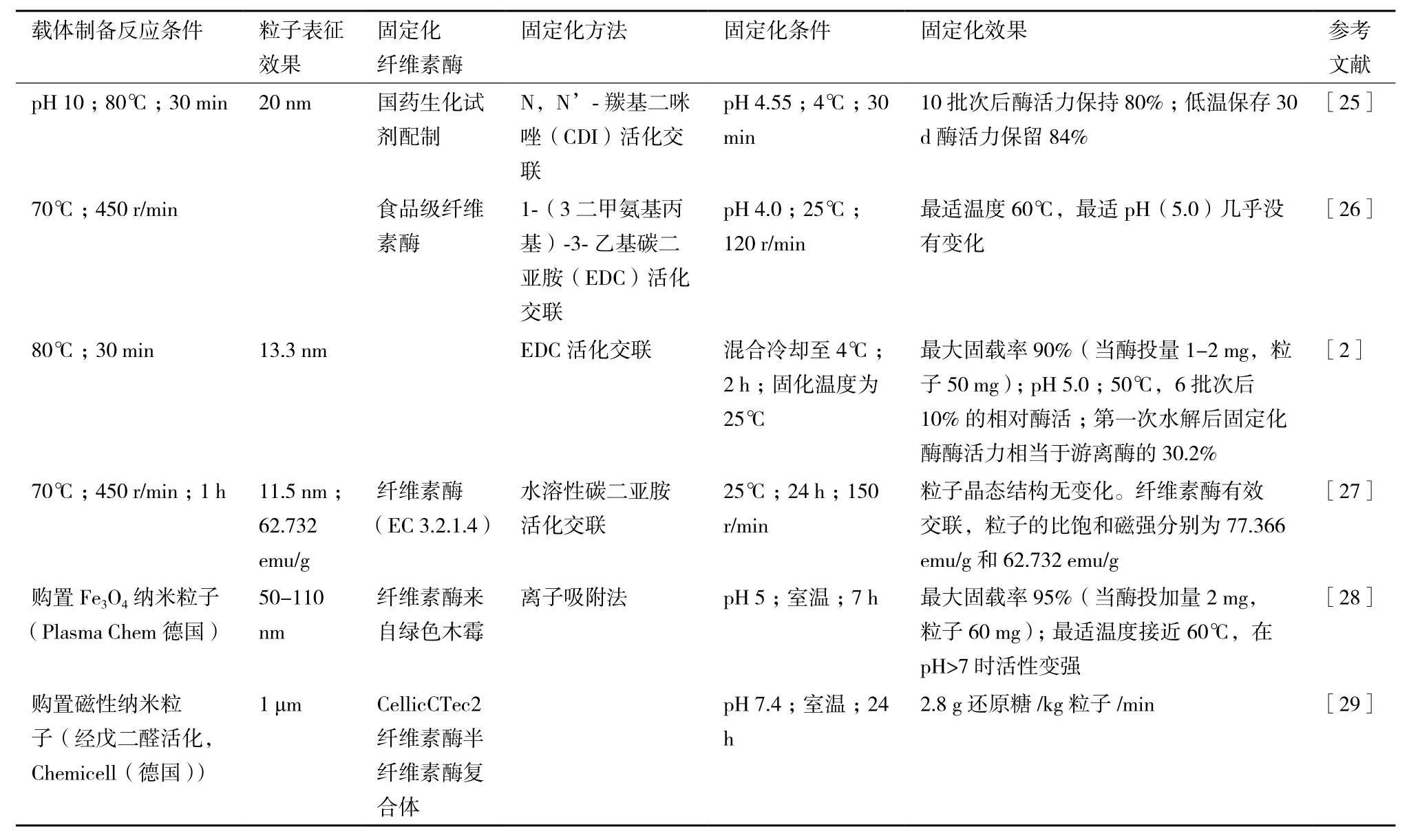
表1 纖維素酶直接固定在磁性納米載體
在直接固定化中,更加常見和成熟的方案是共價吸附法[30]。表1中列舉的前幾項研究都建立在此方法之上。一般在載體結合酶的時候要經過兩個階段:吸附與共價結合。當酶分子在溶液中因為物理作用靠近帶有化學功能基團位點的載體附近后,足夠接近的酶分子上的非活性部位基團與載體上數量足夠的活性化學功能團發生化學反應,使得酶分子結合到載體上。雖然直接固定不需要對磁性納米粒子進行修飾,流程較為簡單,在這種條件下,酶的活力取決于吸附與共價結合兩個操作過程[31],擴散限制、載體活性位點官能團和固定化條件、體系的pH及溫度等都會影響酶的活性。表1顯示,直接固定條件的選擇存在多樣性,而共價結合的取向難以控制[32],從而導致了酶活力的差異。20世紀70年代就有研究者提出,固定化載體和酶之間的靜電復合物對于固定化酶的活性與穩定性具有重要意義,不同的活化劑選擇、固定化條件的控制都會導致纖維素酶的固載率和酶活力的差異,從而導致應用上的局限。除了磁性納米粒子的物理特性(粒徑、比表面積以及粒子形貌等)的差異,選擇合適的活化劑,調控合適的固定化條件仍是現在研究的重點。表1中列舉的方案多采用水溶性碳二亞胺活化纖維素酶再將其與磁性納米粒子交聯固化,無論是EDC還是CDI,價格都偏高,若需要大規模生產經濟成本較高,有待進一步尋找合適的交聯活化劑。
2.2 修飾固定
相比較直接將酶固定于磁性納米粒子,對載體表面化學修飾后使其帶上各種反應性功能基團(如環氧基、羰基或氨基等),可在一定程度上增加其結合酶的強度[33],使得固定化酶不易脫落[34],同時因為部分修飾方法需要進行較為劇烈的化學反應,因此可能會對酶的活性中心造成相對的損傷,從而導致固定化酶活性的下降,所以在修飾固定化纖維素酶時需要格外注意修飾的功能團化學生物性質以及修飾方法的溫和性,盡量不要對固定化的酶催化性能造成損失,表2列舉了近年來常見的幾種較為成熟的修飾固定纖維素酶的方法。

表2 纖維素酶固定在表面修飾的磁性納米載體
修飾固定法的設計理念是:先經過與化學試劑反應使得制備的磁性納米顆粒表面帶上特定的官能團,再通過物理或化學作用讓酶分子接近反應位點并與活化的官能團結合,從而使得酶分子牢固結合到載體上[39]。在表2列舉的固定化方法中,經過多批次的水解之后,固定纖維素酶仍保有相當高的酶活性,這說明了經過修飾的載體與酶分子間的結合更為牢固,并且可以重復水解纖維素。修飾載體上共價結合的酶可以看作是經過化學或物理作用修飾過的酶,它們的理化性質被所使用的載體修飾了。在進行固定化的時候,酶和載體上修飾的化學官能團發生反應,這改變了酶的構象,同時酶分子的空間取向也因為結合到反應位點而發生了相應的改變,因此酶的化學性質也相應改變,這都使得成功固定化的纖維素酶在催化性能、選擇性和穩定性上都比傳統吸附法固定的酶或天然酶有了顯著提升。
2.3 復合載體固定
以磁性納米粒子作為載體直接通過吸附、偶聯的方式固定纖維素酶,操作要求較低、工藝較為簡便,易于實現工業化,但是直接固定往往導致纖維素酶的固載量偏低,這是由于簡單吸附的附著力較弱,酶分子易脫落,即使是使用脫水劑活化之后共價結合,也較容易受到溶液環境的影響,在表1實驗方案中的高固載率往往要在比較低的纖維素酶投加量下得到,且高固載率下的重復性能仍待實驗驗證;以表面功能化的磁性納米粒子作為載體固定纖維素酶,雖然可以通過增加粒子表面的可用官能團數量,或者利用復雜化的空間結構提高酶分子與結合位點的反應機會,從而增加酶分子的固載量,但是表2固定化方法中,化學修飾相對繁瑣,操作要求較高,而且經過復雜的表面修飾,高刺激性的化學試劑殘留也可能會對酶的生物特性產生影響。另外,由于共價結合改變了酶分子的空間構象,有時反而會使固定的纖維素酶酶活降低。因此,研究者們開始研究以磁性高分子微球為載體的復合固定化酶技術。對于無孔的磁性載體顆粒,如以包覆法制備的微球,在可分離的非均相反應體系中,顆粒越小,其固定化的表面積越大,越有利于增加載體的固載量;對于制備的多孔載體,因為會有濃度梯度的存在,滲透到載體內部的酶分子會因為擴散限制出現功能性失活,通常在制備載體微球時可以通過改變載體制備條件,如致孔劑,交聯劑的選擇和濃度,控制載體的孔隙率,對于較大的顆粒,酶活可以通過酶的固載率進行控制。另外復合載體兼有強磁響應性、高比表面積、機械強度高、單分散性好的優勢。其中四氧化三鐵-殼聚糖復合載體因為其良好的機械性能、化學穩定性以及抗金屬離子干擾等優點而備受關注。
殼聚糖本身也可以單獨成為纖維素酶的固定化載體[40],結合磁性材料的殼聚糖復合載體繼承了其生物大分子的特性[41],目前,磁性殼聚糖微球的結構可分為3類[42]:核-殼結構,磁性材料為核,高分子材料為殼;混合結構,磁性材料分散在磁性微球內部;多層夾心結構,外層和內層為高分子材料,中間為磁性材料。
制備的四氧化三鐵-殼聚糖復合載體兼具磁性納米材料的磁響應性以及殼聚糖生物大分子的生物相容性、易于修飾的特點,提高了載體的機械性能以及穩定性,在酶固定化領域具有廣闊的應用前景,表3以修飾方法為出發點,介紹了以殼聚糖磁性納米材料為固定化載體制備的纖維素酶(蛋白質)固化方法及效果。

表3 纖維素酶固定在四氧化三鐵-殼聚糖復合載體
現階段應用于固定纖維素酶的復合載體,特別是與磁性納米粒子復合的載體數量還有待進一步開發,研究者們就如何得到更高效的四氧化三鐵-殼聚糖磁性納米復合載體,在修飾基團[46]、固定化方法[47]、固定化條件[48]控制等方面并未達成一致,還有待深入研究。由于結合了兩種或多種載體材料,復合載體顯示出了優于單一載體的理化性能,同時也發揮了磁性納米材料的優勢,但是開發新的載體并不表明要與已有的載體材料分割開來,研究者們開發了眾多的酶固定化載體,這些載體材料都可能經過新的設計特異性地應用到纖維素酶的固定化中。可以說,利用磁性納米材料為基礎的復合固定化載體會為大規模的工業應用奠定基礎。但是不容忽視的一點是,雖然復合載體優勢突出,但是制作工藝相對較復雜,操作條件要求相對較高,所以尋找更優化的復合材料,以及如何簡化復合材料的制備和固定化流程將是進一步研究開發的重點。
3 展望
纖維素酶以其高效、專一的催化作用已經成為國內外研究者開發的關注點。殼聚糖是自然界含量第二豐富的天然高分子,具有多種優良的生物、物理化學性能,是一種出色的纖維素酶固定化載體,兩者結合必然能為生物質轉化領域帶來新的突破。從現在國內外研究者們的成果來看,利用磁性納米粒子固定纖維素酶已展現出卓有成效的科研和實業價值。但是現階段關于磁性納米作為固定纖維素酶的研究中仍然存在一些亟待進一步研究的方面:(1)研究開發優質的交聯劑,制備出具有更高活力和穩定性的固定化纖維素酶;(2)采用結構、化學鍵檢測手段深入研究酶的集聚狀態、超分子結構等微觀結構的變化,更好的闡明磁性固定化交聯酶聚集形態形成機理;(3)針對不同的纖維素結構和纖維素酶種類,研究開發更適宜的改性結構以及更加深入闡釋固定化纖維素酶水解發酵工藝中的微觀動力學。
[1]Humbird D, Davis R, Tao L, et al, Process design and economics for biochemical conversion of lignocellulosic biomass to ethanol:diluteacid pretreatment and enzymatic hydrolysis of corn stover[R]. USA:National Renewable Energy Laboratory(NREL), 2011.
[2]Jordan J, Kumar CSSR, Theegala C. Preparation and characterization of cellulase-bound magnetite nanoparticles[J]. Journal of Molecular Catalysis B:Enzymatic, 2011, 68(2):139-146.
[3]Bornscheuer UT. Immobilizing enzymes:how to create more suitable biocatalysts[J]. Angewandte Chem ie International Edition, 2003, 42(29):3336-3337.
[4]Mateo C, Palomo JM, Fernandez-Lorente G, et al. Improvement of enzyme activity, stability and selectivity via immobilization techniques[J]. Enzyme and Microbial Technology, 2007, 40(6):1451-1463.
[5] 王景林. 纖維素酶固定化的研究進展[J]. 生命科學, 1997, 9(3):116-118.
[6]Nelson JM, Griffin EG. Adsorption of invertase[J]. Journal of the American Chemical Society, 1916, 38(5):1109-1115.
[7]Hanefeld U, Gardossi L, Magner E. Understanding enzyme immobilisation[J]. Chemical Society Reviews, 2009, 38(2):453-468.
[8]Mosbach K. Immobilized enzymes[J]. Trends in Biochemical Sciences, 1980, 5(1):1-3.
[9] 徐莉, 侯紅萍. 酶的固定化方法的研究進展[J]. 釀酒科技,2010(1):86-89.
[10]Sheldon RA. Enzyme immobilization:the quest for optimum performance[J]. Advanced Synthesis & Catalysis, 2007, 349(8-9):1289-1307.
[11]Wang S, Su P, Ding F, et al. Immobilization of cellulase on polyam idoam ine dendrimer-grafted silica[J]. Journal of Molecular Catalysis B:Enzymatic, 2013, 89:35-40.
[12] Tebeka IR, Silva AG, Petri DF. Hydrolytic activity of free and immobilized cellulase[J]. Langmuir, 2009, 25(3):1582-1587.
[13] Safari Sinegani AA, Em tiazi G, Shariatmadari H. Sorption and immobilization of cellulase on silicate clay minerals[J]. J Colloid Interface Sci, 2005, 290(1):39-44.
[14] Wu L, Yuan X, Sheng J. Immobilization of cellulase in nanofibrous PVA membranes by electrospinning[J]. Journal of Membrane Science, 2005, 250(1-2):167-173.
[15] Kim J, Jia H, Wang P. Challenges in biocatalysis for enzyme-based biofuel cells[J]. Biotechnol Adv, 2006, 24(3):296-308.
[16] Cipolatti EP, Silva MJA, Klein M, et al. Current status and trends in enzymatic nanoimmobilization[J]. Journal of Molecular Catalysis B:Enzymatic, 2014, 99:56-67.
[17]Gokhale AA, Lu J, Lee I. Immobilization of cellu lase on magnetoresponsive graphene nano-supports[J]. Journal of Molecular Catalysis B:Enzymatic, 2013, 90:76-86.
[18]Mubarak NM, Wong JR, Tan KW, et al. Immobilization of cellulase enzyme on functionalized multiwall carbon nanotubes[J]. J Mol Catal B:Enzym, 2014, 107:124-131.
[19] Suh WH, Suslick KS, Stucky GD, et al. Nanotechnology,nanotoxicology, and neuroscience[J]. Progress in Neurobiology,2009, 87(3):133-170.
[20] Ansari SA, Husain Q. Potential applications of enzymes immobilized on/in nano materials:A review[J]. Biotechnology Advances,2012, 30(3):512-523.
[21]Lupoi JS, Smith EA. Evaluation of nanoparticle-immobilized cellulase for improved ethanol yield in simultaneous saccharification and fermentation reactions[J]. Biotechnology and Bioengineering, 2011, 108(12):2835-2843.
[22] Tang ZX, Qian JQ, Shi LE. Characterizations of immobilized neutral lipase on chitosan nano-particles[J]. Materials Letters, 2007, 61(1):37-40.
[23] 辛寶娟, 邢國文. 氧化鐵磁性納米粒子固定化酶[J]. 化學進展, 2010, 22(4):593-602.
[24] Mehta RV, Upadhyay RV, Charles SW, et al. Direct binding ofprotein to magnetic particles[J]. Biotechnology Techniques,1997, 11(7):493-496.
[25] 王玫, 宋芳, 汪世龍, 等. 磁性納米顆粒Fe3O4固定化纖維素酶的光譜學研究[J]. 光譜學與光譜分析, 2006(5):895-,88.
[26] 霍書豪, 許敬亮, 張猛, 等. Fe3O4納米顆粒固定化纖維素酶的酶學特性研究[J]. 可再生能源, 2009(6):33-35, 40.
[27] 霍書豪, 許敬亮, 莊新姝, 等. 超順磁性納米顆粒固定化纖維素酶初步研究[J]. 現代化工, 2009(S2):188-190.
[28] Khoshnevisan K, Bordbar AK, Zare D, et al. Immobilization of cellulase enzyme on superparamagnetic nanoparticles and determination of its activity and stability[J]. Chemical Engineering Journal, 2011, 171(2):669-673.
[29] Alftren J, Hobley TJ. Immobilization of cellulase mixtures on magnetic particles for hydrolysis of lignocellulose and ease of recycling[J]. Biomass and Bioenergy, 2014, 65:72-78.
[30] Xu J, Huo S, Yuan Z, et al. Characterization of direct cellulase immobilization with superparamagnetic nanoparticles[J]. Biocatalysis and Biotransformation, 2011, 29(2-3):71-76.
[31] Talbert JN, Goddard JM. Enzymes on material surfaces[J]. Colloids and Surfaces B:Biointerfaces, 2012, 93:8-19.
[32] Zoungrana T, Norde W. Thermal stability and enzymatic activity of α-chymotrypsin adsorbed on polystyrene surfaces[J]. Colloids and Surfaces B:Biointerfaces, 1997, 9(3):157-167.
[33] ?ulek F, Drofenik M, Habulin M, et al. Surface functionalization of silica-coated magnetic nanoparticles for covalent attachment of cholesterol oxidase[J]. J Magn Magn Mater, 2010, 322(2):179-185.
[34] Lopez-Gallego F, Betancor L, Mateo C, et al. Enzyme stabilization by glutaraldehyde crosslinking of adsorbed proteins on aminated supports[J]. Journal of Biotechnology, 2005, 119(1):70-75.
[35] 李詠蘭, 呂桂芬, 弓劍, 等. 納米磁性微粒固定化纖維素酶及水解秸稈的研究[J]. 江西師范大學學報:自然科學版,2011(6):574-578.
[36] 廖紅東, 袁麗, 童春義, 等. 基于聚乙烯醇/Fe2O3納米顆粒的纖維素酶固定化[J]. 高等學校化學學報, 2008(8):1564-1568.
[37] 張猛, 許敬亮, 張宇, 等. 氨基硅烷化磁性納米微球固定化纖維素酶研究[J]. 太陽能學報, 2013(2):337-342.
[38] 王秀玲, 顧銀君, 莊虹, 等. 新型氨基化磁性樹狀分子納米顆粒的制備與表征[J]. 化工新型材料, 2012(11):61-63.
[39] Liao H, Chen D, Yuan L, et al. Immobilized cellulase by polyvinyl alcohol/Fe2O3magnetic nanoparticle to degrade microcrystalline cellulose[J]. Carbohydrate Polymers, 2010, 82(3):600-604.
[40] Mao X, Guo G, Huang J, et al. A novel method to prepare chitosan powder and its application in cellulase immobilization[J]. J Chemi Technol Biotechnology, 2006, 81(2):189-195.
[41] Liu X, Hu Q, Fang Z, et al. Magnetic chitosan nanocomposites:a useful recyclable tool for heavy metal ion removal[J]. Langmuir,2008, 25(1):3-8.
[42] 石浩明, 張樹彪, 陳會英, 等. 殼聚糖/Fe3O4復合納米顆粒的制備[J]. 大連民族學院學報, 2012(3):213-216.
[43] 李冰, 邵海員, 黎錫流, 等. 磁性固定化纖維素酶的交聯法制備及其磁致酶學性質[J]. 河南工業大學學報:自然科學版,2006(6):10-14.
[44] Zang L, Qiu J, Wu X, et al. Preparation of magnetic chitosan nanoparticles as support for cellulase immobilization[J]. Industrial & Engineering Chemistry Research, 2014, 53(9):3448-3454.
[45] 馬云輝, 陳國, 趙珺. 殼聚糖包覆磁性納米粒子的制備和表征以及蛋白質吸附特性[J]. 高分子學報, 2013(11):1369-1375.
[46] Dincer A, Telefoncu A. Improving the stability of cellulase by immobilization on modified polyvinyl alcohol coated chitosan beads[J]. J Mol Catal B:Enzym, 2007, 45(1-2):10-14.
[47] Jiang Y, Guo C, Xia H, et al. Magnetic nanoparticles supported ionic liquids for lipase immobilization:Enzyme activity in catalyzing esterification[J]. J Mol Catal B:Enzym, 2009, 58(1-4):103-109.
[48]Podrep?ek GH, Primo?i? M, Knez ?, et al. Immobilization of cellulase for industrial production[J]. Chemical Engineering,2012, 27:235-240.
(責任編輯 狄艷紅)
Research Progress on Cellulase Immobilized by M agnetic Nanoparticles as Carriers
Xing Zhaohui1Su Yuelong2Zhang Qi1Ruan Xinyi1Lin Yan1Wang Xinze1Kong Hainan1
(1. School of Environmental Science and Engineering,Shanghai Jiao Tong University,Shanghai200240;2. Environmental Monitoring Bureau of Yunlong Country,Dali672700)
Conversion of biomass to reducing sugar by cellulase is the foundation of the biomass fuel production. Nowadays researchers have invented the enzyme immobilization technology to avoid the disadvantages of free enzymatic hydrolization. Utilization of magnetic nanoparticles as carriers for the cellulase immobilization can increase the catalytic activities of enzyme and enhance stability of the enzyme. Moreover, replacing conventional mechanical stirring by external magnetic field can give full play to the role of carriers’ magnetic response;with the immobilization on magnetic nanoparticles, the produced cellulase can be separated easily from the mixture in the reaction systems. Researchers have proposed many excellent immobilization methods. Here the different methods of cellulase immobilization by magnetic nanoparticles are reviewed, their applications are explained in detail, and consequently the advantages and disadvantages as well as the development prospect are discussed.
bioethanol; cellulase; cellulase immobilization; magnetic nanoparticles as carrier
10.13560/j.cnki.biotech.bull.1985.2015.08.009
2014-12-15
國家科技重大專項(2012ZX07105-003),上海市自然科學基金項目(11ZR1417200)
邢朝暉,男,碩士研究生,研究方向:固定化技術應用;E-mail:doulejuice2013@sjtu.edu.cn
林燕,女,博士,副教授,研究方向:生物質能源利用;E-mail:linyan2002@sjtu.edu.cn

