耐鹽芽孢桿菌LAY的分類鑒定及其抗白色念珠菌活性研究
曹建斌 于慧瑛 李新
(運城學院生命科學系,運城 044000)
耐鹽芽孢桿菌LAY的分類鑒定及其抗白色念珠菌活性研究
曹建斌 于慧瑛 李新
(運城學院生命科學系,運城044000)
旨在從運城鹽湖黑泥樣品中分離獲得一株耐鹽細菌LAY,對其進行分類鑒定及抗菌特性研究。基于16S rRNA基因序列對菌株進行分類鑒定。以白色念珠菌為指示菌,采用杯碟法對菌株LAY發酵上清液進行抗菌活性檢測,研究不同因素對其抗菌活性的影響;采用掃描電鏡和透射電鏡觀察其抗菌效果,并對菌株基因組進行功能基因的PCR篩查。系統發育分析表明,菌株LAY為Bacillus屬成員,為耐鹽細菌。電鏡觀察發現,菌株LAY發酵上清液可導致白色念珠菌細胞結構出現明顯異常。抗菌穩定性研究表明,菌株LAY發酵上清液活性較為穩定,表現出良好的對溫度、pH、NaCl和紫外光的耐受性。功能基因篩查發現菌株LAY基因組中含有聚酮合酶(PKS)基因,表明該菌具有產聚酮類化合物的潛力。結果表明,鹽湖環境中的極端微生物資源可作為抗菌活性物質的潛在新來源。
耐鹽細菌;Bacillus;Candida albicans;抗菌活性;功能基因
白色念珠菌(Candida albicans)是念珠菌屬中致病力最強的一種革蘭氏陽性條件致病菌[1],常常侵犯人體皮膚、黏膜,并導致內臟或全身感染。近年來,隨著大量抗生素、激素、免疫抑制劑的應用,以及器官移植術的開展,使該菌導致的感染發病率逐漸增高,甚至危及生命[2]。因此尋找和開發具有抗白色念珠菌活性的新化合物,已成為醫學和微生物學研究領域的重要課題。
運城鹽湖是個典型的內陸咸水湖,由于湖水及其周圍土壤的含鹽度較高,生活在這類環境中的動植物較為稀少,但卻蘊藏著豐富的嗜/耐鹽微生物資源[3]。這類微生物對環境的適應能力較強,在長期的進化中逐步形成了獨特的種群特點和代謝機制,并產生了許多具有特殊功能的天然活性物質[4],在食品、醫藥、環境保護等領域具有重要的開發利用價值[5,6]。近年來,人們雖對鹽湖微生物資源開展了大量的研究,但將其應用于抗菌活性篩選的報道卻十分有限,僅有少量的嗜/耐鹽細菌次生代謝產物被分離純化,如Halobacillus litoralis YS3106產生的3種具有抗菌作用的環肽[7]和Pelagiobacter variabilis產生的具有抗腫瘤活性的一組吩嗪類化合物[8]。由此可見,鹽湖微生物所蘊含的抗菌代謝產物資源還遠未被人們所發掘。
本研究從運城鹽湖中分離獲得一株對白色念珠菌具有明顯抗菌活性的菌株LAY,采用16S rRNA基因序列分析對其進行分類鑒定,并對其發酵液抗菌活性進行初步研究。此外,在活性研究的基礎上,對菌株LAY基因組進行聚酮合酶(PKS)基因和非核糖體肽合成酶(NRPS)基因的篩查研究,旨在為其在農業生防或醫藥領域的應用提供參考。
1 材料與方法
1.1 材料
1.1.1 菌株 菌株LAY分離自運城鹽湖黑泥樣品,白色念珠菌(C. albicans)由本實驗室保存。
1.1.2 培養基 PDA培養基:馬鈴薯200 g,葡萄糖20 g,瓊脂15-20 g,蒸餾水1 000 mL,37℃(培養菌株LAY)。YPD培養基:酵母浸粉20 g,蛋白胨10 g,葡萄糖10 g,瓊脂20 g,蒸餾水1 000 mL,28℃(活化培養白色念珠菌)。
1.2 方法
1.2.1 菌株LAY的16S rRNA基因序列分析及系統進化樹構建 提取菌株LAY基因組DNA,采用細菌通用引物進行16S rRNA基因的PCR擴增。正向引物(27f):5'-AGAGTTTGATCCTGGCTCAG-3',反向引物(1540r):5'-TACCTTGTTACGACTT-3'。PCR擴增條件:95℃ 5 min;95℃ 45 s,52℃ 45 s,72℃2 min,35個循環;72℃ 10 min。PCR產物由北京三博遠志公司進行測序。測序結果在NCBI 數據庫中進行Blast搜索,選擇同源性較高的相關序列,利用Clustal W 1.8軟件進行多重序列比對后,采用MEGA5.0軟件構建菌株LAY的系統進化樹。
1.2.2 白色念珠菌的活化及菌株LAY發酵上清液的制備 從斜面上挑取適量的白色念珠菌菌苔,接入已滅菌的YPD培養基,28℃下振蕩培養2 d。菌株LAY于37℃振蕩培養3 d,發酵液經12 000 r/min離心10 min,上清液用于抗菌活性檢測。
1.2.3 抗菌活性檢測
1.2.3.1 熱穩定性 將5 mL上清液分別置于30、40、50、60、70、80、90和100℃下處理30 min,以白色念珠菌為指示菌,未處理的發酵上清為對照,采用杯碟法測定抑菌圈直徑,檢測其熱穩定性。
1.2.3.2 pH穩定性 取發酵上清液,將其pH值分別調為4、5、6、7、8、9、10、11和12的溶液,后均定容至5 mL,靜置2 h。采用杯碟法檢測其酸堿穩定性。
1.2.3.3 NaCl穩定性 取1 mL上清液,加入NaCl溶液,分別調節鹽濃度為3%、6%、9%、12%、15%和18%,靜置2 h。采用杯碟法測定其對NaCl的穩定性。
1.2.3.4 紫外光照穩定性 取5 mL菌株LAY發酵上清液置于紫外燈下,分別于0.5、1、1.5、2、2.5、3、3.5、4、4.5和5 h取樣,以白色念珠菌為指示菌,未處理的發酵上清為對照,采用杯碟法測定其光照穩定性。
1.2.4 電鏡觀察 取1 mL活化的白色念珠菌懸液(108CFU/mL),加入2 mL發酵上清液,28℃,120 r/min振蕩培養24 h,離心收集細胞,用磷酸緩沖液(pH7.4)沖洗,加入2.5%(V/V)的戊二醛溶液進行固定。細胞樣品經處理后,分別在掃描電鏡(JSH-35CF,日本)和透射電鏡(DXB2-12,上海)下進行觀察。
1.2.5 菌株LAY生長曲線與抗生素產生量的關系 以1%的接種量將菌株LAY接種于PDA培養基中,于37℃下振蕩培養。在培養2 h后,每隔2 h測OD600值,以PDA培養基做空白對照。同時,取1 mL菌液,于12 000 r/min離心10 min,取上清液,用于抗菌活性檢測。
1.2.6 功能基因的PCR篩查及序列分析 采用Zhu等[9]設計的特異引物,對菌株LAY基因組進行聚酮合酶(PKS)和非核糖體肽合成酶(NRPS)基因的PCR篩查。PCR產物通過1%的瓊脂糖凝膠電泳檢測后,進行回收純化、酶連及轉化。挑取陽性克隆由北京三博遠志生物公司進行測序。將獲得的基因序列提交到GenBank中獲得基因登錄號。采用DNAman軟件將獲得的基因序列轉換為氨基酸序列,在GenBank數據庫中進行Blast比對分析,選取同源性較高的相關序列,采用MEGA5.0軟件進行系統發育分析。
2 結果
2.1 菌株LAY的分類鑒定
2.1.1 部分生理生化特征 如圖1所示,菌株LAY在0-25.0%的鹽濃度范圍內均能生長,最適生長濃度為5%,確定其為耐鹽細菌;菌株生長的最適pH和溫度分別為pH7.0和35℃。
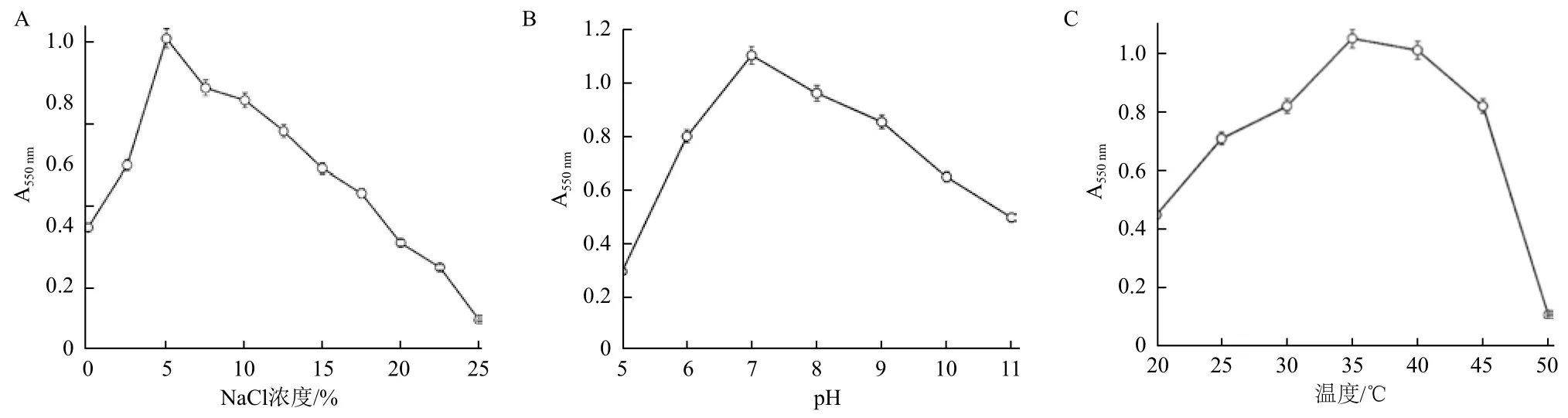
圖1 NaCl濃度(A)、pH(B)和溫度(C)對菌株LAY生長特性的影響
2.1.2 系統進化樹構建 采用PCR 擴增菌株LAY的16S rRNA基因,獲得大小為1 449 bp的片段。采用鄰接法構建的系統進化樹。結果(圖2)顯示,菌株LAY與Bacillus屬內各種的同源性均在98.0%以上,確定其為Bacillus屬成員,命名為Bacillus sp. LAY。
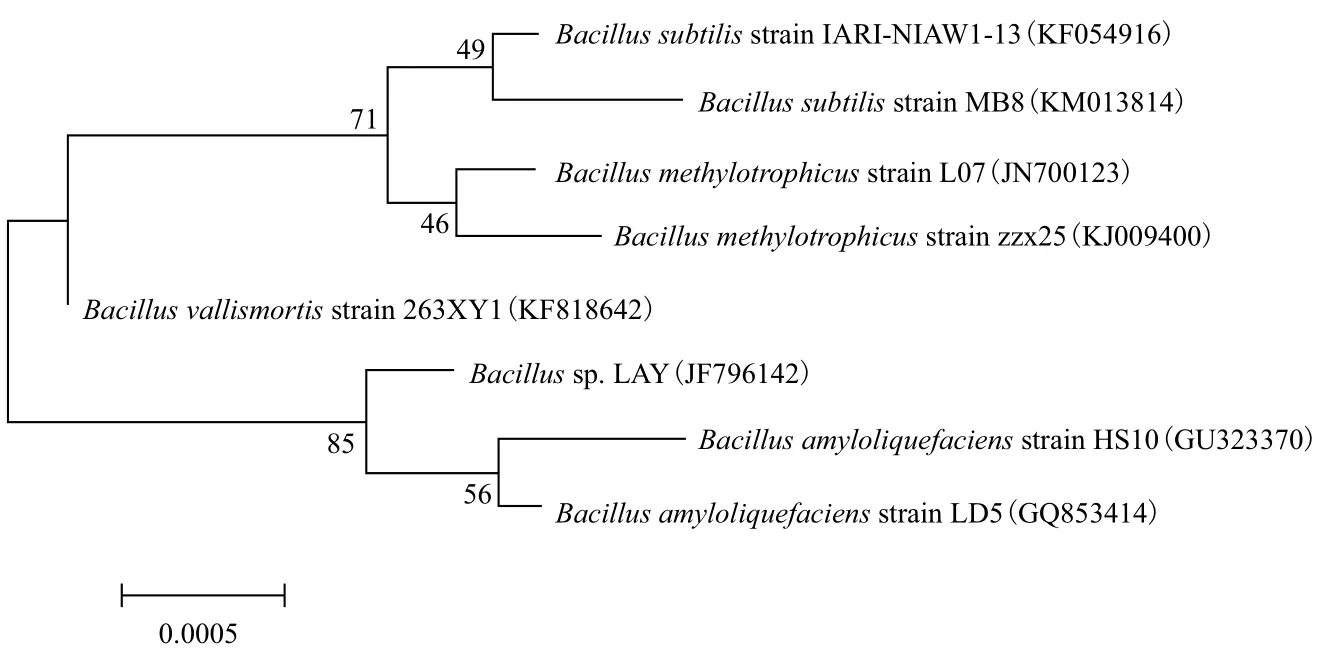
圖2 基于16S rRNA基因序列構建的菌株LAY的系統發育樹
2.2 菌株LAY發酵液抗白色念珠菌活性研究
2.2.1 抗菌活性檢測 采用杯碟法檢測菌株LAY發酵上清液的抗菌活性,結果(圖3)表明該菌可產生胞外抗菌物質,對白色念珠菌具有明顯的抑制作用。
2.2.2 抗菌穩定性研究 熱穩定性(圖4-A)結果表明,在70℃以下,抗菌活性較為穩定;80℃時,抗菌活性最佳;溫度高于90℃,抗菌活性開始有所下降。在pH11時,上清液對白色念珠菌的抗菌活性最強。pH為4-10時,抗菌活性比較穩定。在pH12時,抗菌活性明顯下降。結果(圖4-B)表明,菌株LAY發酵液的抗菌活性對酸堿的耐受性較好。鹽穩定性結果(圖4-C)表明,菌株LAY抗菌活性在鹽度為0-3%時最高。但隨著鹽度的升高,抗菌活性不斷下降,當鹽濃度超過15%時,抗菌活性基本消失。此外,研究發現,菌株LAY發酵上清液具有良好的對紫外光的穩定性(圖4-D)。
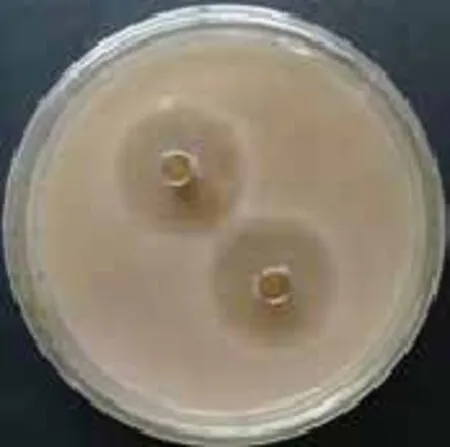
圖3 菌株LAY發酵液抗菌活性檢測
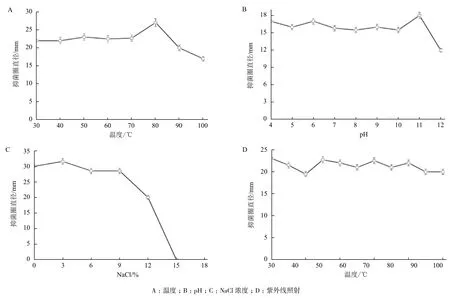
圖4 菌株LAY發酵上清液的抗菌特性
2.3 電鏡觀察
采用掃描電鏡觀察菌株LAY上清液對白色念珠菌的抗菌作用,如圖5所示。正常白色念珠菌細胞形狀規則,呈圓球形,表面較為光滑,直徑約為2-4 μm(圖5-A)。經上清液處理后的細胞形態發生明顯變化,細胞表面粗糙并出現裂紋,且部分細胞發生破裂(圖5-B)。
透射電鏡觀察發現,正常細胞內結構規則,細胞質分布均勻,細胞壁厚度約為150-200 nm,且細胞質中含有豐富的電子致密物質(圖6-A)。經處理后的細胞發生明顯改變,胞內結構紊亂,部分細胞胞壁疑似消失(圖6-B)或增厚(圖6-C)。此外,發現細胞質與細胞壁的界限變得模糊,且無法直接觀察到細胞核的存在(圖6-C)。

圖5 掃描電鏡觀察
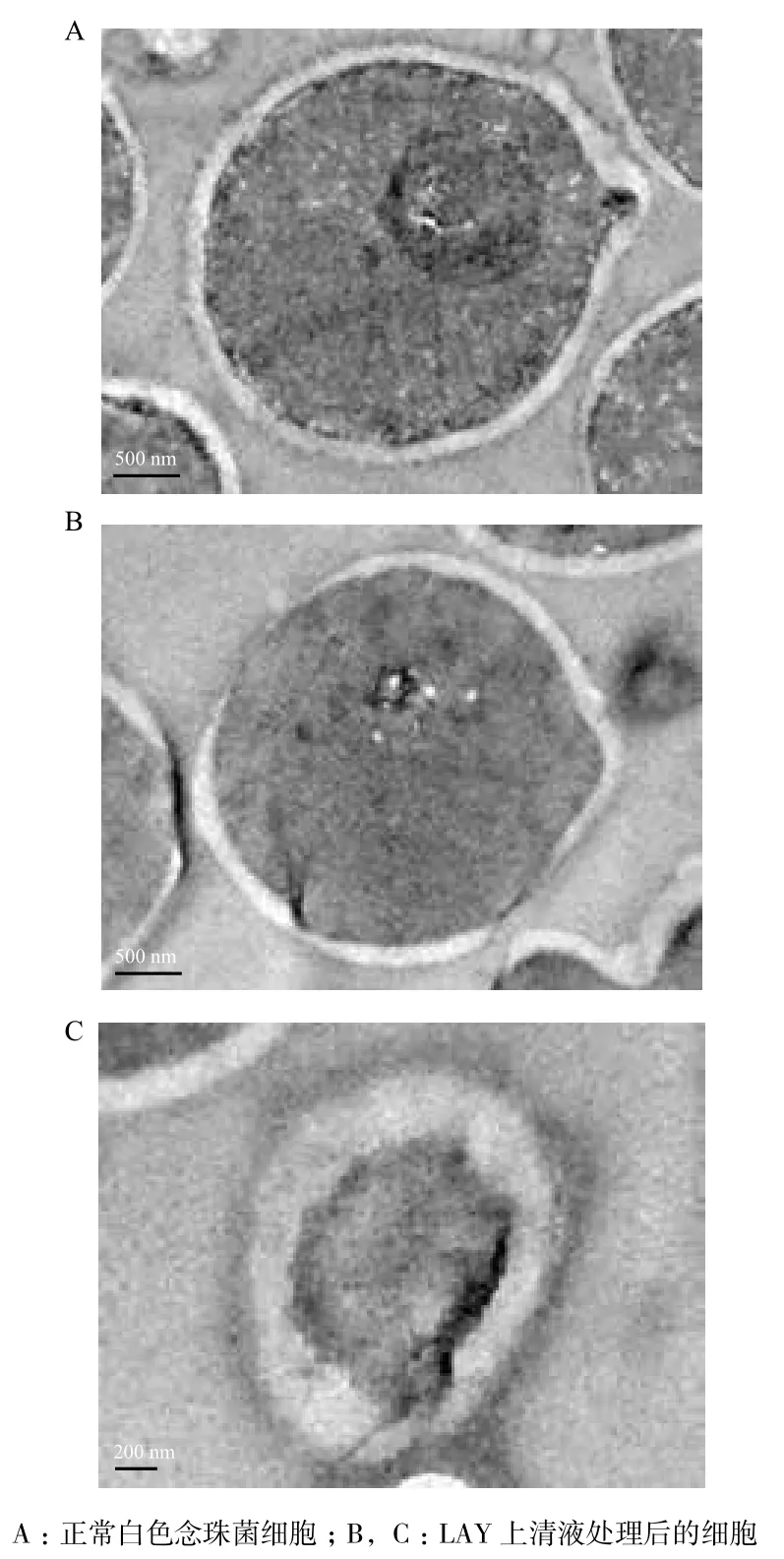
圖6 透射電鏡觀察
2.4 菌株LAY生長曲線與抗生素產生量的關系
如圖7所示,菌株LAY在培養開始后即進入對數生長期,30 h后達到峰值,并隨后進入穩定期(30-46 h)。由于菌株LAY產生抗菌物質的量與抑菌圈直徑的大小成正比,抗菌物質在菌株培養18 h后開始產生,32 h后產生量最高,后趨于穩定。
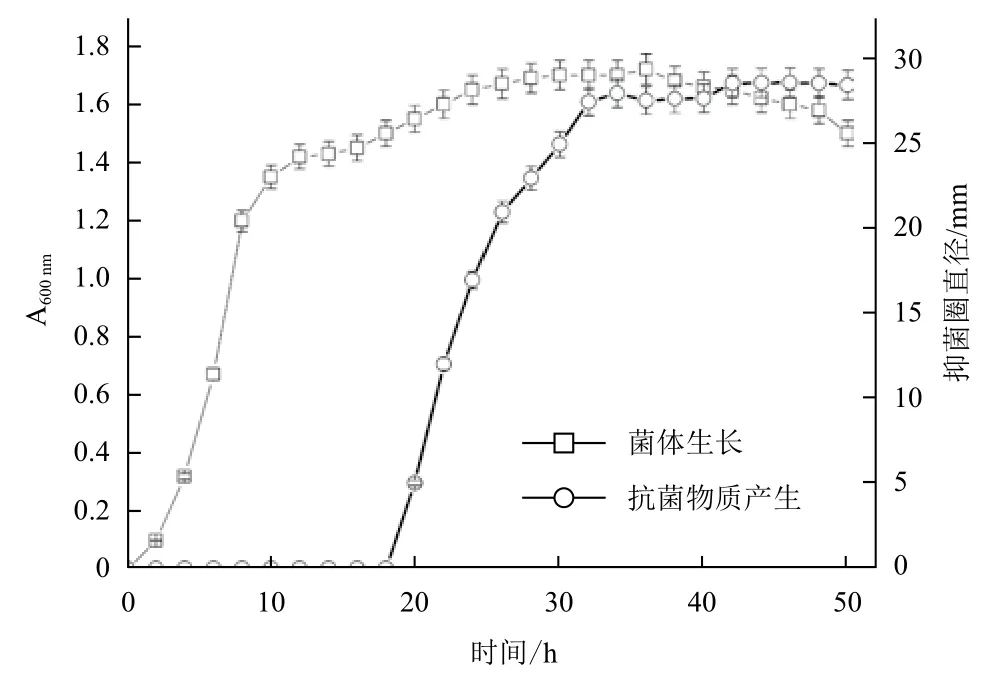
圖7 菌株LAY生長曲線與抗生素產生量的關系
2.5 功能基因的PCR篩查與分析
對菌株LAY基因組進行聚酮合酶(PKS)和非核糖體肽合成酶(NRPS)基因PCR篩查,結果發現該菌株基因組中不存在NRPS基因,但發現了PKS基因的存在。經測序后,獲得一條666 bp的PKS基因片段,提交到GenBank中獲得基因登錄號為KM000039。將獲得的基因片段轉換為氨基酸序列(AIO09649),進行Blastx比對,發現該序列與GenBank中已有序列的最高相似度為99%。系統發育分析表明,菌株LAY的PKS基因序列編碼的氨基酸序列為酮縮合酶(KS)基因的高度保守序列(圖8)。
3 討論
作為一類重要的藥源性微生物資源,芽孢桿菌具有產豐富次生代謝產物的巨大潛力,它們易于繁殖,分布廣泛,適應環境能力強,在工業、農業、醫學等領域具有廣闊的開發利用價值[10]。近年來,隨著陸地微生物資源的日益匱乏和細菌耐藥性問題的不斷出現,尋找新種屬或特殊性狀的微生物來開拓微生物篩選的新資源顯得尤為迫切。因此,從極端環境中尋找和發現具有抗菌活性的特殊菌株就成為研究者關注的新熱點[11]。多年來,本課題組針對運城鹽湖的微生物資源,開展了大量的調查研究工作,篩選并獲得了一批具有明顯抗菌活性的鹽湖芽孢桿菌菌株。本研究針對其中一株具有抗白色念珠菌活性的耐鹽細菌菌株LAY進行研究,通過基因序列分析發現其為Bacillus屬成員。

圖8 基于氨基酸序列的PKS基因的系統進化樹
由微生物產生的聚酮類化合物(Polyketide)和非核糖體肽類化合物(Non-ribosomal peptide)是天然化合物的兩大重要家族,它們大多具有良好的生物學活性,被廣泛用于醫用或農用抗生素、免疫抑制劑和抗癌藥等[12]。目前已報道的聚酮類化合物和非核糖體肽類化合物可達數萬種,主要來源于各種細菌、放線菌和真菌[13]。對此,本研究采用PCR技術主要開展了菌株LAY基因組中的PKS基因和NRPS基因的分子篩查,結果發現Bacillus sp. LAY也具有產聚酮類化合物的潛力。近年來,在耐鹽細菌的許多常見種群中,如Aeromonas,Burkholderia,Photobacterium,Pseudomonas等,均發現了具有抗菌活性菌株的存在[14-16],但對其次級代謝產物的報道卻相對較少。
本研究表明,菌株LAY發酵上清液對白色念珠菌具有明顯的抗菌活性。同時,對其發酵上清液進行各種處理后,發現其抗菌活性表現出對紫外光照、熱、環境酸堿度等良好的穩定性,因此可能具有廣闊的應用潛力。細胞壁是真菌細胞外的重要結構,在維持細胞的生長和正常的生理功能上發揮重要作用。由于哺乳動物無細胞壁,因而作用于真菌細胞壁的藥物具有高效、低毒的特點。通過電鏡觀察,發現經菌株LAY發酵上清液處理后的真菌細胞出現破裂或變形。Leite等[17]報道該現象主要是由于化合物導致細胞滲透性發生變化引起的,而這可能源于抗菌物質的作用靶點為真菌細胞膜或細胞壁。該結果表明,菌株LAY可能產生了某種可破壞真菌細胞壁的抗菌物質。
通過長期的自然選擇與進化,生長在鹽(堿)湖、海水等鹽域環境中的微生物形成了獨特的環境適應機制,極有可能會產生某些具有獨特化學結構或生物學活性的代謝產物,因此可作為發現新型天然化合物的潛在資源。隨著科學研究的廣泛開展,來源于極端環境中的抗菌活性微生物也將被不斷發現和鑒定。在本研究結果的基礎上,今后將著重針對菌株LAY所產代謝產物進行分離純化及結構解析等相關工作,為其在農業生防或醫藥領域的應用奠定基礎。
4 結論
本研究從運城鹽湖黑泥樣品中篩選獲得一株對白色念珠菌具有明顯抗菌活性的菌株LAY,通過16S rRNA基因序列分析鑒定其為Bacillus屬成員。抗菌活性研究結果表明,菌株LAY發酵上清液活性較為穩定,表現出良好的耐熱性、抗酸堿及耐鹽性等。抗菌上清液處理白色念珠菌后,可導致其細胞結構出現明顯異常。通過功能基因的PCR篩查,發現Bacillus sp. LAY基因組中含有聚酮合酶(PKS)基因,表明該菌可產聚酮類化合物的。綜合上述研究表明,鹽域環境中的嗜/耐鹽微生物資源可能是獲得新型抗菌活性物質的重要資源。
[1]邵穎, 丁婷, 葛飛, 等. 40株蟲生真菌發酵液對白色念珠菌的抑制作用[J]. 安徽農業大學學報, 2005, 32(3):328-331.
[2]江文俊, 姜福全, 崔彥. 白色念珠菌生物學特性研究進展[J].基礎醫學與臨床, 2014, 34(4):550-554.
[3]Li X, Yu HY. Biodiversity and screening of halophilic bacteria with hydrolytic and antimicrobial activities from Yuncheng Salt Lake,China[J]. Biologia, 2015, 70(2):151-156.
[4]Oren A. Halophilic microbial communities and their environments[J]. Current Opinion in Biotechnology, 2015, 33C:119-124.
[5]Morozkina EV, Slutskaia ES, Fedorova TV, et al. Extremophilic m icroorganisms:biochemical adaptation and biotechnological application[J]. Applied Biochemistry and Microbiology, 2010,46:1-14.
[6]Margesin R, Schinner F. Potential of halotolerant and halophilic microorganisms for biotechnology[J]. Extremophiles, 2001, 5:73-83.
[7]Yang L, Tan R, Wang Q, et al. Antifungal cyclopeptides from Halobacillus litoralis YS3106 of marine origin[J]. Tetrahedron Letters, 2002, 33(51):6545-6548.
[8]Imamura N, Nishijima M, Takadera T. New anticancer antibiotics pelagiomicins, produced by a new marine bacterium Pelagiobacter variabilis[J]. Journal of Antibiotics, 1997, 50(1):8-12.
[9]Zhu P, Zheng Y, You Y, et al. Molecular phylogeny and modular structure of hybrid NRPS/PKS gene fragment of Pseudoalteromonas sp. NJ6-3-2 isolated from marine sponge Hymeniacidon perleve[J]. Journal of Microbiology and Biotechnology, 2009, 19(3):229-237.
[10]葉晶晶, 曹寧寧, 張劍飛, 等. 芽孢桿菌在植病生防中的應用研究進展[J]. 農業科學與技術:英文版, 2013, 14(5):695-698.
[11]李江, 李光友. 極端微生物—生物活性物質的新源泉[J]. 自然雜志, 2011, 33(5):275-280.
[12] Calcott MJ, Ackerley DF. Genetic manipulation of non-ribosomal peptide synthetases to generate novel bioactive peptide products[J]. Biotechnology Letters, 2014, 36(12):2407-2416.
[13]Walsh CT. Polyketide and nonribosomal peptide antibiotics:modularity and versatility[J]. Science, 2004, 303(5665):1805-1810.
[14]陳奇輝, 張麗, 劉祝祥, 等. 小溪自然保護區嗜鹽及耐鹽菌抗菌活性篩選及生物學特征[J]. 微生物學雜志, 2010, 30(4):7-11.
[15]陳雷, 王光玉, 卜同, 等. 一株中度嗜鹽細菌whb45的鑒定及其抗菌與抗腫瘤活性篩選[J]. 微生物學通報, 2010, 37(1):85-90.
[16]陳義光, 姜怡, 崔曉龍, 等. 具抗腫瘤活性中度嗜鹽菌YIM 80186的分離和系統發育分析[J]. 云南大學學報:自然科學版,2006, 28(5):444-449.
[17]Leite MC, Bezerra AP, de Sousa JP, et al. Evaluation of antifungal activity and mechanism of action of citral against Candida albicans[J]. Evidence-based Complementary and Alternative Medicine, 2014, 2014:378280.
(責任編輯 馬鑫)
Identification of Bacillus sp. LAY and Its Antim icrobial Activity Against Candida albicans
Cao Jianbin Yu Huiying Li Xin
(College of Life Sciences,Yuncheng University,Yuncheng044000)
The goal of this work is to identify a halotolerant bacterium LAY isolated from Yuncheng Salt Lake and study its antimicrobial properties. The strain LAY was identified by 16S rRNA gene sequence analysis. Using Candida albicans as the indicator, the antimicrobial activity of the fermentation broth of strain LAY was detected by cylinder plate method, and meanwhile the effects of different factors on the activities were studied. Morphological and ultra-structural changes of treated cells were observed by scanning electron microscopy(SEM)and transmission electron microscopy(TEM). PCR screening of functional genes were also carried out. The results of phylogenetic analysis indicated that it was a halotolerant bacterium, and characterized as the genus of Bacillus, and named as Bacillus sp. LAY. The observation by electron spectroscopy discovered that morphological and ultra-structural changes of C. albicans after treatment by fermentation broth of Bacillus sp. LAY were significant. Antimicrobial properties of the strain LAY indicated that the activity of fermentation broth was stable, and showed excellent tolerance towards temperature, pH, NaCl and ultraviolet. Using specific primers, a gene for polyketide synthase(PKS)was detected by PCR technique, indicating that the strain LAY possessed the potential of producing polyketide. In conclusion, results from the study showed that extremophiles from salt lake might be developed as a potential new source of antimicrobial active substances.
halotolerant bacteria;Bacillus;Candida albicans;antimicrobial activity;functional gene
10.13560/j.cnki.biotech.bull.1985.2015.09.023
2015-01-14
國家青年科學基金項目(31300002),運城學院博士啟動基金項目(YQ-2011043)
曹建斌,男,碩士,講師,研究方向:分子生物學;E-mail:caojianbin2006@126.com
李新,男,博士,副教授,研究方向:極端微生物學;E-mail:lixin-eva@163.com

