洋蔥伯克霍爾德氏菌Lu10-1產脂肪酶發酵條件優化及酶學性質研究
張瑤路國兵周波王冰牟志美
(1. 山東農業大學林學院,泰安 271018;2. 山東農業大學生命科學學院,泰安 271018)
洋蔥伯克霍爾德氏菌Lu10-1產脂肪酶發酵條件優化及酶學性質研究
張瑤1,2路國兵1周波2王冰2牟志美1
(1.山東農業大學林學院,泰安271018;2.山東農業大學生命科學學院,泰安271018)
旨在對洋蔥伯克霍爾德氏菌(Burkholderia cepacia)Lu10-1產脂肪酶的發酵條件及酶學性質進行研究。通過單因素和正交實驗探討了碳源、氮源、誘導物、初始pH值、溫度等主要發酵參數的影響,并初步考察了溫度、pH、金屬離子和有機溶劑等對其催化反應的影響。結果表明,B. cepacia Lu10-1產脂肪酶最佳培養基組成和發酵參數為:可溶性淀粉1.5%,蛋白胨1.5%,橄欖油3 g/L,K2HPO42 g/L,發酵溫度32℃,初始pH 9.0,培養48 h酶活達12.4 U/mL,比初始酶活提高了2.7倍。酶的最適溫度和pH值分別為60℃和9,在60℃以下保持100 h酶活仍保持在80%以上,在pH5.0-10.0之間活性穩定,對甲醇、乙醇等有機溶劑耐受性好。
脂肪酶;洋蔥伯克霍爾德氏菌;發酵條件優化;酶學性質
脂肪酶(Lipase,EC3.1.1.3),又稱三酰基甘油水解酶,不僅催化酯水解反應還能催化酯合成反應和轉酯反應,為重要的工業酶之一,廣泛應用于生物能源、油脂工業、食品加工、皮革絹紡原料脫脂、洗滌工業、醫藥及飼料工業等諸多領域[1-3]。洋蔥伯克霍爾德氏菌(Burkholderia cepacia)脂肪酶在酶法催化生產生物柴油中極具應用前途[4,5]。然而,目前脂肪酶的生產成本問題成為酶法制備生物柴油的最大制約因素,優良產酶菌種的發酵工藝優化已成為提高脂肪酶產量和質量的關鍵途徑。本實驗室在前期分離鑒定了產脂肪酶的洋蔥伯克霍爾德氏菌Lu10-1[6]。本研究擬采用單因素和正交試驗對Lu10-1的產酶條件進行優化,并考察該酶的酶學性質,旨在為進一步提高脂肪酶的市場競爭力和拓寬其工業應用范圍奠定基礎。
1 材料與方法
1.1 材料
1.1.1 菌種 洋蔥伯克霍爾德氏菌B. cepacia Lu10-1由本實驗室保藏。
1.1.2 培養基 種子培養基(g/L):蛋白胨 10,牛肉浸提物 5,NaCl 5,pH值7.0。
發酵基礎培養基(g/L):蛋白胨10,蔗糖5,K2HPO42,橄欖油10,MgSO40.5,pH值7.0。
1.2 方法
1.2.1 培養方法 種子培養:將活化菌種接種到10 mL種子培養基中,32℃、200 r/min培養12 h。發酵培養:根據實驗方案改變培養基組成及培養條件,按5%接種量將上述種子液接入50 mL發酵培養基中,32℃、200 r/min培養48 h。
1.2.2 單因素優化 改變發酵基礎培養基組分如下:(1)碳源:可溶性淀粉、蔗糖、乳糖、葡萄糖、甘油(濃度設0.5%、1.0%、1.5%三水平);(2)氮源:蛋白胨、酵母粉、(NH4)2SO4、NaNO3、尿素(濃度設1.0%、1.5%、2%三水平);(3)橄欖油添加量為1 g/L、2 g/L、3 g/L、4 g/L四水平;(4)K2HPO4:1 g/L、1.5 g/L、2 g/L、2.5 g/L、3 g/L;(5)金屬離子:CaCl2、MgCl2、CuCl2、MnCl2、ZnCl2(濃度設1 mmol/L、2.5 mmol/L兩水平)。
改變發酵條件如下:(1)培養溫度設25℃、28℃、30℃、32℃、37℃五個水平;(2)pH設7.5、8.0、8.5、9.0、9.5五個水平。每個實驗組只改變一個因素,其他條件一致。
1.2.3 正交試驗 在以上單因素的基礎上,設計正交試驗來優化發酵條件,采用“四因素三水平”方案,選取4個對產酶影響顯著的因素進行實驗。
1.2.4 分析方法
1.2.4.1 菌體生物量測定 采用分光光度計檢測菌液在600 nm波長處的吸光度值,即OD600,以此測定菌體的生物量。
1.2.4.2 脂肪酶酶活測定 脂肪酶的酶活力測定采用以橄欖油為反應底物的堿式滴定法[7]。酶活單位(U)定義為:在pH 7.0、50℃條件下,1 min內水解產生1 μmoL的的游離脂肪酸所需的酶量。
1.2.4.3 最適反應溫度及熱穩定性測定 以橄欖油為底物,50 mmol/L磷酸鉀緩沖液(pH8.0),在不同溫度(35-80℃)測定脂肪酶活力,以酶活最高為100%,其余酶活與之相比計算相對酶活。將脂肪酶粗酶液放置于50-80℃)的水浴保溫,每隔一定時間將部分酶液取出,立即冰浴冷卻,測定殘留酶活。
1.2.4.4 最適反應pH值及pH穩定性測定 以50 mmol/L的Na2HPO4/檸檬酸(pH4.0-6.0)、K2HPO4/ KH2PO(4pH6.5-8.5)和NaHCO3/Na2CO(3pH9.0-11.0)緩沖液為酶活測定緩沖液,在37℃測定脂肪酶酶活,考察酶的最適作用pH。將酶在不同pH值(pH5.0-11.0)的緩沖液中,于37℃下放置24 h后測殘余脂肪酶酶活,以初始未保溫(4℃,pH8.0)的酶活為100%,殘余酶活與之相比計算相對酶活。
1.2.4.5 有機溶劑對脂肪酶酶活的影響 5 mL脂肪酶酶液中加入終濃度75%(V/V)不同有機溶劑(甲醇、乙醇、異丙醇、丁醇、丙酮、正己烷、苯),20℃放置18 h后測定酶活。以未加有機溶劑的酶活設為100%,其余酶活與之相比計算相對酶活。
1.2.4.6 表面活性劑對脂肪酶酶活的影響 5 mL脂肪酶酶液中加入不同濃度表面活性劑(Triton X-100、Tween 20、Tween 80、SDS和 TDOC),37℃ 保 溫5 min后測酶活。以未加表面活性劑的酶活設為100%,其余酶活與之相比計算相對酶活。
2 結果
2.1 B. cepacia Lu10-1產脂肪酶發酵條件優化
2.1.1 種子生長曲線和最佳種齡的確定 菌體生長分為延遲期、對數期、穩定期和消亡期4個時期。由圖1可知,0-6 h為菌體生長延遲期,菌株在6 h以后開始進入快速生長的對數期,并在10 h后進入穩定期,隨后菌體生長速度逐漸放慢,在有限的空間內,菌體生長達到飽和。選擇對數中后期的菌種最為合適,即可以確定生長8-10 h的種子為最佳種齡。
2.1.2 碳源對B. cepacia Lu10-1產脂肪酶酶活的影響 培養基中碳源是最重要的組成部分。分別以0.5%、1.0%,1.5%三個水平的可溶性淀粉、蔗糖、乳糖、葡萄糖、甘油為碳源,其他條件一致,測定酶活力,將最大脂肪酶活力設為100%,在30℃,200 r/min搖瓶發酵48 h以確定碳源對B. cepacia Lu10-1發酵產酶的影響,結果見圖2。可溶性淀粉對B. cepacia Lu10-1產脂肪酶促進作用最大,且最適濃度為1%;而乳糖和甘油作碳源時產酶酶活相對較小,不適合作培養基中的碳源。因而,選擇1%可溶性淀粉為碳源最適于脂肪酶產量的提高。
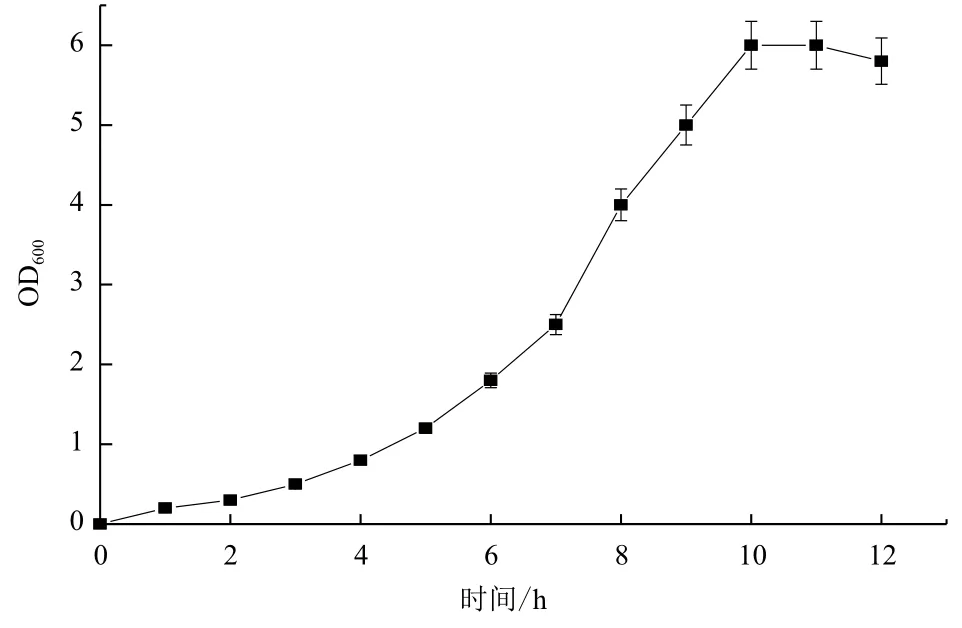
圖1 B. cepacia Lu10-1種子生長曲線
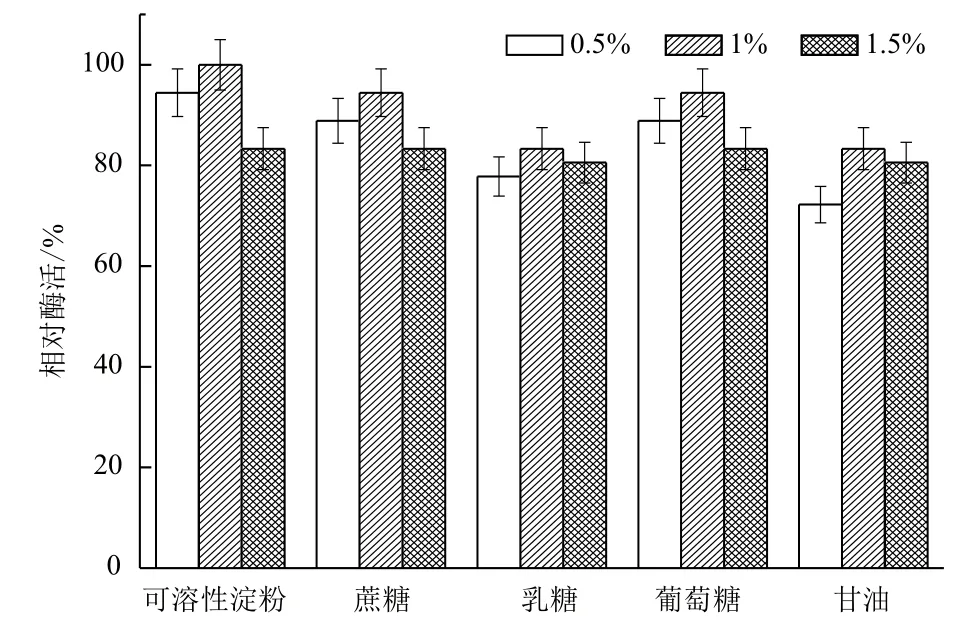
圖2 碳源對B. cepacia Lu10-1產脂肪酶酶活的影響
2.1.3 氮源對B. cepacia Lu10-1產脂肪酶酶活的影響 培養基中除了碳源外,氮源也很關鍵。分別以1.0%、1.5%、2.0%三個水平的蛋白胨、酵母粉、(NH4)2SO4、NaNO3、尿素為氮源,其他條件一致,測定酶活力。由圖3可知,蛋白胨對于B. cepacia Lu10-1產酶作用效果最好,且最適濃度為1.5%;其次是酵母粉,而(NH4)2SO4、NaNO3作氮源時產酶酶活只有50%-60%,不適合作發酵培養基的氮源。
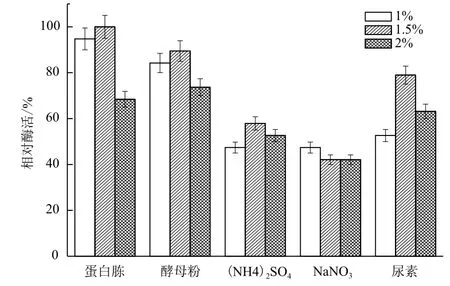
圖3 氮源對B. cepacia Lu10-1產脂肪酶酶活的影響
2.1.4 橄欖油添加量對B. cepacia Lu10-1產脂肪酶酶活的影響 橄欖油是脂肪酶作用的底物,也常作為脂肪酶表達的誘導物,其使用量對脂肪酶誘導表達效果影響很大。發酵培養基中橄欖油的添加量對B. cepacia Lu10-1發酵產酶的影響結果見圖4。由圖4可知,初始脂肪酶活性隨橄欖油添加量增大而提高,橄欖油添加量在3 g/L時產酶活力最大,隨后橄欖油添加量增多反而使脂肪酶活力降低。
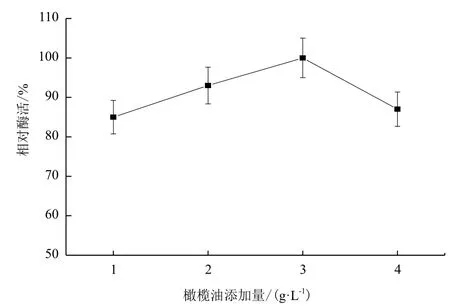
圖4 橄欖油添加量對B. cepacia Lu10-1產脂肪酶酶活的影響
2.1.5 K2HPO4對B. cepacia Lu10-1產脂肪酶酶活的影響 菌株B. cepacia Lu10-1在不同濃度K2HPO4的培養基中,產酶情況差異不大(圖5)。在2 g/L K2HPO4的培養基中,菌株產酶能力達到最大值。
2.1.6 金屬離子對B. cepacia Lu10-1產脂肪酶酶活的影響 為確定金屬離子對B. cepacia Lu10-1產酶是否有影響,分別將1.0 mmol/L和2.5 mmol/L的CaCl2、MgCl2、CuCl2、MnCl2、ZnCl2添加到發酵培養基中,30℃,200 r/min培養36 h后測酶活結果見圖6。將最大脂肪酶活力設為100%,由圖6可知不同金屬離子對菌體產脂肪酶的作用不盡相同,Ca2+、Mg2+、Cu2+、Mn2+、Zn2+對脂肪酶均沒有促進作用,其中1 mmol/L的CaCl2的抑制作用最大。
圖5 K2HPO4對B. cepacia Lu10-1產脂肪酶酶活的影響
圖6 金屬離子對B. cepacia Lu10-1產脂肪酶酶活的影響
2.1.7 溫度對B. cepacia Lu10-1產脂肪酶酶活的影響 溫度是菌體生長和蛋白合成分泌的重要影響因素。分別在25℃、28℃、30℃、32℃、35℃,200 r/min條件下搖瓶培養48 h測定菌體生長和產酶情況,結果見圖7。由圖7可知,溫度過低,使菌體生長緩慢;隨溫度升高,菌體生長產酶速度加快;在32℃下酶活力達到最大值,但溫度過高會導致酶活降低。因此,32℃為菌體生長和產酶的最適溫度。
圖7 溫度對B. cepacia Lu10-1產脂肪酶酶活的影響
2.1.8 初始pH值對B. cepacia Lu10-1產脂肪酶酶活的影響 pH值也影響微生物代謝和產物合成的另一重要因素。圖8結果顯示,控制初始pH在8.0-9.0有利于菌株生長和產酶,初始pH在8.0時菌體生長最快,在pH9.0時酶活最高,綜合考慮最適產酶發酵培養基的pH值為9.0。
圖8 初始pH值對B. cepacia Lu10-1產脂肪酶酶活的影響
2.1.9 正交試驗 在上述單因素的基礎上,設計正交試驗來優化發酵條件,采用“四因素三水平”方案,選取可溶性淀粉、蛋白胨、橄欖油乳化液、pH對產酶影響顯著的因素進行實驗。具體實驗設計方案如表1所示。
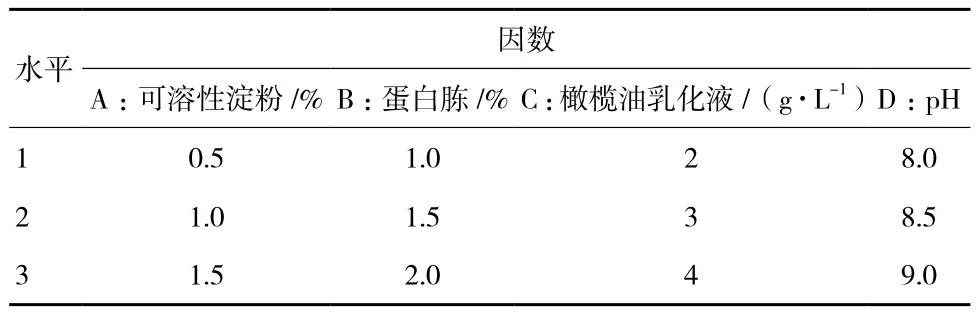
表1 正交實驗設計方案
正交試驗結果及極差分析如表2所示。極差值的大小表明該因素水平的改變對結果的影響大小,極差值越大,該因素對脂肪酶產量的影響就越大。由表2極差值大小,各因素對脂肪酶產量的影響從大到小依次為:蛋白胨、橄欖油乳化液、可溶性淀粉、pH。為了獲得最高產量,應選擇的最優組合是A3B2C2D3,即可溶性淀粉1.5%,蛋白胨1.5%、橄欖油乳化液3 g/L、pH9。采用此最優組合培養菌體最終酶活達12.4 U/mL,比初始酶活提高2.7倍。
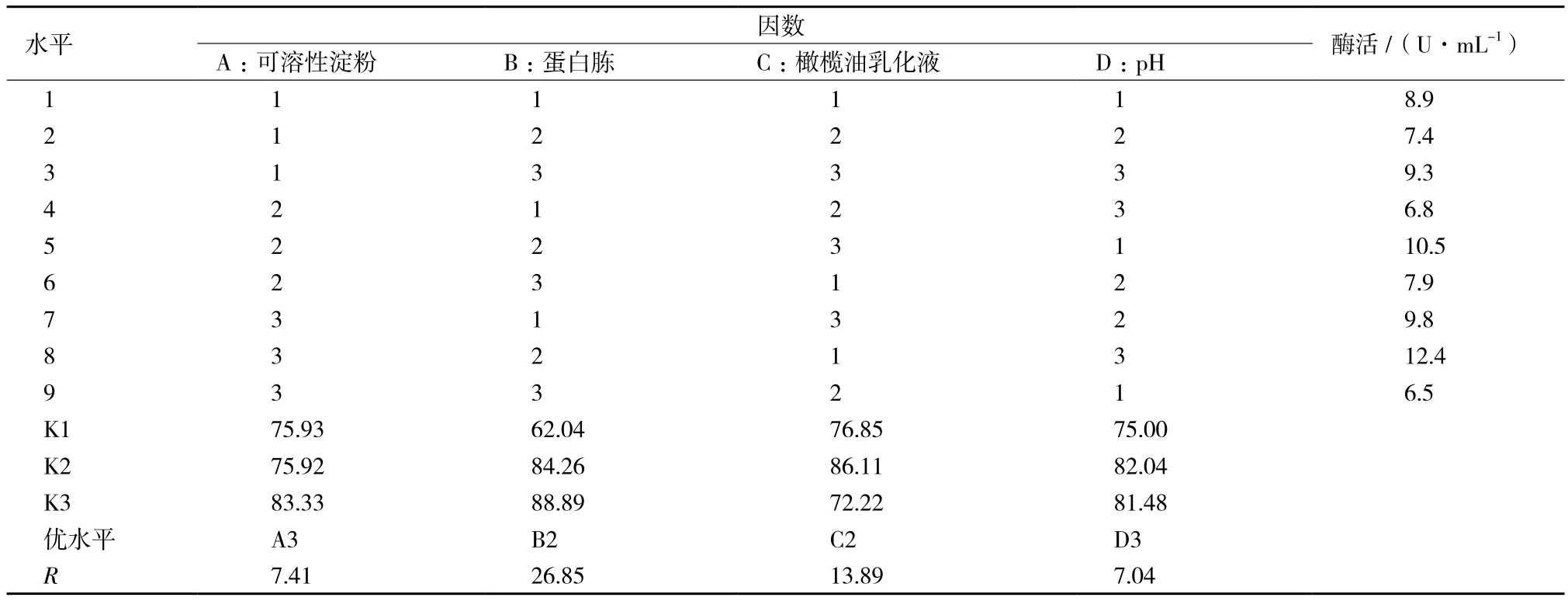
表2 正交實驗結果L9(34)
2.2 B. cepacia Lu10-1脂肪酶的酶學性質
2.2.1 最適溫度及熱穩定性 由于脂肪酶在生物化工、紡織等工業上應用大多需要在高溫條件下進行,因此對B. cepacia Lu10-1脂肪酶的最適溫度和熱穩定性的考察十分必要。B. cepacia Lu10-1脂肪酶在35-80℃范圍內的酶活力測定結果見圖9-A。隨著溫度的升高,酶活力也逐漸升高,在溫度達到60℃時酶活最高;而當溫度繼續上升后,酶活力逐漸下降,可能是由于高溫造成了酶蛋白逐漸變性。由圖9-A可知,酶作用的最適溫度為60℃,在此溫度下酶活力達到最高,以該值作100%脂肪酶活力,50℃、70℃時脂肪酶相對活力都能達到80%,80℃時酶幾乎失活,只有10%的相對酶活。將B. cepacia Lu10-1脂肪酶分別于50℃、60℃、70℃和80℃下保溫,考察其熱穩定性,結果如圖9-B,該酶在60℃以下比較穩定,保溫100 h后仍有80%以上的活性;在70℃下保溫30 h,酶活殘留60%左右,保溫100 h,酶活仍可達50%以上;80℃下保溫8 h后,酶活力基本喪失。
2.2.2 最適pH及pH穩定性 將脂肪酶活力測定緩沖液體系分別調至不同的pH,以最高酶活點為相對酶活100%,相對酶活與pH的關系如圖10-A所示。結果表明B. cepacia Lu10-1脂肪酶的最適pH為9.0。為考察B. cepacia Lu10-1脂肪酶的pH穩定性,將其置于pH 5.0-11.0的緩沖體系中37℃保溫24 h后,測定殘留酶活。由圖10-B可知,脂肪酶在pH6.0-9.0范圍內均具有很好的穩定性,相對酶活力均保持在95%以上;在pH5.0-11.0范圍內保溫24 h,酶活仍可保持在70%以上;而當pH大于10時,脂肪酶穩定性急劇下降。
2.2.3 表面活性劑對B. cepacia Lu10-1脂肪酶酶活的影響 表面活性劑對脂肪酶的影響成為應用的關鍵。洗滌劑中主要使用的是非離子表面活性劑和陰離子表面活性劑,本研究考察常用的非離子表面活性劑Triton X-100、Tween 20、Tween 80和陰離子表面活性劑SDS、TDOC對B. cepacia Lu10-1脂肪酶活性的影響。結果(圖11)表明,在1 mmol/L或10 mmol/L濃度下,Triton X-100、Tween 20、Tween 80和SDS對脂肪酶活性均有抑制作用,其中Tween 20的抑制作用最明顯;TDOC對脂肪酶有一定程度的激活作用,其中10 mmol/L的TDOC使脂肪酶活力提高28.7%。

圖9 B. cepacia Lu10-1脂肪酶的最適溫度(A)及熱穩定性(B)
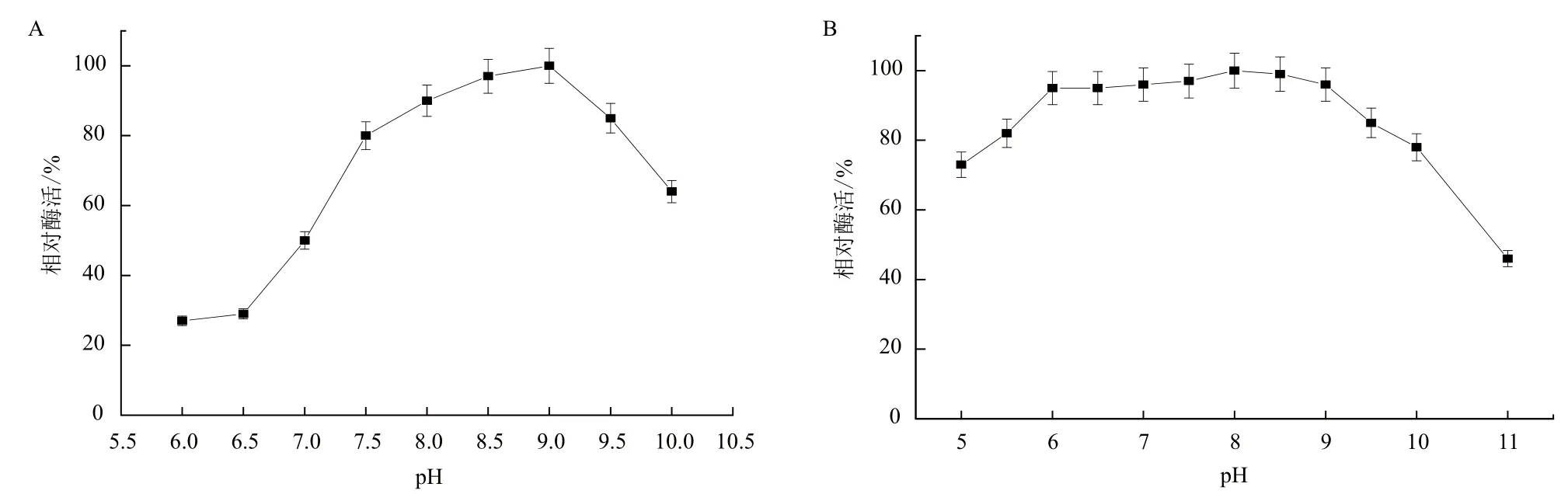
圖10 B. cepacia Lu10-1脂肪酶的最適pH(A)和pH穩定性(B)
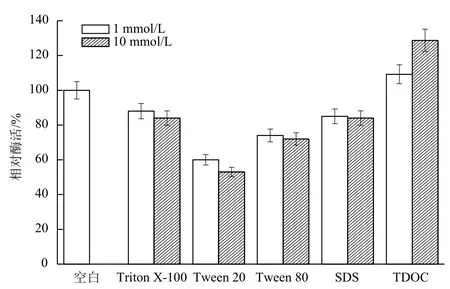
圖11 表面活性劑對B. cepacia Lu10-1脂肪酶酶活的影響
2.2.4 有機溶劑對B. cepacia Lu10-1脂肪酶酶活的影響 生物柴油的生產在有機相中進行,這就要求參與生產的脂肪酶具有良好的有機溶劑耐受性。將B. cepacia Lu10-1脂肪酶在終濃度75%的常用有機溶劑中于20℃保溫18 h,考察其在有機溶劑中的穩定性。由圖12可知,Lu10-1脂肪酶在甲醇、乙醇、丙酮、正己烷、苯中均具有較好的穩定性,而在異丙醇、丁醇中穩定性較差。Lu10-1脂肪酶在有機溶劑尤其是甲醇、乙醇中良好的穩定性,使其在生物柴油制造方面顯示出巨大的潛力。
3 討論
目前,脂肪酶的大規模工業應用仍然受制于酶活低和生產成本高的限制。通過改良發酵參數,創造適合菌體生長和產酶的最佳條件以提高酶產量,降低生產成本在工業上有重要意義。影響微生物脂肪酶發酵的因素主要有:碳源、氮源、誘導劑、金屬離子、發酵溫度、pH等。在碳源方面,淀粉等碳水化合物對B. cepacia Lu10-1脂肪酶發酵有很好的促進作用;在氮源方面,有機氮源相對于無機氮源能更好地促進B. cepacia Lu10-1發酵產酶;在誘導劑方面,最適濃度的橄欖油可大大提高B. cepacia Lu10-1脂肪酶的產量;在金屬離子方面,Ca2+、Mg2+、Cu2+、Mn2+、Zn2+對B. cepacia Lu10-1脂肪酶均沒有促進作用,這與Rashid等[8]研究發現Ca2+能顯著提高Pseudomonas sp. KB700A低溫脂肪酶產量的結果不一致。采用正交設計法對B. cepacia Lu10-1脂肪酶的培養基組成和發酵條件進行優化,篩選獲得適宜發酵產酶的最優組合,使B. cepacia Lu10-1脂肪酶產量顯著提高。
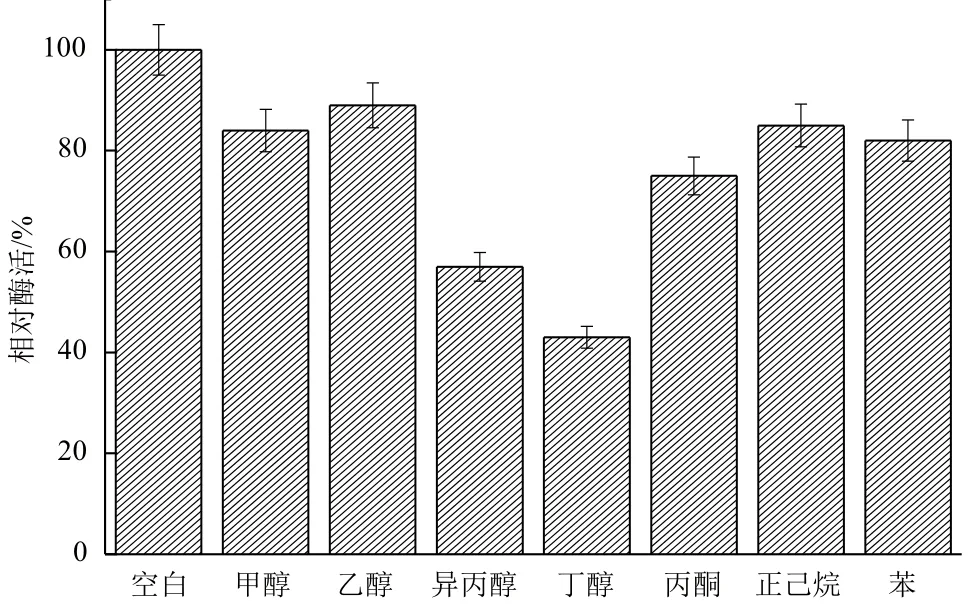
圖12 有機溶劑對B. cepacia Lu10-1脂肪酶酶活的影響
脂肪酶作為重要的工業用酶之一,其酶學性質也備受關注。不同來源脂肪酶,其適宜溫度、作用pH及酶的抑制劑和激活劑等都有較大差異。因此考察B. cepacia Lu10-1脂肪酶的酶學性質具有較高的理論價值和應用價值。一般微生物脂肪酶最適溫度在30-40℃之間[9,10]。本研究報道的B. cepacia Lu10-1脂肪酶具有較高的作用溫度為60℃,而且穩定性很好,60℃以下保溫100 h仍保持80%以上的酶活。大多數細菌脂肪酶作用pH在中性或堿性范圍內[10]。本研究報道B. cepacia Lu10-1脂肪酶的最適pH為9.0,有較寬的pH穩定性,在pH5.0-10.0之間內保溫24 h酶活均超過70%。此外,該酶還表現為較好的耐醇性,在甲醇、乙醇、丙酮、正己烷、苯中保溫18 h仍能保持75%以上的活性。由此可見,B. cepacia Lu10-1脂肪酶具有熱穩定性好、pH穩定范圍寬以及良好的有機溶劑耐受性,已經具備了作為工業用酶的條件,應用前景廣闊。
4 結論
B. cepacia Lu10-1適宜發酵產脂肪酶的培養基組成和發酵參數為:可溶性淀粉1.5%,蛋白胨1.5%,橄欖油3 g/L,K2HPO42 g/L,發酵溫度32℃,初始pH 9.0,培養48 h酶活達12.4 U/mL,比初始酶活提高了2.7倍。B. cepacia Lu10-1脂肪酶的最適溫度和pH值分別為60℃和9,60℃以下保溫100 h仍保持80%以上的酶活,在pH5.0-10.0之間內保溫24 h酶活均超過70%,在甲醇、乙醇、丙酮、正己烷、苯中保溫18 h酶活保持75%以上。
[1] Hasan F, Shah AA, Hameed A. Industrial applications of microbial lipase[J]. Enzyme and Microbial Technology, 2006, 9:235-251.
[2] Jaeger KE, Reetz MT. Microbial lipases form versatile tools for biotechnology[J]. Trends in Biotechnology, 1998, 16(9):396-403.
[3] Jaeger KE, Eggert T. Lipases for biotechnology[J]. Current Opinion in Biotechnology, 2002, 13(4):390-397.
[4] Yang J, Guo D, Yan Y, et al. Cloning, exp ression and characterization of a novel thermal stable and short-chain alcohol tolerant lipase from Burkholderia cepacia strain G63[J]. Journal of Molecular Catalysis B-Enzymatic, 2007, 45(3-4):91-96.
[5] 賈彬, 劉文山, 楊江科, 等. 洋蔥伯克霍爾德菌脂肪酶的基因改造及其在畢赤酵母中組成型和誘導型的表達[J]. 微生物學報, 2010, 50(9):1194-1201.
[6] Ji X, Lu G, Gai Y, et al. Colonization of Morus alba L. by the plant growth-promoting and antagonistic bacterium Burkholderia cepacia strain Lu10-1[J]. BMC Microbiology, 2010, 10:243-254.
[7] Van HE, Litthauer D, Verger R. Biochemical characterisation and kinetic properties of a purified lipase from Aspergillus niger in bulk phase and monomolecular films[J]. Enzyme and Microbial Technology, 2002, 30(7):902-909.
[8] Rashid N, Shimada Y, Ezaki S, et al. Low-temperature lipase from psychrotrophic Pseudomonas sp. strain KB700A[J]. Applied and Environmental Microbiology, 2001, 67(9):4064-4069.
[9] 劉光燁, 盧世珩. 煙色紅曲霉耐熱解脂酶的形成及特性[J].微生物學報, 1995, 35(2):109-114.
[10] 惲麗紅. Burkholderia mana SYBC LI-1產脂肪酶發酵條件優化及酶學性質研究[D]. 無錫:江南大學, 2008.
(責任編輯 李楠)
Optim ization of Fermentation and Enzymatic Characterization of Lipase-producing Burkholder cepacia Lu10-1
Zhang Yao1,2Lu Guobing1Zhou Bo2Wang Bing1Mu Zhimei1
(1. College of Forestry,Shandong Agricultural University,Taian271018;2. College of Life Science,Shandong Agricultural University,Taian271018)
It is aimed to optimize the fermentation conditions of lipase-producing Burkholder cepacia Lu10-1 and analyze its enzymatic properties. The single factor and orthogonal experiments were adopted to study the major factors that affected the lipase yield, such as carbon,nitrogen, inducer, initial pH, temperature, etc. The impact of temperature, pH, metal ion, and organic solvents on lipase catalytic reaction was also primarily investigated. The optimal medium and culture conditions were as follows: soluble starch 1.5%, peptone 1.5%, olive oil 3 g/L, K2HPO42 g/L, temperature 32℃, initial pH 9.0, and fermentation time 48 h, the enzyme activity reached 12.4 U/mL, increased 2.7-fold compared to the initial activity. The optimal temperature and pH were 60℃ and 9.0 respectively. The lipase was stable under 60℃ for 100 h remaining over 80% of the activity and it was also stable at pH 5.0-10.0. Moreover, the lipase had solid tolerance to organic solvent such as methanol and ethanol.
lipase;Burkhoideria cepacia;fermentation;enzymatic characterization
10.13560/j.cnki.biotech.bull.1985.2015.09.027
2014-12-20
中國博士后科學研究基金(2013M531641),山東農業大學博士后基金(76363),山東農業大學青年科技創新基金(23786)
張瑤,女,博士,講師,研究方向:微生物學;E-mail:yaozhang@sdau.edu.cn
牟志美,女,教授,研究方向:微生物學;E-mail:lz20011022@126.com

