發酵法生產蝦青素的 研究進展
蔡 俊,游智能
(湖北工業大學 發酵工程教育部重點實驗室,工業發酵湖北省協同創新中心,湖北 武漢 430068)
發酵法生產蝦青素的研究進展
蔡俊,游智能
(湖北工業大學 發酵工程教育部重點實驗室,工業發酵湖北省協同創新中心,湖北 武漢430068)
蝦青素(astaxanthin)是一種類胡蘿卜素,具有很強的抗氧化活性,抗癌功能,顯著的著色能力以及增強免疫力等功能。本文介紹了蝦青素的生物活性及其在食品、化妝品、保健品、水產養殖和醫藥等領域的應用,并著重對蝦青素的發酵法生產研究現狀進行了綜述,提出了蝦青素未來的主要研究方向,以期為蝦青素的研究開發和綜合利用提供理論依據。
蝦青素;生物活性;發酵
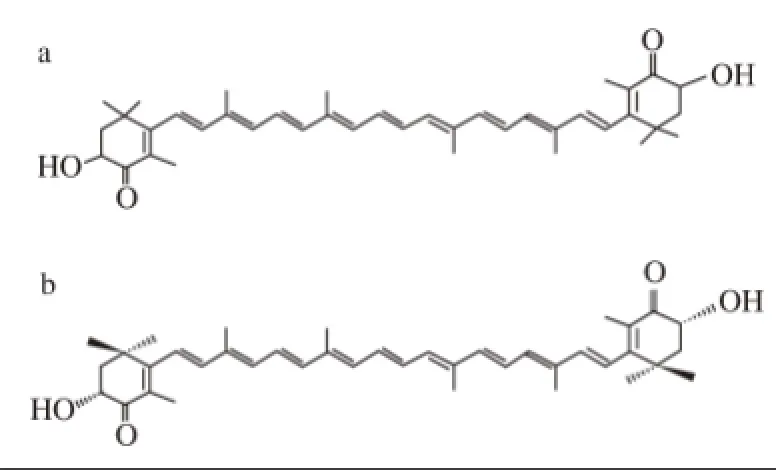
蝦青素(astaxanthin)是一種類胡蘿卜素,分子式C40H52O4,摩爾質量596.86 g/mol,全稱3,3'-二羥基-β,β'-胡蘿卜素-4,4'-二酮(圖1a),有(3R, 3'R)、(3R,3'S)、(3S, 3'S)3 種旋光異構體(圖1b~1d),化學結構見圖1。Andrewes等[1-2]研究發現紅球藻和磷蝦卵中蝦青素的構象為(3S, 3'S),1975年又分析了紅法夫酵母中蝦青素的構象,發現92%的異構體是(3R, 3'R)。蝦青素具有很強的抗氧化活性,抗癌功能,顯著的著色能力以及增強免疫力等功能,在水產養殖、食品、化妝品、醫藥和保健品等領域均被利用[3-10]。
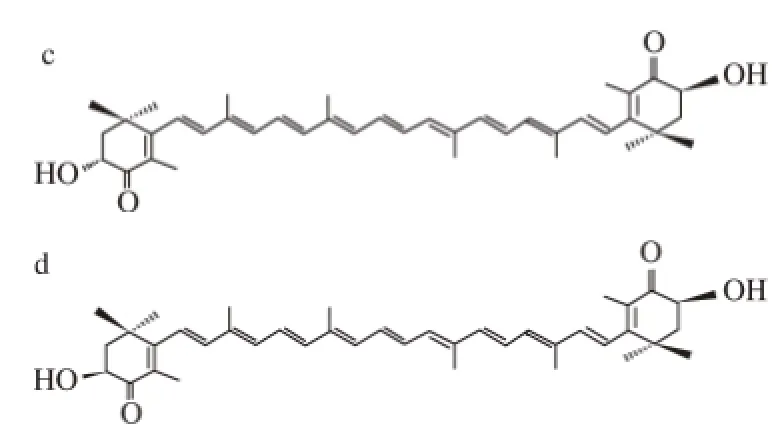
圖1 蝦青素的化學結構式(a)和3 種旋光異構體(b~d) [11--22]Fig.1 Chemical structure (a) and three stereoisomers (b-d) of astaxanthin[1-2]
目前,蝦青素的生產主要有3 種方法:化學合成法、提取法和微生物發酵法(表1)。化學合成法具有生產成本較低,產量高等優點,但是合成的蝦青素多為順式結構,而動物機體只對反式蝦青素有較高的吸收利用率;提取法主要從水產品加工的廢棄物中提取蝦青素,提取前必須除去廢棄物中的石灰質成分,提取費用高且容易污染;微生物發酵法主要有兩種方式:一是利用藻類生產;二是利用酵母發酵生產,發酵法生產的蝦青素天然無污染,但受到成本高、培養條件苛刻、產量低等因素的制約[11-12]。筆者參考近年來國內外有關文獻對蝦青素的生物活性及應用進行了概述,并著重綜述了蝦青素的發酵法生產研究現狀,提出了蝦青素未來的主要研究方向,以期為蝦青素的研究開發和綜合利用提供理論依據。
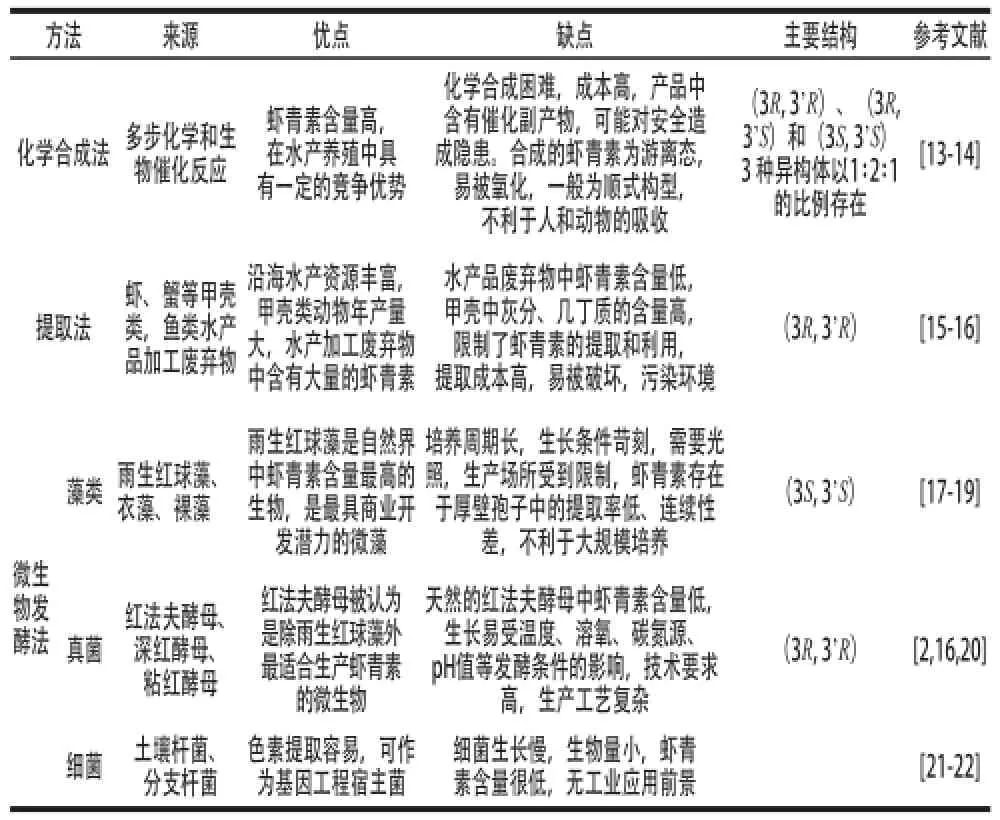
表1 蝦青素的生產方法Table 1 Comparison of production methods for astaxanthin
1 蝦青素的生物活性及應用現狀
蝦青素具有抗氧化、抗癌、增強免疫力、預防神經系統及心血管疾病、提高動物繁殖能力和存活率、著色等功能,已被廣泛接受和應用。
1.1蝦青素的生物活性
1.1.1抗氧化
蝦青素是一種非VA原的類胡蘿卜素,其獨特共軛雙烯以及不飽和羰基的化學結構賦予了它超強的抗氧化活性,其淬滅活性氧和捕捉自由基的能力是其他類胡蘿卜素的10 倍以上,是VE的80~550 倍[23],所以有“超級VE”之稱。Kiyotaka等[24]通過隨機、雙盲人體實驗證明了蝦青素有助于改善紅細胞抗氧化性能,降低磷脂氫過氧化物水平;Lee等[25]比較了番茄紅素、玉米黃素、葉黃素、異玉米黃素和蝦青素5 種類胡蘿卜素在豆油光氧化作用中活性氧能力,發現蝦青素淬滅活性氧能力最強。
1.1.2抗癌
研究發現,蝦青素具有比β-胡蘿卜素等類胡蘿卜素更強的抑制癌變的能力。Kim等[26]通過對被注入易引起胃潰瘍性病變的萘普生小鼠的研究發現,隨著飼喂蝦青素,小鼠體內的胃潰瘍不斷減少甚至消失,防止了胃癌的發生。另外許多相關研究表明蝦青素對由黃曲霉毒素誘發的肝癌、口腔癌、膀胱癌、結腸癌、皮膚癌和乳腺癌等癌癥都有著一定的預防和治療作用[27-31]。
1.1.3增強免疫力
蝦青素具有很強的誘導細胞分裂活性,在機體內能起免疫調節作用[32]。Park等[33]研究發現蝦青素能增強貓體內外周血單個核細胞增殖和細胞毒活性能力,并可以提高血漿免疫球蛋白和抗體的濃度。Boon等[34]研究表明蝦青素能增強狗機體的免疫力。
1.1.4預防神經系統及心血管疾病
蝦青素可以有效治療脊髓損傷、Parkinson綜合征、Alzheimer綜合征等中樞神經系統疾病[35-36]。研究發現蝦青素能明顯降低血液中低密度脂蛋白膽固醇(low density lipoprotein-cholesterin,LDL-C)的水平,防止心血管疾病的發生,而其他類胡蘿卜素如β-胡蘿卜素對LDL-C沒有明顯的影響[37]。
1.1.5提高動物繁殖能力和存活率
蝦青素在動物生殖過程中的作用類似于激素[38],蝦青素可作為受精卵激素改善卵質,保護受精卵抵御惡劣的環境,促進卵的成熟,減少胚胎死亡,提高生殖能力。Torrissen等[39]發現成年鮭、鱒魚類在某些特定水域中不能繁衍后代,原因是它們產的卵子中和魚苗體內缺乏蝦青素,所以蝦青素及其他類胡蘿卜素可能是通過提高動物免疫力來提高存活率的。
1.1.6著色
蝦青素是一種脂溶性色素,能夠不經修飾、轉換直接存儲在組織中[40],所以能使一些鳥類的羽毛及水生動物肌肉皮膚呈紅色或金色。Johnson等[41]在鮭魚等飼料中加入破碎的紅法夫酵母,發現魚體皮膚和肌肉中都積累了大量的蝦青素,顏色亮麗,味道鮮美。蝦青素作為一種著色劑加到畜、禽飼料中,可使禽蛋的蛋黃顏色加深,更有營養價值,增強著色的效果,從而提高市場競爭力。
1.2蝦青素的應用現狀
目前蝦青素主要作為一種功能性色素廣泛應用于水產養殖、食品、化妝品等領域,主要用作魚類、蝦蟹等甲殼類動物以及家禽的飼料添加劑,提高畜禽、魚類的繁殖能力和成活率,改善健康狀況,優化體色肉質。天然蝦青素已被作為食品添加劑用于食品的著色、保鮮及增強營養。Bjerkeng等[42]研究表明蝦青素有助于鱒魚片的保鮮。近年隨著蝦青素生物功能研究和藥理藥效實驗的不斷深入,蝦青素因其在心血管疾病、癌癥、代謝綜合征、糖尿病、神經退行性疾病、眼科疾病、皮膚病等疾病的預防和治療中具有突出的效果而受到了科學界極大的關注,表明蝦青素在醫藥、保健品等領域中具有巨大的潛在應用價值和廣闊開發前景[43-45]。
2 發酵法生產蝦青素的研究進展
當前利用發酵法生產蝦青素主要有兩種方式:一是利用藻類生產;二是利用酵母發酵生產蝦青素。
2.1利用藻類生產蝦青素
自然界中一些藻類如衣藻(Chlamydomonas)、傘藻(Acetabularia)、裸藻(Euglena)中含有蝦青素。雨生紅球藻(Haematococcus pluvialis)是天然蝦青素含量最高的生物,達10~40 mg/g,因而是目前生產蝦青素的主要藻類。在脅迫條件下,雨生紅球藻能誘導積累蝦青素,積累量可達藻細胞干質量的1.0%~5.0%,且所含蝦青素的結構多為反式結構,被公認為天然蝦青素的最佳生物來源[46-47]。
2.1.1雨生紅球藻的生物特性[48-49]
雨生紅球藻是一種淡水單細胞綠藻,屬于綠藻門,團藻目,紅球藻科,紅球藻屬,能夠進行光合自養和化能異養,且兩種營 養方式可同時進行,藻細胞在適宜的生長條件下為運動細胞,在脅迫條件下,如受到強光照射,缺氮、磷等因素的刺激,由運動細胞變為不動細胞,此時開始大量積累蝦青素。蝦青素在葉綠體內合成,然后轉運、貯存到細胞質內的脂質液泡中。
2.1.2雨生紅球藻培養技術生產蝦青素的研究現狀
雨生紅球藻培養技術的研究從20世紀90年代初就開始了,國外研究比較多,國內相對較少。目前雨生紅球藻培養技術的研究主要集中在兩個方面:一是提高生物量,包括培養基、培養方法的優化和確定最佳的培養條件等基礎性研究;二是誘導蝦青素的合成,即在較高生物量的基礎上,改善營養和環境條件,誘導細胞大量合成蝦青素[50]。雨生紅球藻的培養方法主要包括分批培養、補料培養、兩步培養和半連續培養,在實際的操作過程中有時混合使用各種培養方法以提高蝦青素產量[51]。
2.1.3雨生紅球藻培養技術生產蝦青素的展望
侯冬梅[52]對雨生紅球藻產蝦青素的光誘導工藝的基本條件及營養成分對誘導積累蝦青素的效果進行了研究和戶外驗證,初步確定了戶外雨生紅球藻光誘導的基本工藝,并發現雨生紅球藻固定化吸附誘導需水量少,難受到原生動物的污染,具有成本低、節省水資源、環保等優點。
盡管利用雨生紅球藻生產蝦青素已經成為國內外蝦青素研究的熱點,但依然有許多不足。雨生紅球藻中蝦青素的合成、積累和藻的生長呈相反的趨勢:即當藻細胞生長條件適宜時,蝦青素的合成速率卻較低;當蝦青素快速積累時,環境條件卻不利于藻細胞的生長,導致誘導蝦青素積累的逆境脅迫與藻細胞生物量的增加互成矛盾。而且雨生紅球藻培養周期長,需要光照,生產場所受到限制,藻類破壁釋放蝦青素產率低,雨生紅球藻誘導積累蝦青素的具體機制又尚不清楚,從而限制了大規模化培養雨生紅球藻生產蝦青素[50-52]。
總之,雨生紅球藻的培養技術雖已經應用于商業化生產,但技術還不成熟,仍需要深入細致的研究,可以通過探索雨生紅球藻誘導積累蝦青素的具體機制,從代謝工程和系統生物學的角度進行發酵菌種育種和發酵優化,也可以通過篩選或基因工程技術構建出生長周期短且薄壁的雨生紅球藻細胞來提高蝦青素的產量。
2.2利用酵母發酵生產蝦青素
自然界中含有蝦青素的酵母主要有紅法夫酵母(Phaffia rhodozyma/Xanthophyllomyces dendrorhous)、深紅酵母(Rhodotorula rubra)和粘紅酵母(Rhodotrula glutinis)等。紅法夫酵母中蝦青素含量最多,野生株系中蝦青素達細胞干質量的0.05%,一些突變株系中達0.3%。紅法夫酵母是真菌界、真菌門、半知菌亞門、隱球酵母科、紅法夫酵母屬的唯一種,繁殖方式為無性繁殖中的芽殖,于1970年在美國的阿拉斯加的高山和日本北海道一帶山區落葉松的滲出液中分離得到,可利用有氧呼吸和發酵兩種方式代謝,是目前國內外微生物發酵生產蝦青素普遍采用的真菌[53-55]。
紅法夫酵母可利用多種糖作為碳源發酵生產蝦青素,細胞代謝繁殖快,可實現高密度培養;生產周期短,成本低,天然無污染;細胞壁容易破碎,生產的蝦青素為反式結構,破壁后可直接作為飼料添加劑;被認為是除雨生紅球藻外最為適合生產蝦青素的微生物。然而紅法夫酵母的蝦青素含量遠不如雨生紅球藻,易受溫度、溶氧、碳氮源、pH值等發酵條件的影響。且紅法夫酵母中蝦青素的積累與酵母細胞的生長速率也是一對矛盾,往往在改變發酵條件增加蝦青素的合成、積累量時,菌體量卻相應降低。因此,未來的研究可以通過探究細胞生理功能,選育蝦青素高產菌株,開發廉價發酵培養基,優化發酵工藝來實現紅法夫酵母工業化生產蝦青素。目前國內外許多研究主要集中在蝦青素的生物合成途徑、高產菌株的選育、發酵過程的控制與優化以及蝦青素的提取與檢測等方面。
2.2.1蝦青素的生物合成途徑
紅法夫酵母生物合成蝦青素的途徑分為兩個階段:第一階段為β-胡蘿卜素的合成;第二階段為β-胡蘿卜素通過氧化 及羥基化生成蝦青素[56-57]。比較系統全面的蝦青素生物合成途徑如圖2所示。
異戊烯焦磷酸異構酶(isop entenyl pyrophosphate isomerase)由idi基因編碼,催化烯焦磷酸(IPP)異構化為二甲基烯丙基焦磷酸酯(DMAPP)[59]。從類異戊二烯前體物質到β-胡蘿卜素的過程需要4 種酶:1)四異戊二烯焦磷酸(GGPP合成酶,由crtE基因編碼,能催化3 分子IPP與DMAPP縮合成前體物質C20GGPP[60];2)八氫番茄紅素合成酶(phytoene synthase),由crtYB基因編碼,催化兩分子GGPP縮合形成番茄紅素(lycopene)[61];3)八氫番茄紅素脫氫酶(phytoene desaturase),由crtI基因編碼,主要催化八氫番茄紅素通過一系列脫氫反應生成為番茄紅素[62];4)番茄紅素環化酶(lycopene cyclase),由crtYB基因編碼,催化番茄紅素分子兩端發生兩次環化,依次生成γ-胡蘿卜素和β-胡蘿卜素[61]。最后β-胡蘿卜素經過兩步酶促反應最終生成蝦青素,其中酮化酶(ketolase)催化β-胡蘿卜素分子上引入2 個4位的酮基,羥化酶(hydroxylase)催化引入2 個3位的羥基。在紅法夫酵母細胞中,這兩步反應則通過由crtS基因編碼的蝦青素合成酶來實現,它先對β-胡蘿卜素進行4位的酮化,然后進行3位的羥化[63]。此外,.lvarez等[64]發現細胞色素P450還原酶(由crtR基因編碼)對紅法夫酵母中的crtS基因起輔助作用,可為底物的氧化提供電子。Ukibe等[65]表明在產β-胡蘿卜素的釀酒酵母中單獨表達crtR基因并沒有蝦青素生成,而crtS和crtR基因協同表達時,則有少量的蝦青素累積。紅法夫酵母蝦青素生物合成途徑中部分相關酶及其基因如表2所示。
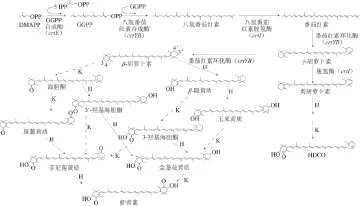
圖2 紅法夫酵母中蝦青素的生物合成途徑[22,5588]Fig.2 Biosynthetic pathway leading to astaxanthin formation in Phaffi a rhodozyma[2,58]
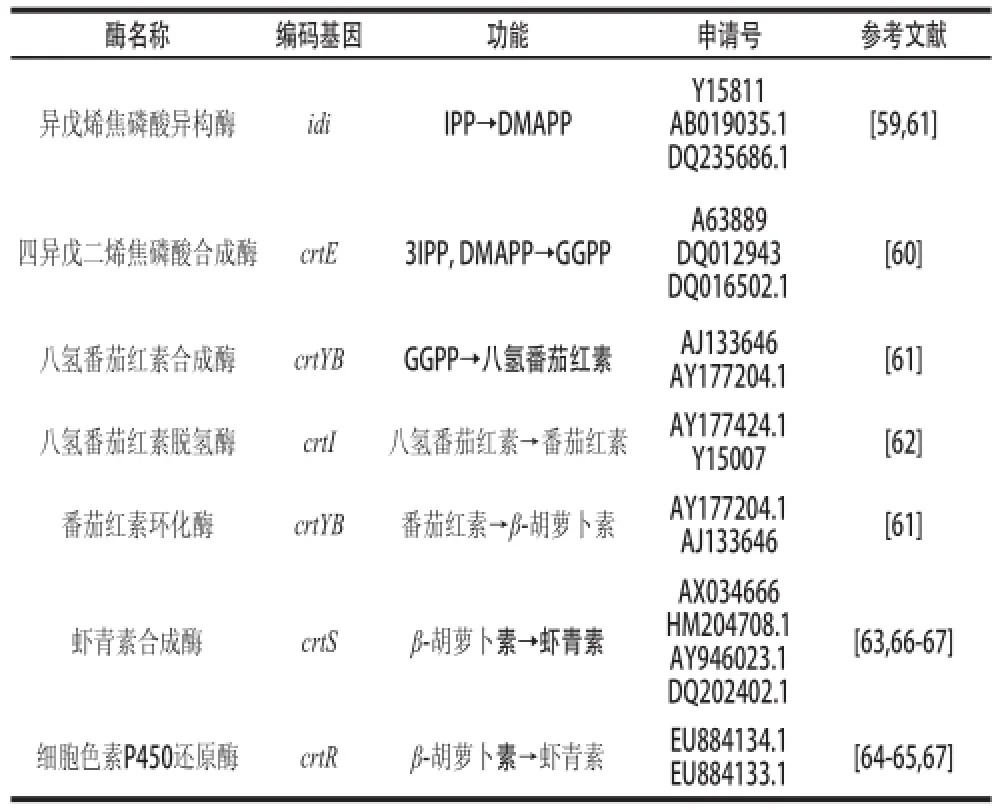
表2 紅法夫酵母蝦青素生物合成途徑中部分相關酶及其基因Table 2 Enzymes and their encoding genes related to the biosynthetic pathway of astaxanthin in Phaffifi a rhodozyma
2.2.2蝦青素高產菌株的選育
紅法夫酵母野生菌株產蝦青素僅350 .g/g左右,發酵溫度低,一般為18~22 ℃,易于退化,而且當葡萄糖的質量濃度超過2 g/100 mL時,蝦青素產量會急劇的下降,這些性質使其工業化生產受到制約[68]。因此需要通過選育獲得高產蝦青素、耐高溫、發酵溫度高、不易退化的優良菌種,再通過對發酵條件的優化可使蝦青素的產量達到最大。紅法夫酵母高產菌株的選育主要有誘變育種、原生體融合和基因工程育種3 種方式。
徐彩榮[57]采用超聲波、超聲波-氯化鋰及亞硝基胍對紅發夫酵母進行誘變處理,用二苯胺及2-D-脫氧葡萄糖篩選蝦青素高產菌株進行,最終得到一株蝦青素含量高,遺傳性能穩定的突變菌株N-22,其蝦青素含量為949.19 μg/g,比出發菌株提高了4.37 倍。Sun等[69]用小于10 kGy的γ射線重復誘變,選育得到一株蝦青素高產菌株,產量為3.3 mg/g,較野生菌株提高了50%。韓偉[51]經過多次紫外誘變、微波誘變處理,二苯胺推理篩選,最終獲得一株遺傳穩定性良好,蝦青素產量高的突變菌株TY-I-8,其蝦青素產量達到了12.92 mg/L。Schmidt等[20]利用原生質體融合技術,將親本細胞F406和F307原生質體融合得到了一株蝦青素高產菌株。Verdoes等[61]首次研究了紅法夫酵母番茄紅素脫氫酶基因,并將idi基因成功導入大腸桿菌中,得到蝦青素高產菌株,為紅法夫酵母蝦青素合成的基因工程育種研究奠定了基礎。目前,誘變育種仍然是對高產菌株進行選育的主要途徑。因此,應該尋找新型的誘變育種技術運用到紅法夫酵母的菌種改良中,以提高蝦青素的產量。
2.2.3發酵過程的控制與優化
發酵過程的控制與優化主要集中于培養基和發酵條件、前體物質和增強劑、發酵方法等因素對蝦青素產量的影響。獲得蝦青素高產菌株后,通過優化培養基和發酵條件,可進一步提高蝦青素的產量,同時研制廉價的培養基和優化發酵工藝來降低成本,為紅法夫酵母工業化生產蝦青素提供理論依據。
朱明軍等[70]通過實驗獲得了適合紅法夫酵母生長的“糖蜜+硫酸銨+尿素”的簡單培養基配方,何璞等[71]利用響應面法優化得到了蔗糖和酵母粉的最佳培養基,菌株產蝦青素含量是優化前的近2 倍。鄭蕾[72]研究發現蔗糖是紅法夫酵母生長的最佳碳源,葡萄糖是蝦青素在細胞內積累的最佳碳源;最佳的氮源組成為(NH4)2SO44.9 g/L、蛋白胨6.2 g/L、酵母膏1 g/L,蝦青素的產量達6.78 mg/L,發酵產率提高了1.8 倍左右。Fang等[73]研究表明蛋白胨是最好的單一氮源,而酵母膏-牛肉膏-硝酸鉀質量比為1∶1∶1.5的混合氮源更有利于蝦青素的積累。有研究提出以甘蔗糖蜜為主要碳源,蛋白胨為主要氮源,硝酸鉀為無機鹽,再配以生長因子的培養基是適合紅法夫酵母生長的最佳培養基,通過對發酵條件的優化,能有效提高蝦青素的產量[43]。Johnson等[74]探究了紅法夫酵母的基本生長條件:最適培養溫度及色素積累溫度為20~22 ℃,適合生長的最佳pH值為5.8,而蝦青素產率最大時的最佳pH值為5.0。杜似鵑等[75]研究表明發酵液pH 8.0、接種量20%、振蕩速率160 r/min、發酵時間168 h條件下,蝦青素產量最大。王立梅等[76]對發酵條件進行優化后,蝦青素產量從5.89 mg/L提高到10.9 mg/L。劉瀅等[77]將發酵分成兩個階段,不同的階段選擇不同的發酵培養基和發酵條件,有效提高了菌株的生物量、生長速率及蝦青素產量。對培養基中的營養組分進行選擇和優化是對蝦青素進行工業化生產的主要前提,也是降低蝦青素生產成本的重要途徑之一(表3)。
研究表明,在酵母發酵過程中,向已經確定了營養組分及其配比的發酵培養基中添加某些前體物質或色素合成的增強劑如菠蘿汁、西紅柿汁、甲羥戊醛、檸檬酸、乙酸、乙醇、豆油等均可有效提高蝦青素的產量[51]。Johnson等[74]在紅法夫酵母的培養基中添加含有大量前體物質(番茄紅素)的番茄汁,紅法夫酵母蝦青素產量達到了814 μg/L。檸檬酸是三羧酸循環中的重要物質,有利于提高體系中的乙酰CoA,而乙酰CoA是蝦青素生物合成的起始,因而被視為蝦青素生物合成的一種前體物質。研究發現通過向發酵培養基中添加檸檬酸鹽,可提高蝦青素的產量[78](表3)。
目前,紅法夫酵母的發酵方法主要有分批發酵、連續補料發酵、間歇補料發酵和兩步補料發酵等。分批發酵操作簡單,常用于工業生產中。汪洪濤等[79]用甘油做碳源,以蛋白胨和酵母膏為混合氮源一次投料發酵168 h,蝦青素產量為33.7 mg/L。通過補料發酵可以實現酵母的高密度培養,高密度培養基本思想在于對胞內次生代謝產物,在保證比生產率的前提下盡可能提高細胞密度,使體積生產率大幅提高,提高色素和菌體的生產效率。Vázquez等[80]在2 L發酵罐中用主要是木糖的木材水解液做碳源,在裝液量1 L,溫度22 ℃的條件下,對連續補料發酵和間歇補料發酵進行了比較,實驗結果表明間歇補料發酵的生物量和蝦青素產量都高于連續補料發酵。間歇補料發酵和連續補料的生物量分別為30.6 g/L和10.3 g/L,蝦青素產量分別為30.5 mg/L和7.19 mg/L。兩步補料發酵是一種特殊間歇補料發酵。Yamane等[81]研究發現,在供氧量充足、含氮量固定的前提下,培養基中高C/N可提高蝦青素的合成速率,但低C/N卻有利于菌體的生長。根據這一特點進行兩步流加法發酵:第一步控制低C/N促進菌體細胞的生長;第二步流加糖提高C/N增加蝦青素的產量。結果生物量30 g/L,蝦青素含量0.72 mg/g,蝦青素產量21.6 mg/L。目前認為通過高密度培養技術更有利于蝦青素的積累,因此是實現紅法夫酵母工業化生產蝦青素最理想的發酵方法。高密度培養技術可以延長微生物的對數生長期和穩定期的持續時間,有效增加菌體生物量和代謝產物的積累。既避免了分批發酵因為一次投料過多造成的底物抑制,葡萄糖的阻遏效應以及因菌體生長過旺而導致的供氧不足,又比連續發酵更易操作,更為精確,應用于實際生產中可以避免原料的浪費,縮短生產周期,提高產物的濃度,對于降低生產成本,提高生產效率有著深遠的意義[22,44](表3)。
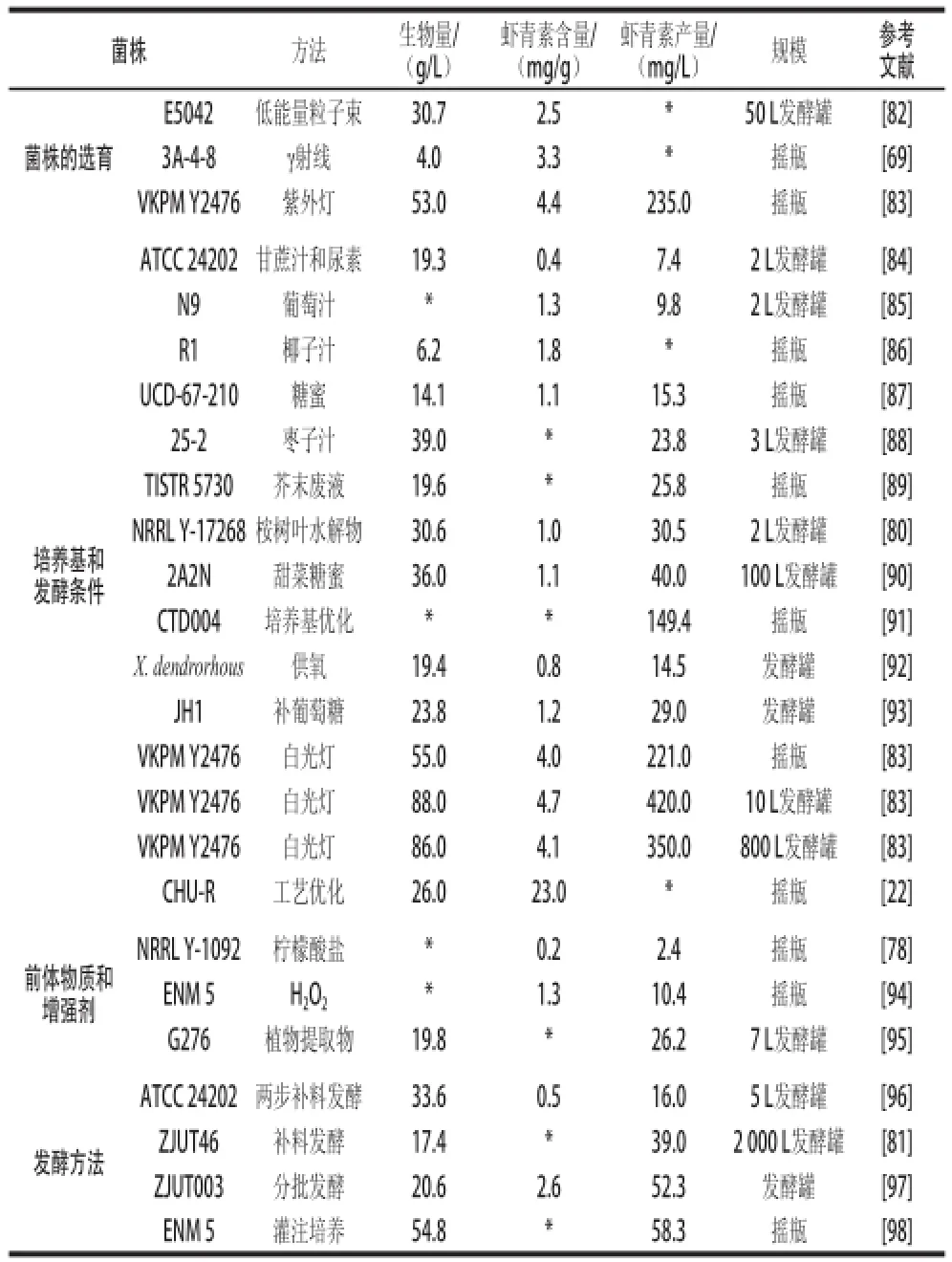
表3 紅法夫酵母菌株的選育及其發酵過程的控制與優化對蝦青素產量的影響Table 3 Astaxanthin productivity obtained with different strains of Xanthophyllomyces dendrorhous using low-cost raw materials, inducers,and optimal fermentation parameters
2.2.4蝦青素的提取與檢測[99-101]
蝦青素是胞內產物,而酵母菌的細胞壁厚而堅韌,給其提取造成很大障礙。因此蝦青素的提取重點在于酵母的破壁。破壁的方法主要有機械法、物理法、化學法和酶法4 種。
機械法是利用機械設備將細胞壁撕裂,靠胞內滲透壓使內含物釋放出來。目前主要有高壓均漿法、噴霧撞擊破碎法、珠磨法及超聲波破碎法。機械法操作簡便而被廣泛使用,但易引起局部高溫而導致蝦青素氧化損失。
物理法有溫差法和壓力差法等,目前較為常用的是溫差法。物理法沒有其他物質摻雜,不會導致輻射能源污染,避免了高溫和化學物質對蝦青素的破壞。
化學法主要有酸堿加熱法、有機溶劑滲透和二甲基亞砜法等。堿提法和酸溶法需要消耗大量堿和有機酸,導致污水排放增加,對環境中水源污染嚴重,近幾年已逐漸退出歷史舞臺。研究發現酸熱法破壁所得提取液中總類胡蘿卜素濃度最高,有機溶劑滲透破壁次之,二甲基亞砜法破壁所得提取液中蝦青素濃度最高[51]。
酶法能水解細胞壁骨架成分β-葡聚糖,所以相對于其他方法能更加有效地破壁,且不使蝦青素溢出菌體避免損失。同時酶法處理條件溫和,提取的蝦青素比其他方法破壁提取所得蝦青素穩定,其對設備也無需像酸法一樣有耐酸、耐高溫的特殊要求,處理過程對環境造成的污染也較小,因此是實現工業化最為理想的方法。用于提取的一些新興的方法如負壓空化法、超臨界流體萃取法、微波處理提取法,目前也逐步開始應用于工業生產。
在檢測方面,層析法應用最為廣泛,主要用到薄層層析法(thin-layer chromatography,TLC)和柱層析法,薄層層析法的分離度不高,結果受外界干擾因素大,重現性差,不便于實驗操作,所以對操作過程要求極高。柱層析法是最常用的純化方法之一,與其他色譜方法相比,柱層析設備低廉,更換固定相和流動相方便;雖然柱效不是特別高,但是利用不同固定相和流動相的組合能夠實現一些相對簡單樣品的分離與純化,應用范圍很廣。高效液相色譜(high performance liquid chromatography,HPLC)法分離效果更好,但成本較高。與薄層層析和柱層析相比,高效液相色譜的儀器價格高昂,需要定時維修檢查,使用時對儀器的磨損度大,無法在工業中大規模普及。
3 結 語
目前,紅法夫酵母發酵生產蝦青素的生物合成途徑及代謝調控機理被逐漸闡明,在高產菌株的選育、培養基和發酵條件的優化方面取得了較大的進展。但是依然存在著蝦青素產量低,生產成本高等問題,制約了蝦青素的大規模工業化生產。要突破此瓶頸除了選育高產菌株,優化發酵工藝,還應從以下四方面進行更為深入的研究:1)不斷完善蝦青素的生物合成途徑及代謝調控機理,特別是雨生紅球藻誘導積累蝦青素的具體機制,從代謝工程和系統生物學的角度進行發酵菌種育種和發酵優化;2)以現代分子生物學知識為理論,利用基因工程技術將蝦青素合成關鍵酶基因通過基因重組定向構建出高產菌株。其載體可以是紅法夫酵母和雨生紅球藻,也可以選擇大腸桿菌和乳酸菌等細菌;3)研發新型的生物反應器,解決高密度培養存在的高濃度基質對生長的抑制,高的氧需求,培養基的黏度不斷增加,紅法夫酵母與雨生紅球藻共有的蝦青素的積累和菌體的生產量呈相反趨勢等問題;4)尋找合適的酶,使其不但能最大程度的破壁,而且可以保證蝦青素的穩定性不被破壞,利用先進的分離純化技術提高產量。
蝦青素因其獨特的生物學功能,在醫藥、高級保健品等領域必將有著巨大的應用價值和廣闊的開發前景,所以實現蝦青素的工業化生產尤為重要,相信這四方面的研究是蝦青素未來的主要研究方向,特別是后兩方面可能成為未來解決蝦青素產量低,生產成本高等問題的關鍵技術。
[1]ANDREWES A G, BORCH G, LIAAEN-JENSEN S, et al. On the absolute configuration of astaxanthin and actinoerythrin[J]. Acta Chimica Stand, 1974, 28(1): 730-736.
[2]ANDREWES A G, PHAFF H J, STARR M P. Carotenoids of Phaffi a rhodozyma a red pigmented fermenting yeast[J]. Phytochemistry,1976, 15(2): 1009-1011.
[3]PU J, DAVID B J, SATHIVEL S. Developing microencapsulated flaxseed oil containing shrimp (Litopenaeus setiferus) astaxanthin using a pilot scale spray dryer[J]. Biosystems Engineering, 2011,108(2): 121-132.
[4]KATSUMATA T, ISHIBASHI T, KYLE D. A sub-chronic toxicity evaluation of a naturalastaxanthin-rich carotenoid extract of Paracoccus carotinifaciens in rats[J]. Toxicology Reports, 2014, 1(2):582-588.
[5]SOWMYA R, SACHINDRA N M. Evaluation of antioxidant activity of carotenoid extract from shrimp processing byproducts by in vitro assays and in membrane model system[J]. Food Chemistry, 2012,134(1): 308-314.
[6]MONROY R J, SEVILLA M, CARRON R, et al. Astaxanthinenricheddiet reduces blood pressure and improves cardiovascular parameters in spontaneously hypertensive rats[J]. Pharmacological Research, 2011,63(1): 44-50.
[7]REVES F A, MENDIOLA J A, IBANEZ E, et al. Astaxanthin extraction from Haematococcus pluvialis using CO2-expanded ethanol[J]. The Journal of Supercritical Fluids, 2014, 92(1):75-83.
[8]TEIERA N, CEJAS J R, RODRIGUEZ C, et al. Pigmentation,carotenoids, lipid peroxides and lipid composition of skin of red porgy(Pagrus pagrus) fed diets supplemented with different astaxanthin sources[J]. Aquaculture, 2007, 270(1/4): 218-230.
[9]GUERIN M, HUNTLEY M E, OLAIZOLA M. Haematococcus astaxanthin: applications for human health and nutrition[J]. Trends in Biotechnology, 2003, 21(5): 210-216.
[10] BIRKELAND S, BIERKENG B. Extractabilities of astaxanthin and protein from muscle tissue of Atlantic salmon (Salmo salar) as affected by brine concentration and pH[J]. Food Chemistry, 2004, 85(4):559-568.
[11] 董玉華, 趙元鳳. 蝦青素生物學來源和功能的研究進展[J]. 水產科學, 2005, 24(10): 50-52.
[12] AMAKASU K, ONO A, HIRANO D, et al. Distribution and density of Antarctic krill (Euphausia superba) and ice krill (E. crystallorophias)off Adélie Land in austral summer 2008 estimated by acoustical methods[J]. Polar Science, 2011, 5(2): 187-194.
[13] 滕長英, 張立, 秦松, 等. 蝦青素的應用及生產來源[J]. 安徽農業科學, 2007, 35(8): 2298-2299.
[14] EMST H. Recent advances in industria lcarotenoid synthesis[J]. Pure and Applied Chemistry, 2002, 74(8): 1369-1382.
[15] BON J A, LEATHERS T D, JAVASWAL R K. Isolation of astaxanthin over-producing mutants of Phaffia rhodozyma[J]. Biotechnology Letters, 1997, 19(2): 109-112.
[16] 高桂玲, 成家楊, 馬炯. 雨生紅球藻和蝦青素的研究[J]. 水產學報,2014, 38(2): 297-304.
[17] KATSUDA T, SHIRAISHI H, ISHIZU N, et al. Effect of light intensity and frequency of flashing light from blue light emitting diodes on astaxanthin production by Haematococcus pluvialis[J]. Journal of Bioscience and Bioengineering, 2008, 105(3): 216-220.
[18] KIM Z, KIM S, LEE H, et al. Enhanced production of astaxanthin by flashing light using Haematococcus pluvialis[J]. Enzyme and Microbial Technology, 2006, 39(3): 414-419.
[19] IP P, WONG K, CHEN F. Enhanced production of astaxanthin by the green microalga Chlorella zofi ngiensis in mixotrophic culture[J]. Process Biochemistry, 2004, 9(11): 1761-1766.
[20] SCHMIDT I, SCHEWE H, GASSEL S, et al. Biotechnological production of astaxanthin with Phaffi a rhodozyma/Xanthophyllomyces dendrorhous[J]. Applied Microbiology and Biotechnology, 2011,89(3): 555-571.
[21] YUAN Jianping, CHEN Feng. Purification of trans-astaxanthin from a high-yielding astaxanthin ester-producing strain of the microalga Haematococcus pluvialis[J]. Food Chemistry, 2000, 68(4): 443-448.
[22] 譚穎嫦, 廖美德, 秦鵬, 等. CHU-R菌株產蝦青素的發酵工藝研究[J].現代食品科技, 2012, 28(3): 289-296.
[23] MAOKA T, ETOH T, OSAWA A, et al. Characterization and singlet oxygen quenching activity of (3R)-3-hydroxy-4-ketotorulene and(3R)-3-hydroxy-4-keto-γ-carotene from the yeast Xanthophyllomyces dendrorhrous[J]. Journal of Oleo Science, 2012, 61(7): 401-406.
[24] KIYOTAKA N, TAKEHIRO K, TAIKI M, et al. Antioxid effect of astaxanthin on phospholipid peroxidation in human erythrocytes[J]. British Journal of Nutrition, 2011, 105(11): 1563-1571.
[25] LEE S H, MIN D B. Effects, quenching mechanisms, and kinetics of carotenoids in chlorophyll-sensitized photooxidation of soyean oil[J]. Journal of Agricultural and Food Chemistry, 1990, 35(38): 630-634.
[26] KIM J H, KIM Y S. Protective effect of astaxanthin on naproxeninduced gastric antral ulceration in rats[J]. European Journal of Pharmacology, 2005, 514(1): 53-59.
[27] 張曉麗, 劉建國. 蝦青素的抗氧化性及其在營養和醫藥應用方面的研究[J]. 食品科學, 2006, 27(1): 258-262.
[28] LEE S H, CHERL W P, WONG S P, et al. Inhibition of benzo pyrene-induced mouse for estomach neoplasia by astaxanthin containing egg yolks[J]. Agricultural Chemistry and Biotechnology,1997, 40(6): 490-494.
[29] 項榮, 丁棟博, 李杰. 蝦青素抑癌作用機制研究進展[J]. 天然產物研究與開發, 2013, 25(7): 1011-1015.
[30] GRADELET S, BON A, BERGES R, et al. Dietary carotenoids inhibit aflatoxin B1-induced liver preneoplastic foci and DNA damage in the rat: role of the modulation of aflatoxin B1metabolism[J]. Carcinogenesis, 1998, 19(3): 403-411.
[31] CHEW B P, PARK J S, WONG M W, et al. A comparison of the anticancer activities of dietary betacarotene, canthaxanthin and astaxanthin in mice in vivo[J]. Anticancer Research, 1999, 19(3):1849-1853.
[32] 付佳. 天然蝦青素的生物保健功能及安全性概述[J]. 國外醫學: 衛生學分冊, 2007, 34(6): 382-386.
[33] PARK J S, MATHISON B D, HAYEK M G, et al. Astaxanthin stimulates cell-mediated and humoral immune responses in cats[J]. Veterinary Immunology and Immunopathology, 2011, 144(3/4): 455-461.
[34] CHEW B P, MATHISON B D, HAYEK M G, et al. Dietary astaxanthin enhances immune response in dogs[J]. Veterinary Immunology and Immunopathology, 2011, 140(3/4): 199-206.
[35] TSO M O, LAM T T. Method of retarding and ameliorating central nervous system and eye damage: US Patent, 5527533[P]. 1996-06-18.
[36] SNODDERLY D M. Evidence for protection against agerelated macular degeneration by carotenoids and antioxidant vitamins[J]. The American Journal of Clinical Nutrition, 1995, 62(Suppl 1): 1448-1461.
[37] MIKI W, HOSODA K, Kondo K, et al. Astaxanthin-containing drink:JP, 10155459[P]. 1998-06-16.
[38] HIGUERA-CIAPARA I, F.LIX-VALENZUELA L, GOYCOOLEA F M. Astaxanthin: a review of its chemistry and applications[J]. Food Science and Nutrition, 2006, 46(2): 185-196.
[39] TORRISSEN O J, CHRISTIANSEN R. Requirements for carotenoids in fish diets[J]. Journal of Applied Ichthyology, 1995, 11(3/4): 225-230.
[40] BJORNDAHL T. The economics of salmon aquaculture[M]. Oxford:Blackwell Scientific, 1990: 179-191.
[41] JOHNSON E A, VILLA T G, LEWIS M J. Phaffia rhodozyma as an 1astaxanthin source in salmonid diets[J]. Aquaculture, 1980, 20(2):123-134.
[42] BJERKENG B, JOHNSEN G. Frozen storage quality of rainbow trout(Oncorhynchus mykiss) as affected by oxygen, illumination, and fillet pigment[J]. Journal of Food Science, 1995, 60(2): 284-288.
[43] DASILVA F O, TRAMONTE V L C G, PARISENTI J, et al. Litopenaeus vannamei muscle carotenoids versus astaxanthin:acomparison of antioxidant activity and in vitro protective effectsagainst lipid peroxidation[J]. Food Bioscience, 2015, 9: 12-19.
[44] YANG Y, KIM B, PARK Y K, et al. Astaxanthin prevents TGF-β1-induced pro-fibrogenic gene expression by inhibiting Smad3 activation in hepatic stellate cells[J]. Biochimica et Biophysica Acta, 2015,1850(1): 178-185.
[45] SILA A, KAMOUN Z, GHLISSI Z, et al. Ability of natural astaxanthin from shrimp by-products to attenuate liver oxidative stress in diabetic rats[J]. Pharmacological Reports, 2015, 67(2): 310-316.
[46] SANDESH K B, VIDHYAVATHI R, SARADA R, et al. Enhancement of carotenoids by mutation and stress induced carotenogenic genes in Haematococcus pluvialis mutants[J]. Bioresource Technology, 2008,99(18): 8667-8673.
[47] HE P, DUNCAN J, BARBER J. Astaxanthin accumulation in the green alga Haematococcus pluvialis: effects of cultivation parameters[J]. Journal of Integrative Plant Biology, 2007, 49(4): 447-451.
[48] GR.NEWALDK, ECKERTM, HIRSCHBERG J, et al. Phytoene desaturase is localized exclusively in the chloroplast and up-regulated at the mRNA level during accumulation of secondary carotenoids in Haematococcus pluvialis (Volvocales Chlorophyceae)[J]. Plant Physiology, 2000, 122(4): 1261-1268.
[49] BOUSSIBA S. Carotenogenesis in the green alga Haematococcus pluvialis: celluar physiology and stress response[J]. Physiologia Plantarum, 2000, 108(2): 111-117.
[50] 趙曉燕, 朱海濤, 陳軍, 等. 響應曲面法優化有機溶劑萃取雨生紅球藻中蝦青素[J]. 食品工業, 2014, 35(10): 124-127.
[51] 韓偉. 蝦青素高產菌株的推理篩選與發酵條件優化[D]. 泰安: 山東農業大學, 2010.
[52] 侯冬梅. 雨生紅球藻高產蝦青素的光誘導工藝研究[D]. 上海: 華東理工大學, 2014.
[53] WANG J, HAN D, SOMMERFELD M R, et al. Effect of initial biomass density on growth and astaxanthin production of Haematococcus pluvialis in an outdoor photobioreactor[J]. Journal of Applied Phycology, 2013, 25(1): 253-260.
[54] YUAN Chao, DUA Lei, JIN Zhengyu, et al. Storage stability and antioxidant activity of complex of astaxanthin with hydroxypropyl-βcyclodextrin[J]. Carbohydrate Polymers, 2013, 91(1): 385-389.
[55] ANARJAN N, TAN C P. Developing a three component stabilizer system for producing astaxanthin nanodispersions[J]. Food Hydrocolloids, 2013, 30(1): 437-447.
[56] 高新征, 黃東愛, 鄔強, 等. 蝦青素生產及其生物合成途徑的研究進展[J]. 海南醫學院學報, 2013, 19(1): 141-144.
[57] 徐彩榮. 高產蝦青素措施的研究[D]. 泰安: 山東農業大學, 2013.
[58] RODRíGUEZ-S.IZ M, de la FUENTE J L, BARREDO J L. Xanthophyllomyces dendrorhous for the industrial production of astaxanthin[J]. Applied Microbiology Biotechnology, 2010, 88(3):645-658.
[59] KAJIWARA S, FRASER P D, KONDO K, et al. Expression of an exogenous isopentenyl diphosphate isomerase gene enhances isoprenoid biosynthesis in Escherichia coli[J]. Biochemical Journal,1997, 324(2): 421-426.
[60] NIKLITSCHEK M, ALCAINO J, BARAHONA S, et al. Genomic organization of the structural genes controlling the astaxanthin biosynthesis pathway of Xanthophyllomyces dendrorhous[J]. Biological Research, 2008, 41(2): 93-108.
[61] VERDOSE J C, KRUBASIK P, SANDMANN G, et al. Isolation and functional characterisation of a novel type of carotenoid biosynthetic gene from Xanthophyllomyces dendrorhous[J]. Molecular & General Genetics, 1999, 262(3): 453-461.
[62] VERDOS J C, MISAWA N, VANOOYEN A J J. Cloning and characterization of the astaxanthin biosynthetic gene encoding phytoene desaturase of Xanthophyllomyces dendrorhous[J]. Biotechnology and Bioengineering, 1999, 63(5): 750-755.
[63] OJIMA K, BREITENBACH J, VISSER H, et al. Cloning of the astaxanthin synthase gene from Xanthophyllomyces dendrorhous and its assignment as a beta-carotene-3-hydroxylase/4-ketolase[J]. Molecular Genetics and Genomics, 2006, 275(2):148-158.
[64] .LVAREZ V, RODRíGUEZ-S.IZ M, de la FUENTE J L, et al. The crtS gene of Xanthophyllomyces dendrorhous encodes a novel cytochrome-P450 hydroxylase involved in the conversion of β-carotene into astaxanthin and other xanthophylls[J]. Fungal Genetics and Biology, 2006, 43(4): 261-272.
[65] UKIBE K, HASHIDA K, YOSHIDA N, et al. Metabolic engineering of Saccharomyces cerevisiae for astaxanthin production and oxidative stress tolerance[J]. Applied and Environmental Microbiology, 2009,75(1): 7205-7211.
[66] ALCAíNO J, BARAHONA S, CARMONA M, et al. Cloning of the cytochrome p450 reductase (crtR) gene and its involvement in the astaxanthin biosynthesis of Xanthophyllomyces dendrorhous[J]. BMC Microbiology, 2008, 8(1): 169-181.
[67] 李天麗, 蔡慧農, 李利君, 等. 紅法夫酵母蝦青素合成途徑相關基因的研究進展[J]. 微生物學通報, 2013, 40(9): 1673-1685.
[68] 田小群. 紅法夫酵母(Phaffia rhodozyma)的誘變和原生質體融合及發酵優化研究[D]. 廣州: 華南理工大學, 2003.
[69] SUN N, LEE S, SONG K B. Characterization of a carotenoid hyperproducing yeast mutant isolated by low-dose gamma irradiation[J]. International Journal of Food Microbiology, 2004,94(3): 263-267.
[70] 朱明軍, 杜順堂, 梁世中. 紅法夫酵母以糖蜜為原料的培養基優化[J].河南工業大學學報, 2005, 26(1): 32-35.
[71] 何璞, 余龍江, 周蓬蓬, 等. 響應面法對紅法夫酵母合成蝦青素主要影響因素的優化[J]. 工業微生物, 2007, 37(1): 63-66.
[72] 鄭蕾. 紅法夫酵母產蝦青素發酵培養基的優化[J]. 宿州學院學報,2012, 27(8): 60-62.
[73] FANG T J, CHENG Y. Improvement of astaxanthin production by Phaffi a rhodozyma through mutantion and optimization of culture conditions[J]. Journal of Fermental Bioengineering, 1993, 75(6): 466-469.
[74] JOHNSON E A, LEWIS M J. Astaxanthin formation by the yeast Phaffi a rhodozyma[J]. Journal of General and Applied Microbiology,1979, 115(1): 173-183.
[75] 杜似鵑, 梅艷珍, 胡耀輝, 等. 紅法夫酵母生產蝦青素的培養條件研究[J]. 食品科學, 2008, 29(8): 441-444.
[76] 王立梅, 杜似娟, 鄭麗雪, 等. 響應面法優化高產蝦青素菌株的發酵條件[J]. 食品科學, 2009, 30(21): 312-315.
[77] 劉瀅, 葉淑紅, 王際輝. 搖瓶培養條件對紅法夫酵母突變菌株UV-801e-S015產蝦青素的影響[J]. 食品工業科技, 2009, 30(3): 159-161.
[78] FLORES-COTERA L B, MARTIN R, SANCHEZ S. Citrate, a possible precursor of astaxanthin in Phaffi a rhodozyma: influence of varying levels of ammonium, phosphate and citrate in a chemically defined medium[J]. Applied Microbiology and Biotechnology, 2001,55(3): 341-347.
[79] 汪洪濤, 徐學明, 金征宇. 不同補料發酵方式對法夫酵母產蝦青素的影響[J]. 生物技術, 2003, 13(5): 28-30.
[80] V.ZQUEZ M, MARTIN A M. Optimization of Phaffi a rhodozyma continuous culture through response surface methodology[J]. Biotechnology and Bioengineering, 1998, 57(3): 314-320.
[81] YAMANE Y I, HIGASHIIDA K, NAKASHIMADA Y, et al. Influence of oxygen and glucose on primary metabolism and astaxanthin production by Phaffia rhodozyma in batch andfed-batch cultures: kinetic and stoichiometric analysis[J]. Applied and Environmental Microbiology ,1997, 63(11): 4471-4478.
[82] LIU Z Q,ZHANG J F,ZHENG Y G,etal. Improvementof astaxanthinp roduction by a newly isolated Phaffi a rhodozyma mutant with low-energy ion beam implantation[J]. Journal of Applied Microbiology, 2008, 104(3): 861-872.
[83] de la FUENTE J L, RODRIGUZE-SAIZ M, SCHLEISSNER C,et al. High-titer production of astaxanthin by the semi-industrial fermentation of Xanthophyllomyces dendrorhous[J]. Journal of Biotechnology, 2010, 148(2/3): 144-146.
[84] MORIEL D G, CHOCIAI M B, PEREIRA MACHADO I M, et al. Effect of feeding methods on the astaxanthin production by Phaffi a rhodozyma in fed-batch process[J]. Brazilian Archives of Biology and Technology, 2005, 48(3): 397-401.
[85] MEYER P S, du PREEZ J C. Astaxanthin production by a Phaffi a rhodozyma mutant on grape juice[J]. World Journal of Microbiology & Biotechnology, 1994, 10(2): 178-183.
[86] DOMINGUEZ-BOCANEGRA A R, TORRES-MUNOZ J A. Astaxanthin hyperproduction by Phaffia rhodozyma with raw coconut milk as sole source of energy[J]. Applied Microbiology and Biotechnology, 2004, 66(2): 249-252.
[87] HAARD N F. Astaxanthin formation by the yeast Phaffi a rhodozyma on molasses[J]. Biotechnology Letters, 1988, 10(2): 609-614.
[88] RAMIREZ J, OBLEDO N, ARELLANO M, et al. Astaxanthin production by Phaffi a rhodozyma in a fed-batch culture using a low cost medium feeding[J]. e-Gnosis Num, 2006, 4(1): 1-9.
[89] TINOI J, RAKARIVATHAM N, DEMING R L. Utilization of mustard waste isolates for improved production of astaxanthin by Xanthophyllomyces dendrorhous[J]. Journal of Industrial Microbiology & Biotechnology, 2006, 33(2): 309-314.
[90] AN G H, JANG B G, CHO M H. Cultivation of the carotenoidhyperproducing mutant 2A2N of the red yeast Xanthophyllomyces dendrorhous (Phaffia rhodozyma) with molasses[J]. Journal of Bioscience and Bioengineering, 2001, 92: 121-125.
[91] 劉艷, 馮印, 莫言, 等. 響應面法優化產蝦青素假單胞菌的發酵培養基[J]. 食品工業科技, 2014, 35(20): 186-190.
[92] WANG Wenjun, YU Longjiang. Effects of oxygen supply on growth and carotenoids accumulationby Xanthophyllomyces dendrorhous[J]. Meitschrift fur Naturforschung Section B: a Journal of Chemical Sciences, 2009, 64(4): 853-858.
[93] KIM J H, KANG S W, KIM S W, et al. High-level production of astaxanthin by Xanthophyllomyces dendrorhous mutant JH1 using statistical experimental designs[J]. Bioscience, Biotechnology, and Biochemistry, 2005, 69(1): 1743-1748.
[94] LIU Yuanshuang, WU Jianyong. Hydrogen peroxide-induced astaxanthin biosynthesis and catalase activity in Xanthophyllomyces dendrorhous[J]. Applied Microbiology and Biotechnology, 2006,73(3): 663-668.
[95] KIM S K, LEE J H, LEE C H, et al. Increased carotenoid production in Xanthophyllomyces dendrorhous G276 using plant extracts[J]. The Journal of Microbiology, 2007, 45(2): 128-132.
[96] HU Zhongce, ZHENG Yuguo, WANG Zhao, et al. Production of astaxanthin by Xanthophyllomyces dendrorhous ZJUT46 with fedbatch fermentation in 2.0 m3fermentor[J]. Food Technology and Biotechnology, 2007, 45(2): 209-212.
[97] ZHENG Y G, HU Z C, WANG Z, et al. Large-scale production of astaxanthin by Xanthophyllomyces dendrorhous[J]. Food and Bioproducts Processing, 2006, 84(1): 164-166.
[98] LIU Yuanshuai, WU Jianyong. Perfusion culture process plus H2O2stimulation for efficient astaxanthin production by Xanthophyllomyces dendrorhous[J]. Biotechnology and Bioengineering, 2007, 97(2): 568-573.
[99] 武一琛, 楊慧茹, 方園, 等. 天然蝦青素提取及分離純化研究進展[J].食品研究與開發, 2014, 35(12): 117-120.
[100] 宋素梅. 南極磷蝦殼中蝦青素的提取與分離純化[D]. 無錫: 江南大學, 2013.
[101] 姜啟興, 宋素梅, 夏文水, 等. 大孔樹脂分離純化南極磷蝦殼中的蝦青素[J]. 食品科學, 2014, 35(16): 1-5. doi:10.7506/spkx1002-6630-201416001.
Current Status of Fermentative Production of Astaxanthin
CAI Jun, YOU Zhineng
(Key Laboratory of Fermentation Engineering, Ministry of Education, Hubei Collaborative Innovation Center for Industrial Fermentation, Hubei University of Technology, Wuhan430068, China)
Astaxanthin is a carotenoid that has very strong antioxidant activity, anticancer function, significant coloring capacity and immunoenhancing activity. The biological activities of astaxanthin and its applications in food, cosmetics,health products, aquaculture, medicine and other fields are summarized in this review, with focus on the current status of fermentative production of astaxanthin. Moreover, the future directions of astaxanthin research are proposed. It is expe cted that this review can provide a theoretical basis for in-depth exploration and comprehensive utilization of astaxanthin.
astaxanthin; biological activity; fermentation
TS209
A
1002-6630(2015)23-0358-09
10.7506/spkx1002-6630-201523064
2015-01-15
湖北省自然科學基金重點項目(2009CDA059)
蔡俊(1968—),男,教授,博士,研究方向為發酵工程。E-mail:caijun@mail.hbut.edu.cn

