稠李花色苷的純化及體外抗氧化活性
劉劍利,劉 曉,曹向宇*,于 慧,楊思敏,孫宇航
(遼寧大學(xué)生命科學(xué)院,遼寧 沈陽 110036)
LIU Jianli, LIU Xiao, CAO Xiangyu*, YU Hui, YANG Simin, SUN Yuhang
(School of Life Science, Liaoning University, Shenyang 110036, China)
稠李花色苷的純化及體外抗氧化活性
劉劍利,劉 曉,曹向宇*,于 慧,楊思敏,孫宇航
(遼寧大學(xué)生命科學(xué)院,遼寧 沈陽 110036)
目的:建立AB-8大孔樹脂純化稠李花色苷的方法,并檢測稠李花色苷體外抗氧化活性。方法:通過AB-8大孔樹脂對稠李花色苷的動態(tài)吸附與解吸條件優(yōu)化,確定最佳純化條件;采用四唑氮藍(lán)(nitroblue tetrazolium,NBT)光化還原法測定花色苷體外抗氧化活性,2',7'-二氫二氯熒光素二乙酸酯(2',7'-dichlorodihydrofluoresce in diacetate,DCFH-DA)法觀察花色苷對H2O2誘導(dǎo)的N 2A細(xì)胞氧化損傷的保護(hù)作用。結(jié)果:稠李花色苷的最佳動態(tài)純化條件是:吸附流速0.01 mL/s,粗提液質(zhì)量濃度8 mg/mL,過柱次數(shù)2 次;解吸劑乙醇體積分?jǐn)?shù)70%,流速0.01 mL/s,pH 3,純化之后稠李花色苷的色價為57.1,純化了16.31 倍;NBT實(shí)驗(yàn)結(jié)果表明,稠李花色苷具有清除超氧陰離子自由基的能力,且具有較好的劑量-效應(yīng)關(guān)系;0.025 mg/mL的稠李花色苷能夠保護(hù)H2O2損傷的N2A細(xì)胞,0.05 mg/mL的稠李花色苷能夠降低細(xì)胞內(nèi)活性氧水平。結(jié)論:AB-8大孔樹脂是純化稠李花色苷的一種有效方法,稠李花色苷在一定質(zhì)量濃度范圍內(nèi)具有較好的體外抗氧化活性。
稠李;花色苷;純化;大孔樹脂;抗氧化;活性氧
LIU Jianli, LIU Xiao, CAO Xiangyu*, YU Hui, YANG Simin, SUN Yuhang
(School of Life Science, Liaoning University, Shenyang 110036, China)
稠李,為薔薇科稠李屬的植物,果期一般在5-10月。稠李果實(shí)味澀,微甜,形狀卵球形,徑長可達(dá)0.8~1 cm,果皮為紅褐色至紫色[1]。稠李屬植物因較耐濕寒,并且花香濃郁,為早春觀賞植物之一。稠李在我國黑龍江、吉林、遼寧、內(nèi)蒙古、河北、山西、河南、山東等地均有分布。由于稠李的樹皮、葉、花和果均可入藥,樹干可做木材,因此其用途廣泛[2]。
花色苷不僅具有很高的營養(yǎng)價值,也是替代合成色素的理想材料[3]。同時它具有較好的抗腫瘤、抗癌、抗炎等作用[4-6],還可與活性氧反應(yīng),減少和消除活性氧對生物體的傷害[7-8],因此,花色苷越來越受到人們的關(guān)注,在食品領(lǐng)域、醫(yī)藥與化妝品、保健品行業(yè)都有著巨大的應(yīng)用價值和開發(fā)價值。
目前,國內(nèi)外對于稠李的研究主要集中在稠李苗木繁育和稠李葉片成分分析兩個方面[9],對稠李花色苷的研究也主要集中在花色苷制備及功能研究上[10-11],而對其分離純化、抗氧化方面少有報道[12]。花色苷類化合物的分離純化方法很多,有萃取法、添加劑法、重結(jié)晶法、層析法、高速逆流色譜技術(shù)法等,但均存在不同程度的缺點(diǎn),從而限制了其工業(yè)化的生產(chǎn)[13-14]。目前采用的分離純化花色苷類化合物的主要方法是大孔樹脂吸附法,它具有效率高、質(zhì)量穩(wěn)定、成本低且操作簡單易行等優(yōu)點(diǎn)[15]。本實(shí)驗(yàn)采用AB-8大孔樹脂對稠李花色苷進(jìn)行有關(guān)吸附-解吸性能的純化研究,并對純化后的稠李花色苷進(jìn)行了體外抗氧化活性和細(xì)胞水平損傷保護(hù)作用的研究,以期為稠李資源開發(fā)和深加工轉(zhuǎn)化提供理論基礎(chǔ)和實(shí)驗(yàn)依據(jù)。
1 材料與方法
1.1材料與試劑
薔薇科稠李屬稠李 遼寧大學(xué)校內(nèi)采集并冷凍保存;AB-8大孔樹脂 南開大學(xué)化工廠。
氮藍(lán)四唑(nitroblue tetrazolium,NBT)、甲硫氨酸 國藥集團(tuán)化學(xué)試劑有限公司;乙二胺四乙酸 加拿大BioBasic公司;核黃素 北京奧博星生物技術(shù)有限公司;氯化鉀、鹽酸、無水乙醇等均為國產(chǎn)分析純。
1.2儀器與設(shè)備
HH-W420數(shù)顯三用恒溫水浴箱 金壇市晶玻實(shí)驗(yàn)儀器廠;DZKW-D-6數(shù)顯電熱恒溫水浴鍋 上海申光儀器儀表有限公司;721N可見光分光光度計(jì) 上海精密科學(xué)儀器有限公司;JW-3021HR高速冷凍離心機(jī) 安徽嘉文儀器裝備有限公司;CHRIST冷凍干燥機(jī) 北京鑫盛鴻陽科技有限公司;063335型電子蠕動泵 上海青浦滬西儀器廠;SHA-2型恒溫?fù)u床 上海比朗儀器有限公司;RE-52CS-2型旋轉(zhuǎn)蒸發(fā)儀 上海虹昕電子儀器儀表有限公司。
1.3方法
1.3.1稠李果實(shí)花色苷的制備[16]
取稠李果實(shí)去柄,破碎,去核,于-80 ℃冰箱冷凍,冷凍干燥后取出,用體積分?jǐn)?shù)為60%的乙醇按照1∶30(m/V)的比例混合均勻,在超聲功率為300 W的條件下超聲45 min,離心,取上清液比色。收集提取液,用旋轉(zhuǎn)蒸發(fā)儀進(jìn)行濃縮,最后冷凍干燥,得到稠李果實(shí)花色苷粉末。
1.3.2花色苷含量的測定
根據(jù)pH示差法[17]測定稠李果實(shí)中花色苷的含量,通過全波長掃描,確定稠李花色苷在可見光區(qū)的最大吸收波長是520 nm。根據(jù)花色苷的結(jié)構(gòu)特性,當(dāng)pH值為1.0時在520 nm波長處有最大吸收峰,而當(dāng)pH值為4.5時,花色苷就轉(zhuǎn)變?yōu)闊o色查耳酮形式,在520 nm波長處沒有吸收峰,用示差法計(jì)算溶液中總花色苷含量,根據(jù)公式(1)計(jì)算花色苷含量。
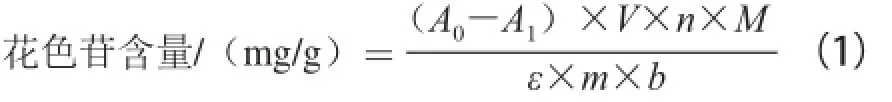
式中:A0、A1分別為pH 1.0、4.5時花色苷在520 nm波長處的吸光度;V為提取溶液總體積/mL;n為稀釋倍數(shù);M為矢車菊-3-葡萄糖苷的摩爾質(zhì)量/(g/mol);ε為矢車菊-3-葡萄糖苷的消光系數(shù)26 900/(L/(mol·cm));m為稠李果實(shí)質(zhì)量/g;b為比色皿厚度/cm。
1.3.3大孔樹脂動態(tài)純化花色苷
1.3.3.1大孔樹脂的預(yù)處理[18]
用蒸餾水對大孔樹脂進(jìn)行充分淋洗,置于無水乙醇中浸泡24 h,蒸餾水清洗殘留乙醇;然后酸堿處理,用體積分?jǐn)?shù)為5% HCl溶液浸泡12 h后,用蒸餾水洗至中性;然后用質(zhì)量分?jǐn)?shù)為2% NaOH溶液浸泡12 h,用蒸餾水洗至中性。
1.3.3.2吸附流速對花色苷動態(tài)吸附率的影響
量取5 份50 mL花色苷粗提液,測定吸光度A0,然后將粗提液均速過柱1 次,流速分別為0.01、0.05、0.10、0.15、0.20 mL/s,分別測定流出液的吸光度A1,根據(jù)公式(2)計(jì)算不同流速下的吸附率[19]。
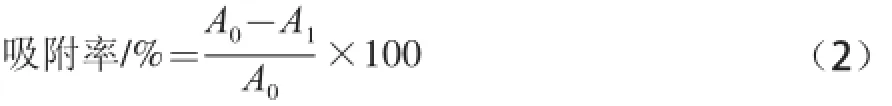
1.3.3.3粗提液質(zhì)量濃度對花色苷動態(tài)吸附率的影響
將花色苷粗提物分別配制成質(zhì)量濃度為1、2、4、8、16 mg/mL的溶液,分別測定吸光度A0,然后溶液依次過柱,流速為0.01 mL/s,分別測定流出液的吸光度A1。按照公式(2)計(jì)算各自的吸附率。
1.3.3.4過柱次數(shù)對花色苷動態(tài)吸附率的影響
量取50 mL花色苷粗提液,測定吸光度A0,然后將粗提液分別過柱1~5 次,流速調(diào)為0.01 mL/s,分別測定流出液的吸光度A1。按照公式(2)計(jì)算各自的吸附率。
1.3.3.5乙醇體積分?jǐn)?shù)對花 色苷動態(tài)解吸率的影響
將同一批次中吸附了花色苷的大孔樹脂等量分配,量取5 份體積分?jǐn)?shù)分別為40%、50%、60%、70%、80%的乙醇溶液,依次通過樹脂柱,分別測定流出液吸光度A2,根據(jù)公式(3)計(jì)算解吸率[19]。
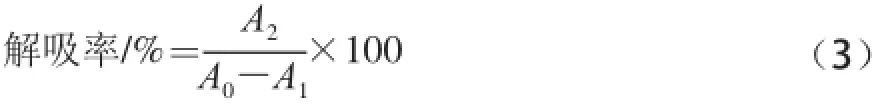
1.3.3.6解吸流速對花色苷動態(tài)解吸率的影響
將同一批次中吸附了花色苷的大孔樹脂等量分配,量取5 份體積分?jǐn)?shù)70%乙醇溶液,流速分別調(diào)為0.01、0.05、0.10、0.15、0.20 mL/s,依次通過樹脂柱后,測定流出液的吸光度A2,按照公式(3)計(jì)算不同流速的解吸率。
1.3.3.7pH值對花色苷動態(tài)解吸率的影響
根據(jù)相關(guān)文獻(xiàn)[20-21]可知,花色苷在酸性條件下較穩(wěn)定,而在堿性溶液中,其穩(wěn)定性受較大影響,因而將同一批次中吸附了花色苷的大孔樹脂等量分配,量取5 份體積分?jǐn)?shù)70%乙醇溶液,將pH值分別調(diào)至2、3、4、5、6,以0.01 mL/s的速率通過樹脂柱。每次過柱后測定流出液吸光度A2,按照公式(3)計(jì)算解吸率。
1.3.4稠李花色苷色價的測定[22]
按照最佳的純化條件對稠李果實(shí)花色苷進(jìn)行純化,經(jīng)減壓濃縮、冷凍干燥得到花色苷粉末。準(zhǔn)確稱取0.10 g的花色苷粉末,用pH 3.0的檸檬酸緩沖溶液定容到100 mL,稀釋一定倍數(shù),在520 nm波長處測定其吸光度,并按照公式(4)計(jì)算稠李花色苷色價E。

式中:A為樣品在520 nm波長處的吸光度;m為花色苷粉末樣品質(zhì)量/g;r為測定吸光度時所吸樣品被稀釋的倍數(shù)。
1.3.5NBT光化還原法測定稠李花色苷的體外抗氧化活性[23]
配制質(zhì)量濃度為0.02、0.04、0.06、0.08、0.10 mg/mL的稠李花色苷溶液進(jìn)行實(shí)驗(yàn)。具體參考呂淑霞[24]的方法略有改進(jìn)。
1.3.6稠李花色苷對H2O2誘導(dǎo)N2A細(xì)胞損傷的影響[25]
用含體積分?jǐn)?shù)10%胎牛血清的培養(yǎng)液配成單個N2A細(xì)胞懸液,以每孔105個細(xì)胞接種到6 孔板,每孔體積2 mL,接著在37 ℃,體積分?jǐn)?shù)5% CO2培養(yǎng)箱中進(jìn)行細(xì)胞培養(yǎng)24 h,然后對細(xì)胞進(jìn)行處理,設(shè)置3 個實(shí)驗(yàn)組,分別為正常對照組、模型組和花色苷處理組。其中模型組H2O2濃度為0.5 mmol/L,花色苷處理1組用0.5 mmol/L H2O2和0.025 mg/mL的花色苷作用于細(xì)胞,花色苷處理2組用0.5 mmol/L H2O2和0.05 mg/mL的花色苷作用于細(xì)胞,繼續(xù)培養(yǎng)1 h,顯微鏡下分別觀察不同組細(xì)胞的狀態(tài)并計(jì)算貼壁細(xì)胞數(shù)目百分比。
1.3.7稠李花色苷對H2O2損傷的N2A細(xì)胞內(nèi)活性氧含量的影響[26]
將N2A細(xì)胞進(jìn)行種板,對照組加入0.5 mmol/L H2O2,花色苷處理組加入0.05 mg/mL的花色苷和0.5 mmol/L H2O2,去除細(xì)胞培養(yǎng)液,加入磷酸鹽緩沖液(phosphate buffered saline,PBS)淋洗后,加入終濃度為20 μmol/L稀釋好的2',7'-二氫二氯熒光素二乙酸酯(2',7'-dichlorodihydrofluorescein diacetate,DCFH-DA),包上錫紙,37 ℃培養(yǎng)箱內(nèi)溫育30 min,再用PBS進(jìn)行淋洗,加入甲醇0.5 mL,-20 ℃固定30 min,再次淋洗后,加入丙酮(4 ℃預(yù)冷)0.5 mL固定6 min,然后每5 min用PBS淋洗3 次,最后進(jìn)行封片觀察。
1.4數(shù)據(jù)分析
實(shí)驗(yàn)重復(fù)3 次測定,結(jié)果表示為±s,采用SPSS 19.0軟件進(jìn)行統(tǒng)計(jì)分析。
2 結(jié)果與分析
2.1稠李果實(shí)花色苷含量
根據(jù)pH示差法,測得花色苷的含量為(0.897±0.013) mg/g,冷梅等[27]測得紫葉稠李花色苷的含量為(0.830±0.033)mg/g,本研究得到含量比其高8%。
2.2大孔樹脂動態(tài)純化稠李花色苷結(jié)果
2.2.1吸附流速對稠李花色苷動態(tài)吸附率的影響

圖1 吸附流速對稠李花色苷動態(tài)吸附率的影響Fig.1 Effect of sample loading flow rate on the dynamic adsorption rate of Padus racemosa anthocyanins
圖1為吸附流速對稠李花色苷動態(tài)吸附率的影響,在吸附流速為0.01 mL/s時,AB-8大孔樹脂對稠李花色苷的吸附率為80.7%,而吸附流速為0.20 mL/s時,吸附率僅為41.2%,吸附率隨流速的增加而降低。流速越低,稠李花色苷經(jīng)過柱子所需的時間越長,與樹脂接觸的時間也就越久,從而吸附效果越好,因而在后續(xù)的吸附實(shí)驗(yàn)中采用吸附流速為0.01 mL/s。
2.2.2粗提液質(zhì)量濃度對稠李花色苷動態(tài)吸附率的影響如圖2所示,粗提液的質(zhì)量濃度對稠李花色苷動態(tài)吸附率的影響不大,在質(zhì)量濃度為8 mg/mL時,動態(tài)吸附率達(dá)到最大值,為89.2%。而當(dāng)質(zhì)量濃度繼續(xù)加大時,樹脂的吸附能力有所下降,原因可能是花色苷質(zhì)量濃度的提高使得與花色苷競爭吸附的雜質(zhì)的含量也增加,影響了花色苷在樹脂內(nèi)部的擴(kuò)散[28]。因而,選擇8 mg/mL的粗提液質(zhì)量濃度為吸附原液質(zhì)量濃度。

圖2 稠李花色苷粗提液質(zhì)量濃度對動態(tài)吸附率的影響Fig.2 Relationship between Padus racemosa anthocyanin concentration and dynamic adsorption rate
2.2.3過柱次數(shù)對稠李花色苷動態(tài)吸附率的影響
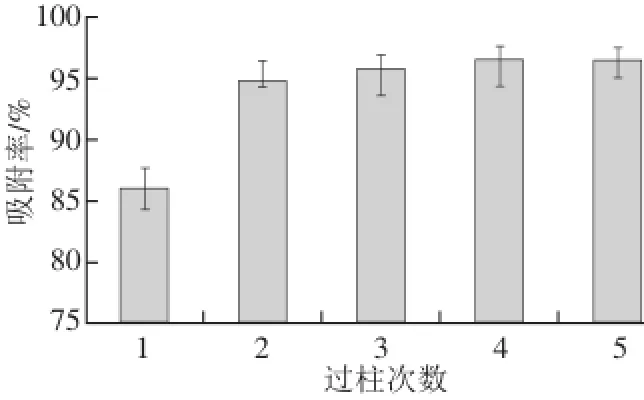
圖3 過柱次數(shù)對稠李花色苷動態(tài)吸附率的影響Fig.3 Effect of sample loading number on the dynamic adsorption rate of Padus racemosa anthocyanin
如圖3所示,隨著過柱次數(shù)的增多,樹脂對稠李花色苷的吸附效果略有增加,其中在過柱2 次后,吸附率為94.7%,而過柱5 次時的吸附率為96.4%。通過數(shù)據(jù)的比對可以得出:過柱2 次以后,吸附率增加的幅度不大,因此,出于實(shí)際操作和經(jīng)濟(jì)方面的考慮,過柱2 次為最佳選擇。
2.2.4乙醇體積分?jǐn)?shù)對稠李花色苷動態(tài)解吸率的影響
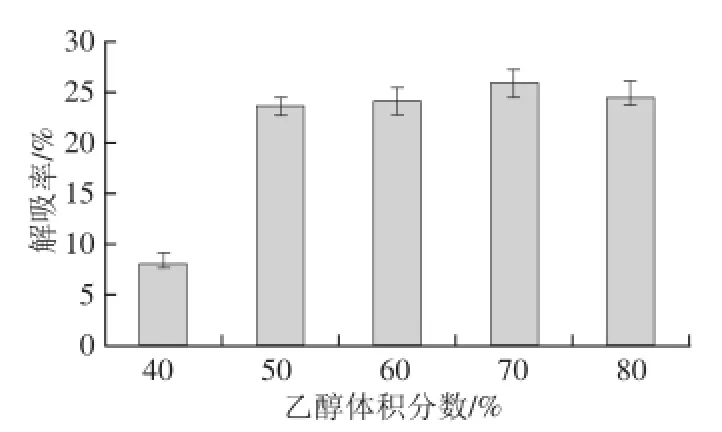
圖4 乙醇體積分?jǐn)?shù)對稠李花色苷動態(tài)解吸率的影響Fig.4 Effect of ethanol concentration on the dynamic desorption rate of Padus racemosa anthocyanins
乙醇可以使大孔樹脂溶脹,減弱大孔樹脂和被吸附物質(zhì)之間的作用力,并且能夠溶解被吸附的物質(zhì)。如圖4所示,當(dāng)乙醇體積分?jǐn)?shù)<70%時,稠李花色苷的解吸率隨著乙醇體積分?jǐn)?shù)的增大而增大;在70%時的解吸率為25.8%,而當(dāng)乙醇體積分?jǐn)?shù)>70%時,解吸率下降,在乙醇體積分?jǐn)?shù)為80%時,解吸率為24.5%。因而,乙醇的體積分?jǐn)?shù)選擇為70%。
2.2.5解吸流速對稠李花色苷動態(tài)解吸率的影響

圖5 解吸流速對稠李花色苷動態(tài)解吸率的影響Fig.5 Effect of flow rate on the dynamic desorption rate of Padus racemosa anthocyanins
如圖5所示,隨解吸流速的增加,乙醇對吸附了稠李花色苷的大孔樹脂的解吸效果呈下降趨勢,在0.01 mL/s時的解吸率為35.5%,而當(dāng)流速為0.20 mL/s時,解吸率下降至25.4%,并且隨著解吸流速的增加,解吸率略有降低,因而為獲得比較高的解吸率,解吸流速選取0.01 mL/s進(jìn)行實(shí)驗(yàn)。
2.2.6pH值對稠李花色苷動態(tài)解吸率的影響

圖6 pH值對稠李花色苷動態(tài)解吸率的影響Fig.6 Effect of pH on the dynamic desorption rate of Padus racemosa anthocyanins
pH值對稠李花色苷動態(tài)解吸率的影響如圖6所示,隨著pH值的增大,稠李花色苷的解吸率呈現(xiàn)為先上升后下降的趨勢。當(dāng)pH值為3時,解吸率最大,達(dá)68.2%,并且稠李花色苷在酸性條件下比較穩(wěn)定。因此,后續(xù)實(shí)驗(yàn)中采用實(shí)驗(yàn)條件為pH 3,以獲得最好的解吸效果。
2.3稠李花色苷的色價
按最佳純化條件進(jìn)行純化,稠李花色苷的吸附率為95.6%,解吸率為68.2%。純化前的色價為3.5,純化之后色價為57.1,純化了16.31 倍。張勇等[29]利用AB-8大孔樹脂對土豆色素進(jìn)行純化,最終純化后的色價為43.15,是純化前的8.4 倍;董周永等[30]用AB-8大孔樹脂純化紅心蘿卜花色苷,最終純化后的色價為47.8,是純化前的12 倍,證明AB-8大孔樹脂是對花色苷純化的有效方法,同時本研究得到的純化方法效果相對好一些,但是對花色苷的純化還不夠完善,還可以利用凝膠層析、膜分離技術(shù)、超濾等方法進(jìn)一步純化,并且還可采用高效液相色譜的方法對純化之后的花色苷進(jìn)行鑒定。
2.4稠李花色苷的體外抗氧化活性
按照抗氧化物抑制NBT在光下的還原作用原理,來確定花色苷體外抗氧化活性。核黃素首先被光還原,有氧化物質(zhì)存在下,被還原的核黃素在有氧條件下極易再氧化,而產(chǎn)生超氧陰離子自由基(),可將NBT還原為藍(lán)色的甲腙,后者在560 nm波長處有最大吸收,而花色苷可清除,抑制甲腙的形成[24]。于是在光還原反應(yīng)后,反應(yīng)液藍(lán)色愈深,說明花色苷的抗氧化性愈低,反之花色苷的抗氧化性愈高。由圖7可知,稠李花色苷具有體外抗氧化活性,且隨著花色苷質(zhì)量濃度的增大,其對清除能力有上升的趨勢。

圖7 稠李花色苷的體外抗氧化活性Fig.7 Antioxidant activity of Padus racemosa anthocyanins in vitro
2.5稠李花色苷對H2O2誘導(dǎo)N2A細(xì)胞損傷的保護(hù)作用
通過0.5 mmol/L的H2O2處理能夠顯著降低N2A細(xì)胞的活力。然而,加入稠李花色苷之后,可以對N2A細(xì)胞進(jìn)行保護(hù),阻止H2O2對N2A細(xì)胞的損傷,其結(jié)果如圖8、9所示。

圖8 各組N2A細(xì)胞的形態(tài)Fig.8 Mo rphology of N2A cells in four experimental groups
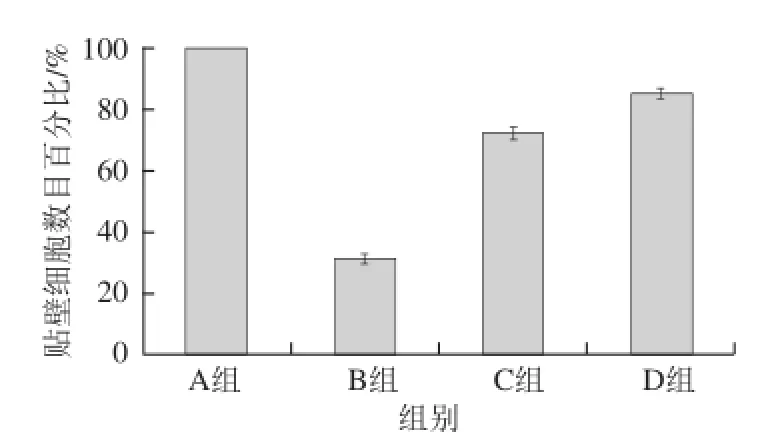
圖9 稠李花色苷對HH2O2誘導(dǎo)N2A細(xì)胞損傷的保護(hù)作用Fig.9 Protective effect of Padus racemosa anthocyanins on H2O2-induced N2A cell damage
由圖8、9可知,正常對照組的細(xì)胞折光性強(qiáng),細(xì)胞規(guī)則,貼壁狀態(tài)良好;模型組細(xì)胞變圓,折光性變?nèi)酰N壁不良,而稠李花色苷處理組細(xì)胞形態(tài)較模型組有所改善。H2O2能夠損傷細(xì)胞膜的完整性,降低細(xì)胞的活性,對細(xì)胞的損傷很大,加入濃度為0.5 mmol/L的H2O2后,顯微鏡觀察貼壁細(xì)胞數(shù)目只達(dá)到正常對照組的31.4%,但是,經(jīng)0.025 mg/mL的花色苷處理后,貼壁細(xì)胞數(shù)目為正常對照組的72.2%,與模型組比較,差異極顯著(P<0.01),經(jīng)0.05 mg/mL的花色苷處理后,貼壁細(xì)胞數(shù)目為正常對照組的84.9%,與模型組比較,差異極顯著(P<0.01)。由此,可以得出稠李花色苷對H2O2誘導(dǎo)的N2A細(xì)胞損傷具有很強(qiáng)的保護(hù)作用,能夠顯著提高細(xì)胞的活性,且具有較好的劑量-效應(yīng)關(guān)系。張麗霞等[31]通過形態(tài)學(xué)觀察、四甲基偶氮唑藍(lán)實(shí)驗(yàn)得到黑莓花色苷對H2O2誘導(dǎo)的血管內(nèi)皮細(xì)胞損傷有保護(hù)作用,Heo等[32]發(fā)現(xiàn)草莓花色苷同樣可使H2O2誘導(dǎo)損傷細(xì)胞的存活率增加,都證明了花色苷對H2O2損傷的細(xì)胞具有較好保護(hù)作用。
2.6稠李花色苷對H2O2損傷的N2A細(xì)胞內(nèi)活性氧水平的影響

圖10 稠李花色苷對HH2O2損傷的N2A細(xì)胞內(nèi)活性氧水平的影響Fig.10 Effect of Padus racemosa anthocyanin on ROS activity in N2A cells
如圖10所示,相對于正常細(xì)胞(圖10A),0.5 mmol/L H2O2處理的氧化應(yīng)激條件下,細(xì)胞熒光信號顯著增強(qiáng),說明細(xì)胞內(nèi)活性氧水平較高(圖10B),加入0.05 mg/mL稠李花色苷后,細(xì)胞內(nèi)熒光信號強(qiáng)度顯著降低(圖10C),說明細(xì)胞內(nèi)活性氧水平降低,即稠李花色苷能夠抑制細(xì)胞氧化應(yīng)激。Ullah等[33]通過活性氧的熒光實(shí)驗(yàn),也同樣證明了花色苷能夠降低細(xì)胞內(nèi)活性氧水平。
3 結(jié) 論
本實(shí)驗(yàn)確定了AB-8大孔樹脂純化稠李花色苷最佳條件為:吸附流速為0.01 mL/s,粗提液質(zhì)量濃度為8 mg/mL,過柱2 次;解吸劑乙醇體積分?jǐn)?shù)為70%,解吸流速為0.01 mL/s,pH值為3。純化之后稠李花色苷的色價為57.1,純化了16.31 倍。分離純化的稠李花色苷對O2-·清除能力較強(qiáng),并存在劑量-效應(yīng)關(guān)系;稠李花色苷對H2O2誘導(dǎo)的N2A細(xì)胞損傷具有較強(qiáng)的保護(hù)作用,DCFH-DA法觀察稠李花色苷具有較好的降低細(xì)胞內(nèi)活性氧水平作用,說明稠李花色苷具有較好的體外抗氧化活性。本研究為稠李花色苷深加工和保健食品的開發(fā)利用提供了基礎(chǔ)資料和理論依據(jù),但是有關(guān)稠李果實(shí)花色苷對H2O2誘導(dǎo)的N2A細(xì)胞損保護(hù)作用的確切機(jī)制以及對正常細(xì)胞的影響如何,還有待進(jìn)一步研究。
[1] 俞德浚. 中國植物志[M]. 北京: 科學(xué)出版社, 1986: 89-104.
[2] 辛越, 劉榮, 何嬌, 等. 稠李屬三種果實(shí)花色苷對HepG2細(xì)胞的增殖抑制作用比較[J]. 食品工業(yè)科技, 2013, 34(9): 348-355.
[3] 鄧潔紅, 譚興和, 王鋒, 等. 刺葡萄皮花色苷的分離與檢定[J]. 中國食品學(xué)報, 2010, 10(1): 200-205.
[4] LALA G, MALIK M, ZHAO Cuiwei, et al. Anthocyanin-rich extracts inhibit multiple biomarkers of colon cancer in rats[J]. Nutrition and Cancer, 2006, 54(1): 84-93.
[5] CHEN Peini, KUO W H, CHIANG C L, et al. Black rice anthocyanins inhibit cancer cells invasion via repressions of MMPs and u-PA expression[J]. Chemico-Biological Interactions, 2006, 163(3): 218-229.
[6] NETZEL M, NETZEL G, KAMMERER D R, et al. Cancer cell antiproliferation activity and metabolism of black carrot anthocyanins[J]. Innovative Food Science and Emerging Technologies,2007, 8(3): 365-372.
[7] 王湛, 付鈺潔, 常徽, 等. 桑葚花色苷的提取及對人乳腺癌細(xì)胞株MDA-MB-453生長的抑制[J]. 第三軍醫(yī)大學(xué)學(xué)報, 2011, 33(10):988-990.
[8] 宋雪, 韓勇, 籍保平, 等. 篤斯越橘花色苷提取物對光損傷人視網(wǎng)膜色素上皮細(xì)胞的保護(hù)作用[J]. 食品科學(xué), 2010, 31(21): 324-328.
[9] 王書凱, 徐善光, 高千榮, 等. 稠李和紫葉稠李的形態(tài)識別及園林應(yīng)用[J]. 遼寧林業(yè)科技, 2010(1): 55-59.
[10] 王光全, 黃勇, 孟慶杰, 等. 紫葉稠李色素提取及測定研究[J]. 食品科學(xué), 2007, 28(7): 178-181.
[11] 劉榮, 辛越, 何嬌, 等. 山桃稠李果實(shí)花色苷對HepG2細(xì)胞抗氧化系統(tǒng)的影響[J]. 食品工業(yè)科技, 2013, 34(15): 66-69.
[12] 王振宇, 任健, 張寧, 等. 稠李屬果實(shí)色素理化性質(zhì)研究[J]. 食品科學(xué), 2010, 31(17): 92-97.
[13] 譚仁祥. 植物成分分析[M]. 北京: 科學(xué)出版社, 2002: 67-87.
[14] 高孔榮, 黃惠華, 梁照為. 食品分離技術(shù)[M]. 廣州: 華南理工大學(xué)出版社, 1998: 5-7.
[15] EL-MEKKAWY S, MESELHY M R, NAKAMURA N, et al. Anti-HIV-1 and anti-HIV-1-protease substances from Ganoderma lucidum[J]. Phytochemistry, 1998, 49(6): 1651-1657.
[16] 焦巖, 王振宇. 藍(lán)靛果花色苷超聲波輔助提取優(yōu)化及其降血脂作用[J].中國食品學(xué)報, 2010, 10(2): 52-59.
[17] 肖軍霞, 黃國清. 紅樹莓花色苷的提取及抗氧化活性研究[J]. 食品科學(xué), 2011, 32(8): 15-18.
[18] 郭慶啟, 張娜, 付立營, 等. 大孔樹脂法純化樹莓花色苷及初步鑒定[J].食品與發(fā)酵工業(yè), 2010, 36(6): 177-180.
[19] 李穎暢, 鄧鳳娥, 孟憲軍. 大孔樹脂純化藍(lán)莓果中花色苷的研究[J].食品與生物技術(shù)學(xué)報, 2009, 28(4): 496-500.
[20] 孫健, 蔣躍明, 彭宏祥, 等. 紅毛丹果皮色素的提取及其穩(wěn)定性的研究[J]. 食品科學(xué), 2009, 30(11): 71-75.
[21] 韓林, 張海德, 萬婧, 等. 檳榔紅色素的提取工藝優(yōu)化及穩(wěn)定性研究[J].食品科學(xué), 2010, 31(4): 1-5.
[22] 凌關(guān)庭. 天然食品添加劑手冊[M]. 北京: 化學(xué)工業(yè)出版社, 2000:226-228.
[23] 劉劍利, 曹向宇. 小米多肽的制備及其抗氧化功能研究[J]. 食品科學(xué), 2009, 30(8): 64-67.
[24] 呂淑霞. 基礎(chǔ)生物化學(xué)實(shí)驗(yàn)指導(dǎo)[M]. 北京: 中國農(nóng)業(yè)大學(xué)出版社,2003: 77-82.
[25] 楊莉, 袁丁, 代艷文, 等. 竹節(jié)參總提物對H2O2誘導(dǎo)SH-SY5Y神經(jīng)細(xì)胞損傷的保護(hù)作用[J]. 第三軍醫(yī)大學(xué)學(xué)報, 2014, 36(2): 143-169.
[26] 王海濤, 林潔, 楊波, 等. 過氧化氫誘導(dǎo)人巨核細(xì)胞系Dami氧化應(yīng)激模型的建立及評價[J]. 解放軍醫(yī)學(xué)院學(xué)報, 2014, 35(4): 349-356.
[27] 冷梅, 劉榮. 紫葉稠李果實(shí)花色苷的抗氧化活性[J]. 食品科學(xué), 2013,34(11): 67-71. doi: 10.7506/spkx1002-6630-201311016.
[28] 王華, 菅蓁. 大孔吸附樹脂純化葡萄果皮花色素苷的研究[J]. 食品科學(xué), 2008, 29(1): 86-90.
[29] 張勇, 李彩霞, 麻貝貝, 等. 大孔吸附樹脂純化“黑美人”土豆色素研究[J]. 食品工業(yè)科技, 2012, 33(2): 345-409.
[30] 董周永, 阿嘎, 趙國建. 等. 大孔樹脂對紅心蘿卜花色苷的純化[J].食品科學(xué), 2011, 32(4): 21-24.
[31] 張麗霞, 周劍忠, 黃開紅, 等. 黑莓花色苷對過氧化氫誘導(dǎo)血管內(nèi)皮細(xì)胞損傷的保護(hù)作用[J]. 食品科學(xué), 2013, 34(13): 257-261. doi:10.7506/spkx1002-6630-201313054.
[32] HEO H J, LEE C Y. Strawberry and its anthocyanins reduce oxidative stress-induced apoptosis in PC12 cells[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 1984-1999.
[33] ULLAH I, PARK H Y, KIM M O, et al. Anthocyanins protect against kainic acid-induced excitotoxicity and apoptosis via ROS-activated AMPK pathway in hippocampal neurons[J]. CNS Neuroscience and Therapeutics, 2014, 20(4): 327-338.
Purification and in vitro Antioxidant Activity of Anthocyanins from Padus racemosa
Purpose: To establish the best purification conditions for anthocyanins from the fruit pulp of Padus racemosa with AB-8 macroporous resin and detect the in vitro antioxidant activity of the extracted anthocyanins. Methods: The adsorption and desorption properties of macroporous resin AB-8 for anthocyanins from Padus racemosa were investigated to optimize the purification procedure, and the antioxidant activity in vitro was detected by nitroblue tetrazolium (NBT) photochemical reduction method. The protective effect of the extracted anthocyanins against oxidative stress induced by H2O2in N2A cells was analyzed by 2',7'-dichlorodihydrofluorescein diacetate (DCFH-DA) fluor escent probe assay. Results: The best purification conditions were achieved by adsorption performed twice with at a flow rate of 0.01 mL/s after adjustment of the crude extract concentration to 8 mg/mL and subsequent desorption with 70% ethanol acidified to pH 3 at a flow rate of 0.01 mL/s. The color value after purification was 57.1, achieving a 16.31-fold purification factor. The anthocyanins had a strong superoxide anion radical scavenging capacity in a dose-dependent manner. N2A cells could be protected by the anthocyanins at a concentration of 0.025 mg/mL, and the level of reactive oxide species in N2A cells could be reduced by the anthocyanins at 0.05 mg/mL. Conclusion: Macroporous resin AB-8 is an effective adsorbent for the purification of Padus racemosa anthocyanins, and Padus racemosa anthocyanins have strong antioxidant activity in vitro in a certain concentration range.
Pad us racemosa; anthocyanin; purification; macroporous resin; antioxidant; reactive oxide species
TS264.4
A
1002-6630(2015)15-0005-06
10.7506/spkx1002-6630-201515002
2014-10-05
國家自然科學(xué)基金委員會科學(xué)部主任基金項(xiàng)目(31240005);遼寧省高等學(xué)校優(yōu)秀人才支持計(jì)劃項(xiàng)目(LJQ2013002);遼寧省高等學(xué)校科學(xué)研究一般項(xiàng)目(L2014007);遼寧省科技廳農(nóng)業(yè)攻關(guān)計(jì)劃項(xiàng)目(2011211001);遼寧大學(xué)博士科研啟動項(xiàng)目
劉劍利(1980—),男,副教授,博士,研究方向?yàn)槭称飞锛夹g(shù)。E-mail:liujianli119@163.com
曹向宇(1980—),男,教授,博士,研究方向?yàn)槭称飞锛夹g(shù)。E-mail:xycaolnu@163.com

