一種米曲霉蛋白酶的分離純化及酶解特性研究
宗 紅,馮穎杰,陸信曜,諸葛斌,*,方慧英,孫 進,馮 倩,樓笑笑,程英雀(1.江南大學糖化學與生物技術教育部重點實驗室,江蘇無錫141;.江南大學工業生物技術教育部重點實驗室,工業微生物研究室,江蘇無錫141;.浙江正味食品有限公司,浙江省調味食品制造工程技術研究中心,浙江義烏000)
一種米曲霉蛋白酶的分離純化及酶解特性研究
宗紅1,2,馮穎杰1,2,陸信曜1,2,諸葛斌1,2,*,方慧英1,2,孫進3,馮倩3,樓笑笑3,程英雀2
(1.江南大學糖化學與生物技術教育部重點實驗室,江蘇無錫214122;2.江南大學工業生物技術教育部重點實驗室,工業微生物研究室,江蘇無錫214122;3.浙江正味食品有限公司,浙江省調味食品制造工程技術研究中心,浙江義烏322000)
對米曲霉固態發酵所產蛋白酶分離純化,采用硫酸銨鹽析、DEAE-FF層析、Butyl-HP層析和Superdux 75 10/300GL凝膠層析得到一種電泳純的蛋白酶,SDS-PAGE顯示分子量大小為27 ku左右。以酪蛋白為底物時,該蛋白酶Km=1.23 g·L-1,Vm=27.03 μg·mL-1·min-1,最適反應條件為50℃,pH9.0。該蛋白酶對酪蛋白水解活性最高,而對牛血清蛋白的水解活性很低;對牛胰島素B鏈上-Phe-Val-,-Cys-Gly-,-Glu-Ala-和-Arg-Gly-組成的肽鍵有較強的切割能力,酶切位點較多,對疏水性氨基酸具有較高的選擇性,為米曲霉所產蛋白酶在食品上的應用提供有力的參考。
米曲霉,蛋白酶,分離純化,酶切位點
微生物法產蛋白酶以其生長繁殖快、培養條件簡單、生產成本低廉以及便于生產控制等優勢而逐漸成為蛋白酶制劑的主要生產方式[1],越來越多的微生物蛋白酶應用于食品生產。由于食品安全日益受到全球人們的重視,因此,對于安全微生物所產蛋白酶的研究顯得尤為重要。米曲霉作為美國FDA公布的安全菌株廣泛應用于食品行業[2],其蛋白酶酶系豐富,具有廣泛的應用范圍。
目前米曲霉蛋白酶的研究大多集中在提高酶活及初步分離等方面[3-5],曾小波等[6]從米曲霉所產酶系中初步分離出了一種內肽酶和一種外肽酶,馬俊陽等[7]獲得了兩種不同蛋白酶并對其酶學性質進行了初步研究,除此之外關于米曲霉各蛋白酶組分酶解特性及其酶切方式的深入研究較少,從而影響了對米曲霉蛋白酶的充分利用。不同的蛋白酶作用于蛋白質肽鏈的不同位置,對氨基酸殘基形成的肽鍵有其酶解專一性,不同的蛋白酶作用于同一底物時,會產生不同的氨基酸或肽水解物,從而使蛋白水解物呈現不同的口味及功能特性,因此,為應對不同的生產需求,需要發現更多的蛋白酶,不同食品用安全蛋白酶的獲得及其酶解特性研究對于蛋白酶食品業應用的深度開發具有重要意義。
本研究對一株米曲霉所產蛋白酶系進行了分離純化,并對獲得的蛋白酶組分進行酶解特性及酶切方式研究,為米曲霉所產蛋白酶在食品上的應用提供指導。
1 材料與方法
1.1材料與儀器
米曲霉(Aspergillus oryzae)為本研究中心篩選和保藏;牛胰島素氧化B鏈購自Sigma公司;酪蛋白、牛血清白蛋白購自國藥集團化學試劑公司;麩皮、豆粕、馬鈴薯為市售;其他試劑均為國產分析純。
AKTA蛋白純化儀GE公司;可見光分光光度計WFJ7200 Unic上海儀器有限公司。
1.2實驗方法
1.2.1培養基米曲霉固態發酵培養基:麩皮5 g,豆粕5 g,水10 mL,裝瓶于500 mL三角瓶,攪拌混勻。
1.2.2粗酶液的制備將制備好的孢子懸浮液接種于固態培養基中,30℃靜置培養36 h,每隔6 h翻曲一次。發酵結束后加入3倍質量的無菌生理鹽水,40℃浸提1 h,用八層紗布過濾后,濾液經冷凍離心機8000 r/min離心30 min,取上清即為粗酶液。
1.2.3蛋白酶的分離純化將粗酶液加入(NH4)2SO4至40%飽和度去除雜質,用70%飽和度的(NH4)2SO4沉淀蛋白酶,透析后的樣品上樣于用20 mmol/L Tris-HCl(pH8.5)平衡過的DEAE-FF層析柱,待穿透蛋白充分洗下后,用含0.5 mol/L NaCl的緩沖液線性洗脫,收集酶活組分并等體積加入3 mol/L(NH4)2SO4溶液,上樣于1.5 mol/L(NH4)2SO4-20 mmol/L Tris-HCl(pH7.5)緩沖液平衡好的Butyl-HP層析柱,用不含(NH4)2SO4的緩沖液線性洗脫,收集蛋白酶活性組分;得到的樣品繼續上樣于20 mmol/L Tris-HCl平衡后的Superdux 75 10/300GL凝膠層析柱,收集酶活組分。
1.2.4蛋白酶酶活測定采用Folin-酚法[8],以2%的酪蛋白為底物。
1.2.5蛋白含量測定采用Brad-Ford法[9],以牛血清白蛋白為標準。
1.2.6蛋白酶分子量及酶譜檢測分子量檢測采用SDS-PAGE測定分子量[10];酶譜檢測按照SDS-PAGE稍加改進[11],樣品與上樣緩沖液混合后不經煮沸處理,低溫(冰浴)電泳后,脫色搖床上用2%Triton X-100的振蕩30 min以脫去凝膠中的SDS,0.1 mol/L pH7.2磷酸鹽緩沖液洗膠3次,置于2%酪蛋白溶液中40℃水解30 min后,染色及脫色。
1.2.7酶學性質測定
1.2.7.1最適溫度與溫度穩定性在不同的溫度下測定蛋白酶酶活,測定最適酶反應溫度;把蛋白酶分別放置于不同溫度(30、40、50、60℃)保溫30、60、90、120 min后,40℃下測定酶活,測定酶的溫度穩定性。
1.2.7.2最適pH與pH穩定性用不同的緩沖系統,檸檬酸-檸檬酸鈉(pH4.0~6.0),Tris-HCl(7.0~8.0),硼砂-NaOH(9.0~11.0),配制成酪素溶液,測定蛋白酶的最適pH;用不同的pH的緩沖液調節酶液pH到3.0~10.0,40℃保持1 h,調節回最適pH測定酶活。以調節前的酶活作為100%酶活,計算相對酶活。
1.2.7.3金屬離子的影響向酶液中分別加入不同的金屬離子(Cu2+、Ca2+、Mn2+、Zn2+、Mg2+、Fe3+、Fe2+、Ni2+、Co2+),使金屬離子終濃度分別達到5 mmol/L和10 mmol/L。40℃放置1 h后,測定酶活,以未加入金屬離子時的酶活為100%,計算相對酶活。
1.2.7.4米氏常數測定在蛋白酶的最適條件下,以不同濃度的酪蛋白溶液(1、2、5、10、15、20 g/L)為底物測定酶活,以濃度的倒數1/[S]為橫坐標,反應速率的倒數1/V為縱坐標,利用雙倒數作圖確定Vm與Km。
1.2.8底物選擇性選擇2%濃度的酪蛋白、牛血清白蛋白、大豆分離蛋白為底物,用Folin-酚法測定蛋白酶P酶活,底物濃度均為2%,以酪蛋白為底物時的酶活為100%,計算相對酶活。
1.2.9酶切位點測定用蛋白酶水解牛胰島素氧化B鏈,水解液通過MALDI-TOF-MS檢測酶解肽段分子量,與牛胰島素氧化B鏈的隨機片段比對,得到酶解肽段的氨基酸序列,與牛胰島素氧化B鏈氨基酸序列對比,確定蛋白酶的酶切位點[12]。
2 結果與分析
2.1米曲霉蛋白酶的分離純化
粗酶液經過硫酸銨鹽析、透析后上樣于DEAEFF層析柱、Butyl-HP層析柱和Superdux 75 10/300GL凝膠層析柱,最后經過透析、超濾,得到電泳純的蛋白酶P(圖1)。經過純化,蛋白酶P的比活力達到了6450 U/mg,純化倍數為6.26倍,回收率為4.5%(表1)。

表1 蛋白酶P純化結果Table 1 Purification of protease P from Aspergillus oryzae
2.2米曲霉蛋白酶的分子量及酶譜分析
將純化后的蛋白酶P進行SDS-PAGE和酶譜分析(圖2),純化出的蛋白酶P只有一條帶,條帶清晰,純度達到電泳純,分子量約為27 ku左右。相應的酶譜條帶為單一的亮帶,結合分析其SDS-PAGE條帶,說明該蛋白酶為單亞基的蛋白,由一條肽鏈折疊形成。該酶分子量大小與Vishwanatha[12]、湯鳴強[13]和馬俊陽等[7]純化的蛋白酶均不相同,推測該酶是新發現的蛋白酶,這將為米曲霉蛋白酶的進一步應用提供依據。

圖1 米曲霉蛋白酶的層析洗脫曲線Fig.1 Elution profile of Aspergillus oryzae protease on Chromatography
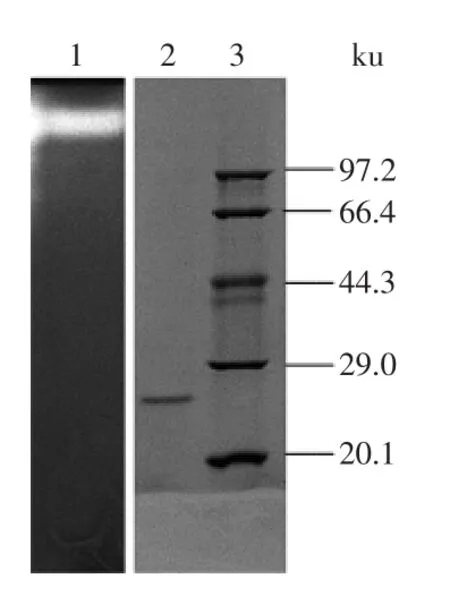
圖2 蛋白酶P的SDS-PAGE與酶譜分析Fig.2 SDS-PAGE and zymography analysis of the purified P
2.3蛋白酶P的pH及溫度特性
考察了pH、溫度對蛋白酶P活性及穩定性的影響,結果如圖3、圖4所示。蛋白酶P的最適pH為9.0,最適溫度為50℃。pH6~10條件下,酶活維持在90%以上;40℃放置120 min,酶活在95%以上,酶活穩定性較好。
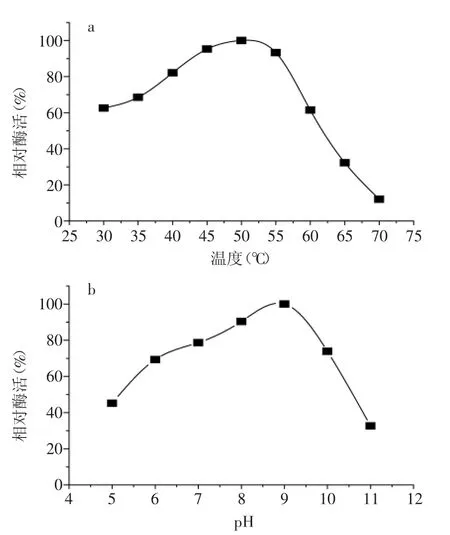
圖3 pH、溫度對蛋白酶P酶活的影響Fig.3 Effect of pH and temperature on enzyme activity of P
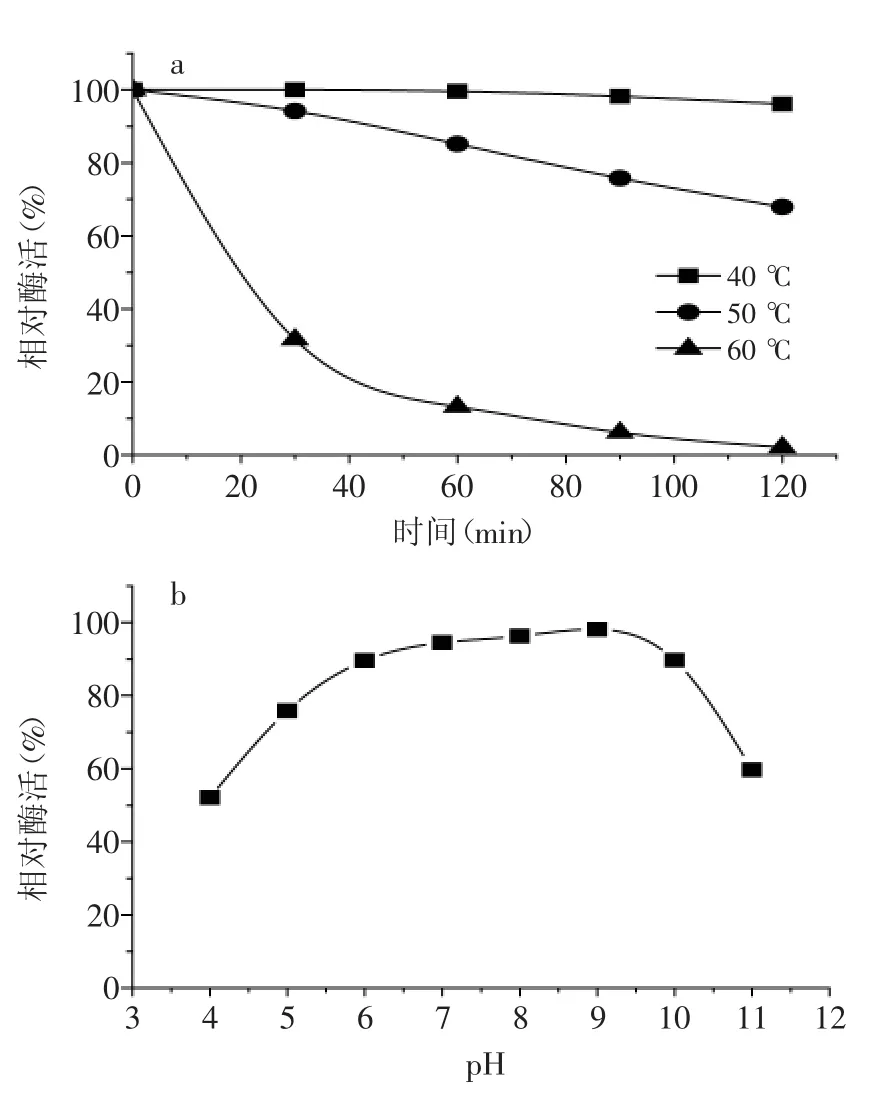
圖4 pH、溫度對蛋白酶P穩定性的影響Fig.4 Effect of pH and temperature on the enzyme stability of P
2.4蛋白酶P的動力學
以酪蛋白為底物,分別在不同底物濃度下測定蛋白酶P的活性。以底物濃度和產物(酪氨酸)生成量作圖,以1/S為橫坐標,1/V為縱坐標,得到蛋白酶P的雙倒數曲線如圖5所示,經米氏方程計算,得到P的表觀米氏常數Km=1.23g·L-1,Vm=27.03 μg·mL-1·min-1。Km值反映了酶與底物的親和力,較低的Km值說明蛋白酶P與酪蛋白具有較高的親和力。

圖5 蛋白酶P的米氏方程作圖Fig.5 Plot of Michaelis-Menten equation of P
2.5金屬離子對蛋白酶P酶活的影響
不同濃度金屬離子對蛋白酶P酶活的影響如圖6所示。Cu2+、Ca2+、Fe3+、Fe2+、Mg2+、Zn2+、Ni2+及Co2+對蛋白酶P均有不同程度的抑制作用,而Mn2+對蛋白酶P有激活作用,可以提高其酶活。
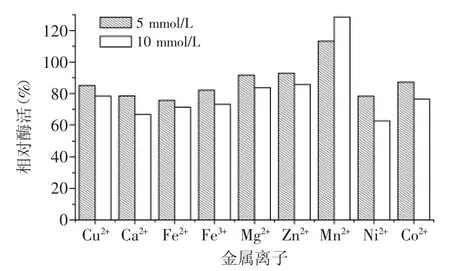
圖6 金屬離子對蛋白酶P酶活的影響Fig.6 Effect of metal ion on enzyme activity of P
2.6蛋白酶P的底物選擇性及酶切位點
考察了蛋白酶P對酪蛋白(Casein)、牛血清白蛋白(BSA)和大豆分離蛋白(SPI)三種不同底物的水解活性(表2)。蛋白酶P對Casein的水解活性最高,其次為SPI,最差的是BSA。這與底物特性及蛋白酶的肽鍵選擇性有密切聯系,Casein是典型的疏水性蛋白,而BSA是一種親水性蛋白,其肽鏈中疏水性氨基酸的比例相對較低,此表明蛋白酶P對疏水氨基酸構成的肽鍵有較強的選擇性。

表2 蛋白酶P對不同蛋白底物的水解活性Table 2 Activity of P against different proteins
通過以上實驗可知,蛋白酶P對于由疏水性氨基酸構成的肽鍵有相對較強的選擇性。為了明確這一特性,以牛胰島素氧化B鏈為底物,用MALDI-TOFMS測定牛胰島素B鏈酶解后片斷的分子量,并與牛胰島素氧化B鏈隨機片斷的分子量比對,以此確定蛋白酶P在胰島素B鏈上的酶切位點,如表3所示。可以看出蛋白酶P對牛胰島素B鏈的-Phe-Val-,-Cys-Gly-,-Glu-Ala-和-Arg-Gly-組成的肽鍵有較強的切割能力,表明該蛋白酶對Phe、Val、Ala、Gly等疏水性氨基酸具有較高的選擇性。

表3 蛋白酶P在胰島素B鏈上的酶切位點Table 3 Cleavage sites of P on the oxidized insulin B chain
3 結論
米曲霉蛋白酶以其安全性高和酶系豐富等優點廣泛應用于食品行業中,研究不同蛋白酶的酶解特性對于擴展其在食品中的應用具有重要意義。本文利用硫酸銨鹽析、DEAE-FF層析、Butyl-HP層析和Superdux 75 10/300GL凝膠層析從米曲霉所產酶系中分離純化出一種蛋白酶組分P,達到電泳純,分子量約為27 ku左右,蛋白酶P的最適溫度為50℃,最適pH為9.0,pH6~10內酶活穩定,40℃放置120 min,酶活仍能保持95%以上。
以Casein、SPI和BSA三種天然蛋白為底物時,蛋白酶P對疏水性蛋白Casein有較高的水解活性,說明該酶對蛋白底物中的疏水性肽鍵具有很強的切割能力;通過對蛋白酶P水解牛胰島素氧化B鏈得到的肽段進行研究發現,蛋白酶P對牛胰島素B鏈的-Phe-Val-,-Cys-Gly-,-Glu-Ala-和-Arg-Gly-組成的肽鍵有較強的切割能力,進一步表明該酶對疏水性氨基酸組成的肽鍵有較高的選擇性。一般來說,多肽中疏水性氨基酸的含量越多苦味越強,而本研究分離純化獲得的蛋白酶P對疏水性氨基酸具有很強的選擇性,因此可在一定程度上降低多肽的苦味,為其在食品中的應用提供理論指導。
[1]張樹政.酶制劑工業[M].北京:科學出版社,1996:5.
[2]劉麗萍,劉麗華.米曲霉研究進展與應用[J].中國調味品,2008(4):28-32.
[3]傅力,章運,涂振東.米曲霉高產蛋白酶菌株的選育及在醬油釀造中的應用研究[J].新疆農業科學,2009,46(6):1274-1278.
[4]楊秋明,肖安風,楊遠帆,等.米曲霉的定向發酵[J].重慶理工大學學報,2011,25(2):53-58.
[5]李艷麗,徐少春,徐堯興.中性蛋白酶高產菌株的篩選及產酶酶系分析[J].生物技術,2007,17(1):20-23.
[6]曾小波,伍麗瑜,宋小焱,等.醬油曲蛋白酶的分離及催化性質研究[J].中國調味品,2010,35(1):50-52.
[7]馬俊陽,諸葛斌,方慧英,等.米曲霉蛋白酶的分離純化及酶學性質研究[J].微生物學通報,2014,41(1):83-89.
[8]Kembhavi AA,Kulkarni A.Pant A.Salt-tolerant and thermostable alkaline protease from Bacillus subtilis NCIM No. 64[J].Appl Biochem Biotechnol,1993(38):83-92.
[9]Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976(72):248-254.
[10]汪家政,范明.蛋白質技術手冊[M].北京:科學出版社,2000.
[11]Haddar A,Bougatef A,Agrebi R,et al.A novel surfactantstable alkaline serine-protease from a newly isolated Bacillus mojavensis A21.purification and characterization[J].Process Biochem,2009,44(1):29-35.
[12]Vishwanatha KS,Appu Rao AG,Singh SA.Characterisation of acid protease expressed from Aspergillus oryzae MTCC 5341[J].Food Chemistry,2009(114):402-407.
[13]湯鳴強,曾小芳.米曲霉F-81菌株產中性蛋白酶的分離純化[J].生物技術通報,2010(4):194-197.
Purification and characterization of a protease from Aspergillus oryzae
ZONG Hong1,2,FENG Ying-jie1,2,LU Xin-yao1,2,ZHUGE Bin1,2,*,FANG Hui-ying1,2,SUN Jin3,FENG Qian3,LOU Xiao-xiao3,CHENG Ying-que2
(1.The Key Laboratory of Carbohydrate Chemisty and Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.The Key Laboratory of Industrial Biotechnology,Ministry of Education,the Research Centre of Industrial Microbiology,Jiangnan University,Wuxi 214122,China;3.Zhejiang Zhengwei Food Co.Ltd.,Research Center of Seasoning Food Processing of Zhejiang,Yiwu 322000,China)
This study aimed to purify and characterize protease from Aspergillus oryzae.Ammonium sulfate precipitation,DEAE-FF anion exchange chromatography,Butyl-HP chromatography and Superdux 75 10/300GL gel filtration chromatography were used to purify the protease from A.oryzae.The molecular weights of the protease was approximately 27 ku.Using casein as a substrate,the Kmwas 1.23g·L-1,and the Vmwas 27.03 μg·mL-1·min-1.Moreover,the optimum conditions of the protease were 50℃ and pH9.0.The protease had the highest hydrolytic activity to casein while lowest activity to BSA(Bull Serum Albumin).The protease had cleavage ability between-Phe-Val-,-Cys-Gly-,-Glu-Ala and-Arg-Gly-residues in bovine insulin chain B,showing a wide range of residue specificity and high selectivity to hydrophobic amino acids.The results provided a reference for use of proteases from A.oryzae in food industry.
Aspergillus oryzae;protease;purification;cleavage site
TS201.1
A
1002-0306(2015)20-0210-05
10.13386/j.issn1002-0306.2015.20.036
2015-03-01
宗紅(1981-),女,博士,講師,研究方向:發酵工程,E-mail:zonghong163@163.com。
諸葛斌(1969-),男,博士,教授,研究方向:生物工程,E-mail:Bzhuge@163.com。
浙江省重大科技專項計劃項目(2012C12004-3)。

