梅毒螺旋體Tp0844重組蛋白的表達、純化及免疫反應性研究
劉雙全 劉瓊
梅毒螺旋體Tp0844重組蛋白的表達、純化及免疫反應性研究
劉雙全 劉瓊
目的 克隆、表達梅毒螺旋體重組蛋白Tp0844,純化表達產物并進行免疫反應性分析,篩選與宿主具有高反應性的Tp主要蛋白。方法 通過生物信息學分析,獲取Tp0844基因序列,構建原核載體進行誘導表達;Ni-NTA親合層析柱純化重組蛋白,Western印跡法檢測其重組蛋白與梅毒陰陽性血清的反應情況。結果 成功構建PET-30a(+)-Tp0844原核表達重組體,經誘導表達后發現該重組體可高表達出可溶性的重組蛋白,經親和層析純化后獲得了相對分子質量為43 000的重組蛋白;以梅毒IgG抗體陰、陽性血清為一抗,采用Western印跡法檢測發現,Tp0844重組蛋白與梅毒陽性血清能發生明顯特異反應,而與健康陰性血清未出現反應條帶。結論 可溶性重組表達的Tp0844蛋白具有較好的免疫反應性,可作為梅毒發病機制研究的候選抗原。
蒼白密螺旋體;重組蛋白質類;TP0844;免疫學;免疫反應性
梅毒是由梅毒螺旋體(Treponema Pallidun,Tp)感染引起的危害人類健康的性傳播疾病[1]。其不僅可嚴重損害人體的多個器官,還可由母體經胎盤垂直傳播給胎兒,引起早產、流產、死胎和畸胎或胎傳梅毒,嚴重影響出生人口質量[2]。如何有效控制和預防梅毒,已成為普遍關注的公共衛生問題,而進行梅毒早期診斷方法研究以及闡明Tp的發病機制是控制本病的關鍵環節。由于Tp不能體外連續人工培養,對于其發病機制研究進展緩慢。近年來,基因序列分析發現,Tp缺乏明顯的毒力因子編碼基因,包括革蘭陰性細菌常見的內毒素(脂多糖)、Ⅲ型分泌系統、熱休克蛋白等細胞毒因子的編碼基因[2-5]。因而,篩選與宿主具有高反應性的Tp主要蛋白或膜蛋白等致病因素是進行Tp發病機制研究的關鍵。本研究經篩選、克隆表達、鑒定Tp0844重組蛋白并進行免疫反應性的研究,現報告如下。
資料與方法
一、主要試劑和材料
1.菌株與載體:Tp Nichols標準株、PET-30a(+)質粒、表達宿主菌E.coliBL-21均為本室保存。
2.主要試劑:蛋白相對分子質量標準,限制性內切酶、T4連接酶、DNA相對分子質量標準、PCR產物純化試劑盒、質粒提取試劑盒,辣根過氧化酶標羊抗人IgG,Taq PCR mix,Ni-NTA親和層析柱均購于德國Qiagen公司,梅毒陽性血清標本為經梅毒螺旋體明膠凝集試驗(TPPA)確證梅毒患者血清;梅毒陰性標本為健康體檢中心健康對照血清,用酶聯免疫吸附試驗(ELISA)和Trust初篩陰性標本。
作者單位:421001湖南衡陽,南華大學附屬第一醫院檢驗科
3.主要儀器:德國Biometra公司生產梯度PCR儀;美國Beckman公司生產DU640核酸蛋白定量分析儀。
二、方法
1.Tp基因組DNA的提取:取Tp Nichol株感染新西蘭兔睪丸組織析出物于滅菌試管中,于水浴搖床150×g振蕩3 h,滅菌紗布過濾,取濾出物制備Tp DNA模板,操作按照Qiagen全基因組提取試劑盒說明進行。
2.Tp0844基因的擴增:從基因庫中查詢Tp0844基因序列,軟件分析選去除信號肽序列,設計1對PCR擴增引物:P1(BamHⅠ酶切位點):5′-GGATCCATGAGAGTTGCAATCAAT-3′,P2(EcoRⅠ酶切位點)5′-GAATTCCTACCGCTTCTGCGAGAT-3′,引物由上海生工生物工程技術服務有限公司合成。以Tp Nichols株的基因組DNA為模板,PCR擴增Tp0884基因,94℃預變性 3 min;94℃變性 30 s,46℃退火30 s,72℃延伸1 min,共30個循環;循環結束后再72℃終延伸5 min。取PCR產物經1%瓊脂糖電泳,在紫外燈下觀察結果。
3.Tp0844重組表達質粒的構建和鑒定:通過BamH和EcoRI酶切位點將Tp0844基因克隆進pET-30a(+)質粒中構建重組質粒pET-30a(+)/Tp0844,篩選陽性質粒,作酶切鑒定和PCR鑒定,初步鑒定的陽性質粒送上海市英濰捷基公司測序。經測序鑒定的重組質粒轉化至表達宿主菌E.coliBL21中構建重組表達體。
4.Tp0844基因的誘導表達:挑選單個陽性菌落37℃培養過夜,次日取培養物1∶50接種繼續培養至菌體A600=0.6時,加入IPTG(終濃度1.0 mmol/L)37℃誘導培養4 h,同時設未誘導組及陰性對照組。離心收集菌體,用超聲波破碎菌體后離心收集沉淀與上清,SDS-PAGE電泳分析表達結果。
5.Tp0844重組蛋白的純化:大量誘導表達重組菌,收集菌體,用緩沖液PBS浮菌并加入適量的溶菌酶作用,超聲波破碎菌體,離心收集上清上Qiagen Ni-NTA親和層析柱純化,具體操作見說明書。純化產物作SDS-PAGE分析。
6.Western印跡分析重組蛋白的免疫反應性:以1∶100稀釋的經TPPA法確證的梅毒陽性或健康血清(陰性對照)為一抗,二抗為辣根過氧化酶標山羊抗人IgG(1∶10 000稀釋),利用增強化學發光法(enhanced chemiluminescent detection,ECL)顯色,暗室曝光顯影,檢測特異性條帶。
結 果
1.Tp0844基因的克隆與鑒定:PCR產物經1%瓊脂糖電泳,在約1 000 bp位置可見一明顯特異性條帶,片段大小與預期一致(圖1)。切膠回收PCR產物,并連接 PET-30a(+)載體,酶切鑒定(圖 2),可見兩株克隆菌均正確,經測序鑒定證明插入片段為Tp0844目的基因,序列測定結果與基因庫上發表的序列完全一致。
2.重組蛋白的誘導、表達與純化:將重組質粒轉化至E.coliBL21表達宿主菌,挑選陽性重組菌進行IPTG誘導表達。SDS-PAGE分析發現在相對分子質量為43 000處有一明顯蛋白條帶,與預期的相對分子質量大小相符(圖3,4),IPTG濃度在1 mmol/L誘導時間為6 h時蛋白表達量最大,并且發現表達蛋白主要存在于上清中。
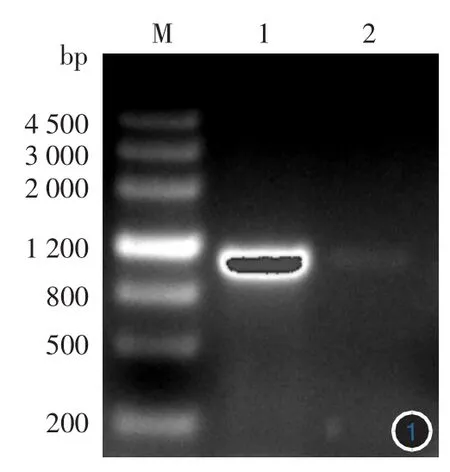
圖1 Tp0844基因PCR擴增結果 M:標準參照物;1:PCR擴增產物;2:陰性對照
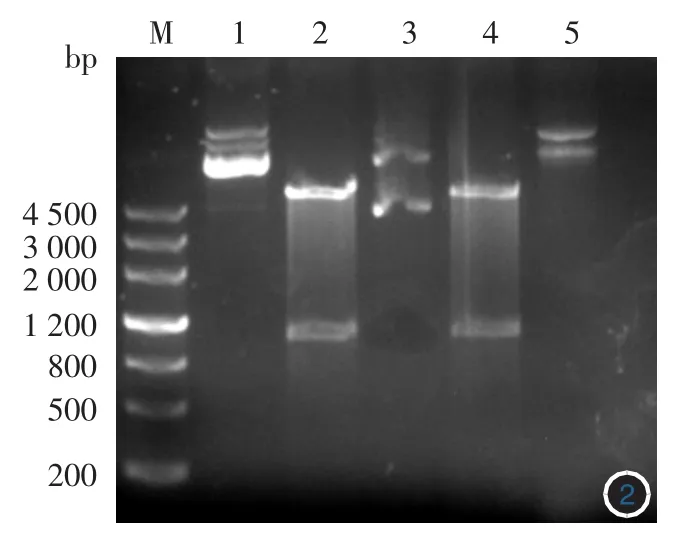
圖2 重組質粒pET-30a(+)/Tp0844雙酶切電泳M:標準參照物;1:pET30a(+)空質粒;2:Tp0844重組質粒1雙酶切;3:Tp0844重組質粒;4:Tp0844重組質粒2雙酶切;5:Tp0844重組質粒2
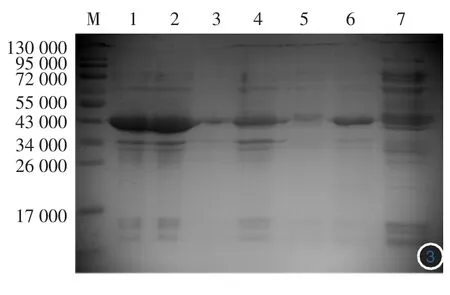
圖3 37℃重組質粒在大腸桿菌中1 mmol/L IPTG誘導不同時間表達的SDS-PAGE結果 M:標準參照物;1:rTp0844誘導6 h上清;2:rTp0844誘導4 h上清;3:rTp0844誘導2 h上清;4:rTp0844誘導6 h沉淀;5:rTp0844誘導2 h沉淀;6:rTp0844誘導4 h沉淀;7:rTp0844未誘導
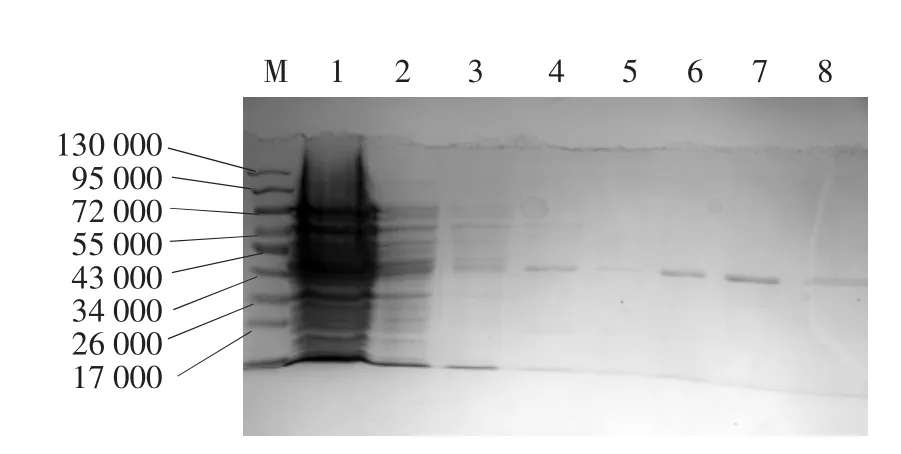
圖4 重組TP0844蛋白純化結果 M:標準參照物;2:裂解上清;3~8:洗滌液過柱流出物;9:蛋白洗脫液(目的蛋白)

圖5 TP0844重組蛋白的Western印跡檢測 1:Tp陽性血清;2:健康陰性血清
3.重組Tp0844蛋白的免疫反應性檢測:以梅毒IgG抗體陰、陽性血清為一抗,采用Western印跡方法檢測Tp0844重組蛋白的免疫反應性。結果顯示,誘導產物與Tp陽性血清在預計位置出現明顯特異反應條帶,而與陰性血清未出現反應條帶(圖 5)。
討 論
近年來,全世界每年新增約1 500萬新感染病例[1-2,6-11],近 3 年全球梅毒的發病率年均增長率達20%,我國的梅毒感染率和發病率也呈上升趨勢,成為一個備受關注的公共衛生問題[1-2,6-11]。尋找 Tp的致病因素、闡明Tp發病機制是控制梅毒的關鍵環節。由于Tp不能體外連續人工培養,缺乏遺傳操作系統及外膜的易脆性導致對其不能進行遺傳操作,嚴重阻礙了從分子水平對Tp發病機制的研究。Tp全基因序列的解析極大地促進了對Tp基因結構與功能的研究[2]。隨著基因工程技術的迅速發展,使得梅毒Tp重組蛋白的獲得相對容易,一方面為建立現有梅毒血清學診斷的替代方法提供了條件,同時為梅毒免疫功能及發病機制研究開辟了一條新的途徑。
作為有望在梅毒致病過程中發揮重要作用的蛋白一般需要滿足兩個條件:首先,必須能早期接觸機體,在感染早期即能在血液里檢測到其相應的抗體;其次要求蛋白含量較高、免疫原性強[3-5,11]。進行Tp發表機制的研究首先須從篩選蛋白入手。Tp0844基因全長1 050 bp,編碼350個氨基酸、相對分子質量約為43 000,在Tp的細胞定位尚不清楚,其生物學功能也尚未明了,且整個分子的抗原性較強,存在多個強抗原表位,可以作為梅毒發表機制研究的候選抗原。本研究的目的是通過克隆、表達獲得重組Tp0844蛋白進行免疫反應性的研究。本文結果顯示,成功獲得高純度、可溶性表達的重組蛋白Tp0844重組蛋白;進一步檢測純化的重組蛋白的免疫反應性,經Western印跡分析,其能與梅毒感染陽性血清發生反應,而與梅毒陰性血清未發生反應,證明Tp0844重組蛋白具有良好的免疫反應性,從而為下一步研究其在梅毒發病中的作用,如黏附、穿透、播散及誘導宿主炎癥反應作用,完整解析Tp0844的生物學功能及進行梅毒早期診斷方法學研究奠定了基礎。
[1]FraserCM,NorrisSJ,WeinstockGM,etal.Completegenomesequence ofTreponema pallidum,the syphilis spirochete[J].Science,1998,281(5375):375-388.
[2]Peeling RW,Hook EW 3rd.The pathogenesis of syphilis:the Great Mimicker,revisited[J].J Pathol,2006,208(2):224-232.
[3]劉雙全,汪世平,肖勇健,等.梅毒螺旋體Tp0319重組蛋白的表達及免疫活性研究[J].中華皮膚科學雜志,2010,43(5):332-335.
[4]余堅,趙飛駿,張曉紅,等.白介素2與梅毒螺旋體膜蛋白Gpd雙價核酸疫苗的免疫活性及保護作用研究[J].中華皮膚科學雜志,2011,44(10):688-692.
[5]劉瓊,劉雙全,張秋桂.梅毒螺旋體膜蛋白研究進展[J].微生物學免疫學進展,2013,41(5):56-59.
[6]Lafond RE,Lukehart SA.Biological basis for syphilis[J].Clin Microbiol Rev,2006,19(1):29-49.
[7]Lee V,Kinghorn G.Syphilis:an update[J].Clin Med,2008,8(3):330-333.
[8]Liu S,Wang S,Wu Y,et al.Production of proinflammatory cytokines in the human THP-1 monocyte cell line following induction by Tp0751,a recombinant protein ofTreponema pallidum[J].Sci China Life Sci,2010,53(2):229-233.
[9]Houston S,Hof R,Francescutti T,et al.Bifunctional role of theTreponema pallidumextracellular matrix binding adhesin Tp0751[J].Infect Immun,2011,79(3):1386-1398.
[10]McGill MA,Edmondson DG,Carroll JA,et al.Characterization and serologic analysis of theTreponema pallidumproteome[J].Infect Immun,2010,78(6):2631-2643.
[11]謝小平,劉雙全,張秋桂.梅毒螺旋體TP0993重組蛋白的表達、純化及免疫活性分析[J].中華皮膚科學雜志,2013,46(5):305-308.
Expression,purification and evaluation of immunoreactivity of the recombinant protein Tp0844 ofTreponema pallidum
Liu Shuangquan,Liu Qiong.Department of Clinical Laboratory,First Affiliated Hospital,University of South China,Hengyang 421001,Hunan,China
Treponema pallidum;Recombinant proteins;TP0844;Immunology;Immunoreactivity
Liu Shuangquan,Email:dantelliu@163.com
10.3760/cma.j.issn.0412-4030.2015.05.007
國家自然科學基金(81201331);湖南省自然科學基金(11JJ4076);湖南省教育廳青年基金(11B107)
劉雙全,Email:dantelliu@163.com
2014-05-13)
(本文編輯:吳曉初)
【Absrtact】ObjectiveTo clone,express,purify and evaluate the immunoreactivity of the recombinant protein Tp0844 ofTreponema pallidum(Tp),and to screen major Tp proteins with high host reactivity.MethodsThe Tp0844 gene sequence was obtained through bioinformatics analysis.A prokaryotic expression vector of the Tp0844 gene was constructed and transformed intoE.coliBL21 followed by isopropyl-1-thio-β-D-galactopyranoside (IPTG)induction for the expression of the recombinant protein Tp0844.Nickel-NTA affinity chromatography columns were utilized to purify the recombinant protein,and Western blotting was performed to evaluate the reactivity of the recombinant protein with sera positive or negative for anti-Tp IgG antibodies.ResultsThe recombinant prokaryotic expression vector PET-30a(+)-Tp0844 was successfully constructed.After IPTG induction,a soluble recombinant protein with a relative molecular mass of about 43 000 was highly expressed,and purified by affinity chromatography.Western blotting showed that the Tp0844 recombinant protein specifically reacted with anti-Tp IgG antibody-positive sera,but not with anti-Tp IgG antibody-negative sera.Conclusions The soluble recombinant protein Tp0844 has good immunoreactivity,and can serve as a candidate antigen for investigation into the pathogenesis of syphilis.

