高壓促進豬肉肌內脂肪氧化過程中脂肪氧化酶的作用
黃業傳,李 鳳,嚴 成
(西南科技大學生命科學與工程學院,四川綿陽621010)
高壓促進豬肉肌內脂肪氧化過程中脂肪氧化酶的作用
黃業傳,李鳳,嚴成
(西南科技大學生命科學與工程學院,四川綿陽621010)
為研究高壓促進豬肉肌內脂肪氧化過程中脂肪氧化酶(Lipoxygenase,LOX)的作用,以去除LOX的豬背最長肌為原料,在其中加入事先從豬肉中提取的或外源LOX(大豆脂肪氧化酶),經600MPa、50℃或350MPa、20℃處理并經6d冷藏后,測定各樣品高壓處理和冷藏后LOX活性和TBARS值。結果表明:LOX對高壓下肌內脂肪氧化的啟動有重要作用,但其不會影響樣品冷藏后的最終氧化狀態(TBARS值);在高壓處理后的冷藏中,LOX的作用不明顯,主要以脂肪自動氧化為主,即使加入5倍濃度的外源LOX,也只引起樣品最終TBARS值的少量增加。因此,高壓促進豬肉肌內脂肪氧化中主要以自動氧化為主,而LOX的作用很小。
高壓,豬肉,脂肪氧化,脂肪氧化酶
高壓技術在食品中的應用始于100多年前,但當時由于設備等方面的限制并沒有真正推廣。直到上世紀90年代,歐美和日本等發達國家開始投入大量人力、物力和財力對高壓技術進行研究。高壓處理能在低溫或常溫下抑制或殺滅食品中有害微生物和酶,從而延長食品保質期;或改善食品的功能特性,如嫩度、凝膠特性等[1]。相比于傳統的熱處理,高壓對食物營養和感官品質破壞更小,能最大限度保留食物的色、香、味和營養成分[2-4]。但高壓處理也有對食品品質不利的地方,如一定壓力下能加快肉中脂肪氧化,從而使肉品質敗壞[5-7]。
壓力誘導肌肉脂肪氧化的原因很多學者進行了研究,但結論并不一致,如可能與變性蛋白的協同作用[8]、高壓下金屬離子釋放[9-11]、高壓下酶活性變化[12]或細胞膜結構損壞有關[3,13-14]。存在這些爭議的關鍵原因之一是高壓促進肌內脂肪氧化中脂肪氧化酶(Lipoxygenase,LOX)的作用仍不清楚。氧化主要分為自動氧化和酶促氧化,高壓下兩者的關系無人研究過,但一些學者研究了干腌肉制品加工中兩者的關系,如Zhou[15]、Huang[16]發現在金華火腿和煙熏臘肉生產中脂肪氧化主要是自動氧化。而Jin[17]發現干腌培根加工中LOX能顯著促進脂肪氧化。Kühn[18]認為LOX催化脂肪氧化有一定的滯后性,而German[19]的觀點則相反,認為內源LOX對脂肪氧化的啟動極為重要,但在隨后的加工中以自動氧化為主,Roozen[20]、Josephson[21]也證明了這一點。
一些芽孢菌在1000MPa的壓力下仍很穩定,而壓力結合一定溫度的熱處理對這些菌有較好的抑制效果,因而現在高壓技術在肉品中的應用大多圍繞高壓結合一定的低溫熱處理進行。本文擬研究高壓(350、600MPa)結合一定的熱處理(20、50℃)對豬肉中LOX活性和脂肪氧化(TBARS值)的影響,并著重探討兩者的關系,以明確高壓促進肌內脂肪氧化中LOX的作用。
1 材料與方法
1.1材料與儀器
白玉黑土豬由綿陽天農生態食品開發有限公司提供,共三頭,同一批飼養,接近商品成豬的重量時宰殺,宰殺后取背最長肌,真空包裝后于-18℃保藏待用;大豆脂肪氧化酶(酶活為50000U/mg)、亞油酸Sigma公司;其他藥品均為國產分析純。
HPP.L2超高壓處理設備天津華泰森淼生物工程技術有限公司;FSH-2A勻漿機上海梅香儀器有限公司;5804R臺式高速冷凍離心機德國Eppendorf公司;U-3900H分光光度計日本Hitachi公司;JYSA800絞肉機山東九陽電器有限公司。
1.2實驗方法
1.2.1去LOX樣品的準備參照靳國鋒[22]的方法,樣品先在4℃解凍24h,并去掉表面可見脂肪、筋膜及結締組織,然后用三倍體積(v/w)的冷去離子水(4℃)清洗三次,清洗后加3倍體積(v/w)50mmol/L的磷酸鈉緩沖液(pH7.4,4℃),并勻漿1min(10000r/min),勻漿結束后用塑料棒攪動2min并靜置15min。然后在10000g、4℃條件下冷凍離心30min,離心結束后用3倍體積(v/w)50mmol/L磷酸鈉緩沖液(pH7.4,4℃)使沉淀再次懸浮,并繼續10000g條件下冷凍離心30min。重復懸浮、離心3次,最后一次所得沉淀即為去LOX肌肉,收集備用。
1.2.2LOX的提取和活性測定未去LOX的樣品先在4℃解凍24h,去掉表面可見脂肪、筋膜及結締組織,并用絞肉機絞碎;事先去LOX的樣品直接按以下程序提取。LOX的提取參考Jin等的方法[17],并進行一定修改。稱取一定量的碎肉,加入4倍體積的濃度為50mmol/L、pH7.4的磷酸鈉緩沖溶液,該溶液中還含有濃度為1mmol/L的二硫蘇糖醇(DTT)和乙二胺四乙酸(EDTA),然后用高速勻漿機在冰水浴中于15000r/min下勻漿4次,每次10s。經四層紗布過濾后,勻漿物在10000g、4℃條件下離心1h,然后得到的上清液經濾紙過濾后即為提取的LOX粗酶液。
亞油酸底物溶液的制備參考Gata等[23]的方法,將稱量好的140mg亞油酸溶解在5mL脫氧重蒸水中,再加入180μL吐溫20,然后用2mol/L的NaOH將溶液的pH調整到9.0,直到亞油酸完全溶解且pH保持穩定,然后用脫氧重蒸水定容至50mL,該溶液于低溫、氮氣環境中貯藏備用。
LOX的活性測定采用分光光度計法。量取0.2mL亞油酸底物溶液和2.9mL、濃度為50mmol/L、pH為5.5的檸檬酸緩沖溶液在20℃快速混合均勻,待其在234nm處吸光值穩定后,加入0.1mL酶溶液,迅速混合均勻后測定1min吸光度的增加量。對照樣為0.2mL亞油酸底物溶液和3.0mL檸檬酸緩沖溶液(50mmol/L,pH為5.5)。1個酶活單位定義為每分鐘每克蛋白中引起吸光度值增加0.001的酶量。
1.2.3TBARS值測定TBARS值的測定參考Siu[24]的方法,結果表示為mg MDA(丙二醛)/kg樣品。
1.2.4樣品處理為研究高壓促進豬肉肌內脂肪氧化中LOX的作用,設計以下四組實驗。
對照樣豬肉:原料使用前在4℃解凍24h,并去掉表面可見脂肪、筋膜及結締組織,用絞肉機絞碎并用聚乙烯塑料袋真空包裝,共15袋,每袋50g左右。
去LOX樣品,用聚乙烯塑料袋真空包裝,共15袋,每袋50g左右。
去LOX的樣品約750g,加入適量從豬背最長肌中提取的LOX溶液,使LOX在樣品中的活性與對照樣豬肉相當,達到8~9U,然后用聚乙烯塑料袋真空包裝,共15袋,每袋50g左右。
去LOX的樣品約750g,加入適量外源LOX(大豆LOX),使LOX在樣品中的活性是對照樣的5倍左右,達到40~45U,然后用聚乙烯塑料袋真空包裝,共15袋,每袋50g左右。
預備實驗發現在600MPa、50℃的條件下處理20min豬肉樣品中的LOX會完全失活;前面的研究發現常溫下350MPa是導致豬肉脂肪氧化加劇的關鍵壓力點[25],而在此條件下LOX活性變化不大,因此本研究中選取600MPa、50℃和350MPa、20℃作為處理條件。以上四組樣品,每組中的3袋準備好后馬上測定其LOX活性;其余12袋分別平均分成兩份,每份6袋,其中一份在350MPa、20℃條件下進行處理,另一份在600MPa、50℃進行處理,處理時間均為20min,高壓處理以癸二酸二辛酯為壓力傳遞介質。高壓處理后,每份的6袋樣品中3袋立即用來測定樣品中LOX活性和TBARS值,另外3袋在0~4℃條件下避光透氧冷藏6d后測定LOX活性與TBARS值。
1.3統計分析
用SPSS13.0軟件(SPSS Inc.,Chicago,Illinois,USA)作方差分析和多重比較,顯著水平為0.05。
2 結果與分析
2.1高壓處理和冷藏對樣品中LOX活性的影響
結果如表1所示,高壓處理前對照樣(1、5組)、去LOX+提取的LOX(3、7組)樣品中的LOX活性相當,而兩組去LOX樣品(第2、6組)未檢出LOX活性,去LOX+外源LOX(4、8組)的兩組中LOX活性較高,因為加入了原料中約5倍濃度的外源LOX。高壓處理后,600MPa、50℃處理的樣品,除了第8組還有少量酶活外,其余三組均已檢不出酶活,說明肉中的LOX在600MPa、50℃處理20min會全部失活。Seyderhelm[26]與Heinisch[27]分別報道了LOX在緩沖溶液中經600MPa、45℃處理10min或在40℃處理30min會全部失活;Rodrigo[28]和Tedjo[29]也分別發現番茄和大豆中LOX的失活壓力為550和570MPa,這些都與本研究的結論基本一致。
350MPa、20℃處理的樣品保留較高酶活,其中對照樣中酶活還升高了7.84%,說明有部分酶被激活,激活作用可能是部分酶在高壓下從溶酶體中釋放出來[30-31]或高壓下酶的結構發生了有利于活性增加的變化[32]。第3和4組中酶活在高壓處理后都有所下降但不顯著,因此第1組中酶活升高可能主要是由于高壓下酶從溶酶體中釋放所致。一方面,壓力下,酶會變性失活,另一方面溶酶體膜破壞后部分酶釋放出來,因此酶活是增加還是減小取決于哪種因素占主導作用。350MPa、20℃下對照樣酶活增加說明此時酶的釋放占主導,第3、4組樣品可能在去除LOX過程中溶酶體已破壞,進而在高壓處理時溶酶體中無酶可釋放,因此酶活有所降低。經過6d冷藏后,各樣品中酶活都有所降低,第1、3和4組分別降低了15.97%、20.66%和26.15%,其中后兩者的降低達到顯著(p<0.05)水平,說明未經提取的肉樣中的LOX在冷藏中更穩定,可能是其處于完整的肌肉結構中,肌肉成分對其有保護作用。
2.2350MPa處理和冷藏對樣品脂肪氧化的影響
350MPa處理后各樣品的TBARS值如圖1所示,可以看出,去LOX的樣品TBARS值顯著(p<0.05)低于其他組,其他組都含有內源或外源的LOX,因此可推測LOX對高壓下脂肪氧化啟動有重要作用。可能是由于脂肪氧化主要分為自動氧化和酶促氧化,自動氧化需要有一個中間過程,啟動相對較慢;而酶促氧化啟動較迅速,其啟動后,生成的一些氧化產物和游離基可迅速帶動自動氧化,因此可使整個脂肪氧化的進度加快。去LOX的樣品中沒有LOX,因此完全是自動氧化,由于自動氧化啟動較慢,因此處理結束時其TBARS值顯著(p<0.05)低于其他三組。去LOX+外源LOX的樣品TBARS值最高,比對照樣高出11.29%,但差異不顯著;而比去LOX+提取的LOX的樣品高出39.86%,差異顯著(p<0.05)。可能是去LOX+外源LOX的樣品中加入了高濃度的(原料中的5倍)外源LOX,而LOX對脂肪氧化啟動有重要作用,因此其脂肪氧化的速度更快。

圖1 350MPa處理后各樣品TBARS值Fig.1 The TBARS values of samples following pressure treatment of 350MPa
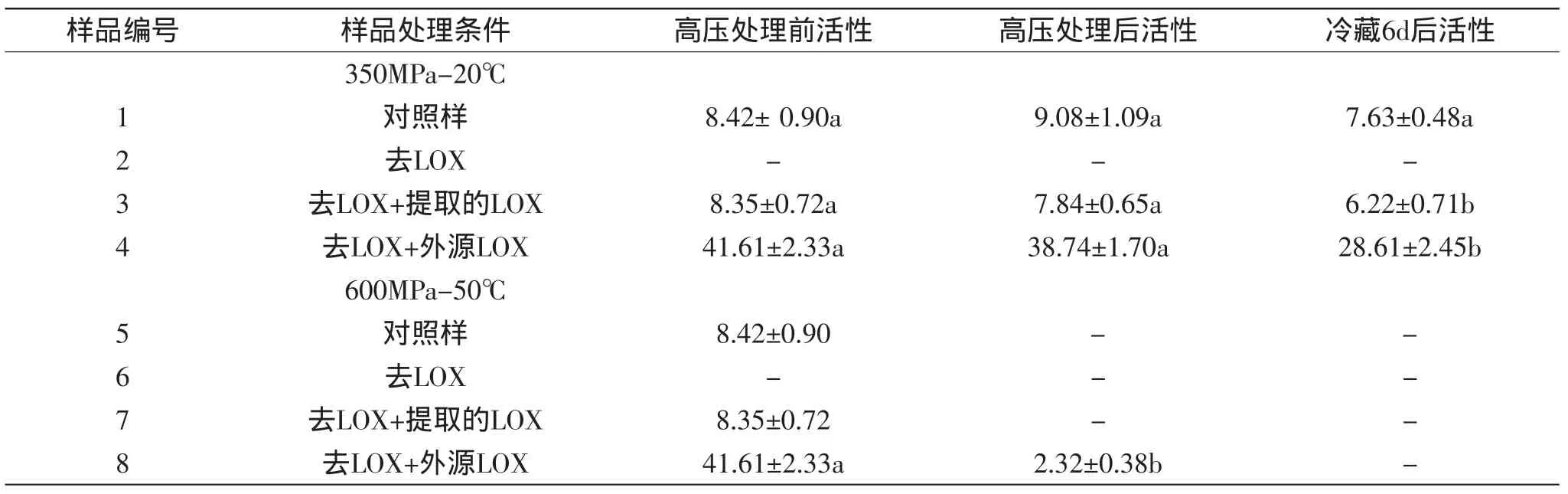
表1 高壓處理和冷藏對各樣品LOX活性的影響(n=3)Table 1 Effect of high-pressure treatment and cold-storage on the activity of LOX in samples(n=3)
350MPa處理的樣品經6d冷藏后TBARS值如圖2所示,剛經高壓處理后,去LOX組的TBARS值顯著(p<0.05)低于去LOX+提取的LOX組(圖1),而經過6d冷藏后,兩者并無顯著差異,這說明LOX雖然對脂肪氧化啟動有重要作用,但不會影響貯藏后樣品最終的TBARS值,對樣品最終TBARS值起決定作用的是自動氧化。可能是由于酶促氧化對底物的專一性較強,且需要酶與底物接觸時才能發生反應,而自動氧化一旦啟動后速度較快;也可能是由于后期自動氧化對酶促氧化的抑制作用,因為生成的大量氫過氧化物會氧化LOX的巰基而使其失活[33],LOX失活后,其分子中所含的鐵離子釋放出來,反而又會加速自動氧化[34]。經6d冷藏后,去LOX+提取的LOX組顯著(p<0.05)低于對照組,可能是由于LOX提取過程中,一些水溶性的助氧化物質比如金屬離子發生了部分損失;而在處理后兩者沒有顯著差異(圖1),可能是處理時間較短,損失的水溶性成分不足以造成顯著影響,而且啟動階段自動氧化的作用也不及貯藏階段,啟動階段LOX發揮了重要作用。加提取LOX組的TBARS值顯著(p<0.05)低于加外源LOX組,可能是由于高濃度的外源脂肪酶引起的脂肪氧化;加外源LOX的樣品冷藏中LOX活性幾乎是加提取LOX組的5倍,但最終TBARS值只比其高36.48%,說明TBARS值的增加程度與加入的LOX濃度不呈比例,因此冷藏中起主要作用的仍是自動氧化。加外源LOX組與對照組沒有顯著差異可能是由于一方面前者中高濃度的LOX增加了脂肪氧化,但同時樣品在去LOX過程中部分助氧化物質損失掉,兩相抵消了。

圖2 350MPa處理樣品經6d冷藏后的TBARS值Fig.2 The TBARS values of samples after 6 day cold-storage following pressure treatment of 350MPa
2.3600MPa處理和冷藏對樣品脂肪氧化的影響
600MPa、50℃處理后各樣品的TBARS值如圖3所示,可以看出,與350MPa處理時類似,去LOX的樣品中TBARS值低于其他組,但與去LOX+提取的LOX和對照樣差異不顯著,而350MPa時去LOX的樣品顯著低于另外兩組,可能是因為600MPa、50℃下LOX迅速失活,因此發揮作用的時間較短,不及350MPa處理明顯。同樣,去LOX+外源LOX的樣品處理后TBARS值最高,可能是加入的酶濃度越高失活所需的時間也更長,到高壓處理結束時仍保留有部分LOX活性(5.58%),因此LOX對脂肪氧化的啟動更明顯。

圖3 600MPa處理后各樣品TBARS值Fig.3 The TBARS values of samples following pressure treatment of 600MPa
600MPa、50℃處理樣品經6d冷藏后的TBARS值如圖4,可以看出,雖然對照樣的TBARS值高于其他三組,但差異不顯著,對照樣中TBARS值稍高可能是由于去除LOX過程中一些助氧化物質的損失。350MPa處理時,加入外源LOX的樣品冷藏后TBARS值最高,而600MPa處理后,加入外源LOX的樣品TBARS值低于對照樣,可能是由于600MPa、50℃條件下加入的外源LOX幾乎全部失活,因此在冷藏中發揮作用的LOX較少,而350MPa處理的樣品中殘留的LOX活性較高,因此冷藏中發揮作用的LOX也較多。

圖4 600MPa處理樣品經6d冷藏后的TBARS值Fig.4 The TBARS values of samples after 6 day cold-storage following pressure treatment of 600MPa
高壓促進肌肉肌內脂肪氧化中自動氧化和酶促氧化的關系還無人作過報道,但很多學者對肉品加工中脂肪自動氧化和酶促氧化的關系作了研究,Zhou[15]、Huang[16]分別報道在金華火腿和煙熏臘肉生產中自動氧化作用更大,這與本研究的結論是一致的;而Jin[17]發現在干腌培根加工中LOX能顯著促進脂肪氧化。關于LOX的作用,German[19]認為內源LOX對脂肪氧化啟動極為重要,但在隨后的加工中自動氧化占優,Roozen[20]和Josephson[21]利用模型系統也證明了這一點,發現若LOX在開始階段失活,脂肪氧化初速度會減慢,但總的氧化程度不會降低,這與本研究的結論一致,但Kühn[18]報道的結論相反,認為LOX在催化脂肪氧化中具有一定的滯后性,因為LOX中所含的Fe2+轉變為Fe3+后LOX才有活性,而Fe2+向Fe3+的轉變需要在脂肪酸氫過氧化物的作用下才能產生。
3 結論
3.1600MPa、50℃處理時豬肉中LOX全部失活,而350MPa、20℃處理對LOX活性沒有顯著影響,甚至存在部分激活作用;LOX在6d冷藏過程中較穩定。
3.2LOX對脂肪氧化的啟動有重要作用,但其不會對產品冷藏后的最終TBARS值產生顯著影響,冷藏中以自動氧化為主。
3.3樣品中加入高濃度外源LOX會在一定程度上促進高壓下的脂肪氧化,但對TBARS值的提高與加入的酶濃度不呈正比。
3.4高壓促進肌內脂肪氧化過程中,脂肪氧化主要以自動氧化為主,LOX的作用十分有限。
[1]馬漢軍.高壓和熱結合處理對僵直后牛肉品質的影響[D].南京:南京農業大學,2004.
[2]Cheftel J C,Culioli J.Effects of high pressure on meat:A review[J].Meat Science,1997,46:211-236.
[3]Orlien V,Hansen E,Skibsted L H.Lipid oxidation in highpressure processed chicken breast muscle during chill storage:critical working pressure in relation to oxidation mechanism[J]. European Food Research and Technology,2000,211:99-104.
[4]Torres J A,Velazquez G.Commercial opportunities and research challenges in the high pressure processing of foods[J]. Journal of Food Engineering,2005,67:95-112.
[5]Angsupanich K,Ledward D A.High pressure treatment effects on cod(Gadus morhua)muscle[J].Food Chemistry,1998,63:39-50.
[6]Cheah P B,Ledward D A.High pressure effects on lipid oxidation in minced pork[J].Meat Science,1996,43:123-134.
[7]CHeah P B,Ledward D A.High-pressure effects on lipid oxidation[J].Journal of the American Oil Chemists’Society,1995,72:1059-1063.
[8]Tanaka M,Xueyi Z,Nagashima Y,et al.Effect of High Pressure on the Lipid Oxidation in Sardine Meat[J].Nippon Suisan Gakkaishi,1991,57:957-963.
[9]Gray J I,Pearson A M.Rancidity and warmed-over flavour[J].Advanced Meat Research,1987,3:221-269.
[10]Beltran E,Pla R,Yuste J,et al.Use of antioxidants to minimize rancidity in pressurized and cooked chicken slurries[J]. Meat Science,2004,66:719-725.
[11]CHeah P B,Ledward D A.Catalytic mechanism of lipid oxidation following high pressure treatment in pork fat and meat[J].Journal of Food Science,1997,62:1135-1138.
[12]Huang Y,He Z,Li H,et al.Effect of antioxidant on the fatty acid composition and lipid oxidation of intramuscular lipid in pressurized pork[J].Meat Science,2012,91:137-141.
[13]Beltran E,Pla R,Yuste J,et al.Lipid oxidation of pressurized and cooked chicken:role of sodium chloride and mechanical processing on TBARS and hexanal values[J].Meat Science,2003,64:19-25.
[14]Kato M,Hayashi R.Effects of high pressure on lipids and biomembranes for understanding high-pressure-induced biological phenomena[J].Bioscience,Biotechnology and Biochemistry,1999,63:1321-1328.
[15]Zhou G H,Zhao G M.Biochemical changes during processing of traditional Jinhua ham[J].Meat Science,2007,77:114-120.
[16]Huang Y,Li H,Huang T,et al.Lipolysis and lipid oxidation during processing of Chinese traditional smoke-cured bacon[J]. Food Chemistry,2014,149:31-39.
[17]Jin G,Zhang J,Yu X,et al.Lipolysis and lipid oxidation in bacon during curing and drying-ripening[J].Food Chemistry,2010,123(2):465-471.
[18]Kühn H,Borchert A.Regulation of enzymatic lipid peroxidation:the interplay of peroxidizing and peroxide reducing enzymes[J].Free Radical Biology and Medicine,2003,33:154-172.
[19]German J B,Kinsella J E.Lipid oxidation in fish tissue. Enzymic initiation via lipoxygenase[J].Journal of Agriculture and Food Chemistry,1985,33:680-683.
[20]Roozen J P,Frankel E N,Kinsella J E.Enzymic and autoxidation of lipids in low fat foods:model of linoleic acid in emulsified hexadecane[J].Food Chemistry,1994,50:33-38.
[21]Josephson D B,Lindsay R C,Stuiber D A.Enzymic Hydroperoxide Initiated Effects in Fresh Fish[J].Journal of Food Science,1987,52:596-600.
[22]靳國鋒.干腌培根加工過程中脂質氧化調控機制研究[D].南京:南京農業大學,2011.
[23]Gata J L,Pinto M C,Macías P.Lipoxygenase activity in pig muscle:purification and partial characterization[J].Journal of Agricultural and Food Chemistry,1996,44:2573-2577.
[24]Siu G M,Draper H H.A survey of malonaldehyde content of retail meats and fish[J].Journal of Food Science,1978,43:1147-1149.
[25]He Z,Huang Y,Li H,et al.Effect of high-pressure treatment on the fatty acid composition of intramuscular lipid in pork[J]. Meat Science,2012,90:170-175.
[26]Seyderhelm I,Boguslawski S,Michaelis G,et al.Pressure induced inactivation of selected food enzymes[J].Journal of Food Science,1996,61:308-310.
[27]Heinisch O,Kowalski E,Goossens K,et al.Pressure effects on the stability of lipoxygenase:Fourier transform-infrared spectroscopy(FT-IR)and enzyme activity studies[J].Z Lebensm Unters Forsch,1995,201:562-565.
[28]Rodrigo D,Jolie R,Van Loey A,et al.Thermal and high pressure stability of tomato lipoxygenase and hydroperoxide lyase[J].Journal of Food Engineering,2007,79:423-429.
[29]Tedjo W,Eshtiaghi M N,Knorr D.Impact of supercritical carbon dioxide and high pressure on lipoxygenase and peroxidase activity[J].Journal of Food Science,2000,65:1284-1287.
[30]Homma N,Ikeuchi Y,Suzuki A.Effect of high pressure treatmentonproteolyticsysteminmeat[J].Progressin Biotechnology,1996,13:327-330.
[31]Lakshmanan R,Patterson M F,Piggott J R.Effects of highpressure processing on proteolytic enzymes and proteins in coldsmoked salmon during refrigerated storage[J].Food Chemistry,2005,90:541-548.
[32]Terefe N S,Yang Y H,Knoerzer K,et al.High pressure and thermal inactivation kinetics of polyphenol oxidase and peroxidase in strawberry puree[J].Innovative Food Science and Emerging Technologies,2010,11:52-60.
[33]Kuo J,Pan B S,Zhang H,et al.Identification of 12-lipoxygenase in the hemolymph of tiger shrimp(Penaeus japonicus Bate)[J].Journal of Agriculture and Food Chemistry,1994,42:1620-1623.
[34]Kuribayashi T,Kaise H,Uno C,et al.Purification and characterization of lipoxygenase from Pleurotus ostreatus[J]. Journal of Agriculture and Food Chemistry,2002,50:1247-1253.
Effect of lipoxygenase on the intramuscular lipid oxidation in pork due to high pressure treatment
HUANG Ye-chuan,LI Feng,YAN Cheng
(College of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621010,China)
To investigate the effect of lipoxygenase(LOX)on the intramuscular lipid oxidation in pork due to high pressure treatment,porcine longissimus muscle which had been removed of LOX was used as material,after addition of some LOX extracted from fresh porcine longissimus muscle or exogenous LOX(from soybean),the samples were treated at 600MPa-50℃ or 350MPa-20℃ before 6 days storage at 4℃,then the activities of LOX and TBARS values in all samples after high pressure treatment and after cold storage were analyzed.The results showed that LOX had important role on the start-up of intramuscular lipid oxidation due to high pressure treatment,but it had no effect on the last oxidation state(TBARS value)of chilled samples.During cold storage after high pressure treatment,the lipid oxidation was mainly the auto-oxidation,and the role of LOX was very limited,even 5 times of exogenous LOX was added,the TBARS value of the chilled samples only increased a little.So the role of LOX on the intramuscular lipid oxidation in pork due to high pressure treatment was very limited compared to auto-oxidation.
high pressure;pork;lipid oxidation;lipoxygenase
TS251.1
A
1002-0306(2015)14-0147-05
10.13386/j.issn1002-0306.2015.14.022
2014-10-20
黃業傳(1975-),男,博士,副教授,研究方向:肉制品食品加工與酶工程。
國家自然科學基金資助項目(31271892)。

