內置LED光源平板型光生物反應器用于微藻培養
——普通小球藻在反應器中的固碳產油性能探究
王曰杰,孟范平*,李永富,崔鴻武(.中國海洋大學海洋環境與生態教育部重點實驗室,山東 青島 6600;.中國科學院海洋研究所,山東 青島 6607)
內置LED光源平板型光生物反應器用于微藻培養
——普通小球藻在反應器中的固碳產油性能探究
王曰杰1,孟范平1*,李永富2,崔鴻武1(1.中國海洋大學海洋環境與生態教育部重點實驗室,山東 青島 266100;2.中國科學院海洋研究所,山東 青島 266071)
為降低光生物反應器(PBR)的光照能耗和提高微藻對光能的利用效率,自制了內置LED光源的平板型光生物反應器,用于綠藻普通小球藻(Chlorella vulgaris)的培養和CO2生物固定.評價了這種新型反應器的進氣CO2濃度對生物質產率(BP)、CO2固定速率(FCO2)和油脂產率(LP)的影響.經過10d連續培養后,與通入空氣的對照組相比,濃度1%~10%的CO2均明顯促進微藻生長,BP [0.258和0.263g/(L·d)]、最大FCO2[1.18、1.00gCO2/(L·d)]和指數生長期平均FCO2[0.57、0.62gCO2/(L·d)]的高值均出現在CO21%、2.5%處理組中.較高濃度(5%、10%)CO2在培養初期造成酸化現象,導致藻細胞密度和生物量較低.CO2濃度變化對微藻總脂含量(17.81%~23.13%)影響較小,以CO22.5%條件下得到微藻油脂產率最大[60.71mg/(L·d)].本研究證明,所設計的平板型PBR能夠高效培養用于CO2固定和生物柴油原料生產的微藻.
普通小球藻;光生物反應器;CO2;生物量;油脂產率
近幾十年來,人類活動導致大氣中CO2濃度不斷增加[1],由此帶來的全球變暖問題大大促進了CO2減排技術的研發與應用.微藻具有光合速率高、繁殖速度快、環境適應能力強等特點,因此基于微藻的CO2生物固定成為最具潛力的減排技術,其中,小球藻屬的微藻因生長速度快[2]、逆境耐受性強[3]、總脂含量高[4]等特性而成為生物固碳研究中常用的藻種.研究發現[5],普通小球藻(Chlorella vulgaris)對高溫(35℃)和酸性條件(pH 4)都具有較強耐受性,因此本研究將其作為研究對象.
微藻培養常用設備包括開放式藻塘和密閉式光生物反應器(PBRs)兩類.后者的優點是培養條件可控,可無菌操作,易進行高密度培養,因而成為今后的發展方向.其中,平板型PBR (F-PBR)因占地面積小、氣液傳質效果好、氧氣積累少、結構簡單、易于放大、造價較低、容易清洗等優勢[6]受到更多關注.然而,培養耗費高、光能利用率低等問題仍是大規模微藻培養和CO2固定的制約因素.采用人工光源的PBRs運行期間的能量消耗包括藻液照光以及藻液混合、CO2供應兩方面,且前者明顯高于后者.在入射光能和藻種一定的情況下,增加單位體積的照光面積和縮短光程能夠明顯提高光能向生物質轉換的效率[7].目前F-PBR等密閉式光生物反應器的設計中一般使用熒光燈管作為光源[8],雖然也有學者將熒光燈設置在PBR兩側,但是只能增大照光面積而無法縮短光程,致使光能損失較大.發光二極管(LED)具有節能、可自動控制和多樣化集成的特點[9],其中,柔性彩色LED燈帶防水性好、幾乎可以任意角度彎曲,特別適于作為PBR的光源.本研究將LED燈帶引入氣升式內環流平板型光生物反應器中,并采用雙側光照模式,設計了內置LED光源—氣升環流式F-PBR,進行普通小球藻培養,期間持續通入不同體積濃度的CO2,以評價普通小球藻在該PBR中的生長、生物質產率、固碳速率和油脂產率,為將這種PBR實際應用于生物固碳提供科學依據.
1 材料、儀器與方法
1.1 材料
普通小球藻(C. vulgaris):購自中國科學院水生生物研究所.為綠藻門淡水藻種.細胞多為球形、橢圓形,營無性繁殖.
實驗采用SE培養基,每升蒸餾水中含有以下成分:250mg NaNO3、75mg K2HPO4、75mg MgSO4·7H2O、25mg CaCl2·2H2O、175mg KH2PO4、25mg NaCl、5mg FeCl3·6H2O、2.86mg H3BO3、1.86mg MnCl2·4H2O、0.22mg ZnSO4·7H2O、0.39mg Na2MoO4·2H2O、0.08mg CuSO4·5H2O、0.05mg Co(NO3)2·6H2O、1mL EDTA·Fe (將0.901g FeCl3·6H2O溶于10mL的1moL/L稀鹽酸中,再與10mL 0.1mol/L的EDTA-Na2溶液混合,加入蒸餾水稀釋至1L )、40mL土壤提取液(將200g避光晾干的未施肥花園土溶于1L去離子水中,水浴煮沸3h,冷卻沉淀24h,重復煮沸3次.過濾取上清液,高壓滅菌后4℃冷藏保存備用).培養基在使用前于120℃下滅菌20min.
CO2氣體:體積濃度分別為0.04%, 1%, 2.5%,5%, 10%,由青島市瑞豐氣體有限公司生產,裝于40L高壓鋼瓶內.
1.2 儀器
3415F型光量子計(美國Spectrum公司);T6型紫外可見分光光度計(北京普析通用儀器有限責任公司);CXZ型智能光照培養箱(寧波江南儀器廠);LDZX-50KBS型高壓蒸汽滅菌鍋(上海申安醫療器械廠);SX716型溶解氧測量儀(極譜型DO電極,上海三信儀表廠);PHB-4型 pH計(上海精密科學儀器廠);XB-K-25型血球計數板(Nikon公司);Freezone2.5L型真空冷凍干燥機(美國Labconco公司);GM-0.33A型隔膜真空泵(天津津騰);DHG-9030A型電熱恒溫鼓風干燥箱(上海一恒科學儀器有限公司);JY92-II型超聲波細胞粉碎機(寧波新芝生物科技股份有限公司).
光生物反應器:自制,內置LED光源的氣升環流式平板PBR.器壁材質為透明亞克力板材,降流區與升流區橫截面積比為4.0;總體積3.8L,有效體積3.0L.詳見圖1.根據Rodolfi等[8]利用20L平板式PBR培養微綠球藻(Nannochloropsis sp. F&M-M24)的研究結論(在總光強保持不變時,雙側照光下的生物質產率高于單側高光照),本研究將兩條LED燈帶并排均勻地纏繞在導流管上,提供持續的雙側光照,平均光強為120 μmol/(m2·s).反應器的平板式結構保證了良好的氣液傳質水平[10],有利于提高CO2利用率.來自鋼瓶的CO2氣體由位于底部的氣體分散器進入PBR中,這種氣升式曝氣系統能提供均質反應環境,即:以氣體為動力,通過導流管的引導,形成氣液相的有序循環,增強氣液混合效果,有利于微藻分布均勻,并防止反應器中氧氣過量積累.反應器置于帶溫控器的自制反應區內,以維持溫度恒定.

圖1 自制平板式光生物反應器Fig.1 Diagrammatic sketch of the flat-plate photobioreactor proposed in this study
1.3 方法
1.3.1 反應器中微藻培養 將微藻接種到裝有足量培養基的三角瓶中,在溫度25℃、光強100μmol/(m2·s)、光照時間24h/d的條件下培養,每天搖瓶3次,培養至指數生長期.然后,將處于指數生長期的微藻接種于上述PBR中,接種密度為2×106cells/mL.根據在碘量瓶中進行的預實驗(暗處測定呼吸耗氧速率,持續光照下測定凈光合放氧速率),當采用來自LED的3種光質(紅光LR、藍光LW和白光LW)照射處于指數生長期的藻細胞時,得到光強20~120μmol/(m2·s)對應的總光合放氧速率P(凈光合放氧速率與呼吸耗氧速率之和),由光合放氧曲線(P-I曲線)計算的最大光合作用速率以LW最高.因此,本研究以白色LED燈帶作為光源,溫度為25℃.期間,不同濃度(1%、2.5%、5%、10%,V/V)的CO2氣體經0.45μm濾膜過濾后,以0.1vvm[單位時間(min)內每升藻液中通入的氣體體積(L)]的流量通入PBR中.運行過程中,定時取樣測定藻細胞密度、藻生物量、藻液pH值;培養結束時測定微藻的總脂含量.以通入空氣(CO20.04%,V/V)的PBR中生長的微藻為對照.
1.3.2 藻細胞密度和pH值測定 藻培養液經適當稀釋后,用血球計數板在顯微鏡下計數,并根據稀釋倍數計算得到藻細胞密度,單位為cells/mL.藻液pH值采用 pH計測定.
1.3.3 藻生物量測定和生物質產率、固碳速率計算 藻生物量(D)采用細胞干重法[11]測定:將10mL藻液在1000g、4℃下離心10min,用蒸餾水沖洗藻泥2次,冷凍干燥,儲存在干燥箱中.根據重量法測定結果計算藻生物量,單位為g (干重)/L.生物質產率(BP)和微藻固碳速率(FCO2)分別按式(1)、式(2)計算:
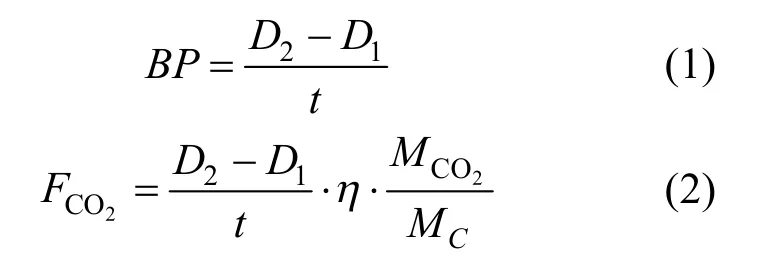
式中:D1、D2分別為培養開始和結束時的藻生物量,g/L;t為培養時間,d; η為微藻生物質的含碳量,%,經測定,普通小球藻的碳含量為47.16%;MCO2為CO2分子量,44;MC為C的原子量,12.
1.3.4 微藻油脂含量測定和油脂產率計算 微藻總脂含量(ω)采用氯仿-甲醇法[12]測定:在具塞離心管中加入冷凍干燥后的藻粉0.1g及蒸餾水、氯仿、甲醇(體積比2:2.5:5)混合液7.6mL,漩渦混合1min后,冰浴中超聲破碎2min(功率700W,間隔5s、工作5s),再加入1mL氯仿和1mL蒸餾水,漩渦混合1min,靜置10min,5000r/min離心10min,將有機相轉移到已稱重的燒杯中.再向原試管中加入2mL氯仿,按前述方法提取2次,有機相均合并到燒杯中,用高純N2吹至恒重.按式(3)計算總脂含量:

式中:ω為總脂的百分含量,%; W0為藻粉干重,g;W1為粗脂重,g.
油脂產率(LP)按式(4)計算:

式中:LP為油脂產率,g(L·d);D1、D2為培養開始和結束時的藻生物量,g/L;ω為微藻的總脂含量,%.
2 結果與討論
2.1 CO2濃度對普通小球藻生長的影響
不同濃度CO2通入PBR后的微藻生長曲線見圖2(A).各處理組的微藻生長延滯期相差不大,但是,指數生長期卻因CO2濃度的不同而有很大差異:通入空氣后,普通小球藻的指數生長期只有3d(2~5d),隨后進入平臺期,最大藻細胞密度為25.46×106cells/mL;高濃度CO2的通入均造成普通小球藻的指數生長期延長,CO2濃度1%、2.5%、5%、10%的處理組對應的指數生長期分別達到6、5、8、5d;相應的藻細胞密度最高值(90.73×106、78.58×106、65.39×106、47.15× 106cells/mL)分別出現在培養9、7、10、10d后,為對照組的3.56倍、3.09倍、2.57倍、1.85倍.可見,4種高濃度CO2處理均能明顯促進普通小球藻生長(最適宜的CO2濃度在1%~2.5%),雖然10% CO2處理組的微藻在培養初期(3~6d)受到一定抑制而生長緩慢,但是培養后期的藻細胞密度明顯高于對照組.Miyachi等[13]研究提出,能夠耐受濃度2%~5%、5%~20%、20%~100% CO2的微藻分別屬于耐性高、非常高和極高的藻種.從這一點看,本研究所用的普通小球藻屬于CO2耐受性非常高的藻種.Yun等[14]發現,藻液在通入含15% CO2的空氣后,普通小球藻(C. vulgaris)生長受到一定抑制,而在5% CO2中生長最快.根據De Morais等[15]的研究,凱氏小球藻(C. kessleri)對濃度18%的CO2表現出良好耐受性.還有研究[16]指出,普通小球藻(C. vulgaris NIES-2173)藻株能夠在15-50%的CO2下生長.不同藻株對高濃度CO2的耐受性存在差異,可能與研究所用藻株、培養基種類不同有關.
由圖2(B)可見,無論對照組還是高CO2處理組,藻液的pH值隨培養時間延長總體呈上升趨勢,并在8d后達到最高,分別為9.11(對照組)、8.93(1% CO2)、8.92 (2.5% CO2)、7.83 (5% CO2)、8.02(10% CO2).這種變化同樣見于Vidyashankar等[17]利用聚乙烯制備的PBR培養二形柵藻(Scenedesmus dimorphus)的研究中:在通入高濃度(5%~15%) CO2培養期間,藻液pH值在10.5~9.78之間,而且CO2濃度越低,藻液pH值越接近于對照組(pH 10.47)水平.出現這種堿化現象的原因是,水體中溶解性無機碳存在形式為,而微藻培養基的初始pH值多在6.0~8.0,其中的無機碳存在形態以為主,因此微藻光合過程中主要利用.各種形式的無機碳之間存在以下動態平衡關系,當體系中的因微藻利用而減少時,反應平衡將自兩邊向中間移動,引起溶液pH值上升,如果此時有足夠的外部CO2予以補充,pH升高幅度會得到減緩.圖2(B)顯示,與通入空氣的對照組相比,4種高CO2處理對于堿化作用具有一定減緩效果,其中5%、10% CO2處理組較為明顯.但是,兩者也引起了培養初期的酸化(pH值小于5.5). pH值可顯著影響微藻的生長和光合作用[18],文獻[16]報道,普通小球藻生長的最適pH值為7.0,過低或過高的pH值均不利于微藻正常生長.因此,雖然CO2可作為微藻生長的碳源,但是,只有處于適宜濃度范圍的CO2才能有效促進微藻生長.對照組pH值自第5d開始高于8.0,第8d則高于9.0.根據趙亞麗等[19]的研究,pH 9.0是形成磷酸鈣沉淀的適宜反應條件.其他研究[20]也指出,高pH值環境以及通入空氣的藻液能夠促進磷酸鈣形成.本研究所用SE培養基中含有Ca2+、,當對照組出現較高堿性時,這些營養成分將轉化為沉淀物而無法被微藻利用,這可能是微藻在第5d即停止生長的主要原因.另一方面,5%、10% CO2處理組在培養初期的pH值較低,相應的,其生長速率小于CO21%、2.5%處理組,主要是因為光合作用的關鍵酶(核酮糖-1,5-二磷酸羧化/加氧酶Rubisco和藻細胞外碳酸酐酶CA)活性受到pH影響.Rubisco具有催化羧化和催化氧化兩種功能,在補充CO2且經CCM (即CO2濃縮機制,需要CA的參與)轉運后,Rubisco活性位點處的CO2濃度得以提高[13],其羧化活性增強而氧化活性受到抑制,有利于光合作用進行;但當CO2濃度過高時,會引起培養基酸化和葉綠體基質酸化,抑制關鍵酶的活性,即產生所謂的“麻醉”作用,降低藻類光合作用水平[21].

圖2 普通小球藻在不同濃度CO2下的生長曲線(A)和pH值變化曲線(B)Fig.2 Growth curve (A) of C. vulgaris under different concentration of CO2and variation of pH (B) in cultures
2.2 CO2濃度對普通小球藻生物質合成和固碳性能的影響
在通氣流量0.1vvm條件下,對照組和高CO2處理組的普通小球藻生物量隨培養時間的變化見圖3:指數生長期結束時,以1% CO2、2.5% CO2處理組的生物量最大(2.42、2.20g/L),分別比對照組(0.73g/L)增加232%和201%.培養期間的BP最大值[0.258、0.263g/(L·d)]也出現在這兩個處理組中(表1).由于培養初期存在酸化現象,10% CO2處理組的BP值處于較低水平[0.115g/(L·d)],僅略高于對照組[0.105g/(L·d)].本研究在1%、2.5%CO2下獲得的生物量和BP值與Ryu等[22]在鼓泡柱中采用批次方式培養小球藻(Chlorella sp.)的研究結果相當:在5%CO2和0.1vvm條件下生長最快,最大生物量和BP值分別為2.02g/L和0.335g/(L·d).相反,有些研究者采用其他類型反應器或裝置進行小球藻屬微藻培養所得到的生物量相對較低.Fan等[23]采用容積2L的膜-鼓泡式螺旋管狀PBR(MSTR)培養普通小球藻以去除CO2,在溫度25℃、光強3600lx和CO2濃度0.093%的條件下,當進氣流量為3.60L/min (相當于1.8vvm)時,最大藻生物量為0.90g/L,僅為本研究在2.5% CO2下生物量的37%.Tang等[24]利用1L錐形瓶培養蛋白核小球藻(C. pyrenoidosa SJTU-2)藻株,在5%~30% CO2下生長良好,最大生物量(1.55g/L)和生物質產率[0.144g/(L·d)]出現在10%CO2下,分別約為本研究在2.5% CO2下相應測定值的70%和55%.Lam等[28]在有效容積5L的鼓泡式柱狀PBR中培養普通小球藻,光強為60~70μmol/(m2·s),連續通入CO2濃度5%的混合氣體,培養10d后的藻生物量和BP值分別僅為0.77g/L和0.073g/(L·d).針對鼓泡柱狀PBR中普通小球藻的生物量和固碳速率較低問題,Lam等[25]將5個同樣的PBR進行串聯,在同樣培養條件下所得到的藻生物量比單級PBR增加5倍,總CO2去除率也由1.5%明顯提高到7.5%,表明CO2在第一級PBR的培養基中溶解量非常低,未被溶解的那些CO2可被隨后的PBR中微藻繼續利用,使總生物量產出增加,這意味著通過進一步增加PBR的串聯數量,CO2去除率可達到100%,同時獲得大量藻生物質用于生物柴油生產.這為今后改進本研究所用的PBR以提高其生物量和固碳效果提供了借鑒.
根據式(1)計算不同濃度CO2下的微藻最大固碳速率以及指數生長期平均固碳速率,見表1.兩者的高值[1.18、1.00gCO2/(L·d); 0.57、0.62gCO2/(L·d)]也出現在CO21%、2.5%處理組中.De Morais[26]認為,密閉式PBR對CO2的去除效率取決于微藻種類、反應器類型和進氣中CO2濃度.

圖3 通入空氣和不同濃度CO2后普通小球藻生物量隨培養時間的變化Fig.3 Variations of biomass with growth time in the cultures of C. vulgaris under conditions with air and various concentrations of CO2
由表2可見,雖然文獻采用了普通小球藻或其同屬的微藻進行研究,但是,由于PBR類型不同,所得到的最大固碳速率存在差異,這是因為,不同類型PBR中的氣液傳質效率、光捕獲效率和混合效率有所差異[27].與文獻報道結果相比,本研究設計的內置LED光源的平板式PBR中普通小球藻具有較好固碳性能,與Kumar等[28]采用氣升鼓泡式柱狀PBR培養小球藻的結果相當.Fan等[23]報道,利用有效容積800mL的膜-鼓泡式螺旋管狀PBR培養普通小球藻,固碳速率為0.148gCO2/(L·h) [即3.55gCO2/(L·d)],但是這種高固碳效果是在進氣CO2濃度為0.093%的條件下獲得的,該濃度比工業煙氣中的CO2濃度(10%~20%)低兩個數量級,因此其實際應用效果難以判斷.另一個高固碳數據[2.22gCO2/(L·d)]來自Anjos等[29]在6.5% CO2、0.5vvm下對普通小球藻P12藻株培養7d的研究結果,應當指出的是,高通氣流量需要消耗較多能量,同時,由于CO2在水中的溶解度較小(25℃、1.03×105Pa下約為1.45g/L)[30],較大的通氣流速將會減少氣泡在PBR中的滯留時間,導致大多數CO2在未溶于水和被微藻利用之前就釋放到PBR之外[31].

表1 普通小球藻的生物質產率和固碳速率Table 1 Biomass productivity (BP) and rate of carbon fixation (FCO2) of C. vulgaris under different concentrations of CO2

表2 在通入CO2的PBR中小球藻的固碳速率比較Table 2 Comparison of rates of carbon fixation by Chlorella sp. cultured in PBRs aerated with different concentrationsof CO2
2.3 CO2濃度對普通小球藻總脂含量及油脂產率的影響
微藻產品的油脂產率決定著其適于制備藻基生物柴油的可行性.油脂產率的高低由微藻的生物質產率和總脂含量兩方面決定.本研究所設計的PBR中,普通小球藻在不同濃度CO2下培養10d后的ω值及LP統計于表3. ω值隨CO2濃度增加呈先升后降趨勢,以2.5% CO2、5% CO2處理組的微藻ω值最大(23.13%、22.79%),兩者之間無顯著差異,但顯著高于對照組和其他CO2處理組. CO2濃度增加引起的微藻總脂含量變化幅度不大(<6%).這與文獻報道相似:鼓泡式柱狀PBR中普通小球藻的ω值未隨著CO2濃度上升而出現顯著變化,保持在18.1~18.7%[25];蛋白核小球藻(C. pyrenoidosa STJU-2)藻株的ω值由0.03% CO2下的20.9%逐漸增加到10% CO2下的24.25%、20% CO2下的25.48%和50% CO2下的26.75%[24];擬眼點微綠球藻(Nannichloropsis oculata)半連續培養過程中,通入濃度2%、5%、10%、15%CO2時,ω值分別為29.7%、26.2%、24.6%、22.7%[32].這是因為,除了以脂肪形式保存所固定的碳外,微藻還能將吸收的碳儲存于蛋白質、糖類和色素中,在高CO2濃度下,微藻固定的CO2中有更大比例轉化為脂肪以外的有機物質[33].由此看來,在PBR中,CO2濃度對微藻總脂含量的調控作用小于其對光合及生物量的調控幅度,因此,期望通過增加CO2濃度以大幅度提高微藻油脂含量的可能性不大.在這種情況下,油脂產率高低主要取決于生物質產率,表3中的LP計算值、表1中的平均BP值隨CO2濃度變化的高低順序可證明這一點.在研究所設置的CO2濃度范圍內,最大LP值[60.71mg/(L·d)]出現在CO2濃度2.5%處理組中,主要是由該濃度CO2下的生物質產率最高所致.該數值為大多數文獻報道的普通小球藻油脂產率[8~14.8mg/ (L·d)]的4.1~7.6倍,只是低于Huang等[16]采用30% CO2培養普通小球藻NIES-2173藻株的測定值.這是因為,本研究所用普通小球藻自身的總脂含量較低(表4).今后的研究中,在利用內置LED光源的平板式PBR培養微藻的同時,采用NO3-濃度適宜的培養基(即氮限制的培養基)使微藻油脂含量提高10%以上[34],則PBR中普通小球藻的油脂產率將會得到進一步增加.
3 結論
3.1 利用內置LED光源的平板式PBR培養普通小球藻,與通入空氣的對照組相比,濃度1%~10%的CO2均明顯促進微藻生長,最適CO2濃度為1%~2.5%.較高濃度(5%、10%)CO2引起培養初期的酸化現象,導致藻細胞密度和生物量較低.

表3 普通小球藻在不同濃度CO2中的總脂含量及油脂產率Table 3 Total content and production efficiency of lipid within cells of C. vulgaris under different concentrations of CO2
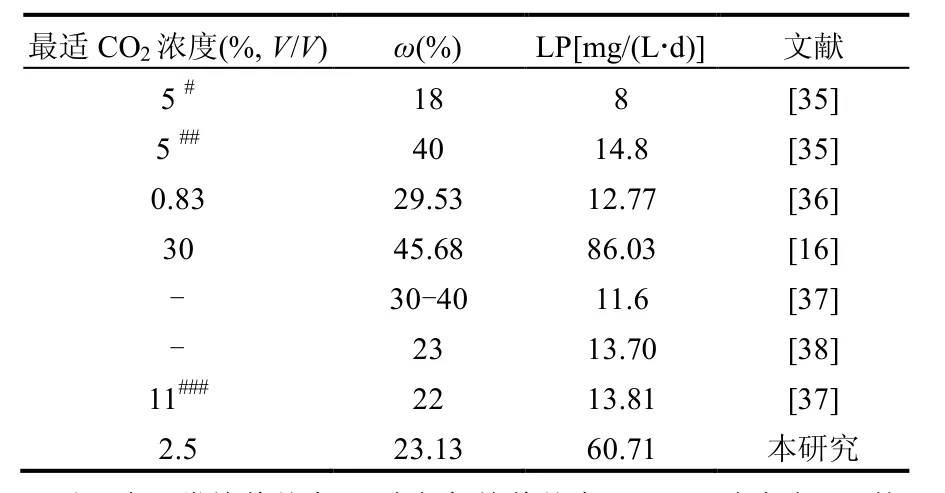
表4 不同濃度CO2培養條件下小球藻的油脂含量和油脂產率比較Table 4 Comparison of total content and production efficiency of lipid within cells of Chlorella sp. aerated with different concentrations of CO2
3.2 培養期間,微藻最大固碳速率及指數生長期平均固碳速率的高值[1.18、1.00gCO2/(L·d);0.57、0.62gCO2/(L·d)]出現在CO21%、2.5%處理組中.
3.3 微藻總脂含量隨CO2濃度增加呈先升后降趨勢,在CO22.5%條件下得到總脂含量、油脂產率的最大值[23.13%、60.71mg/(L·d)].
[1]Aikawa M, Yoshikawan K, Yomida M, et al. Continuous monitoring of carbon dioxide concentration in the urban atmosphere of Nagoya, 1991-1993 [J]. Analytical Sciences, 1995,11:357-362.
[2]Radakovits R, Jinkerson R E, Fuerstenberg S I, et al. Draftgenome sequence and genetic transformation of the oleaginous alga Nannochloropsis gaditana [J]. Nature Communications,2012,3:686.
[3]Liang Y, Sarkany N, Cui Y, et al. Biomass and lipid productivities of Chlorella vulgaris under autotrophic, heterotrophic and mixotrophic growth conditions [J]. Biotechnology Letters, 2009,31(7):1043-1049.
[4]Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances[J]. The Plant Journal, 2008,54(4):621-663.
[5]張 倩,李祥蕾,孟范平,等.酸性和高溫條件下4株小球藻的生長及總脂含量研究 [C]//2014中國環境科學學會學術年會論文集.北京:中國環境科學出版社, 2014:7122-7133.
[6]Ugwu C U, Aoyagi H, Uchiyama H. Photobioreactors for mass cultivation of algae [J]. Bioresource Technology, 2008,99:4021-4028.
[7]Pegallapati A K, Arudchelvam Y, Nirmalakhandan N. Energy-efficient photobioreactor configuration for algal biomass production [J]. Bioresource Technology, 2012,126:266-273.
[8]Rodolfi L, Chini Zittelli G, Bassi N, et al. Microalgae for oil: strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor [J]. Biotechnology Bioengineer, 2009,102(1):100-112.
[9]Chen C Y, Yeh K L, Aisyah R, et al. Cultivation, photobioreactor design and harvesting of microalgae for biodiesel production: a critical review [J]. Bioresource Technology, 2011,102:71-81.
[10]Zittelli G C, Rodolfi L, Bassi N, et al. Photobioreactors for microalgal biofuel production [A]. Algae for Biofuels and Energy[M]. Netherlands: Springer, 2013:115-131.
[11]Ranga R A, Sarada R, Ravishankar G A. Influence of CO2on growth and hydrocarbon production in Botryococcus braunii [J]. Journal of Microbiology and Biotechnology, 2007,17(3):414-419.
[12]Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification [J]. Canadian Journal of Biochemistry and Physiology,1959,37(8):911-917.
[13]Miyachi S, Iwasaki I, Shiraiwa Y. Historical perspective on microalgal and cyanobacterial acclimation to low-and extremely high-CO2conditions [J]. Photosynthesis Research, 2003,77:139-153.
[14]Yun Y S, Lee S B, Park J M, et al. Carbon dioxide fixation by algal cultivation using wastewater nutrients [J]. Journal of Chemical Technology and Biotechnology, 1997,69(4):451-455.
[15]De Morais M G, Costa J A V. Carbon dioxide fixation by Chlorella kessleri, C. vulgaris, Scenedesmus obliquus and Spirulina sp. cultivated in flasks andvertical tubular photobioreactors [J]. Biotechnology Letters, 2007,29(9):1349-1352.
[16]Huang Y T, Su C P. High lipid content and productivity of microalgae cultivating under elevated carbon dioxide [J]. International Journal of Environmental Science and Technology,2014,11(3):703-710.
[17]Vidyashankar S, Deviprasad K, Chauhan V S, et al. Selection and evaluation of CO2tolerant indigenous microalga Scenedesmus dimorphus for unsaturated fatty acid rich lipid production under different culture conditions [J]. Bioresource Technology, 2013,144:28-37.
[18]楊 波,儲昭升,金相燦,等.CO2/pH對三種藻生長及光合作用的影響 [J]. 中國環境科學, 2007,27(1):54-57.
[19]趙亞麗,宋永會,錢 鋒,等.碳酸根對磷酸鈣沉淀反應回收磷的影響 [J]. 環境工程學報,2014,8(1):48-54.
[20]Huang C-C, Hung J-J, Peng S-H, et al. Cultivation of a thermotolerant microalga in an outdoor photobioreactor: Influences of CO2and nitrogen sources on the accelerated growth [J]. Bioresource Technology, 2012,112:228-233.
[21]Krause G H, Weis E. Chlorophyll fluorescence and photosynthesis: the basics [J]. Annual Review of Plant Biology,1991,42(1):313-349.
[22]Ryu H J, Oh K K, Kim Y S. Optimization of the influential factors for the improvement of CO2utilization efficiency and CO2mass transfer rate [J]. Journal of Industrial and Engineering Chemistry, 2009,15(4):471-475.
[23]Fan L H, Zhang Y T, Zhang L, et al. Evaluation of a membranesparged helical tubular photobioreactor for carbon dioxide biofixation by Chlorella vulgaris [J]. Journal of Membrane Science, 2008,325(1):336-345.
[24]Tang D, Han W, Li P, et al. CO2biofixation and fatty acid composition of Scenedesmus obliquus and Chlorella pyrenoidosa in response to different CO2levels [J]. Bioresource Technology,2011,102:3071-3076.
[25]Lam M K, Lee K T. Effect of carbon source towards the growth of Chlorella vulgaris for CO2bio-mitigation and biodiesel production [J]. International Journal of Greenhouse Gas Control,2013,14:169-176.
[26]De Morais M G, Costa J A V. Biofixation of carbon dioxide by Spirulina sp. and Scenedesmus obliquus cultivated in a threestage serial tubular photobioreactor [J]. Journal of Biotechnology,2007,129(3):439-445.
[27]Carvalho A P, Meireles L A, Malcata F X. Microalgal reactors: a review of enclosed system designs and performances [J]. Biotechnology Progress, 2006,22(6):1490-1506.
[28]Kumar K, Das D. Growth characteristics of Chlorella sorokiniana in airlift and bubble column photobioreactors [J]. Bioresource Technology, 2012,116:307-313.
[29]Anjos M, Fernandes B D, Vicente A A, et al. Optimization of CO2bio-mitigation by Chlorella vulgaris [J]. Bioresource Technology,2013,139:149-154.
[30]Devgoswami C R., Kalita M C., Talukdar J, et al. Studies on the growth behavior of Chlorella haematococcus and Scenedesmus sp. in culture media with different concentrations of sodium bicarbonate and carbon dioxide gas [J]. African Journal of Biotechnology, 2013,10(61):13128-13138.
[31]Fan L H, Zhang Y T, Cheng L H, et al. Optimization of carbon dioxide fixation by Chlorella vulgaris cultivated in a membranephotobioreactor [J]. Chemical Engineering and Technology,2007,30(8):1094-1099.
[32]Chiu S Y, Kao C Y, Tsai M T, et al. Lipid accumulation and CO2utilization of Nannochloropsis oculata in response to CO2aeration[J]. Bioresource Technology, 2009,100(2):833-838.
[33]Sydney E B, Sturm W, De Carvalho J C, et al. Potential carbon dioxide fixation by industrially important microalgae [J]. Bioresource Technology, 2010,101(15):5892-5896.
[34]Arudchelvam Y, Nirmalakhandan N. Optimizing net energy gain in algal cultivation for biodiesel production [J]. Bioresource Technology, 2012,114:294-302.
[35]Illman A M, Scragg A H, Shales S W. Increase in Chlorella strains calorific values when grown in low nitrogen medium [J]. Enzyme and Microbial Technology, 2000,27(8):631-635.
[36]Widjaja A, Chien C C, Ju Y H. Study of increasing lipid production from fresh water microalgae Chlorella vulgaris [J]. Journal of the Taiwan Institute of Chemical Engineers, 2009,40(1): 13-20.
[37]Yeh K L, Chang J S. Effect of light supply and carbon source on cell growth and cellular composition of a newly isolated microalga Chlorella vulgaris ESP-31 [J]. Engineering in Life Sciences, 2010,10(3):201-208.
[38]Moheimani N R. Inorganic carbon and pH effect on growth and lipid productivity of Tetraselmis suecica and Chlorella sp.(Chlorophyta) grown outdoors in bag photobioreactors [J]. Journal of Applied Phycology, 2013,25(2):387-398.
Internally LED-illuminated flat plate photobioreactor for microalgae cultivation-carbon-fixation and production of lipid in Chlorella vulgaris cultured in photobioreactor.
WANG Yue-jie1, MENG Fan-ping1*, LI Yong-fu2, CUI Hong-wu1(1.Key Laboratory of Marine Environment and Ecology, Ministry of Education, Ocean University of China,Qingdao 266100, China;2.Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China). China Environmental Science, 2015,55(5):1526~1534
s:In order to improve the utilization efficiency of light by microalgae within a photobioreactor (PBR), an internally LED-illuminated flat plate PBR with volume of 3L was constructed and used for Chlorophyta (Chlorella vulgaris) in this study. Effects of the concentration of inlet CO2on the biomass production (BP), fixation efficiency of carbon (FCO2) and the production of lipid (LP) were evaluated. Biomass of microalgae in each treatment with concentration of CO2ranging from 1% to 10% was higher than that of control with air (0.04% CO2) aeration in the cultures after 10-days growth. High levels of BP [0.258 and 0.263g/(L·d)], FCO2[1.18 and 1.00gCO2/(L·d)]and average FCO2[0.57 and 0.62gCO2/(L·d)]during the exponential growth stage were obtained under the concentration of CO2at 1% and 2.5%, respectively. The cell density and biomass of microalgae were inhibited by the higher concentrations of CO2(5% and 10%) during the initial growth stage because of acidification in cultures. Significant effects of CO2concentrations on the production of lipid (17.81% ~ 23.13%) were not found here. The highest productivity of lipid [60.71mg/(L·d)]was obtained under the concentration of CO2at 2.5%. The present results suggested that the PBR used here was useful to improve CO2biofixation and the production of lipid of microalgae.
Chlorella vulgaris;photobioreactor;carbon dioxide;biomass;production of lipid
X17
A
1000-6923 (2015)05-1526-09
王曰杰(1990-),男,山東高唐人,碩士研究生,主要從事環境污染生物凈化技術研究.
2014-09-18
國家科技支撐計劃課題(2011BAD14B04)資助
* 責任作者, 教授, fanpingm@tom.com

