肺硬化性血管瘤的MSCT特征與病理分析
廣東省茂名市人民醫院MR室 (廣東 茂名 525000)
梁 波 蔡培坤
肺硬化性血管瘤(pulmonary sclerosing hemangioma,PSH)由Liebow和Hubbell 1956年首次報道并認為是血管起源性病變,PSH現已證實是起源于II型肺泡細胞的上皮腫瘤[1,2],但至今對其細胞起源和性質仍存在爭議。2004年WHO將其歸為肺雜類腫瘤,但未明確其組織學起源及分化方向。雖然醫學界目前普遍認為PSH為良性腫瘤,但是淋巴結、葉間胸膜轉移以及術后復發等惡性生物學行為仍偶見報道[3]。手術切除是PSH唯一根治手段,但有學者提出PSH患者在對臨床癥狀耐受情況下,可帶瘤生存[4]。
因此術前確診PSH至關重要。本文回顧性分析經外科手術及病理證實的18例PSH患者的臨床表現和MSCT圖像資料,并分析其病理特征,以提高其術前診斷準確率,為手術實施方案及預后評估提供依據。
1 資料和方法
1.1 一般資料 收集2009年1月~2014年6月茂名市人民醫院經手術及病理證實肺硬化性血管瘤共18例,對其臨床表現,MSCT特征及病理學檢查進行總結分析。
1.2 檢查方法 所有患者術前均行MSCT平掃及增強掃描,采用GE 128層CT掃描儀。掃描參數:管電壓120KV,管電流200mAs,矩陣512×512,層厚為5mm,層間距2.5mm。胸部軸面平掃后,采用高壓注射器經肘前靜脈注射碘必樂造影劑,濃度300mgI/ml,總量80~100ml,注射速度2.0~2.5ml/s。
1.3 圖像分析 所有MSCT圖像均在PCA閱片系統上進行,病例均由2名具有豐富臨床經驗的影像科副主任醫師閱片,如有異議時由第3名醫師(主任醫師)分析決定。記錄患者性別,年齡及臨床癥狀,觀察病灶的位置、數目、形態、大小、界限、內部結構及與周圍組織的關系,觀察分析病灶如“血管貼邊征”、“肺氣腫帶包繞征”,“暈征”和鈣化等征象,并記錄病灶強化方式。
1.4 統計學方法 本研究采用SPSS13.0統計學軟件,分別采用獨立樣本t檢驗、Logistic回歸及方差分析進行相關數據的統計分析,設定p<0.05有統計學差異。
2 結 果
2.1 臨床表現 18例PSH患者中,女性11例,年齡20~66歲,平均45.9歲;男性7例,年齡30~59歲,平均43.7歲。女性發病率較高(p<0.05);11例患者無明顯臨床癥狀,在進行體檢胸片攝影時發現。7例有臨床癥狀的患者中,胸痛3例,咳嗽2例,胸悶及痰中帶血1例,低熱1例。筆者采用Logistic回歸分析病灶大小與臨床征象的相關性,發現兩者無相關性(p>0.05);同時筆者根據病灶的位置劃分為中央型和周圍型,發現病灶位置和臨床癥狀同樣不存在相關性(p>0.05)。
2.2 MSCT特征 本組包括18例患者,17例均為單發病灶,1例呈多發病灶(2個),總共19個病灶。右肺病灶11個,左肺病灶8個,其中左肺下葉病灶7個,右肺中葉病灶6個,兩者占所有病灶的68.4%。參考肺癌劃分標準,發現14個(約73.7%)病灶為周圍型,5個病灶為中央型。肺窗見病灶最大直徑大小約0.8~3.2cm,17個病灶最大直徑小于3.0cm,占約89.5%。
17例病灶界限均清楚,19個病灶中有2個呈輕度淺分葉,余病灶均呈類圓形,邊緣光滑;2個病灶內見斑點鈣化(圖1)。CT增強掃描所有病灶均呈持續性強化,2個病灶呈不均性強化(圖2),17個病灶呈較均勻性強化效應。12個病灶(占63.2%)邊緣見“血管貼邊征”(圖2、4),3個病灶周圍見“暈征”(圖3、5)。2個病灶周圍見肺氣腫帶(圖6)。
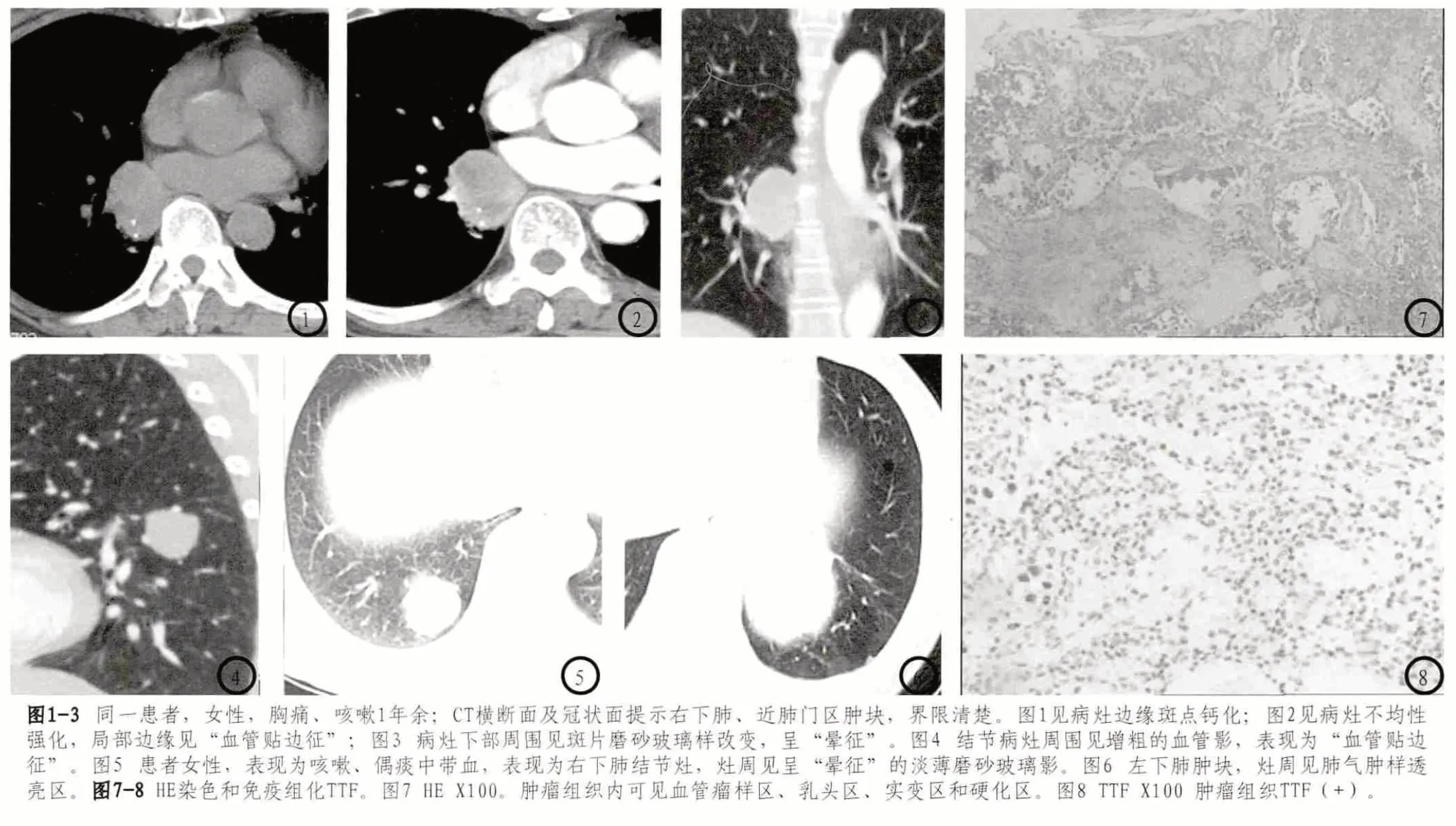
2.3 病理學特征 腫瘤實質由圓形細胞和表面立方上皮細胞構成,圓形細胞主要分布于實性區和乳頭軸心,立方細胞主要被覆于乳頭表面。病灶組織內均包含血管瘤樣區、乳頭區、實變區和硬化區,且按不同比例混合存在,并且相互移行。免疫組化顯示:甲狀腺轉錄因子-1(thyroid transcription factor 1,TTF)陽性。
3 討 論
3.1 臨床特點 PSH好發于中年女性,有學者發現PSH細胞核中存在黃體脂酮受體,因此推出女性易患PSH可能與黃體脂酮受體有關[2],本組資料PSH病例男女比例約1:1.3,女性發病率較高。PSH缺乏特異性臨床癥狀,目前報道多表現為胸痛,咳嗽、胸悶、痰中帶血等,少數病例可表現為消瘦、發熱;而大多數患者均無臨床癥狀,而在體檢時無意發現,因此,本病多為偶然發現。本組資料18例PSH患者中,10例(約58.9%)無任何臨床癥狀而行體檢或常規檢查時意外發現,僅7例PSH患者表現為胸痛,咳嗽,低熱、胸悶及痰中帶血等癥狀,與以往報道一致[5]。
3.2 MSCT表現特征 PSH在MSCT上具有一般良性腫瘤一般特征,同時具備自身的特征性表現。PSH多表現為肺周邊部,可貼近縱隔、胸膜下單發實性腫物,類圓形,邊緣光滑。本組資料14個病灶(約73.7%)為周圍型,5個病灶為中央型;17例為單發病灶,占94.4%,而僅1例為多發病灶;所有病灶均界限清楚,未見毛刺,除2病灶出現淺分葉征象外,其余17個病灶均呈類圓形;以上所見與PSH為良性腫瘤、病理解剖顯示部分結節可見假包膜有關。本組病例與文獻[5-7]報道基本一致。PSH發病部位右葉多于左葉,下葉多于上葉,筆者發現本組資料中也存在相似的表現,共11個病灶位于右肺,8個病灶位于左肺,其中左肺下葉7個,但同時筆者發現右肺中葉有6個病灶,占右肺病灶的54.5%,筆者認為右肺中葉是PSH的好發部位,其原因仍有待考究。文獻報道PSH以小結節多見,約70%病變直徑<3.0cm[8],本組19個病灶,最大徑為0.8~3.2cm,其中直徑<3.0cm結節共17個,占89.5%,與以往報道一致[5,8]。本研究中筆者對病灶的位置(中央型和周圍型)、大小和是否具有臨床癥狀做了相關的統計分析發現,兩者間無統計學相關性,與Yang等人[4]研究結果相符。
PSH在CT平掃圖像上密度常較均勻,少數可見鈣化,鈣化的部位可以位于中央部位,也可位于邊緣部位。鈣化的形態可呈細小點狀,也可呈粗顆粒狀,另有學者[9]報道PSH可表現為彌漫性鈣化灶。以往多數學者把結節中含鈣化灶的病例考慮為錯構瘤或結核瘤,從本組病例看,PSH也可以出現鈣化灶,主要病灶形成是一個慢性過程,病灶內均可見鈣鹽沉著。王建衛等[10]認為鈣化的來源為膽固醇結晶。本組2病灶(2/19,10.5%)周邊斑點狀鈣化,鈣化率與文獻[5]報道大致相似,但也有報道高達41%[10]。筆者認為鈣化不能作為PSH特異性征象,但是可能是肺部良性腫瘤的一個有價值的征象。PSH囊變較少見,Cheung等[11]報道的一組病例中,囊變發生率為50%(3/6例),其形成原因推測與因支氣管阻塞不能排出瘤內出血有關。史訊[12]等研究認為長徑>5cm時,瘤內出現囊變、壞死;本組病例腫瘤均較小,未發現有明顯囊變表現。因此,PSH發生囊變、壞死的概率與病灶大小是否呈正相關有待以后研究來證實。
PSH因其組織學構成的復雜性,強化特征與組織學類型密切相關[5,10]。病灶血管瘤樣區及乳頭區表現為早期明顯強化,血管瘤樣區組織內小血管、管壁透明樣變和硬化是其強化的主要病理基礎,增強的程度取決于血管的密度;而實性區和硬化區表現為緩慢持續強化。王宏偉等[13]對PSH行動態增強發現大部分病灶早期即明顯強化,而強化持續時間長為PSH 增強的最大特點。本組病例所有病灶均呈持續性強化效應,17個病灶均表現為較均勻性強化,僅2個病灶呈不均性強化,與以往報道相符[7,13]。本組2個不均性強化的病灶直徑均大于3.0cm,筆者考慮雖然病灶組織成份多樣,但是本組病例病灶體積較小有關,肉眼對細微差異難以鑒別,同時易受部分容積效應影響而導致影像細節信息的丟失有關。
“貼邊血管征”被認為PSH較特異性征象,表現為增強掃描病灶周圍增粗、迂曲血管影,橫斷面上表現為病灶周緣逗點狀強化影,考慮為PSH良性生長,推擠、壓迫周圍血管所致,因此該征象在中央型PSH更常見,可能與肺血管從肺門向外周走行逐漸稀疏變細有關。本組資料12個病灶邊緣見“血管貼邊征”,占63.2%,其中5個中央型病灶均可見此征象。但是筆者認為“貼邊血管征”雖然在PSH中常見,但不能作為其特異性征象,因為其在良性腫瘤中亦見相關報道。“暈征”也是PSH較重要的CT征象,表現為腫瘤周圍肺野“磨玻璃”影。本組3例可見此征象,其中2例病灶患者臨床出現咳嗽、咳血絲痰表現,手術大體標本內見腫瘤內及周緣出血,目前認為“暈征”為病灶周緣出血有關[14],筆者認同這一觀點。“空氣新月征”也被認為是PSH一種特征性表現,比較少見,表現為病灶周圍“新月”形或“半月”形肺氣腫樣透亮區,其發生機制可能是瘤體毛細血管增生,使氣道變形,形成腫瘤與包膜間的游離氣腔,或瘤體內血管破裂出血后完全吸收遺留改變。本組2例可見此征象,表現為病灶偏側性的透亮區。暈征伴空氣新月征同時發生可被認為是PSH特征性表現[15]。
病理組織檢查可見PSH與肺組織分界清,部分病灶可見假包膜形成。瘤細胞圍繞血管排列,可見立方上皮,部分形成乳頭狀,有實變區、硬化區及血管瘤樣結構,均未見核分裂象,與文獻[5,10,12,15]報道大致相同。PSH免疫組化可表現為TTF(+),Vim(+),CK(+),EMA(+),CD31(+),CD34(+)和NSE(+)等,而TTF(+)往往被認為較具特異性,本組資料均只行TTF免疫組化檢查,發現TTF(+),與以往報道相符[3]。
總之,PSH好發于中年女性,以單發為主,好發于肺外周部;病灶多呈類圓形,界限清楚,平掃時密度較均勻,增強掃描持續性強化是其重要特征;“血管貼邊征”,“暈征”和“空氣新月征”是PSH診斷有價值的特征,但并非特異性表現。如能掌握PSH的MSCT特征性表現將能提高其術前診斷準確性。
[1]Liebow AA,Hubbell DS: Sclerosing hemangioma (histiocytoma,xanthoma)of the lung.Cancer.1956; 9: 53-75.
[2]Devouassoux-Shisheboran M,Hayashi T,Linnoila RI,et al.A clinicopathologic study of 100 cases of pulmonary sclerosing hemangioma with immunohistochemical studies:TTF-1 is expressed in both round and surface cells,suggesting an origin from primitive respiratory epithelium.Am J Surg Pathol.2000.24: 906-916.
[3]YASUSHI ADACHI,KOJI TSUTA,RYUJI HIRANO,et al.Pulmonary sclerosing hemangioma with lymph node metastasis: A case report and literature review.ONCOLOGY LETTERS.2014.7(4): 997-1000.
[4]Yang Lei,Duan Yong,Ruan Jun-Zhong,et al.Treatment of 28 patients with sclerosing hemangioma (SH)of the lung.Journal of Cardiothoracic Surgery.2012.7:34.
[5]陳淮,曾慶思,周潔等.肺硬化性血管瘤的影像征象與病理分析.中國醫學影像學雜.2012.20(4): 268-271.
[6]Soumil VJ,Navin B,Sangeeta D,et al.Multiple sclerosing hemangiomas of the lung.Asian Cardiovasc Thorac Ann.2004.12(4): 357-359.
[7]岳奎濤,吳春艷,周茂義等.18例肺硬化性血管瘤患者MSCT征象分析.山東醫藥.2012.52(3):74-75.
[8]張衛東,黃子林,吳沛宏.肺硬化性血管瘤的CT影像學特點.解剖學研究.2008.30(5): 362-364.
[9]Zhu Y,Pu Q,Liu C,et al.Large masses with diffuse calcification: pulmonary sclerosing hemangioma.Ann Thorac Surg.2010.90(3): e45.
[10]王建衛,林冬梅,石木蘭.肺硬化性血管瘤的影像學與病理學對照研究.中華放射學雜志.2004.38(9): 962-966.
[11]Cheung YC,Ng PSH,Chang JW,et al.Histopathological and CT features of pulmonary sclerosing haemangiomas.Clin Radiol.2003.58(8): 630-635.
[12]史訊,張志勇,張興偉等.肺硬化性血管瘤的CT表現與病理對照分析(附21例報告).實用放射學雜志.2007.23(3): 311-314.
[13]王立振.肺硬化性血管瘤的CT診斷.罕少疾病雜志.2007.11(4): 39-41.
[14]Yoshida K,Kurokawa K,Ouchi H,et al.A case of pulmonary sclerosing hemangioma with ground-glass opacity and emphysematous change.Rinsho Hoshasen.1999.44(5): 623-626.
[15]Takatani H,Ashizawa K,Kawai K,et al.Pulmonary sclerosing hemangioma manifesting as a nodule with irregular air clefts on high-resolution CT.AJR Am J Roentgenol.2007.189(1): 26-28.

