山東泰安甜櫻桃“花葉病”樹體癥狀觀察及病毒檢測
王文文,宗曉娟,魏海蓉,王甲威,朱東姿,譚 鉞,劉慶忠
(山東省果樹研究所/山東省果樹生物技術育種重點實驗室,泰安 271000)
?
山東泰安甜櫻桃“花葉病”樹體癥狀觀察及病毒檢測
王文文,宗曉娟,魏海蓉,王甲威,朱東姿,譚 鉞,劉慶忠*
(山東省果樹研究所/山東省果樹生物技術育種重點實驗室,泰安 271000)
為了探明山東泰安患有“花葉病”的甜櫻桃樹體內感染病毒的種類,本研究以嫁接在3種不同砧木上的甜櫻桃品種‘紅燈’葉片為試驗材料,提取植物樣本總RNA,采用隨機六聚體引物反轉錄,選取10種甜櫻桃病毒作為檢測對象,根據各病毒基因組序列設計特異引物,進行RT-PCR檢測。結果顯示,10種甜櫻桃待檢病毒中,5種病毒檢測結果呈陽性,分別為PNRSV(Prunusnecroticringspotvirus,PNRSV)、PDV(Prunedwarfvirus,PDV)、CVA(CherryvirusA,CVA)、CGRMV(Cherrygreenringmottlevirus,CGRMV)、LChV-2(Littlecherryvirus-2,LChV-2),各病毒檢出率較高。各“花葉病”甜櫻桃樣品均至少同時感染2種病毒,多病毒復合感染比例較高。
甜櫻桃; 花葉病; 砧木; 病毒; 檢測
甜櫻桃(PrunusaviumL.)是我國發展較快的果樹之一,因其上市早、經濟效益高,被列為果樹生產的重要樹種。截至2010年,我國甜櫻桃栽培面積約為11萬hm2,其中,山東省甜櫻桃栽培面積5.0萬hm2,約占全國的45.6%,產量22.0萬t,約占全國的62.9%[1],其面積及產量均居全國第一。然而,隨著甜櫻桃產業的發展,病害日益成為影響產量和品質的關鍵因素。由于病毒的危害癥狀與真菌、細菌的不同,加上果農缺少相關的專業知識,往往將其忽略。這樣造成病毒在果園內和果園間不斷傳播,多數甜櫻桃果園樹體因罹患病毒病引起早衰、死亡,嚴重縮短了果園的經濟壽命[2]。
近年來,山東泰安地區甜櫻桃‘紅燈’上普遍出現一種病害,發病葉片上形成淡黃綠色至綠色環斑或褪綠斑,有的葉片產生黃綠相間的線紋。當地果農根據葉片癥狀將其統稱為甜櫻桃“花葉病”。植株花葉病發病程度不等,有的個別枝條出現癥狀,有的整株發病,感病植株通常花期推遲,不能坐果,落花落果現象嚴重,使果樹產量和品質受到極大影響。據報道,植物花葉病可能與多種因素有關,產生的癥狀相似。生理性因素如缺素癥和肥水不足,是黃化型花葉病原因之一。缺磷素葉片出現黃綠和深綠相間的花葉,甚至出現紫紅、紅色的斑塊;櫻桃缺鐵元素幼葉呈黃白色,嫩葉葉脈間失綠,嚴重時葉脈也變成黃色,葉片出現棕色枯斑,稱“黃化病”[3-5]。病理性因素如細菌、真菌、病毒等危害都會使葉片產生花葉,但病狀和病征不同。真菌引起的花葉如大櫻桃褐斑病,初期在嫩葉上形成具有深色中心的黃色斑,逐漸病斑邊緣變厚并呈黑色或紅褐色,病斑近圓形、淺黃褐色至灰褐色;其病原菌為絲孢目核果釘孢菌(Passaloracircumscissa)[6],顯微鏡下可見菌絲和孢子;細菌引起的花葉病如大櫻桃細菌性穿孔病,其病原為甘藍黑腐黃單胞菌桃穿孔致病型[Xanthomonascampestrispv.pruni(Smith) Dye],病斑顯微鏡下可見菌膿溢出;發病初期葉片上出現半透明水漬狀淡褐色小點,擴大成紫褐色至黑褐色圓形不規則病斑,邊緣角質化,周圍有水漬狀淡黃色暈環[7-8]。病毒侵染亦能引起甜櫻桃“花葉”癥狀。與缺素癥及真菌、細菌性病害不同,病毒侵染引起的花葉癥狀的突出特點為不均一失綠。據報道,侵染大櫻桃的病毒有34種,較為常見的有20種左右,葉片上的主要癥狀復雜多樣,包括失綠黃化、葉脈白化、小葉、花葉、皺縮、穿孔等[9]。引起櫻桃花葉癥狀的病毒也有多種,如櫻桃壞死環斑病和皺縮花葉病均由李屬壞死環斑病毒(PNRSV)侵染所致。PNRSV 和蘋果褪綠葉斑病毒(Applechloroticleafspotvirus,ACLSV)復合侵染會引起櫻桃壞死線紋病,即在葉片上出現帶狀的褪綠斑最終壞死[10]。櫻桃褪綠環斑病和櫻桃黃花葉病均由李矮縮病毒(PDV)危害所致[10-11],櫻桃綠環斑駁病毒(CGRMV)可以引起櫻桃綠環斑駁病[12],櫻桃葉斑駁病毒(Cherrymottleleafvirus,CMLV)導致櫻桃葉斑駁病[13],櫻桃壞死銹斑駁病毒(Cherrynecroticrustymottlevirus,CNRMV)產生櫻桃壞死銹斑駁病[14]等。甜櫻桃病毒病的病毒種類繁多,以上病毒無論是單獨侵染還是復合侵染,都可引起植株花葉癥狀,多病毒復合侵染危害更重,可導致果樹絕產絕收[10]。
分子生物學鑒定方法是目前應用最多的技術,此方法比生理學觀察準確,比ELISA 靈敏度高,特異性強,且快速、可靠,其中RT-PCR是最簡單常用的方法之一。本研究以山東泰安地區嫁接在3種不同砧木上的甜櫻桃品種‘紅燈’為對象,對具有花葉癥狀植株的花、葉片及果實等癥狀表現進行觀察記錄,以表現花葉癥狀的葉片為試驗材料,利用RT-PCR技術對花葉病病樣病毒感染情況進行了初步檢測。
1 材料與方法
1.1 供試材料
于山東泰安肥城邊院鎮甜櫻桃生產園,選取以‘吉塞拉7號’(G7)、‘吉塞拉5號’(G5)、‘大青葉’(DQY)為砧木的甜櫻桃‘紅燈’花葉型葉片樣品共12份,以無病毒組培苗作為RT-PCR檢測的陰性對照。取材樣品以液氮速凍后置于-70 ℃冰箱保存。
1.2 方法與步驟
1.2.1 總RNA的提取
采用北京天根TIANGEN RNA plant plus reagent作為總RNA提取試劑,方法參照試劑盒小量法提取步驟稍做改動,0.1 g植物材料液氮研磨,轉至1 mL提取試劑中振蕩混勻,室溫放置5 min,4 ℃ 12 000 r/min離心1 min,轉移上清,加0.1 mL 5 mol/L NaCl、加0.3 mL氯仿,顛倒混勻,4 ℃ 12 000 r/min離心10 min,轉移上層水相,加等體積異丙醇,混勻,放置10 min,4 ℃ 12 000 r/min離心10 min,棄上清,75%乙醇漂洗沉淀,棄上清,室溫晾干沉淀,加適量DEPC-ddH2O溶解混勻,-70 ℃保存。
1.2.2 RT-PCR擴增
反轉錄試劑盒RevertAidTMFirst Strand cDNA Synthesis Kit購自Fermentas (MBI),取5 μg植物總RNA、1 μL隨機六聚體引物(0.2 μg/μL),加適量DEPC-ddH2O至12 μL,70 ℃變性5 min,冰浴冷卻,依次加入4 μL reaction buffer、1 μL ribonuclease inhibitor(20 U/μL)、2 μL dNTP(10 mmol/L),25 ℃溫育5 min,加入1 μL M-MuLV reverse transcriptase,42 ℃溫育1 h,70 ℃ 10 min滅活反轉錄酶。反應完畢后,產物冰上冷卻,-20 ℃保存備用。反轉錄產物適量稀釋后用于PCR擴增。
選取李屬壞死環斑病毒(PNRSV)、李矮縮病毒(PDV)、櫻桃病毒A(CVA)、櫻桃綠環斑駁病毒(CGRMV)、櫻桃小果病毒-2(LChV-2)、蘋果褪綠葉斑病毒(ACLSV)、櫻桃銼葉病毒(Cherryraspleafvirus,CRLV)、櫻桃葉斑駁病毒(CMLV)、櫻桃小果病毒-1(Littlecherryvirus-1,LChV-1)及櫻桃壞死銹斑駁病毒(CNRMV)作為檢測對象,根據GenBank上公布的上述病毒基因組序列為參照,設計合成的引物序列如表1。

表1 RT-PCR檢測引物
選取相應引物用于各病毒的檢測,反應條件為94 ℃ 5 min,94 ℃ 50 s,60 ℃ 50 s,72 ℃ 50 s,72 ℃ 10 min。PCR產物于1.2%瓊脂糖凝膠電泳檢測。
1.2.3 PCR產物克隆測序
PCR產物連接至pMD 18-T vector(TaKaRa),轉化大腸桿菌DH5α感受態細胞,經菌落PCR篩選陽性菌落,提取質粒,酶切鑒定后樣品送Invetrogen公司測序,序列分析采用DNAMAN軟件。
2 結果與分析
2.1 甜櫻桃花葉病癥狀
以山東省泰安市肥城邊院鎮甜櫻桃生產示范園作為田間癥狀觀察地點,對果園內甜櫻桃品種‘紅燈’花葉病癥狀進行觀察記錄。據觀察,植株從3月底至4月初尚未完全展葉時即可發病,至5月底-6月上旬癥狀表現達到高峰。花葉型葉片無萎蔫腐爛現象,病斑表面未見霜狀或粉狀霉層,表面無菌膿或黃色暈圈。在早春尚未完全展葉時葉片上可見黃綠相間的花葉斑駁病斑,隨著葉片展開,病斑出現褪綠黃化現象,伴隨有葉片皺縮、凸起及缺刻癥狀。有的葉片次脈周圍出現淡黃綠色至淺綠色的帶紋、環斑和褪綠斑,后期環斑內部組織壞死脫落,出現穿孔。感病植株整體生長遲緩,花朵小而少,結果量少,果實偏小,落花落果現象嚴重(圖1)。冬季葉片花葉癥狀出現隱癥現象,保護地栽培中發病較重。

圖1 甜櫻桃花葉病田間癥狀Fig.1 Field symptoms of sweet cherry trees suffering from mosaic disease
2.2 RT-PCR鑒定
提取葉片總RNA,以隨機六聚體引物反轉錄的cDNA第一鏈為模板,選取各病毒的特異性檢測引物進行RT-PCR擴增,瓊脂糖凝膠電泳結果顯示(圖2),10種甜櫻桃待檢病毒中,5種病毒檢測結果呈陽性,分別為PNRSV、PDV、CVA、CGRMV、LChV-2;3種不同的砧木樣品中都有病毒檢出,花葉型樣品均至少同時感染2種病毒,多病毒復合感染比例較高,病毒組合與葉片癥狀表型無明顯對應關系。例如,1、2號為以G5為砧木的褪綠斑駁型甜櫻桃樣品,7~12號為以G7為砧木的黃綠相間帶紋花葉型甜櫻桃樣品,卻同時感染PNRSV、PDV、CVA、CGRMV、LChV-2 5種病毒;3~6號同為DQY砧木的樣品,植株葉片都出現壞死環斑癥狀類型,但感染病毒組合類型卻不盡相同。然而,不同砧木類型,不同花葉癥狀類型的葉片均同時感染CGRMV和LChV-2。花葉病甜櫻桃樣品中,嫁接砧木差異與其病毒感染情況并無規律性可循,說明病毒危害與砧木類型無明顯相關性。各病毒的檢出率都在83.3%以上,說明花葉病危害植株體內普遍存在病毒感染(表2)。為進一步驗證該檢測的準確性,將各病毒檢測的PCR片段連接至克隆載體pMD18-T vector,克隆測序,序列結果與GenBank中各病毒基因組序列相應區段比對,同源性皆在91%~99.27%之間。以上結果表明,皺葉型甜櫻桃樹體至少感染5種病毒,而病毒組合類型與葉片癥狀、砧木類型無明顯對應關系。
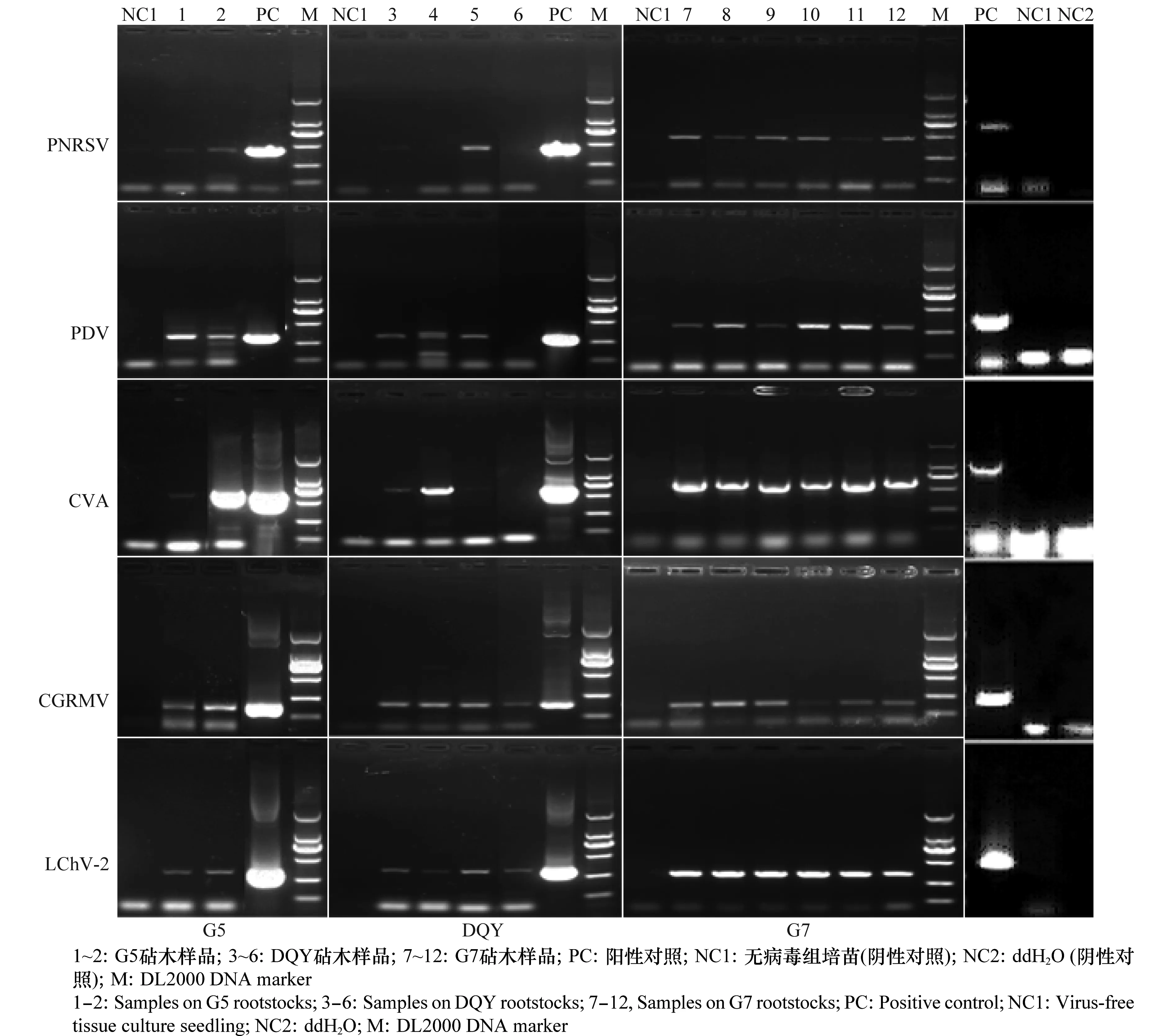
圖2 3種不同砧木的甜櫻桃品種‘紅燈’花葉病樹體內5種病毒的RT-PCR檢測Fig.2 RT-PCR detection of 5 viruses in sweet cherry samples on three different rootstocks
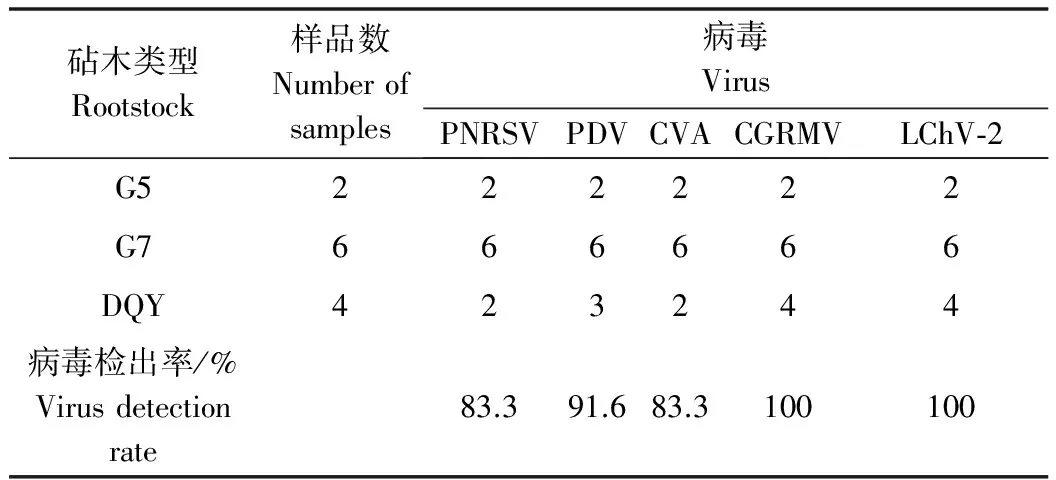
砧木類型Rootstock樣品數Numberofsamples病毒VirusPNRSVPDVCVACGRMVLChV?2G5222222G7666666DQY423244病毒檢出率/%Virusdetectionrate83.391.683.3100100
3 討論
植物花葉病與多因素相關,但各因素產生的花葉病癥狀卻不盡相同。本試驗根據各因素產生的癥狀差異排除葉片感染真菌和細菌的可能[3-8]。據觀察,田間葉片皺縮,多黃綠相間的斑駁花斑,嚴重的出現線紋、帶紋或褪綠環斑,與文獻記錄的病毒病癥狀相似[9]。
試驗選取文獻報道較多、與花葉相關的10種甜櫻桃病毒為鑒定對象,以嫁接3種不同砧木類型的花葉型‘紅燈’樣品為材料進行RT-PCR鑒定。結果顯示,感病樣品5種甜櫻桃病毒檢測呈陽性,且多為病毒復合侵染。進一步分析發現,不同病毒侵染組合與花葉病的不同癥狀類型、不同砧木類型并無直接相關性。檢出結果顯示,PNRSV、PDV、CVA檢出率均較高。據報道PNRSV可導致大櫻桃壞死環斑病和皺縮花葉病,葉片皺縮,出現壞死環斑,后期病斑內部脫落形成穿孔,嚴重時植株整株枯死,造成絕產[10];PDV可引起大櫻桃褪綠環斑病和葉片黃化病,植株產生淡綠色斑點或黃綠相間斑駁,葉脈透明,葉略有皺縮[11];CVA為我國近來發現的一種侵染櫻桃的潛隱性病毒,危害癥狀不明顯[16],但CVA經常和櫻桃小果病毒等其他病毒復合侵染,使果實產量和品質明顯下降[17],以上癥狀描述均與觀察結果相符。另外,各樣品均同時感染CGRMV及LChV-2。關于CGRMV對植物的危害尚無明確結論[18]。而LChV-2是櫻桃小果病的致病原之一,可導致果實發育不完全、糖度降低、上色不均勻等,嚴重影響甜櫻桃的經濟性狀[19-20]。具有花葉病癥狀的甜櫻桃植株通常果實敗育或坐果率不高,推測與感染LChV-2有關。
本研究結合癥狀觀察與分子生物學檢測方法,首次對山東泰安地區嫁接在3種不同砧木上的甜櫻桃品種‘紅燈’花葉病病樣病毒感染情況進行了調查,對當地花葉病樹體的癥狀進行記錄,初步探明泰安地區甜櫻桃“花葉病”樹體內確有病毒存在。花葉病植株體內有多種病毒存在,樹體花葉類型不同可能與體內不同病毒種類的復合侵染相關,病毒復合侵染加重了對甜櫻桃植株的危害。但關于以上病毒單獨或復合侵染甜櫻桃是否會引起花葉病,還需要通過試驗證實。接下來我們會進一步進行病毒回接試驗,根據科赫氏法則,結合病毒在草本指示植物及木本指示植物上的癥狀表現,做出最終的判定,為花葉病的分子生物學鑒定及綜合防治提供可靠的科學依據。由于目前病毒病傳播快,危害嚴重,而無有效的藥物防治,因此,對果園實行檢疫、對病株及時隔離和疏除、嫁接接穗選用無毒材料是當前最有效防治措施。而花葉型葉片可能作為甜櫻桃感染病毒病的指示性癥狀,為今后病害類型的快速診斷奠定基礎。
[1] 張福興,孫慶田,張序,等. 我國大櫻桃產業現狀與發展對策[J]. 煙臺果樹,2012,119(3):3-5.
[2] 吳雅琴,程和禾,常瑞豐,等. 甜櫻桃病毒病的發生及防治[J]. 河北農業科學,2010,14(10):44-45,47.
[3] 晉圖強,王金玉,陳紅艷,等. 果樹缺素癥的癥狀及防治對策[J]. 現代農業科技,2012(14):91.
[4] 鄢新民,葛元華,劉建庫,等. 果樹缺素癥狀及防治[J]. 現代農村科技,2012(1):26-27.
[5] 周世玉.林果樹缺素癥的識別與防治[J].價值工程,2010,29(15):163.
[6] 劉保友,張偉,欒炳輝,等. 大櫻桃褐斑病病原菌鑒定與田間流行動態研究[J]. 果樹學報,2012,29(4):634-637.
[7] 李壽義. 大櫻桃主要病蟲害發生規律與無公害防治技術[J]. 河北果樹,2012(1):22-24.
[8] 史賀奎,杜相堂,張承胤,等. 櫻桃細菌性病害發生特點及防治技術[J]. 山西果樹,2013(1):27-28.
[9] 董薇,宋雅坤,吳明勤,等. 大櫻桃病毒病研究進展[J]. 中國農學通報,2005,21(5):332-336.
[10]侯義龍,張開春,楊俊玲.應用RT-PCR方法檢測桃和櫻桃及其組培苗上的PNRSV和PDV[J].果樹學報,2005,22(3):292-293.
[11]侯義龍,楊俊玲,李春敏.李矮縮病毒RT-PCR方法建立及檢測應用[J].中國農業科學,2005,38(2):425-427.[12]Zhou Jufang,Wang Guoping,Kuang Rongfang,et a1.First report ofCherrygreenringmottleviruson cherry and peach grown in China [J].Plant Disease,2011,95(10):1319.
[13]凌薇,馬云霞,朱水芳,等. 利用實時熒光定量PCR技術檢測櫻桃葉斑駁病毒[J]. 植物檢疫,2011,25(2):28-31.
[14]Masamichi Isogai, Jun Aoyagi, Megumi Nakagawa, et al. Molecular detection of five cherry viruses from sweet cherry trees in Japan[J]. Journal of General Plant Pathology, 2004, 70(5):288-291.
[15]許志剛. 面向21世紀課程教材,普通植物病理學[M]. 第3版.北京:中國農業出版社,2003.
[16]Marais A, Candresse T, Svanella-Dumas L, et al. Cherry virus A [M]∥Hadidi A, Barba M, Candresse T, eds. Virus and virus-like diseases of pome and stone fruits. St Paul, MN, USA: APS Press, 2011.
[17]Marais A, Svanella-Dumas L, Barone M, et al. Development of a polyvalent RT-PCR detection assay covering the genetic diversity of cherry capillovirus A[J]. Plant Pathology, 2012, 61: 195-204.
[18]Zhang Y P, Kirkpatrick B C, Smart C D, et al. cDNA cloning and molecular characterization ofCherrygreenringmottlevirus[J]. Journal of General Virology, 1998, 79: 2275-2281.
[19]Eastwell K C, Bernardy M G. Partial characterization of a closterovirus associated with apple mealybug-transmitted little cherry disease in North America [J]. Phytopathology, 2001, 91(3): 268-273.
[20]Rott M E,Jelkmann W. Detection and partial characterization of a second closterovirus associated with little cherry disease, little cherry virus-2 [J].Phytopathology,2001,91(3):261-267.
Symptom and detection of the virus causing mosaic disease in sweetcherry trees in Tai’an, Shandong
Wang Wenwen, Zong Xiaojuan, Wei Hairong, Wang Jiawei, Zhu Dongzi, Tan Yue, Liu Qingzhong
(Shandong Institute of Pomology, Key Laboratory for Fruit Biotechnology & Breeding of Shandong Province, Tai’an 271000, China)
In order to identify the virus causing the sweet cherry mosaic disease in Tai’an, Shandong Province, leaf samples of sweet cherry cultivar ‘Red Lamp’ showing mosaic symptoms on different rootstocks were selected as the materials for total RNA extraction. Reverse transcription was carried out using random hexamer primer for cDNA synthesis. Specific primers were designed according to the genome sequences of each of the 10 sweet cherry viruses and used for RT-PCR detection. The results indicated that 5 virus species were detected positive, including PNRSV, PDV, CVA, CGRMV and LChV-2. All of the mosaic leaf samples were infected with 2 or more virus species. Mixed infection with various viruses was in a large proportion.
sweet cherry; mosaic disease; rootstock; virus; detection
2014-03-10
2014-06-13
公益性行業(農業)科研專項(201203075);“十二五”國家科技支撐計劃(2013BAD02B03-3-2);山東省現代農業產業技術體系水果創新團隊專項基金(2014)
S 436.629
A
10.3969/j.issn.0529-1542.2015.02.017
* 通信作者 E-mail: qzliu001@126.com

