微擬球藻硫脂酶基因克隆及其在大腸桿菌中的表達*
王麗麗,朱葆華,楊官品,潘克厚**
(中國海洋大學1.海水養殖教育部重點實驗室,2.海洋生命學院,山東 青島 266003)
植物細胞合成脂肪酸時,乙酰CoA羧化酶將乙酰CoA轉變為丙二酸單酰CoA[1],再經過脂肪酸合酶的催化,每循環增加2個碳延伸酰基碳鏈[2],最后硫酯酶(Thioesterase,TE)分解出脂肪酸和ACP,完成脂肪酸合成[3]。根據底物特異性,植物硫脂酶分為2類,FatA和 FatB[4-5]。FatA傾向水解不飽和酰基-ACP,對C18∶1-ACP有很強活性,而FatB傾向水解飽和或較短的酰基-ACP[6-10]。細菌硫脂酶則分為硫脂酶I和硫脂酶II,它們可以水解酰基-CoA和酰基-ACP,其中硫脂酶I催化C12-C18酰基-ACP/CoA水解,而硫脂酶II催化C6-C18酰基-ACP/CoA 水解[11]。目前,多種植物包括加州月桂、澳洲堅果、萼距花、擬南芥等的硫脂酶基因已被克隆并驗證了功能[2,7,12-13]。然而,藻類硫脂酶基因的克隆和功能驗證卻鮮有報道。
微擬球藻(Nannochloropsisoceanica)屬于真眼點藻綱(Eustigmatophyceae),多數分布于海洋,淡水中也有分布[14-15],富含蛋白質、多不飽和脂肪酸、色素等高附加值產物[16-18],是一類重要的單細胞經濟微藻。近年來,微擬球藻更是有望用于生產生物柴油[17-18]。脂質積累必須經過脂肪酸合成、去飽和、延伸、酰基化等步驟。微擬球藻含有豐富的油脂,因此,其必含有一套完整且高效的脂肪酸合成酶系。硫脂酶是脂肪酸合成通路的關鍵酶,水解酰基-ACP,釋放脂肪酸[10,19]。目前,關于微擬球藻脂肪酸去飽和酶和延伸酶的研究已有報道[20-21],但未見針對微擬球藻硫脂酶的研究。因此,探索微擬球藻硫脂酶的功能對全面認識微擬球藻脂肪酸的合成機制至關重要。
本實驗室已測定了N.oceanica基因組序列,并注釋了硫脂酶基因[22]。我們發現注釋的硫脂酶氨基酸序列與其他物種硫脂酶氨基酸序列相似性較低,硫脂酶又缺少功能驗證系統。為驗證微擬球藻硫脂酶基因功能,本研究用反轉錄PCR(RT-PCR)技術分離了微擬球藻硫脂酶基因cDNA(NoTE),并在大腸桿菌中進行了表達,根據大腸桿菌脂肪酸組成變化驗證微擬球藻硫脂酶基因功能。本研究為深入探索硫脂酶在微擬球藻脂肪酸合成過程中的作用奠定了基礎,為下一步通過基因工程手段調控微擬球藻脂肪酸代謝提供依據。
1 材料與方法
1.1 微擬球藻培養
微擬球藻(N.oceanica)為中國海洋大學海水養殖教育部重點實驗室保存,編號為LAMB 0001。將微擬球藻接種于250mL三角瓶中,內裝有200mL高壓蒸汽滅菌后的f/2培養基[23],于(23±1)℃、光強70 μmol·s-1·m-2、光周期12h∶12h、鹽度30、pH=7.8條件下培養。
1.2 引物設計與合成
根據注釋的NoTE設計引物,并引入酶切位點EcoRI和XhoI(下劃線)(見表1)。引物由上海生工生物工程技術服務有限公司合成。

表1 NoTE擴增引物Table 1 Primers used to amplify NoTE
1.3 微擬球藻硫脂酶基因克隆
用Trizol(Iinvitrogen公司)方法提取微擬球藻總RNA。用TransScript?One-Step gDNA Removal and cDNA Synthesis SuperMix(全式金公司)反轉錄合成cDNA,PCR擴增NoTE。PCR反應條件:94℃預變性3min接94℃變性30s,66℃退火30s,72℃延伸1.5min,30個循環和72℃延伸10min一個額外循環。用膠回收試劑盒(Omega公司)切膠純化PCR產物。與pEASY?-Blunt Cloning Vector(全式金公司)進行T-A連接后,轉化大腸桿菌Trans1-T1,PCR篩選陽性克隆并測序。
1.4 硫脂酶基因表達
提取重組質粒。將重組質粒和pET-30a均用EcoRI和XhoI雙酶切,回收純化后連接,構建重組質粒pET30a-NoTE,轉化大腸桿菌BL21(DE3),菌落PCR篩選陽性克隆并測序。
將重組子接種到含50μg/mL卡那霉素的LB液體培養基中[2],37℃震蕩培養過夜。按1∶100比例轉接到新鮮LB培養基,震蕩培養至OD600約0.6,加入IPTG至終濃度0.5mmol/L,30℃誘導4h。4℃下5 000g離心收集菌體,用100μL蒸餾水重懸菌體,加入300μL 4×蛋白質上樣緩沖液,100℃煮沸20min,12 000g離心5min,取上清進行SDS-PAGE檢測。
1.5 重組子脂肪酸組成分析和含量測定
取35mL菌液,4℃下5 000g離心收集菌體,參照文獻[24],在濕菌體中加入3mL萃取劑(甲醇∶氯仿=1∶2),渦旋震蕩10min萃取細胞總脂,再加入5mL皂化試劑(水∶甲醇=1∶4,含6%NaOH),60℃水浴1h,最后加入2mL甲酯化試劑(12%三氟化硼-甲醇溶液),60℃水浴30min,用1mL色譜純正己烷萃取脂肪酸甲酯,然后用AgiLent 6890Series GC Systerm(US10251016,USA)進行GC分析。色譜條件為汽化室溫度250℃,空氣流量450mL/min,氫火焰離子化檢測器(FID),N2載氣,線速45mL/min,H2線速40mL/min,分流比10∶1,程序升溫170℃ (1min)升至210℃ (25min),每分鐘開3℃。以十五烷酸(Sigma公司)為內標進行定量。
2 結果與分析
2.1 微擬球藻硫脂酶基因表達
PCR擴增獲得與預期大小相符的特異性條帶(見圖1)。測序顯示,插入T載體的DNA片段與NoTE預測序列一致。NJ進化樹(見圖2)顯示,硫脂酶主要分為植物FatA和FatB,細菌硫脂酶以及幾個單獨的種類,而微擬球藻硫脂酶與它們的同源性較低,是獨立于它們之外的一類硫脂酶。
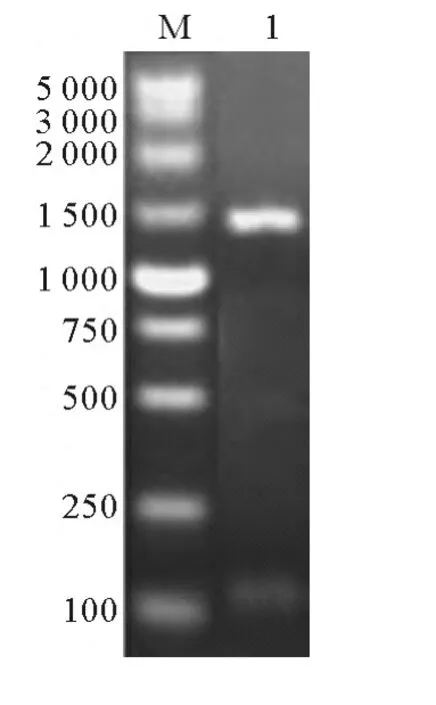
圖1 NoTE擴增結果Fig.1 RT-PCR product of NoTE
將NoTE從T載體上切下并連接到pET-30a上,構建重組質粒,用pET-30a特異性引物(5’-TCA AGA CCC GTT TAG AGG C-3’和 5’-TCA TTC TTC TGG TCT GGT GC-3’)菌落PCR擴增獲得一條特異條帶(見圖3),與預期大小相符。測序顯示插入pET-30aDNA片段與NoTE序列一致,說明重組質粒構建成功。
重組子誘導4h后,SDS-PAGE檢測發現在55kD處有一條特異條帶(見圖4),與預期蛋白大小相符,對照無特異條帶,說明NoTE已在大腸桿菌BL21(DE3)中表達。
2.2 重組子脂肪酸組成和含量
GC分析顯示重組子和對照脂肪酸組分相同,表明NoTE表達不改變大腸桿菌脂肪酸種類。但是,重組子脂肪酸定量(見圖5)顯示C14∶1、C16∶0、C16∶1、C18∶1及總脂肪酸含量與非重組子相比分別提高了11%、18%、32%、49%和30%,證明分離的基因確有硫脂酶活性,其表達能夠改變重組子脂肪酸含量,且微擬球藻硫脂酶傾向催化不飽和酰基-ACP的水解,對C18∶1-ACP有很強活性。
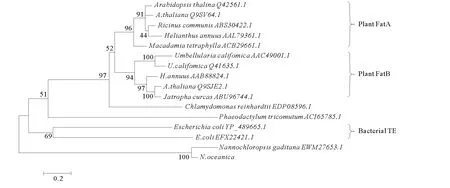
圖2 微擬球藻和其他物種硫脂酶的Neighbor-joining樹Fig.2 The Neighbor-joining tree of the thioesterase of N.oceanicaand those of other species
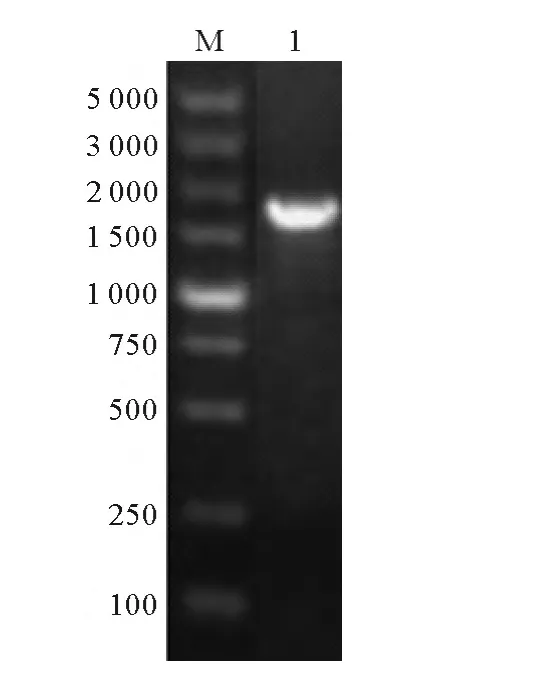
圖3 重組質粒PCR鑒定Fig.3 PCR verification of recombinant plasmid

圖4 NoTE在大腸桿菌中的表達Fig.4 Expression of NoTEin E.coli BL21(DE3)
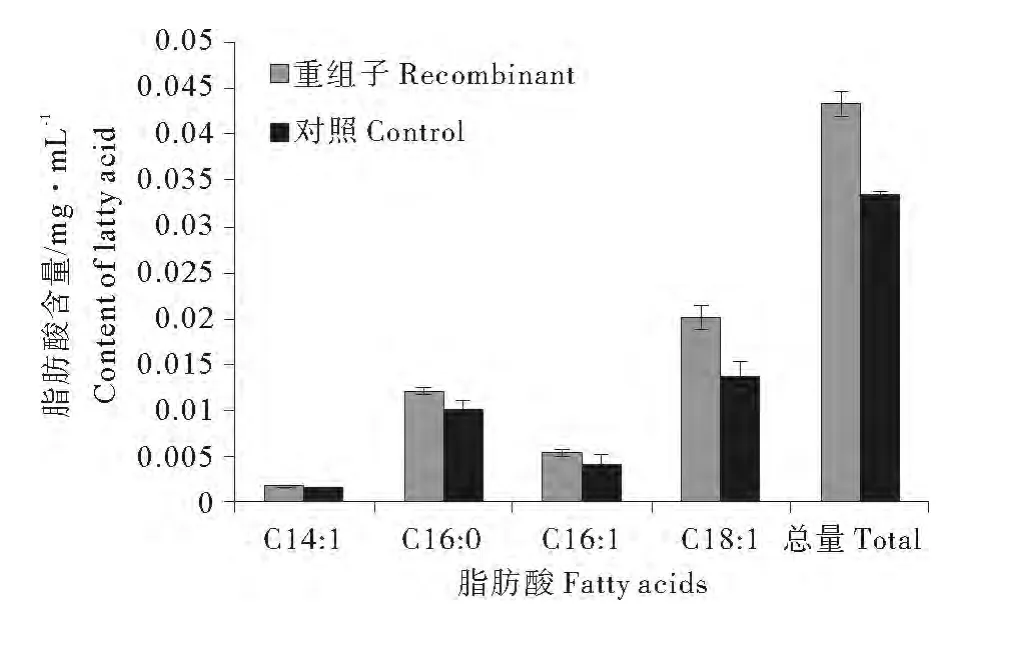
圖5 NoTE表達對大腸桿菌脂肪酸含量的影響Fig.5 Changes in the contents of fatty acids of E.coli BL21(DE3)expressing NoTE
3 討論
本研究分離了微擬球藻一條硫脂酶基因,其功能尚未驗證,因此,確定其功能對利用該基因調控微擬球藻的脂肪酸代謝至關重要。大腸桿菌遺傳背景清楚、表達系統成熟完善、繁殖迅速、培養簡單、操作方便、遺傳穩定,其表達系統為驗證NoTE的功能提供了一個合適的平臺。因此,本實驗選擇大腸桿菌做為表達宿主,通過SDS-PAGE檢測重組子,發現55kD處有一特異條帶,與預期蛋白大小相符,初步說明NoTE在大腸桿菌中成功表達。
通過氣相色譜對重組子進行脂肪酸組成分析,GC數據顯示,大腸桿菌重組子脂肪酸種類雖未發生改變,但其總脂肪酸含量卻顯著增加,說明異源表達硫脂酶基因可顯著提高細菌總脂肪酸含量,這與文獻[3,25]的報道一致。另外,重組子C16∶1、C18∶1的含量顯著提高,這表明微擬球藻硫脂酶與植物FatA功能相似,主要水解不飽和酰基-ACP,并對C18∶1-ACP活性較強,而細菌硫脂酶對C6-C18酰基-ACP/CoA活性更強[3,11]。本研究中,重組子C16∶0脂肪酸的含量也有一定程度的提高,說明微擬球藻硫脂酶也具有一部分植物FatB的功能,表明FatA和FatB的活性有部分是重疊的[25-26]。這些數據充分證明微擬球藻硫脂酶對不飽和酰基-ACP有更強的親和力,主要水解C18∶1-ACP,并且與FatB的活性有一定重疊,也可以水解C16∶0-ACP。由于大腸桿菌表達系統缺乏對真核蛋白質的復性功能和修飾加工系統,更系統、全面的了解NoTE的功能還需要更多的實驗依據。在接下來的實驗中,我們擬純化重組蛋白,對該酶的底物特異性進行分析;進一步通過轉基因技術在微擬球藻中過量表達該基因,從而實現微擬球藻脂肪酸構成的基因工程修飾。
本研究首次對NoTE的功能進行了驗證,為進一步研究該酶基因的功能,并通過基因工程手段調控微擬球藻脂肪酸代謝,提高脂肪酸產量,改變脂肪酸組成提供了一定的基礎。
[1]Ruffing A M.Borrowing genes fromChlamydomonasreinhardtiifor free fatty acid production in engineered cyanobacteria[J].J Appl Phycol,2013,25(5):1495-1507.
[2]Voelker T A,Davies H M.Alteration of the specificity and regulation of fatty acid synthesis ofEscherichiacoliby expression of a plant medium-chain acyl-acyl carrier protein thioe[J].J Bacteriol,1994,176(23):7320-7327.
[3]Gong Y M,Guo X J,Wan X,et al.Characterization of a novel thioesterase(PtTE)fromPhaeodactylumtricornutum[J].J Basic Microbiol,2011,51:666-672.
[4]Jones A,Davies H M,Voelker T A.Palmitoyl-acyl carrier protein(ACP)thioesterase and the evolutionary origin of plant acyl-ACP thioesterases[J].Plant Cell,1995,7:359-371.
[5]Salas J J,Ohlrogge J B.Characterization of substrate specificity of plant FatA and FatB acyl-ACP thioesterases[J].Arch Biochem Biophys,2002,403(1):25-34.
[6]Dani K G S,Hatti K S,Ravikumar P,et al.Structural and functional analyses of a saturated acyl ACP thioesterase,type B from immature seed tissue ofJatrophacurcas[J].Plant Biology,2011,13(3):453-461.
[7]Moreno-Pérez A J,Sánchez-García A,Salas J J,et al.Acyl-ACP thioesterases fromMacadamia(Macadamiatetraphylla)nuts:Cloning,characterization and their impact on oil composition[J].Plant Physiol Biochem,2011,49:82-87.
[8]Wu P Z,Li J,Wei Q,et al.Cloning and functional characterization of an acyl-acyl carrier protein thioesterase (JcFATB1)fromJatrophacurcas[J].Tree Physiol,2009,29:1299-1305.
[9]Wen Q G,Lei Y,Huang J Q,et al.Molecular cloning and charac-terization of an acyl-ACP thioesterase gene(AhFatB1)from allotetraploid peanut(ArachishypogaeaL.)[J].Afr J Biotechnol,2012,11(77):14123-14131.
[10]元冬娟,吳湃,江黎明.高等植物的酰基-ACP硫酯酶研究進展[J].中國油料作物學報,2009,31(1):103-108.
[11]Cho H,Cronan J E.Escherichiacolithioesterase I,molecular cloning and sequencing of the structural gene and identification as aperiplasmic enzyme[J].J Biol Chem,1993,268(13):9238-9245.
[12]Dehesh K,Jones A,Knutzon D S,et al.Production of high levels of 8∶0and 10∶0fatty acids in transgenic canola by overexpression ofChFatB2,a thioesterase cDNA fromCupheahookeriana[J].Plant J,1996,9(2):167-172.
[14]黃偉超,胡晗華.微擬球藻屬對鹽度的耐受及其產油特性分析[J].水生生物學報,2013,37(2):383-387.
[15]Solovchenko A,Khozin-Goldberg I,Recht L,et al.Stress-induced changes in optical properties,pigment and fatty acid content ofNannochloropsissp.:Implications for non-destructive assay of total fatty acids[J].Mar Biotechnol,2011,13:527-535.
[16]Kilian O,Benemann C S E,Niyogi K K,et al.High-efficiency homologous recombination in the oil-producing algaNannochloropsissp.[J].PNAS,2011,108(52):21265-21269.
[17]Pal D,Khozin-Goldberg I,Cohen Z,et al.The effect of light,salinity,and nitrogen availability on lipid production byNannochloropsissp.[J].Appl Microbiol Biotechnol,2011,90:1429-1441.
[18]Nobre B P,Villalobos F,Barragán B E,et al.A biorefinery fromNannochloropsissp.microalga-Extraction of oils and pigments.Production of biohydrogen from the leftover biomass[J].Bioresour Technol,2013,135:128-136.
[19]Radakovits R,Jinkerson R E,Darzins A I,et al.Genetic engineering of algae for enhanced biofuel production [J].Eukaryot Cell,2010,9(4):486-501.
[20]Pan K H,Ma X L,Yu J Z,et al.Cloning and phylogenetic analysis of a fatty acid elongase gene fromNannochloropsisoculataCS179[J].J Ocean Univ China,2009,8(4):392-398.
[21]Ma X L,Yu J Z,Zhu B H,et al.Cloning and characterization of a delta-6desaturase encoding gene ofNannochloropsisoculata[J].Chin J Oceanol Limnol,2011,29(2):290-296.
[22]Pan K H,Qin J J,Li S,et al.Nuclear monoploidy and asexual propagation ofNannochloropsisoceanica(Eustigmatophyceae)as revealed by its genome sequence[J].J Phycol,2011,47:1425-1432.
[23]Guillard R R L,Ryther J H.Studies of marine planktonic diatoms:CyclotellananaHustedt,andDetonulaconfervacea(cleve)Gran[J].Can J Microbiol,1962,8:229-239.
[24]程濤,楊建明,劉輝,等.擬南芥硫酯酶基因(atfata)在大腸桿菌中的表達及其對游離脂肪酸合成的影響 [J].應用與環境生物學報,2011,17(4):568-571.
[25]Serrano-Vega M J,Garcés R,Martínez-Force E.Cloning,characterization and structural model of a FatA-type thioesterase from sunflower seeds(HelianthusannuusL.)[J].Planta,2005,221:868-880.
[26]Huynh T T,Pirtle R M,Chapman K D.Expression of aGossypiumhirsutumcDNA encoding a FatB palmitoyl-acyl carrier protein thioesterase inEscherichiacoli[J].Plant Physiol Biochem,2002,40:1-9.

