2型糖尿病合并侵襲性肺曲霉病9例臨床分析
韓秀迪,劉學東,葛云潔,趙偉業
隨著廣譜抗生素、糖皮質激素、細胞毒藥物及免疫抑制劑應用的增多,侵襲性肺曲霉病(invasive pulmonary aspergillosis,IPA)作為一種臨床少見病,其發病率也在逐年增多。2型糖尿病患者,尤其是血糖控制不佳的患者,由于長期血糖升高,導致機體細胞免疫功能下降,白細胞趨化活性、黏附能力以及殺菌能力降低,從而成為發生IPA 的危險因素。本研究回顧性分析青島市市立醫院單純2型糖尿病合并IPA 患者的臨床資料,探討其臨床特點及預后,加強對該病的認識,提高早期診療水平,改善預后。
1 材料與方法
1.1 研究對象
收集2008 年1 月—2013年12 月我院呼吸內科收治的9例單純2型糖尿病合并IPA 患者的臨床資料。其中男性6例,女性3例,年齡39~81歲。
1.2 診斷標準
糖尿病的診斷標準按WHO1999年制定標準,即空腹血糖≥7.0mmol/L,或餐后2 h血糖≥11.1 mmol/L。
2008年歐洲癌癥/侵襲性真菌感染研究治療組織及國立變態反應和感染病研究院真菌病研究組(EORTC/MSG)共同制定了新的侵襲性真菌病(IFD)的專家共識[1]。根據定義將IFD(包括IPA的診 斷)分 為3 類:確 診(proven)、臨床診 斷(probable)、擬診(possible),具體標準如下。
1.2.1 確診 通過組織病理學或細胞病理學或直接鏡檢的方法,在組織壞死部位活檢或針吸活檢獲取曲霉的證據,鏡檢發現分隔、45°分支的菌絲;或組織培養,通過無菌操作獲取的標本培養出曲霉,除外支氣管肺泡灌洗液(BALF)。
1.2.2 臨床診斷 同時滿足a+b+c中每項標準至少有1條符合。a.宿主因素:包括中性粒細胞減少癥>10 d(中性粒細胞<0.5×109/L)、異基因造血干細胞移植、長期(>3周)應用糖皮質激素(潑尼松每日平均最低劑量0.3 mg/kg或等同劑量其他激素,除外過敏性支氣管肺曲霉病)、近90 d內應用T 細胞免疫抑制劑(如環孢素、TNF-α抑制劑、特異性單克隆抗體或核苷類似物)或遺傳性嚴重免疫缺陷癥(如慢性肉芽腫性疾病或嚴重聯合免疫缺陷)。b.臨床標準:包括下呼吸道真菌病(肺CT 表現至少應具備以下標準中的1條:致密、邊界清楚的實變影伴或不伴暈輪征,空氣-新月征,空洞)或氣管支氣管炎(支氣管鏡下表現為支氣管潰瘍、結節、假膜、斑塊或痂)。c.真菌學標準:直接檢查,通過細胞學、直接鏡檢或培養的方法在痰、BALF 或支氣管刷檢標本中獲取曲霉的證據;間接檢查,通過抗原或細胞壁成分檢測發現曲霉[血漿、血清、BALF 中半乳甘露聚糖試驗(GM)陽性]。
1.2.3 擬診 同時符合上述標準中的a+b,但無真菌學證據。
1.3 療效判定
按衛生部頒發的《抗菌藥物臨床應用指導原則》,療效分為痊愈、顯效、進步、無效4級。痊愈:癥狀、體征、實驗室檢查和病原學檢查4項全部恢復正常;顯效:病情明顯好轉,但4項中1項未完全恢復正常;進步:用藥后病情有好轉,但不明顯;無效:用藥72 h臨床癥狀無改善或加重。治療有效定為痊愈+顯效。
1.4 分析方法
采用回顧性分析的方法對9例單純2型糖尿病合并IPA 患者的病史資料、臨床表現、診斷手段、治療及轉歸進行總結分析。
2 結果
2.1 基本臨床資料
9例2型糖尿病合并IPA 患者的臨床表現及部分實驗室檢查結果見表1。糖尿病病程12 d~20年,其中8例患者監測4點血糖均升高,餐后血糖最高者達32.1 mmol/L,其中1例為住院時初次診斷;1例患者空腹血糖波動在7.8~12.6 mmol/L,餐后2 h血糖基本控制在正常范圍。半數以上的患者炎性指標均明顯升高,如白細胞總數最高達50.1×109/L、中性粒細胞最高達46.6×109/L、血沉最高達147 mm/h、C-反應蛋 白(CRP)最高達98.3 mg/L、降鈣素原(PCT)最高達3.1 ng/mL、D-二聚體最高達16.5 mg/L。
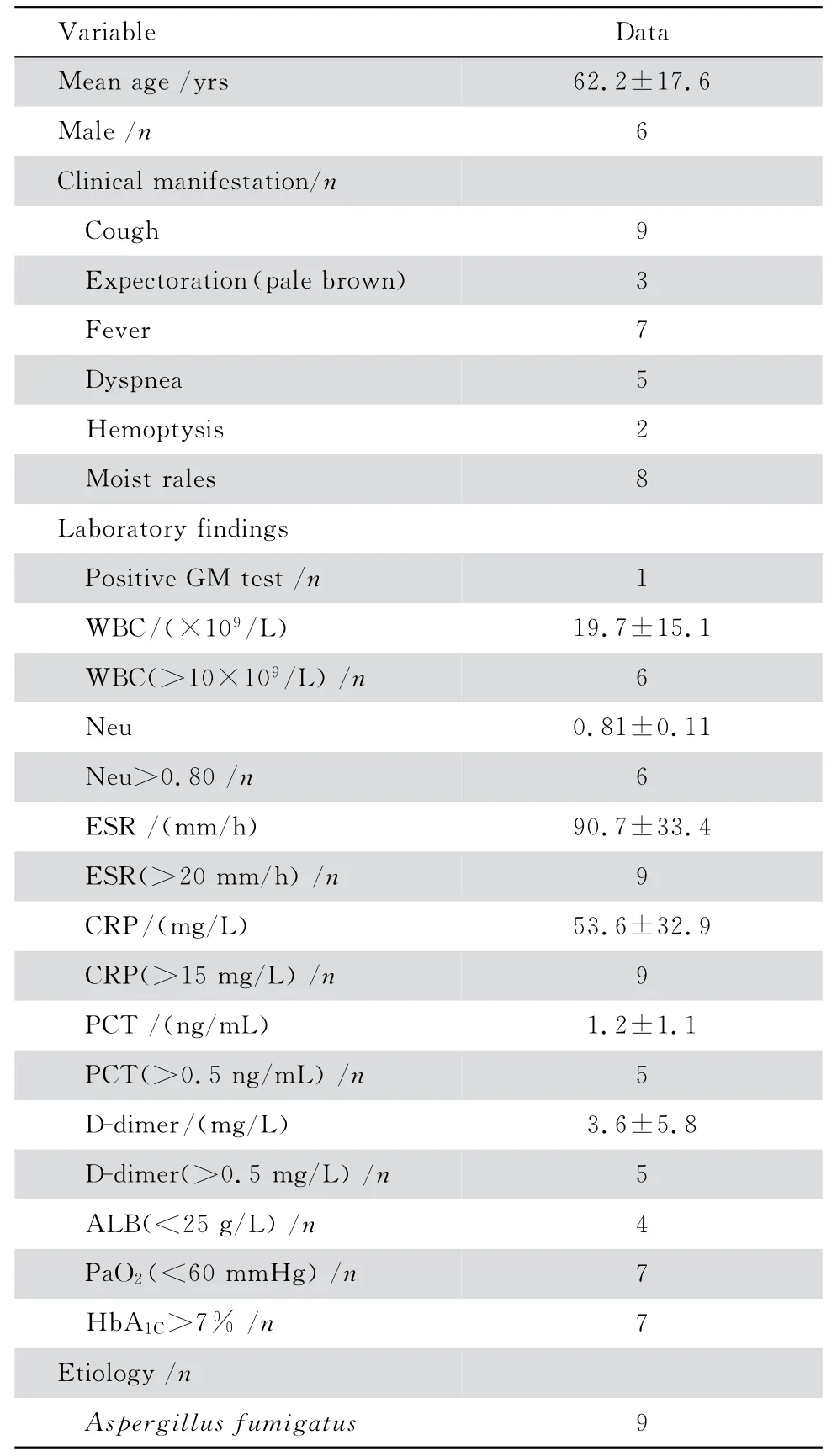
表1 2型糖尿病合并IPA 患者的臨床資料Table 1 Clinical characteristics of 9 cases of type 2 diabetes mellitus complicated with invasive pulmonary aspergillosis
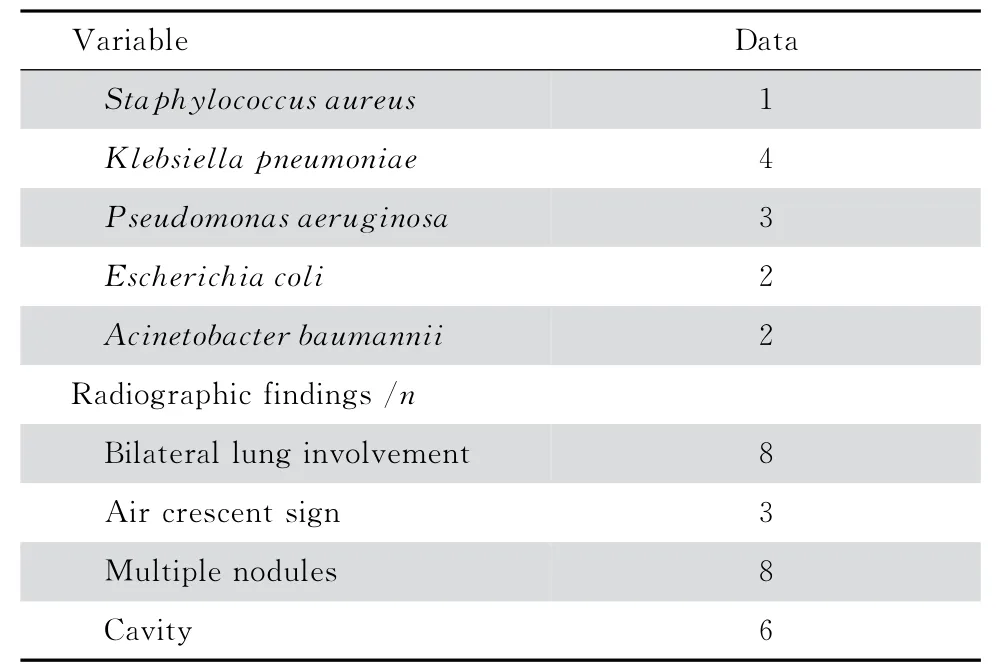
continued table 1
2.2 影像學特征
9例患者主要以雙肺(8/9)、多發病灶(8/9)、結節影(8/9)、空洞征(6/9)表現為主,3例患者可見新月征(圖1)、暈征(圖2),1例患者影像學僅見肺紋理粗亂。
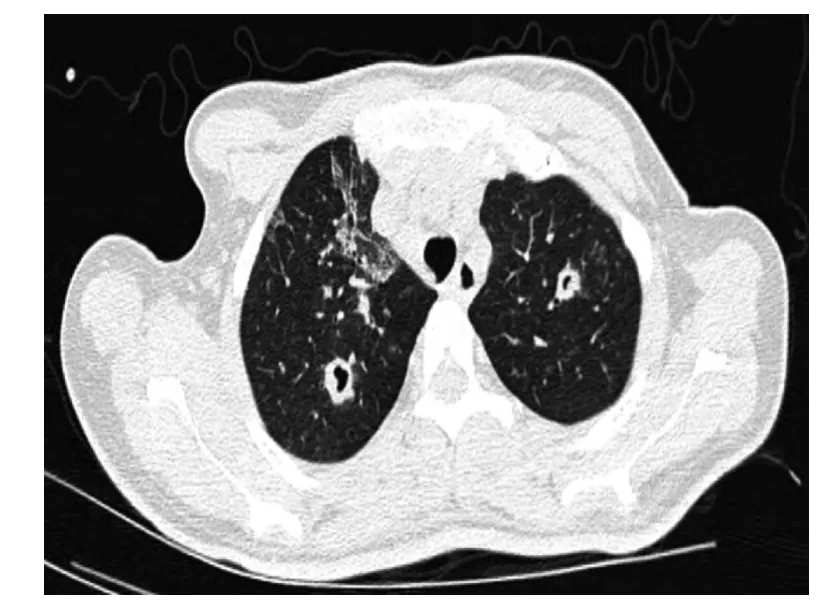
圖1 胸部CT 顯示雙肺上葉可見新月征Figure 1 Chest CT showed“air crescent signs”in upper lobe of bilateral lungs

圖2 胸部CT 顯示雙肺上葉結節影周圍可見暈征Figure 2 Chest CT showed“halo sign”around nodules in upper lobe of bilateral lungs
2.3 支氣管鏡鏡下表現
9例患者支氣管鏡檢查均有異常改變,受累支氣管黏膜充血、水腫、糜爛,其中表面覆蓋白色或黃褐色膿苔8例、充分吸引膿苔后黏膜呈現潰瘍表現2例,黏膜表面結節2 例,管腔內息肉樣新生物1例。2例患者受累支氣管管腔呈不同程度的不規則狹窄(圖3);1例患者段支氣管管腔被白色絲狀分泌物完全阻塞,經充分灌洗、鉗取、冷凍治療后管腔通暢,白色絲狀物病理證實為曲霉(組織切片可見菌絲和孢子,菌絲長短不一,菌絲分隔,分支呈45°角,PAS染色呈紅色),周圍伴大量中性粒細胞浸潤。4 d后再行支氣管鏡檢查發現同一部位再次阻塞(圖4)。
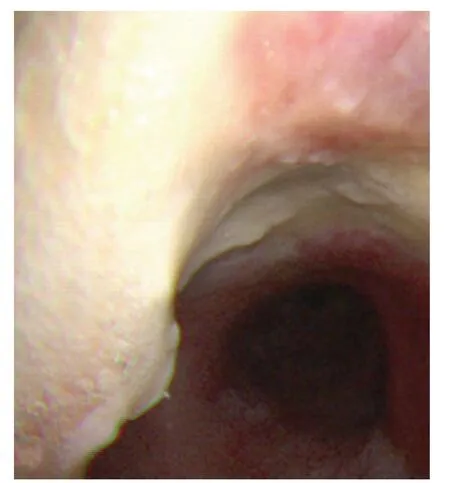
圖3 支氣管鏡檢查提示氣管隆突周圍及前方白苔覆蓋,左前上方氣管壁可見白苔結節樣隆起Figure 3 Bronchoscopic examination revealed white moss around and in front of tracheal carina and nodular bulge in the upper left of trachea wall
2.4 診斷
本組9 例患者均為單純2 型糖尿病患者,無EORTC/MSG 診斷標準中宿主因素所提及的合并癥,但參考2006年中國侵襲性肺部真菌感染工作組侵襲性肺部真菌感染的診斷標準與治療原則(草案),糖尿病亦為其中的危險因素。
IPA 初次診斷誤診6例。所有患者支氣管鏡檢過程中均行黏膜活檢和肺泡灌洗,送檢組織學和細胞學病理和培養,僅有5例患者組織病理學檢查發現曲霉特征性表現(圖5)為確診病例。其中1例為影像學無特征性表現者,該患者因臨床表現呼吸困難較重、咯棕黃色膿性痰而行支氣管鏡檢查,鏡下發現異常,黏膜活檢證實曲霉感染。臨床診斷4例,其中3例患者痰培養連續3次分離出煙曲霉,結合影像學特征(結節影、空洞、新月征、暈征)和臨床表現(發熱、咳嗽、咯痰、呼吸困難)考慮臨床診斷IPA。另1例患者不僅痰培養分離出煙曲霉,同時GM 試驗2次陽性(1周內送檢2次,I值分別為1.031和0.874),結合影像學特征(結節影、空洞、新月征、暈征)考慮臨床診斷IPA。所有患者培養鑒定的曲霉種類均為煙曲霉。

圖4 支氣管鏡檢查發現右肺下葉前基底段亞段白色絲狀物完全阻塞管腔Figure 4 Bronchoscopic examination found that white filaments in anterior basal segment of right lower lobe completely obstructed the lumen
2.5 治療與轉歸
9例均接受抗真菌藥物治療,選用的抗真菌藥物包括伏立康唑、伊曲康唑和兩性霉素B。其中單純用伏立康唑或伊曲康唑治療者分別為5 例和2例,余2例采用伏立康唑聯合兩性霉素B(10 mg+滅菌純化水10 mL霧化吸入,每日2次),總體初始治療以伏立康唑為主。所有患者均接受支氣管鏡介入治療,方法為局部吸引、活檢鉗鉗夾或冷凍痰栓及膿苔。9例患者中4例接受過1次支氣管鏡檢查,因病情危重,未再行支氣管鏡檢查;余患者接受過2次(1例)、3次(3例)、4次(1例)支氣管鏡檢查。經抗真菌治療有效的患者治療后復查支氣管鏡發現支氣管黏膜充血、水腫、糜爛等表現明顯減輕,鏡下未見明顯膿苔覆蓋,與影像學檢查相符合。
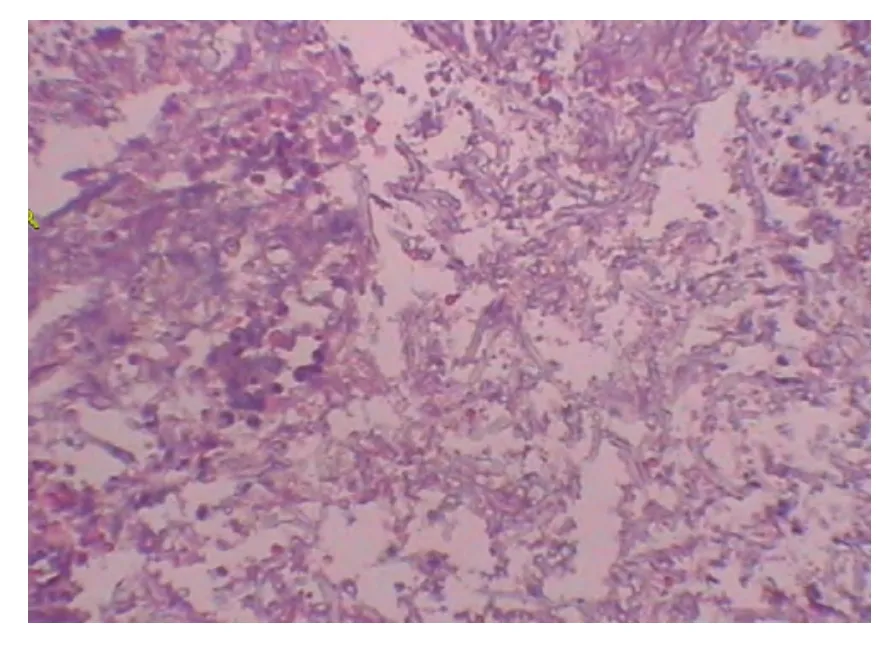
圖5 黏膜活檢病理呈化膿性炎,可見大量壞死和成團曲霉菌絲及孢子Figure 5 Mucosal biopsy showed purulent inflammation associated with large amount of necrosis,and cluster of Aspergillus hyphae and spores
抗真菌藥物治療療程3 d~10周。總有效4例(4/9),其中痊愈2例,顯效2例,死亡5例。死亡的5例中4例為2008年1月—2010年12月死亡,主要與早期誤診、初始治療不當(前期廣譜抗生素應用較多、甚至用過糖皮質激素)、對IPA 認識不足、抗真菌藥物應用不及時有關;另1例患者在早期確診IPA 后,及時、足量應用伏立康唑及兩性霉素B 治療2周,在臨床表現好轉、影像學及支氣管鏡鏡下表現均明顯改善的情況下,突然出現大咯血導致窒息死亡。
3 討論
1953年Rankin[2]首次對IPA 進行了描述,使臨床醫師對IPA 有了初步的認識和了解;在隨后的數十年中,由于器官移植、免疫抑制劑、化療藥物的應用增多,IPA 的發病率也呈增加趨勢。近年來,慢性疾病,如慢性阻塞性肺疾病、支氣管哮喘、糖尿病、營養不良等也成為發生IPA 的高危人群[3-7]。
2型糖尿病患者并發IPA 的發病機制被認為與以下幾方面有關:①糖尿病患者白細胞磷酸果糖激酶活性降低,糖酵解顯著降低,白細胞功能受抑制,中性粒細胞趨化功能缺陷,白細胞內殺菌活性減弱;而長期血糖控制不良的糖尿病患者,蛋白質代謝受損,體內蛋白質合成減慢,分解加速,使免疫球蛋白、補體、抗體等重要物質的分泌減少,機體防御能力減弱,使真菌入侵的抵抗力減弱甚或消失,容易引起曲霉感染;②糖尿病患者合并肺部微血管病變,肺毛細血管基底膜增厚、肺毛細血管減少,組織缺氧。低氧血癥使肺表面活性物質減少,通氣/血流比例失調,局部組織抗感染能力減弱;③因糖尿病患者容易發生呼吸道、泌尿道、皮膚軟組織感染,故抗菌藥物的不合理使用,導致菌群失調,真菌大量繁殖,引起或加重感染;④高血糖環境易于真菌和細菌生長、繁殖[8-9]。
本組資料顯示9例2型糖尿病患者并發IPA 的臨床表現大多以發熱、咳嗽、咯痰為主,但咯典型棕黃色痰栓者僅3例;此外,所有患者血糖控制不良。因糖尿病本身可引起肺毛細血管病變,導致組織缺氧,加之本組患者多為雙肺多發病灶,同時部分患者伴有不規則支氣管管腔狹窄或完全阻塞,7例患者表現為低氧血癥,其中5例主訴有胸悶、憋氣、呼吸困難等;2例患者因糖尿病微血管病變及IPA 產生內毒素與溶血蛋白酶導致血管壞死、溶解、出血而臨床表現為咯血,其中1例患者因大咯血窒息死亡。
本研究發現,半數以上的患者炎性指標均明顯升高,如白細胞總數、中性粒細胞、血沉、CRP、PCT、D-二聚體。CRP、PCT、D-二聚體與感染的相關性已經得到諸多證實[10-13],三者數值越高,說明體內炎性感染越嚴重。糖尿病患者因呼吸系統屏障功能削弱,纖毛活動能力減低,免疫球蛋白分泌減少導致呼吸道抵抗力降低,曲霉以孢子的形式入侵。雖然糖尿病患者免疫功能低下,但機體免疫系統仍有識別霉菌孢子并遏制其生長的能力。病原菌識別受體如Toll樣受體、dectin-1、pentraxin-3等識別并分泌細胞因子及趨化因子,從而刺激局部中性粒細胞募集和抗原特異性免疫反應[14-17]。炎性指標的升高既提示該病的嚴重程度,又說明了曲霉病代表免疫受損與免疫過度反應之間的搏弈導致的一系列臨床疾病。此外,我們還發現,5 例確診IPA 患者的GM試驗均為陰性,僅有1例臨床診斷的IPA 患者連續2次GM 試驗陽性,分析原因如下:其一可能存在試劑盒檢測誤差;其二,人體內過高的葡萄糖水平可代替甘露聚糖和巖藻糖綁定免疫抗體,妨礙免疫受體識別感染性細菌和真菌,從而抑制人體免疫系統C型凝集素的功能,導致甘露聚糖結合凝集素的功能失效。
IPA 的典型影像學特征可表現為新月征、暈征,在本組資料中這些典型征象相對較少,主要考慮這些患者從起病到診斷的時間過長,并非IPA 早期。本研究資料顯示9例患者中8例主要表現為沿支氣管血管束分布的、雙肺多發、大小不等的結節影、斑片影,同時伴有大小不等的空洞征。空洞的出現亦是診斷IPA 的重要CT 征象。1例患者因白色分泌物完全阻塞段支氣管引起遠端阻塞性肺炎的表現。
除了典型的影像學特征,支氣管鏡檢查在IPA的診斷以及治療過程中亦發揮了極其重要的作用,對于疑診病例,病情允許的情況下,建議患者早期、反復多次進行支氣管鏡檢查,及早獲取組織學及病原學結果及時指導治療;對于確診病例,尤其是氣管或支氣管管腔部分或完全堵塞的患者,反復灌洗、鉗夾及冷凍介入治療可通暢氣道,改善阻塞性肺炎,改善氧合。
隨著臨床醫師對IPA 宿主因素、影像學特征的逐步認識,早期診斷、早期治療、聯合治療(藥物聯合治療,藥物+支氣管鏡介入治療)成為挽救IPA 患者生命的關鍵,伏立康唑作為IPA 初始治療的一線藥物[18-19]應用較多。本研究中確診及疑診病例均給予了單藥或雙藥聯合支氣管鏡介入治療,但死亡率仍較高,主要與未早診斷、早治療有關。對于伴咯血的IPA 患者,臨床上應給予高度重視,基于曲霉的嗜血管性,極易侵犯血管,引起血管破裂大咯血導致患者窒息死亡。
通過本研究,總結糖尿病合并IPA 的臨床特點如下:①血糖控制不良,機體免疫力低下,患者容易出現肺部感染;②臨床多表現為發熱、咳嗽、咯痰、呼吸困難,肺部聽診濕啰音;③肺CT 表現多樣化,有特征性征象者高度提示IPA;④支氣管鏡檢查多有異常,可表現為膿苔、假膜、潰瘍、結節;⑤病死率高,預后差。因此,糖尿病作為IPA 發生的高危因素應引起臨床醫師的高度重視,尤其是血糖控制不良的糖尿病患者。當肺部出現實變影(伴或不伴暈征)、結節影、空洞等表現時,應積極與患者及其家屬溝通,條件允許,盡早行支氣管鏡檢查,獲取組織病理學證據明確診斷;若影像學無特異性表現,但患者臨床表現較重,高熱合并呼吸困難,低氧血癥,應高度警惕氣管支氣管炎型肺曲霉病的可能,盡早行支氣管鏡檢查,以便早期診斷,早期給予抗真菌治療,合理調整血糖,改善營養不良、糾正低氧血癥等,從而有效降低IPA 的死亡率,改善患者預后。
[1]De Pauw B,Walsh TJ,Donnelly JP,et al.Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group(EORTC/MSG)Consensus Group[J].Clin Infect Dis,2008,46(12):1813-1821.
[2]Rankin NE.Disseminated aspergillosis and moniliasis associated with agranulocytosis and antibiotic therapy[J].Br Med J,1953,1(4816):918-919.
[3]Bulpa P,Dive A,Sibille Y.Invasive pulmonary aspergillosis in patients with chronic obstructive pulmonary disease[J].Eur Respir J,2007,30(4):782-800.
[4]Tutar N,Metan G,Ko? AN,et al.Invasive pulmonary aspergillosis in patients with chronic obstructive pulmonary disease[J].Multidiscip Respir Med,2013,8(1):59.
[5]Wessolossky M,Welch VL,Sen A,et al.Invasive Aspergillus infections in hospitalized patients with chronic lung disease[J].Infect Drug Resist,2013,6:33-39.
[6]Higa M.Clinical epidemiology of fungal infection in diabetes[J].Nihon Rinsho,2008,66(12):2239-2244.
[7]Morton JR,Mihalas LS,Leung P,et al.Corticosteroids and malnutrition.Aspergillus lung abscess in an asthmatic child[J].Chest,1980,78(4):667-669.
[8]Milla CE,Zirbes J.Pulmonary complications of endocrine and metabolic disorders[J].Paediatr Respir Rev,2012,13(1):23-28.
[9]Peleg AY,Weerarathna T,McCarthy JS,et al.Common infections in diabetes:pathogenesis,management and relationship to glycaemic control[J].Diabetes Metab Res Rev,2007,23(1):3-13.
[10]Niu WY,Wan YG,Li MY,et al.The diagnostic value of serum procalcitonin,IL-10 and C-reactive protein in community acquired pneumonia and tuberculosis[J].Eur Rev Med Pharmacol Sci,2013,17(24):3329-3333.
[11]Claessens YE,Mathevon T,Kierzek G,et al.Accuracy of C-reactive protein,procalcitonin,and mid-regional pro-atrial natriuretic peptide to guide site of care of community-acquired pneumonia[J].Intensive Care Med,2010,36(5):799-809.
[12]Claessens YE,Schmidt J,Batard E,et al.Can C-reactive protein,procalcitonin and mid-regional pro-atrial natriuretic peptide measurements guide choice of in-patient or out-patient care in acute pyelonephritis?Biomarkers In Sepsis(BIS)multicentre study[J].Clin Microbiol Infect,2010,16(6):753-760.
[13]Snijders D,Schoorl M,Schoorl M,et al.D-dimer levels in assessing severity and clinical outcome in patients with community-acquired pneumonia.A secondary analysis of a randomised clinical trial[J].Eur J Intern Med,2012,23(5):436-441.
[14]Garlanda C,Hirsch E,Bozza S,et al.Non-redundant role of the long pentraxin PTX3 in anti-fungal innate immune response[J].Nature,2002,420(6912):182-186.
[15]Bellocchio S,Moretti S,Perruccio K,et al.TLRs govern neutrophil activity in aspergillosis[J].J Immunol,2004,173(12):7406-7415.
[16]Gantner BN,Simmons RM,Canavera SJ,et al.Collaborative induction of inflammatory responses by dectin-1 and Toll-like receptor 2[J].J Exp Med,2003,197(9):1107-1117.
[17]Segal BH.Aspergillosis[J].N Engl J Med,2009,360(18):1870-1884.
[18]Herbrecht R,Denning DW,Patterson TF,et al.Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis[J].N Engl J Med,2002,347(6):408-415.
[19]Walsh TJ,Anaissie EJ,Denning DW,et al.Treatment of aspergillosis:clinical practice guidelines of the Infectious Diseases Society of America[J].Clin Infect Dis,2008,46(3):327-360.

