采用基于PCR的分子標記區分胡蘿卜育性
付任勝+管長志+尹立榮+陳磊+段紅英+劉俊環

摘 ? ?要:利用已發表的區分胡蘿卜育性的標記引物對胡蘿卜線粒體DNA進行PCR擴增,開展育性鑒定研究。結果表明,所用的2對標記引物都能用于區分一種遺傳背景的材料組合,并可用于品種純度鑒定,而另一種材料組合不能區分。
關鍵詞:胡蘿卜;線粒體;PCR;分子標記;育性
中圖分類號:S631.2 ? ? ? ? ? ? ? ?文獻標識碼:A ? ? ? ? ? ? ? DOI 編碼:10.3969/j.issn.1006-6500.2015.12.002
Deferential Carrot Sterility and Fertility by PCR Molecular Marker
FU Ren-sheng1,GUAN Chang-zhi1,YIN Li-rong1,CHEN Lei1,DUAN Hong-ying2,LIU Jun-huan3
(1.Tianjin Research Center of Agricultural Biotechnology, Tianjin 300384, China; 2.Tianjin Xiqing Plant Protection Station,Tianjin 300381, China; 3.Tianjin Wuqing Plant Protection Station, Tianjin 301700, China)
Abstract: Cytoplasmic male sterility usability is important for carrot F1 hybrid development .Carrot mitochondrion DNA was isolated and PCR amplified by published primers. The results showed that two pairs of marker primers could be utilized to deferential one material combination and identify variety purity, not able to deferential another material combination.
Key words: Daucus carota;mitochondria;PCR;molecular marker;sterility and fertility
植物細胞質雄性不育(Cytoplasmic male sterility, CMS ) 是人類能夠高效利用植物生產的一類重要性狀,雄性不育性狀的鑒定通常是在植物開花時觀察鑒定[1-4],分子生物學的發展為細胞質雄性不育研究提供了新的有效手段,其優點在于在植物生長發育的任何階段,只需提取適當的DNA即可鑒定。胡蘿卜CMS的發現應用對人類培育胡蘿卜F1雜交品種具有決定性的作用,開展胡蘿卜CMS分子水平的研究具有重要意義,國內學者在分子水平上開展了胡蘿卜CMS相關工作,如于春霞、梁毅等對瓣化型胡蘿卜胞質雄性不育系和保持系進行了cDNA-AFLP分析,篩選與不育性相關的特異片段[5-6],但僅限于少量的試驗材料,未見報道加以應用。國外學者對胡蘿卜細胞質雄性不育分子水平開展了研究,結果認為細胞質雄性不育與線粒體有關[7-9],并獲得線粒體上與雄性不育有關的DNA標記,采用基于PCR的SSR標記區分胡蘿卜“瓣化型”雄性不育植株和可育植株[10],并在多個胡蘿卜不同根型的線粒體上進行區分驗證,能較好地區分。本研究選取已發表的標記引物,對課題組擁有的胡蘿卜材料進行育性鑒定研究,以期拓展現有標記應用范圍,為進一步篩選穩定、可靠的胡蘿卜CMS的標記奠定基礎。
1 材料和方法
1.1 材 料
胡蘿卜Sk4為瓣化型CMS,HY 為可育。Sk4×HYF1為Sk4與HY雜交種,瓣化型CMS,HYEH為瓣化型CMS。HYEH×HYF1為HYEH與HY雜交種,瓣化型CMS。
1.2 方 法
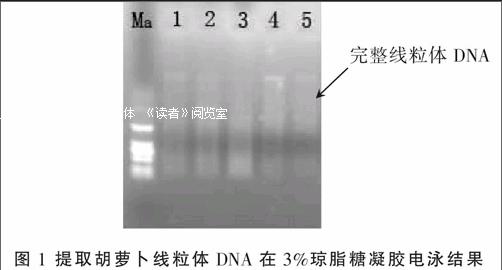
1.2.1 胡蘿卜線粒體DNA的提取 胡蘿卜種子分別播種于口徑30 cm,高度25 cm的塑料盆中,待胡蘿卜苗長至6~8片葉時,進行遮光處理1周,以減少淀粉因素的干擾,剪取黃化幼嫩葉片,采用從上海杰美基因醫藥科技有限公司購買的線粒體DNA提取試劑盒,鑒于胡蘿卜是多糖和多酚類型材料,提取過程中增加了二硫蘇糖醇(DDT)、十六烷基三乙基溴化銨(CTAB)。對最終提取獲得的胡蘿卜線粒體DNA提取物,在1%瓊脂糖凝膠上進行了電泳,予以驗證。電壓100 V,電泳時間30 min,將染色凝膠在成像系統下拍照。
根據已發表文獻確定2對引物,如表1。
1.2.2 PCR擴增 PCR 反應體系:反應總體積為20 μL,包括模板DNA 20~60 ng,Taq DNA 聚合酶0.5 U,dNTPs(each 0.1 mmol·L-1),1.5 mmol·L-1 MgCl2,引物0.4 μmol·L-1。將所有反應物混勻后,于PCR 儀上擴增(MJ PTC-200)。PCR反應條件:預變性95 ℃ 2 min,變性95 ℃ 1 min,引物退火55 ℃1 min,72 ℃引物延伸2 min 30 s;72 ℃延伸7 min。PCR 產物于1%瓊脂糖凝膠電泳檢測。取PCR 產物6 μL 與1 μL loading dye 混合后上樣,在電壓為80 V 條件下電泳25 min,電泳結束后,將染色凝膠置于成像系統中觀察并照相。
2 結果與分析
2.1 胡蘿卜線粒體DNA的提取
泳道Ma為堿基5 000 bpMarker,1為胡蘿卜Sk4×HYF1,2為Sk4,3為HYEH×HYF1,4為HY,5為HYEH。從圖1可以看出,泳道1、2、3、4、5都有一條明顯條帶,表明成功提取了線粒體DNA,泳道3條帶相對較淺,應是線粒體DNA濃度較低。
2.2 引物1擴增片段
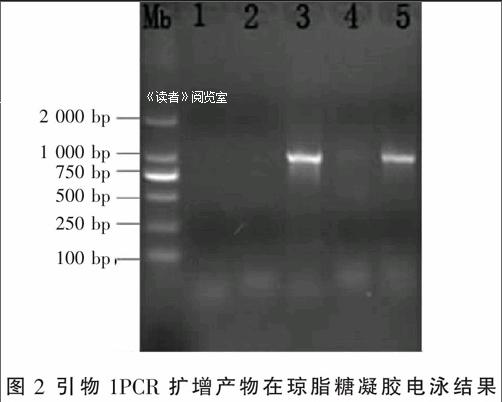
利用引物1對Sk4×HYF1,Sk4,HYEH×HYF1,HY,HYEH進行PCR擴增。從圖2可以看出,泳道3( HYEH×HYF1),5(HYEH)都出現了1條相同的擴增條帶,與Inga C.Bach等人研究結果比較,條帶的堿基大小應為1 100 bp,而其他泳道未出現擴增條帶。1(Sk4×HYF1)和2(Sk4)都為雄性不育系,也未擴增出條帶,試驗結果表明該引物不能對全部不育系都擴增出條帶。
2.3 引物2擴增片段
利用引物2對Sk4×HYF1,Sk4,HYEH×HYF1,HY,HYEH進行PCR擴增。從圖3可以看出,泳道1(Sk4×HYF1),3( HYEH×HYF1),5(HYEH)都出現了1條相同的擴增條帶,與Inga C.Bach等人研究結果比較,條帶堿基大小應為321 bp,而Sk4為雄性不育系,未擴增出條帶,本試驗表明該引物也不能對全部不育系都擴增出條帶。泳道4(HY)有1條擴增條帶,比泳道1(Sk4×HYF1),3( HYEH×HYF1),5(HYEH)的條帶略大,與Inga C.Bach等人研究結果比較,條帶堿基大小應為392 bp。
3 結論與討論
利用2對引物對Sk4×HYF1和Sk4擴增,都未能全部擴增出可以區分胡蘿卜材料雄性不育和可育的標記片斷。而Inga C.Bach等人研究結果為利用這2對引物都能區分試驗全部的雄性不育和可育材料,所用的材料屬于Imperator, Nantes, Imperator-Nantes, Danvers-Chantenay。而本試驗的Sk4為Imperator-Kuroda,存在這種差異可能源于不同核基因組背景導致的線粒體基因組的重排或缺失和線粒體基因組動態特性。這也表明期望1至2個標記區分所有不同遺傳背景的胡蘿卜雄性不育和可育材料是不可靠的。因而,開發更多的標記區分胡蘿雄性不育和可育就顯得非常必要。
HYEH和HY分別是商業種 HYEH×HYF1的雄性不育母本和雄性可育父本,在該試驗中,利用PCR擴增,根據條帶的堿基大小區分胡蘿卜雄性不育和可育,利用這一結果,2對引物都可用于商業種HYEH×HYF1生產制種的純度檢測,防止混雜有父本種子。
參考文獻:
[1] STRUCKMEYER E, SIMON P. Anatomy of fertile and male-sterile carrot flowers from different genetic sources[J]. Amer Soc Hart Sci,1986, 111:965-968.
[2] 尹立榮, 管長志, 顧自豪,等.胡蘿卜雄性不育系及主要經濟性狀的遺傳[J]. 華北農學報,2002,17(2):102-107.
[3] 陳源閩,王勇,張艷萍,王永,等.雄性不育胡蘿卜遺傳特性及主要經濟性狀遺傳規律的研究[J]. 華北農學報,2005,20(3):5-9.
[4] 梁艷榮,胡小紅,陳源閩,等.胡蘿卜雄性不育系生理生化特性研究[J].華北農學報,2006,21(3):19-22.
[5] 于春霞 ,梁毅,李景富.瓣化型胡蘿卜胞質雄性不育相關片段 的分離及序列分析[J].農業生物技術科學,2006 ,22 (1):16-20.
[6] 于春霞 ,梁毅,李龍年. 瓣化型胡蘿卜胞質雄性不育基因atp的CAPS標記建立[J].中國農學通報,2007,23(2):68-72.
[7] NAKAJIMA Y, YAMAMOTO T, MURANAKA T, et al. A novel orfB- related gene of carrot mitochondrial genomes that is associated with homeotic cytoplasmic male sterility (CMS) [J]. Plant Mol Biol,2001,46:99-107.
[8] NAKAJIMA Y, OEDAK, YAMAMOTO T. Characterization of genetic diversity of nuclear and mitochondrial genomes in Daucus varieties by RAPD and AFLP[J]. Plant Cell Rep,1998,17:848-853.
[9] NAKAJIMA Y, YAMAMOTO T, MURANAKA T, et al. Genetic variation of petaloid male-sterile cytoplasm of carrots revealed by sequence-tagged sites(STSs) [J].Theor Appl Genet,1999,99:837-843.
[10] BACH I C,OIESEN A,SIMON P W. PCR-based markers to differentiate the mitochondrial genomes of petaloid and male fertile carrot (Daucus carota L.) [J].Euphytica ,2002,127(3):353-365.

