利用函數關系作圖解讀中和滴定原理
吳文中徐俊龍申 燕
(1越州中學 浙江 紹興 312075;2深圳科學高中 廣東深圳 518129)
利用函數關系作圖解讀中和滴定原理
吳文中1徐俊龍2申燕2
(1越州中學浙江 紹興312075;2深圳科學高中廣東深圳518129)
中和滴定原理,高中學生理解起來是有一定困難的。文章介紹如何利用電解質溶液中的定量關系,建立中和滴定過程中溶液pH值與所滴加溶液體積(V)的函數關系,利用計算機對函數作圖,引導學生直觀、生動地理解體會中和滴定原理。
中和滴定;原理;函數關系;計算機輔助作圖
一、問題的起因
高中化學在闡述NaOH溶液滴定CH3COOH溶液原理時,教師往往采用計算滴入一定量的NaOH溶液時的pH值,然后作V(NaOH(aq))-pH圖得出的,但教師為什么偏偏去引導學生選擇計算少加一滴NaOH溶液或多加一滴NaOH溶液的pH值?其原因在于:教師已然知道最后的結論,教材也安排了這樣的計算引導,這樣的教學過程,“預設”非常嚴重,這并不有利培養(yǎng)學生嚴謹的思維品質,嚴格意義上說,屬于“灌輸型”教學,倘若要求學生單獨來完成這項“艱巨”任務的話,學生也許會計算出“很多很多”的pH值,然后“描點”作圖來說明中和滴定的科學性、可行性,許多教師也就是采用這種方法教學設計來幫助學生體會中和滴定原理[1],但這樣的教學方法實為先入為主,存“先入之見”之嫌疑。
酸堿恰好完全反應時,盡管恰好反應點可能呈酸性、中性或堿性,但由于在酸堿中和滴定過程中,當非常接近酸堿恰好完全反應點時,溶液的pH值變化量很大,依據這樣的情景,假如滴入酚酞或甲基橙等指示劑會在這個“節(jié)骨眼”上顏色發(fā)生突變,依據顏色變化確定“終點”,再加上酸堿中和是“幾乎”完全反應且誤差很小的事實來說明中和滴定的科學性、可行性和合法性[2]。
絕大多數教材也都是這樣來說明中和滴定原理,但這樣的方法是采用不完全歸納法的結果,只是被“后來”的許多實驗證實其準確性而已,對于剛接觸中和滴定的學生來說,很容易持懷疑態(tài)度,甚至覺得是不可信的,同時無法解釋為什么某些一元酸或二元酸無法采用中和滴定來測定其濃度的原因。
二、利用函數關系建立中和滴定的pH-V圖的可行性
利用數學方法建立函數作圖完全則可避免以上問題的出現,現闡述如下:
20 mL 0.1 mol·L-1的CH3COOH溶液,當加入x mL 0.1mol·L-1的NaOH溶液后,設其pH值為y,則存在如下關系:(注:滴入x mL 0.1mol·L-1的NaOH溶液后,混合溶液的體積為(20+x)mL,Kw、Ka分別為室溫下水的離子積常數和CH3COOH的電離常數)
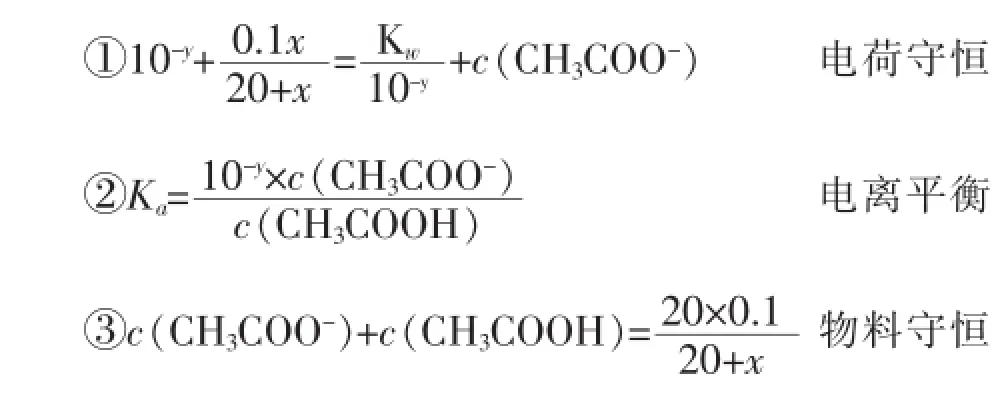
利用以上等量關系,消去 c(CH3COO-)和c(CH3COOH)兩個“未知數”,可得關于x、y的函數關系式如下:
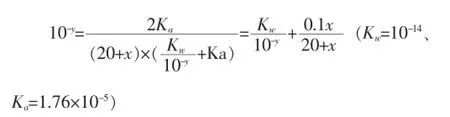
其中關于x、y的函數關系就是中和滴定原理的理論基礎。
利用Wolfram Mathematica 8數學軟件,可作如圖1的pH-V圖。
In:ContourPlot[{10-y+(0.1x)/(20+x)=10(-14+y)+(2× 1.76×10-5)/((20+x)(10-y+1.76×10-5))},{x,0,40},{y,0,14}]
Out:

圖1 NaOH溶液滴定CH3COOH溶液
顯然,用NaOH溶液滴定CH3COOH溶液的過程中,混合溶液的pH值有明顯的突變階段,只要我們能找到一種指示劑,在非常接近CH3COOH溶液和NaOH溶液完全反應點時,顏色發(fā)生顯著變化即可,從而說明中和滴定原理,說明中和滴定實驗的合法性和可行性。
三、建立函數關系作圖在滴定原理教學中的實踐
1.利用作圖法理解強堿滴定一元酸的前提條件
大學教材分析化學中明確指出[2],當某一元酸的酸性太弱的時候,一般不建議直接采用中和滴定方法,為什么不建議采用中和滴定方法的原因實難說清楚,但假如采用建立函數,計算機輔助作圖的方法,通過簡單的觀察其pH值的“突躍”情景,即可直觀地說明問題:對于電離常數很小的弱酸(如氫氰酸),為什么不能直接采用中和滴定方法確定其濃度的原因,具體如圖2(作圖方法原理同上)。
從圖2可以看出,氫氰酸若采用中和滴定的方法來測定其濃度,是不明智的,其原因就是氫氰酸和NaOH溶液恰好完全反應時,其pH無明顯“突躍”過程,會造成滴定誤差較大的后果。
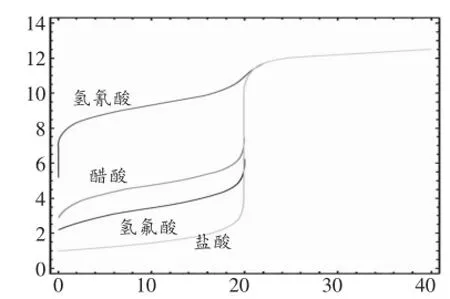
圖2 NaOH溶液滴定不同的一元酸
同時可以看出相同濃度的不同一元酸,滴入同濃度的NaOH溶液時,開始階段,pH值變化顯著的是電離常數更小的弱酸,在達到酸堿中和的理論終點時,電離常數越小的一元酸的pH值變化量越不明顯。
教材分析化學中指出[2],若某弱酸的濃度 c=0.1mol/L,當c×Ka≥10-8時,可以用強堿標準溶液直接滴定,若當c×Ka<10-8時,則不宜用堿溶液直接滴定,其原因就是此時化學計量點的突躍范圍很小 (pH值“突躍”不明顯,見圖2)。如HCN的Ka=6.2×10-10,無法直接滴定,而乙酸的Ka=1.76×10-5,則可用NaOH溶液直接滴定。
2.利用作圖法發(fā)現強堿滴定二元酸的局限性
那為什么實驗室又很少采用中和滴定的方法測定大多二元酸的濃度呢?
同樣方法,可以作一系列二元酸的中和滴定曲線,如圖5(假定標準液NaOH濃度和二元酸濃度為0.10mol·L-1)。
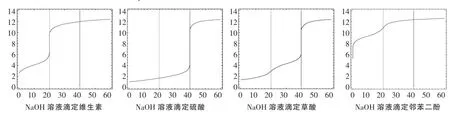
圖3 不同二元酸用NaOH溶液滴定的曲線
從圖3中發(fā)現,盡管H2SO4、維生素、草酸、鄰苯二酚等都是二元酸,出現明顯的pH值的“突躍”時,化學計量比是不一樣的,滴定硫酸溶液的化學計量比(n酸/n堿)為1∶2,維生素的化學計量比為1∶1,草酸的化學計量比是1∶2;而對鄰苯二酚而言,是不能使用中和滴定方法來測定其濃度。
假如不預先從理論上作NaOH溶液滴定二元酸的滴定曲線,幾乎不可能知道不同的二元酸的滴定計量比是不一樣的,也不可能知道某些二元弱酸是不能采用滴定的方法來測定其濃度的。
正因為存在以上的復雜情況,實驗室不建議采用中和滴定的方法來測定二元弱酸的濃度。
之所以出現以上的情景,主要原因在于:不同的二元弱酸的一、二級電離常數絕對大小的顯著差異和電離常數的相對大小的顯著差異。
3.雙指示劑中和滴定原理解讀
NaOH溶液中若混有Na2CO3,或Na2CO3溶液中混有NaHCO3,其雜質的含量也都可以采用中和滴定方法來測定,其原理就是“雙指示劑滴定法”[3],其原理理解起來非常困難,不管教師用多么生動的、形象地言語來描述其原理,都是徒勞的,但通過建立函數關系,計算機輔助作圖的方法,則可讓學生直觀理解其滴定原理,現把其思想方法解析如下:
若有待測液為NaOH和Na2CO3混合溶液,濃度分別為0.1 mol·L-1,則當加入0.1 mol·L-1的鹽酸體積為x L,所得溶液的pH=y,作相應函數圖如圖4:本案的函數關系的得出,依據還是電荷守恒、電離平衡、物料守恒,推演過程并不困難。
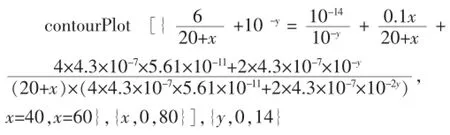

圖4 鹽酸滴定NaOH和Na2CO3混合溶液
觀察圖4發(fā)現,“雙指示劑滴定法”第一次指示劑使用酚酞比較合理,而第二次滴定使用甲基橙為好,很直觀地說明了“雙指示劑滴定法”合理性。
4.解讀以“弱”滴“強”的“不合法”性
教材分析化學中同時也指出[2],實驗室一般情況下,不會用弱酸或弱堿去滴定強堿或強酸,其主要原因和上述很弱的酸用氫氧化鈉溶液滴定“突躍”不明顯的道理一樣,當實驗者以弱酸或弱堿去滴定強堿或強酸時,很難看到滴定過程中pH值的“突躍”過程,從而嚴重影響滴定終點的判斷,造成很大的誤差。
本文采用同樣方法建立相應函數,利用Wolfram Mathematica 8數學軟件作如圖5的pH-V圖,這些曲線分別代表用0.10mol·L-1的NaOH溶液滴定0.10mol·L-1鹽酸和醋酸,以及0.10mol·L-1的氨水滴定0.10mol·L-1鹽酸和醋酸的四條曲線(注:用氨水滴定鹽酸和醋酸是不合法的,但這里是假定可以滴定做出的滴定曲線)。
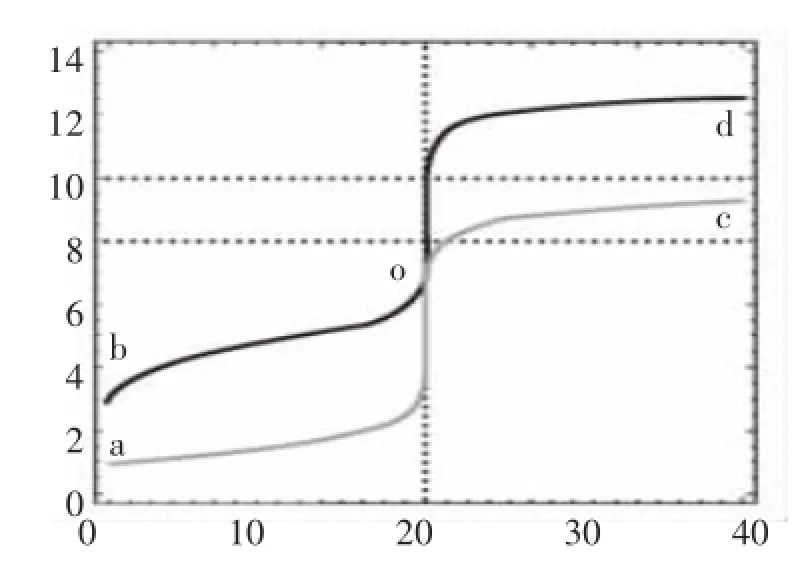
圖5 0.1mol·L-1的NaOH和氨水分別滴定同濃度的鹽酸和醋酸曲線
圖5看上去好像是2條曲線,實為4條曲線,原因是四條曲線有部分幾乎是重合的,看上去好像就象2條曲線,其中:
曲線aod為0.10mol·L-1的NaOH滴定同濃度的鹽酸——經典滴定,合法
曲線bod為0.10mol·L-1的NaOH滴定同濃度的的醋酸——pH“突躍”明顯,酚酞做指示劑,合法
曲線aoc為0.10mol·L-1的氨水滴定同濃度的鹽酸——pH“突躍”明顯,不能用酚酞做指示劑,不合法曲線 boc為 0.10mol·L-1的氨水滴定同濃度的醋酸——pH“突躍”不明顯,不合法
圖5非常“生動”地說明了以“弱”滴定“強”的不合理性,其中氨水滴定醋酸的情況一無明顯的pH“突躍”,也很難選擇判斷滴定終點的恰當指示劑。
用氨水滴定鹽酸,在沒有達到滴定終點時,溶質為鹽酸和氯化銨,其中氯化銨的水解在鹽酸的存在條件下,完全可以忽略不計,因此氯化銨的存在與否,基本不影響溶液的pH值,當鹽酸完全反應后,再滴入氨水,溶質則為氯化銨和氨水,是典型的緩沖溶液,溶液pH不會因為氨水的加入,pH變化很大,這就造成了氨水滴定鹽酸在完全反應時,溶液的pH幾乎沒有突躍的原因。
同理,用氨水滴定醋酸,即便是在達到滴定終點前,生成的醋酸銨和未反應的醋酸已形成了緩沖溶液,在完全反應前,溶液的pH變化緩慢,最后的結果就是pH變化平緩,“突躍”現象很不明顯。
5.直觀分析緩沖溶液的緩沖作用
CH3COONa和CH3COOH混合溶液 (假定濃度相同),具有緩沖作用,這是眾所周知的,大學教材一般采用化學平衡的理論或具體計算的方法,利用不完全歸納法得到該溶液對加入一定量酸或堿后pH值變化很小的事實[4](即緩沖作用)。但學生也只存“只緣身在此山中”之感覺,不能很好地去理解緩沖作用的基本原理,勉強接受教師“強加”的結論。若采用建立函數并作圖的方法,就可以直觀地體會理解緩沖溶液的緩沖作用,現以濃度分別為0.1 mol·L-1的CH3COONa和CH3COOH緩沖溶液為例,展示推演建立函數并作圖來說明問題的教學過程。
1 L0.1mol·L-1的CH3COOH和CH3COONa溶液,當滴加x L 0.1mol·L-1的NaOH溶液后,設其pH為y,則存在如下關系(混合后溶液的體積約為1+x L):
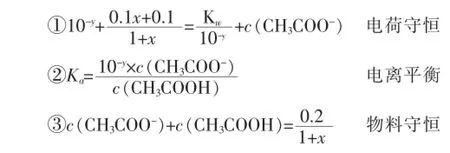
利用以上①②③等量關系,消去c(CH3COO-)和c(CH3COOH)兩個未知數,得關于x、y的函數關系式:
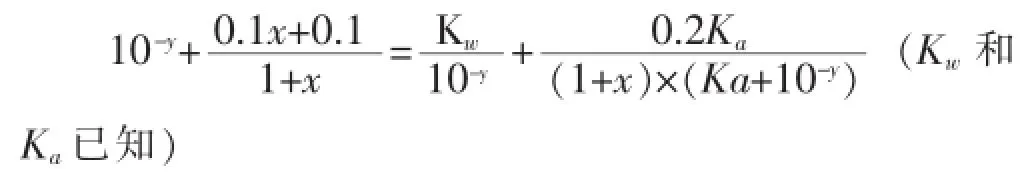
1 L 0.1molL-1的CH3COOH和CH3COONa溶液,當滴加x L 0.1molL-1的鹽酸后,設其pH值為y,則存在以下關系(混合后溶液的體積約為1+x L):
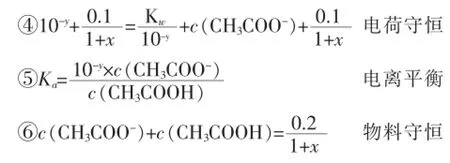
利用以上④⑤⑥等量關系,消去c(CH3COO-)和c(CH3COOH)兩個未知數,得關于x、y的函數關系式:
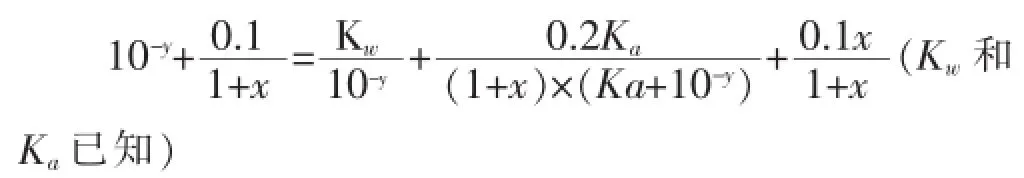
然后利用Wolfram Mathematica 8,同時在同一坐標系中作該緩沖溶液中滴加NaOH溶液或HCl溶液的pH值變化曲線圖,如圖6。
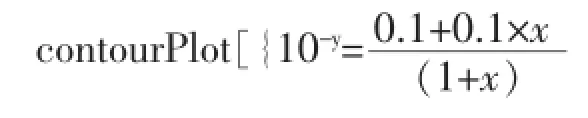
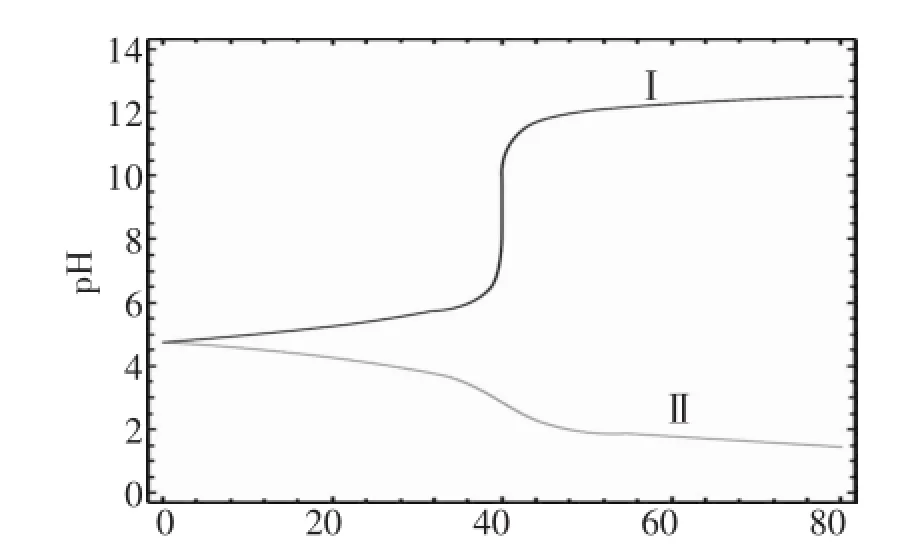
圖6 緩沖溶液中加NaOH或鹽酸的pH值變化曲線

圖6表明在CH3COOH和CH3COONa組成的緩沖溶液中加NaOH溶液或鹽酸后,從圖中可看出,緩沖溶液對酸堿的緩沖作用,且是有范圍的,當滴加的NaOH溶液或鹽酸過多時 (如超過1L的NaOH溶液時),緩沖溶液的pH值變化也是很大的。
注:曲線I描述的是在上述緩沖溶液中滴加NaOH溶液后的pH值變化曲線,曲線II描述的是在上述緩沖溶液中滴加鹽酸后的pH值變化曲線。
四、結束語
中和滴定原理的教學是中學階段的重點,也是難點,如何使用計算機輔助作圖,直觀感悟中和滴定原理,理解中和滴定的科學性,是值得研究和實踐的,建立滴定過程中的函數關系(隱函數),利用計算機計算軟件,快速作圖,讀圖并理解其原理,不但是可行的,而且也是真正“講理”的。
[1]鄒晨光.定性走向定量 理論付諸實踐:“酸堿中和滴定”教學設計[J].化學教與學,2011,(8)
[2]宋天佑,程鵬等.無機化學[M].北京:高等教育出版社,2009
[3]徐書紳主編.化學實驗分冊[M].長春:東北師范大學出版社,1987
[4]孫永華,張信鳳,王艷艷.緩沖溶液教學方法的探討[J].教育教學論壇,2012,(33)
1008-0546(2015)06-0065-04
G633.8
B
10.3969/j.issn.1008-0546.2015.06.026

