TBAB/KCl對構筑陰離子蠕蟲狀膠束的影響
韓一秀 周 洪 韋勇強 梅擁軍 王 航
(中國民航局第二研究所, 成都 610041)
TBAB/KCl對構筑陰離子蠕蟲狀膠束的影響
韓一秀 周 洪 韋勇強 梅擁軍*王 航
(中國民航局第二研究所, 成都 610041)
采用流變測試技術考察了兩種陰離子表面活性劑油酸鈉(NaOA)和芥酸鈉(NaOEr)在四丁基溴化銨(TBAB)和KCl誘導下構筑蠕蟲狀膠束的行為. 隨著KCl濃度增加, NaOA水溶液粘度增加, 而加入TBAB使NaOA-KCl樣品的粘度持續降低. 與之相反, TBAB濃度的增加卻使NaOEr-KCl樣品的粘度大幅度增強. 此外, NaOEr分子比NaOA表現出更強的形成膠束的能力, 構成粘彈性蠕蟲狀膠束所需表面活性劑濃度和鹽濃度更少. 本文采用TBAB和KCl兩種鹽協同誘導NaOEr, 制備了具有強粘彈性的陰離子蠕蟲狀膠束, 探討了鹽TBAB/KCl對長鏈陰離子表面活性劑構筑蠕蟲狀膠束的影響機理.
陰離子表面活性劑; 芥酸鈉; 四丁基溴化銨; 蠕蟲狀膠束; 流變性
1 引 言
兩親結構特點使表面活性劑分子在水溶液中有自發聚集的傾向, 在特定的電解質、溫度、剪切等條件下, 表面活性劑自組裝形成長的柔性蠕蟲狀膠束.1–4當表面活性劑達到臨界交疊濃度(C*)以上,蠕蟲狀膠束互相纏繞形成瞬時三維網絡狀結構, 宏觀上表現出類似聚合物溶液的流變性.5由于蠕蟲狀膠束具有自組裝結構, 它受到機械剪切后能快速恢復膠束結構和溶液流變性, 因而蠕蟲狀膠束也被稱作“living”聚合物.6這一獨特流變特性使蠕蟲狀膠束作為流變控制劑, 在流體減阻、三次采油、清潔壓裂液、日常洗護用品等領域存在潛在的應用價值.7,8
關于蠕蟲狀膠束的研究集中在由尾基鏈長為C16的陽離子表面活性劑構成的體系, 相比之下, 陰離子表面活性劑體系受到的關注較少.6,8–12據報道,陰離子表面活性劑比陽離子表面活性劑更易降解,應用在三次采油時, 由于地層巖石表面多帶負電,還能有效降低吸附損失.13,14根據堆積參數理論, 堆積參數P = V/al, V代表表面活性劑的疏水尾基的體積, a代表頭基的橫截面積, l代表疏水鏈長, 只有當1/3 ≤ P ≤ 1/2時才能形成蠕蟲狀膠束.15可見表面活性劑的分子結構是影響膠束形態的重要因素. 由于離子表面活性劑親水頭基間存在強烈的靜電排斥作用不利于形成蠕蟲狀膠束, 往往通過加入帶相反電荷的無機或有機反離子來屏蔽靜電排斥作用, 才能有效促進膠束形成和增長.16
目前報道的陰離子蠕蟲狀膠束多數是由無機鹽誘導疏水基碳鏈長度不大于C18的陰離子表面活性劑構成, 比如, 油酸鉀-KCl,17十二烷基三乙氧基硫酸鈉-NaCl,18油酸鈉(NaOA)-KCl,13NaOA-NaBr,19十六烷基硫酸鈉-Bola鹽20等體系. 除了無機鹽之外,季銨鹽是陰離子表面活性劑膠束體系里最常見的有機鹽添加劑.21,22不對稱型季銨鹽——芐基三甲基溴化銨利用超強疏水性分別誘導NaOA和芥酸鈉(NaOEr)形成蠕蟲狀膠束.19,23Nakamura和Shikata24考察了不同大小的季銨根離子與不同鏈長的烷基硫酸鈉的相互作用, 發現季銨根離子大小與表面活性劑鏈長存在一定匹配性, 表面活性劑的鏈長越長形成粘彈性蠕蟲狀膠束所需要的季銨根離子越大.24以上報道限于非對稱型季銨根離子, 即四個支鏈不完全相同, 由于有一個較長的支鏈存在, 在促進膠束增長時疏水締合作用占主導. 對稱型季銨鹽(TAA+)存在時, 硫酸根型陰離子表面活性劑往往有濁點出現.21,25不僅如此, 油酸鈉和十二烷基硫酸鈉只能形成球型膠束, TAA+的位阻效應阻礙膠束在一維線型方向增長.13,26對稱型季銨根離子能否克服位阻效應誘導陰離子表面活性劑形成蠕蟲狀膠束尚無定論. 超長鏈(C22)表面活性劑由于在制備蠕蟲狀膠束時表現出有利趨勢, 而使此類表面活性劑成為新研究熱點.23,27
本文考察了兩種陰離子表面活性劑NaOA和NaOEr在水溶液中的膠束聚集和增長行為, 研究了正四丁基溴化銨(TBAB)和KCl的濃度變化對膠束形態變化及溶液流變行為的影響, 探討了對稱性季銨鹽TBAB與表面活性劑的相互作用機理及促進膠束增長的驅動力.
2 實驗部分
2.1 試 劑
NaOA(99%)購于國藥集團, NaOH (99%)、TBAB(97%)和KCl(98%)購于成都科龍化工, 芥酸鈉參照文獻在實驗室自制,23所用芥酸(95%)購買于西普化工. 所有試劑使用前未經過進一步純化, 超純水由Millipore Milli-Q制備. 為了控制表面活性劑水解, 樣品均用pH為10左右的純水溶液配制.28本實驗所用表面活性劑和有機反離子結構如圖1所示.
2.2 分析測試方法
流變測試采用TA流變儀(AR2000ex)進行, 采用椎板(半徑40 mm, 錐角1°)傳感器測量, 使用儀器自帶樣品蓋以減小樣品中水分揮發. 每個樣品在測試前均放置在測試溫度下穩定24 h. 穩態流變測試采用應力控制模式, 剪切速率在10–3–103s–1. 頻率實驗采用振蕩模式(OSC), 首先在固定頻率1 Hz下進行應力譜測試, 確定體系的線性粘彈區后選擇確定的應力值, 在線性粘彈區展開動態流變測試, 頻率范圍在0.01–100 rads–1. 如無特殊說明所有流變測試均在50 °C下進行.
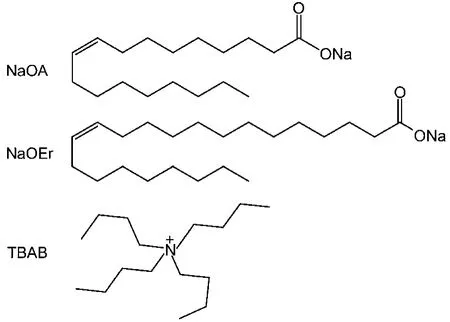
圖1 NaOA, NaOEr和TBAB的分子結構式Fig.1 Molecular structures of NaOA, NaOEr, and TBAB
3 結果與討論
3.1 鹽濃度對NaOA溶液流變性的影響
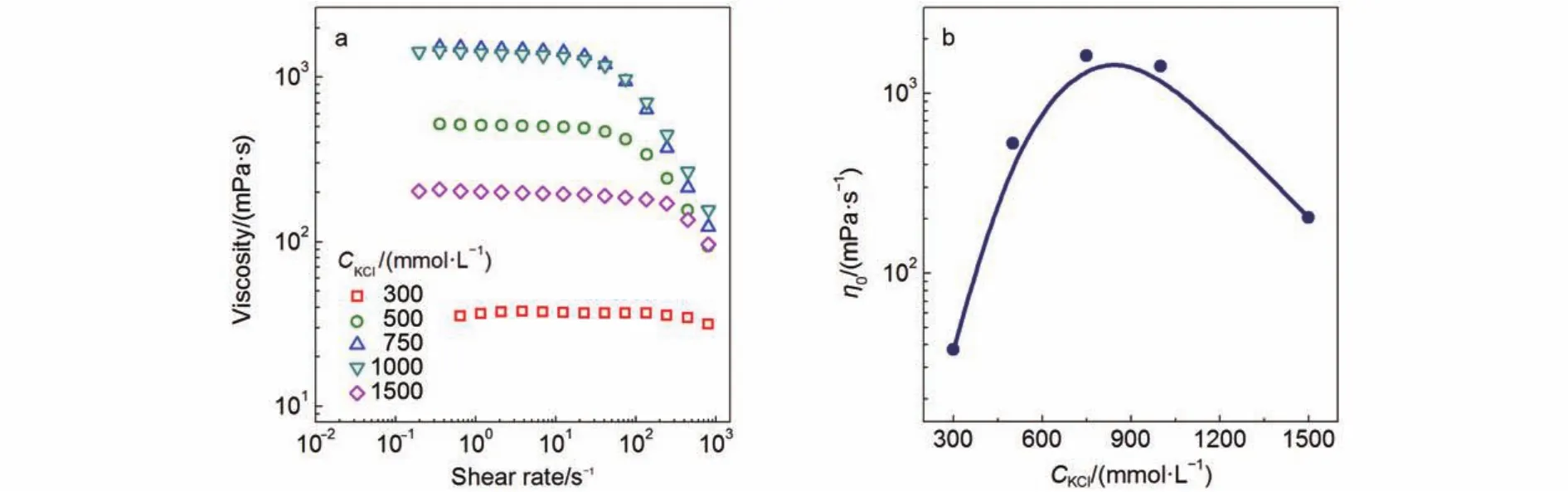
圖2 KCl濃度變化對250 mmolL–1NaOA溶液穩態流變(a)及零剪切粘度η0(b)的影響Fig.2 Effect of KCl concentration on steady rheology (a) and zero-shear viscosity η0(b) of 250 mmolL–1NaOA solution
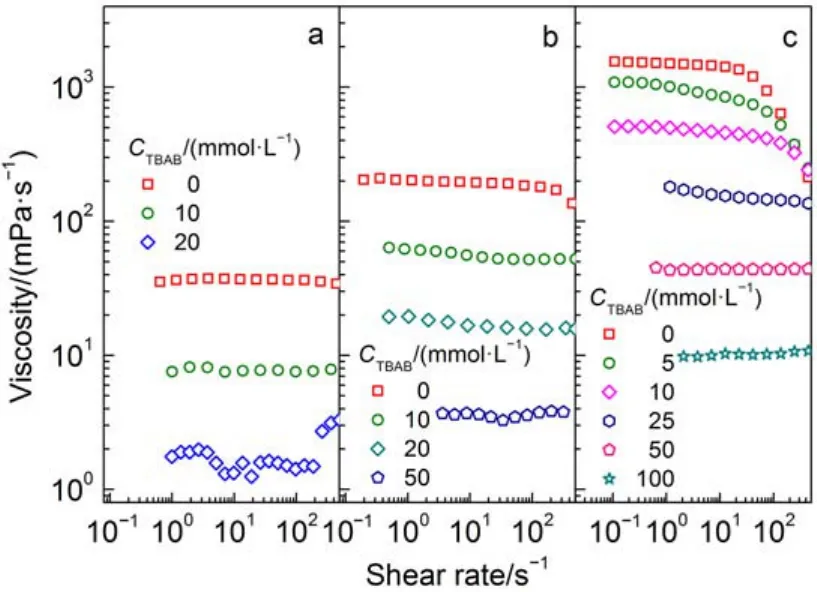
圖3 TBAB濃度變化對樣品穩態流變的影響Fig.3 Effect of TBAB concentration on steady rheology of samples
由圖3的穩態流變曲線所得的η0匯總于圖4. 三個KCl濃度的NaOA膠束溶液, 其η0均隨TBAB濃度增加而降低. KCl濃度為750 mmolL–1時樣品的初始粘度最大, 這條曲線下降相對平緩, TBAB濃度從0 mmolL–1增加到100 mmolL–1, 樣品的η0降低兩個數量級. TBA+通過三種作用影響膠束增長: 靜電屏蔽、空間位阻和疏水締合. TBA+的正電荷被四個支鏈相對分散后對表面活性劑頭基的靜電屏蔽作用被削弱, 樣品“250 mmolL–1NaOA + 750 mmolL–1KCl”中鹽濃度過量, 靜電屏蔽比較充分, TBA+的靜電屏蔽貢獻更加不明顯. 由粘度逐漸減小的結果表明, TBA+的位阻效應起主要作用, 位阻效應影響了表面活性劑聚集.
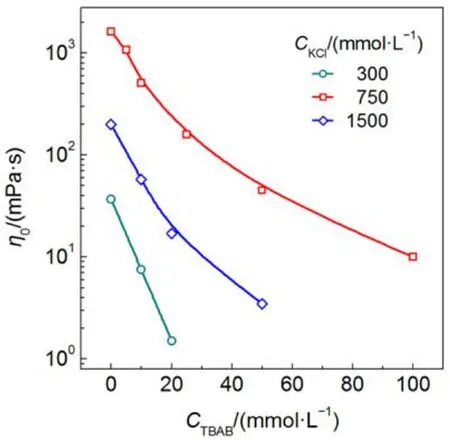
圖4 TBAB濃度變化對不同KCl含量下250 mmolL–1NaOA膠束溶液η0的影響Fig.4 Effect of TBAB concentration on η0of 250 mmolL–1NaOA solution at different KCl contents
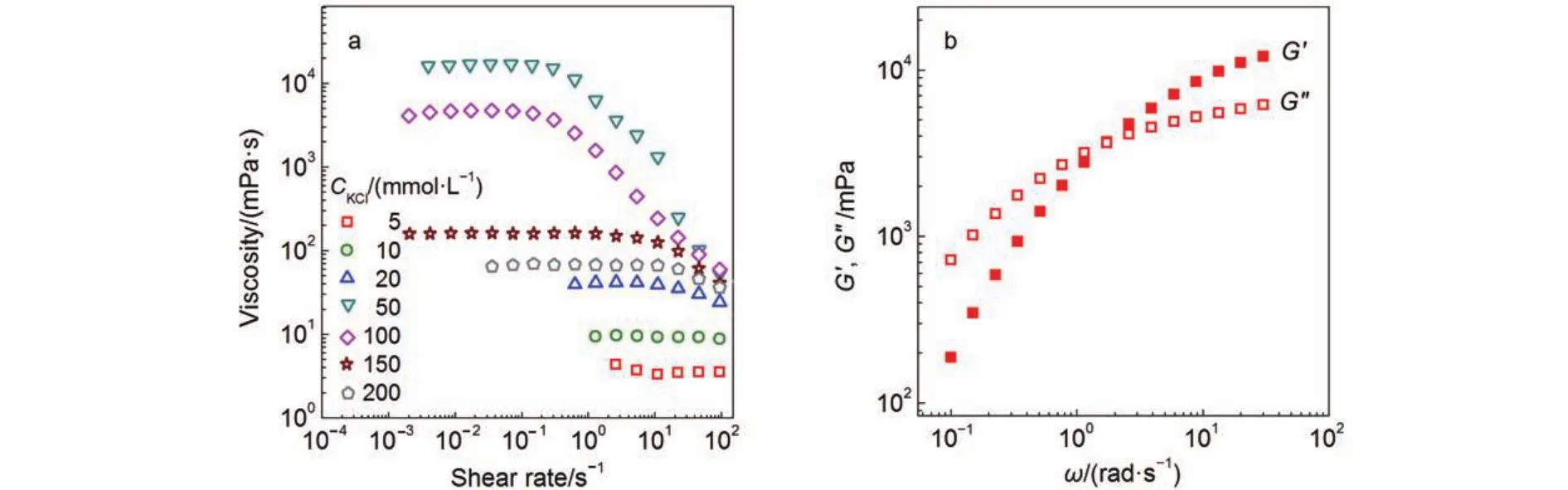
圖5 KCl濃度變化對“50 mmolL–1NaOEr + 14 mmolL–1TBAB”溶液穩態流變的影響(a), 以及樣品“50 mmolL–1NaOEr + 14 mmolL–1TBAB + 50 mmolL–1KCl”的動態流變(b)Fig.5 Effect of KCl concentration on the steady rheology of “50 mmolL–1NaOEr+14 mmolL–1TBAB” solution (a), and dynamic rheology of sample “50 mmolL–1NaOEr + 14 mmolL–1TBAB+50 mmolL–1KCl” (b)
三個樣品體系的η0下降幅度略有不同, 隨著NaOA-KCl樣品初始粘度的降低, 下降曲線變得更加陡峭. KCl濃度為300 mmolL–1時樣品的初始粘度最低, TBAB濃度僅增加20 mmolL–1時樣品的η0就降低1.5個數量級. 可見TBAB濃度增加對初始粘度低的樣品或者膠束長度短的樣品的破壞作用更明顯, 換言之, 粘度偏高的膠束體系更能承受TBAB帶來的不利影響. 由圖3的穩態流變數據可知, 該樣品以分散的短棒狀膠束或者球型膠束為主, 加入TBA+后, 位阻效應得到充分發揮, 表面活性劑分子更加分散, 長的棒狀膠束迅速瓦解成球型膠束, 粘度消失. 樣品“250 mmolL–1NaOA + 750 mmolL–1KCl”的穩態流變表明溶液中形成了纏繞的網絡狀結構, 膠束分布較為密集, 表面活性劑聚集程度提高, TBA+的位阻效應得到部分抑制. 此外, 位阻效應產生的影響為, 蠕蟲狀膠束先變在長度上有所減少,由長的柔性蠕蟲狀膠束變成短棒狀膠束, 最后變成球型膠束. 因此其粘度轉變也是一個循序漸進的過程.
3.2 鹽濃度變化對NaOEr溶液流變性的影響
由于NaOEr具有超長疏水鏈, 水溶性較差, 在50°C不溶, 不能形成穩定均相的KCl-NaOEr膠束溶液.可采用季銨鹽來提高陰離子表面活性劑的溶解性,32加入少量TBAB便能有效改善NaOEr的溶解性, 加入14 mmolL–1TBAB時50 mmolL–1NaOEr樣品在50 °C下呈均相澄清狀態. 以“14 mmolL–1TBAB + 50 mmolL–1NaOEr”為對照樣, 考察加入KCl對樣品穩態流變的影響, 結果如圖5a所示. 未加入KCl時“14 mmolL–1TBAB + 50 mmolL–1NaOEr”樣品的粘度與水的粘度接近, 可見TBAB僅起到促進NaOEr溶解的作用, 不會對膠束形態有明顯影響. 隨著KCl的加入樣品的穩態流變持續升高, 濃度為50 mmolL–1時穩態流變達到最大, 平臺處粘度值達到104mPas. 解決了溶解問題后, NaOEr體系與NaOA體系一樣, 在KCl的靜電屏蔽作用誘導下形成了蠕蟲狀膠束. 然而, 在相同的溫度下NaOA體系最大粘度出現在250 mmolL–1NaOA處, 僅為103mPas, 所需KCl濃度為750 mmolL–1. 顯然,NaOEr體系需要的表面活性劑和鹽濃度都遠遠偏低于NaOA體系, 表現出形成膠束的高效率, 這表明表面活性劑鏈長增加是促進分子締合和膠束增長的主要因素.
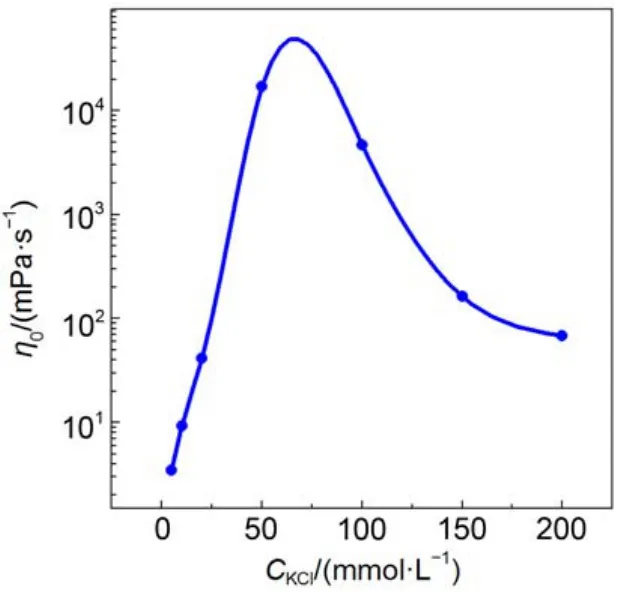
圖6 KCl濃度變化對“50 mmolL–1NaOEr + 14 mmolL–1TBAB”體系η0的影響Fig.6 Effect of KCl concentration on η0of “50 mmolL–1NaOEr + 14 mmolL–1TBAB” solution
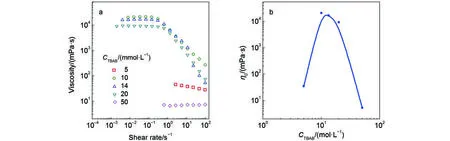
圖7 TBAB濃度變化對“50 mmolL–1NaOEr + 50 mmolL–1KCl”溶液穩態流變的影響Fig.7 Effect of TBAB concentration on the steady rheology of the “50 mmolL–1NaOEr + 50 mmolL–1KCl” solution
以上研究表明, 兩種鹽濃度變化時η0隨鹽濃度(CS)變化趨勢是一致的, 鹽濃度增加都能促進體系粘度增加, 引起“鹽濃度效應”. 此外, 不管是KCl還是TBAB, 兩種混合體系達到最大粘度所需的總鹽濃度接近, 比值CS/CD均略大約1, 所達到的粘度最大值非常接近. 因此, 在相同的表面活性劑濃度下, 給予充分的電解質誘導, 膠束所能達到的纏繞結構應該是類似的.
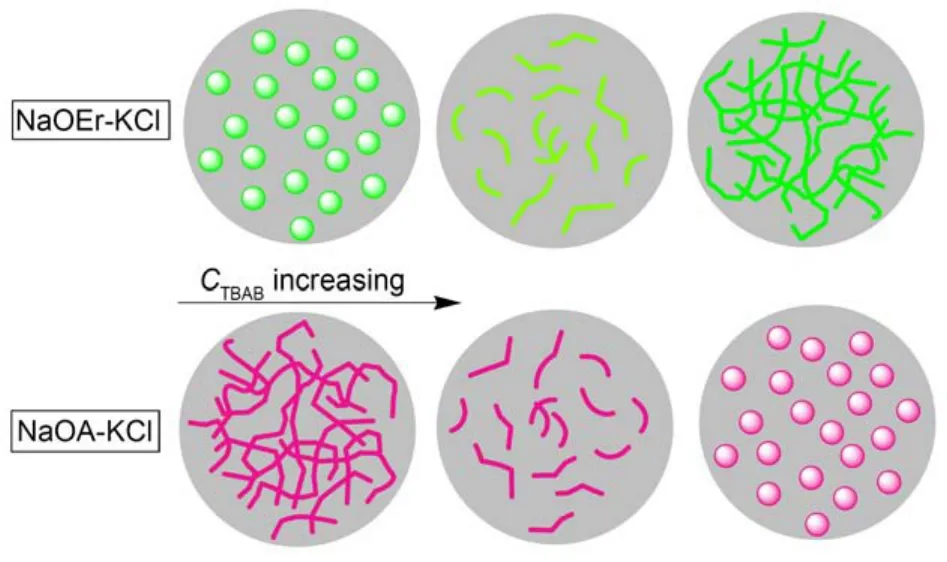
圖8 加入TBAB分別對NaOA-KCl和NaOEr-KCl膠束形態的影響示意圖Fig.8 Influence of adding TBAB on the morphology of micelles constructed by NaOA-KCl and NaOEr-KCl
TBAB的加入引起NaOA-KCl體系的粘度急劇下降, 卻使NaOEr-KCl溶液的粘度大幅度增加. 粘度變化規律的不同反應出膠束形態的差異, TBAB對兩種體系膠束形態的影響示意圖如圖8所示. TBA+的四個疏水支鏈由于空間位阻作用只能有一個或者兩個插入膠束內部, 其余的支鏈留在膠束表面, TBA+帶來的隔離位阻影響NaOA分子之間的疏水締合作用, 從而不利于膠束增長. 從堆積參數角度解釋, 引入TBA+相當于增加了表面活性劑頭基橫截面積, 從而不利于蠕蟲狀膠束形成. 與NaOA相比, NaOEr分子間的疏水締合作用增強, 表面活性劑分子的緊密排列使TBA+的空間位阻影響被削弱, 反而使TBA+疏水締合作用得以發揮. 表面活性劑鏈長是導致兩個體系流變性差異的關鍵因素, NaOEr的鏈長增加引起疏水締合作用增強, 宏觀上引起兩種溶液流變性能的巨大差異.
4 結 論
TBAB/KCl對NaOEr和NaOA構筑蠕蟲狀膠束產生不同的影響. 由于位阻效應, TBAB不能誘導NaOA形成蠕蟲狀膠束, 還會破壞NaOA-KCl體系形成的蠕蟲狀膠束. 由于NaOEr具有超強疏水締合作用, 不僅減弱了TBAB位阻效應的影響, 還使TBAB的疏水締合作用得到充分發揮, 利用其疏水作用與KCl協同誘導NaOEr構筑了具有強粘彈性的蠕蟲狀膠束. 結果證實, 具有位阻效應的對稱型季銨鹽TBAB同樣能誘導陰離子表面活性劑形成蠕蟲狀膠束, 這種季銨鹽可以與超長鏈陰離子表面活性劑協同作用.
(1)Khatory, A.; Kern, F.; Lequeux, F.; Appel1, J.; Porte, J. G.; Morie, N.; Ott, A.; Urbach, W. Langmuir 1993, 9, 933. doi: 10.1021/la00028a010
(2)Bharti, B.; Xue, M.; Meissner, J.; Cristiglio, V.; Findenegg, G. H. J. Am. Chem. Soc. 2012, 134, 14756. doi: 10.1021/ja307534y
(3)Morita, C.; Imura, Y.; Ogawa, T.; Kurata, H.; Kawai, T. Langmuir 2013, 29, 5450. doi: 10.1021/la400604m
(4)Pei, X. M.; Zhao, J. X.; Wei, X. L. Acta Phys. -Chim. Sin. 2011, 27, 913. [裴曉梅, 趙劍曦, 魏西蓮. 物理化學學報, 2011, 27, 913.] doi: 10.3866/PKU.WHXB20110420
(5)Dreiss, C. A. Soft Matter 2007, 3, 956. doi: 10.1039/b705775j
(6)Cates, M. E.; Candau, S. J. J. Phys.: Condens. Matter 1990, 2, 6869. doi: 10.1088/0953-8984/2/33/001
(7)Mohsenipour, A. A.; Pal, R. Ind. Eng. Chem. Res. 2013, 52, 1291. doi: 10.1021/ie3024214
(8)Yang, J. Curr. Opin. Colloid Interface Sci. 2002, 7, 276. doi: 10.1016/S1359-0294(02)00071-7
(9)Wilmsmeyer, K. G.; Zhang, X.; Madsen, L. A. Soft Matter 2012, 8, 57. doi: 10.1039/C1SM06634J
(10)Oelschlaeger, C.; Suwita, P.; Willenbacher, N. Langmuir 2010, 26, 7045. doi: 10.1021/la9043705
(11)Yusof, N. S. M.; Khan, M. N. J. Phys. Chem. B 2012, 116, 2065. doi: 10.1021/jp210467p
(12)Yusof, N. S. M.; Khan, M. N.; Ashokkumar, M. J. Phys. Chem. C 2012, 116, 15019. doi: 10.1021/jp304854h
(13)Kalur, G. C.; Raghavan, S. R. J. Phys. Chem. B 2005, 109, 8599. doi: 10.1021/jp044102d
(14)Maitland, G. C. Curr. Opin. Colloid Interface Sci. 2000, 5, 301. doi: 10.1016/S1359-0294(00)00069-8
(15)Israelachvili, J. N.; Mitchell, D. J.; Ninham, B. W. J. Chem. Soc. Faraday Trans. 2 1976, 72, 1525. doi: 10.1039/f29767201525
(16)Couillet, I.; Hughes, T.; Maitland, G.; Candau, F.; Candau, S. J. Langmuir 2004, 20, 9541. doi: 10.1021/la049046m
(17)Molchanov, V. S.; Shashkina, Y. A.; Philippova, O. E.; Khokhlov, A. R. Colloid J. 2005, 67, 606. doi: 10.1007/s10595-005-0139-8
(18)Parker, A.; Fieber, W. Soft Matter 2013, 9, 1203. doi: 10.1039/C2SM27078A
(19)Han, Y.; Wei, Y.; Wang, H.; Mei, Y.; Zhou, H. J. Surfact Deterg. 2013, 16, 139. doi: 10.1007/s11743-012-1364-x
(20)Zhao, J. X.; Yang, D. P. Acta Phys. -Chim. Sin. 2012, 28, 1218. [趙劍曦, 楊鐸平. 物理化學學報, 2012, 28, 1218.] doi: 10.3866/PKU.WHXB201202211
(21)Kumar, S.; Bhadoria, A. J. Chem. Eng. Data 2012, 57, 521.doi: 10.1021/je200909j
(22)Bales, B. L.; Tiguida, K.; Zana, R. J. Phys. Chem. B 2004, 108, 14948. doi: 10.1021/jp040289x
(23)Han, Y.; Feng, Y.; Sun, H.; Li, Z.; Han, Y.; Wang, H. J. Phys. Chem. B 2011, 115, 6893. doi: 10.1021/jp2004634
(24)Nakamura, K.; Shikata, T. Langmuir 2006, 22, 9853. doi: 10.1021/la061031w
(25)Zana, R.; Benrraou, M.; Bales, B. L. J. Phys. Chem. B 2004, 108, 18195. doi: 10.1021/jp040507m
(26)Benrraou, M.; Bales, B. L.; Zana, R. J. Phys. Chem. B 2003, 107, 13432. doi: 10.1021/jp021714u
(27)Han, Y.; Chu, Z.; Sun, H.; Li, Z.; Feng, Y. RSC Adv. 2012, 2, 3396. doi: 10.1039/c2ra20136d
(28)de Mul, M. N. G.; Davis, H. T.; Evans, D. F.; Bhave, A. V.; Wagner, J. R. Langmuir 2000, 16, 8276. doi: 10.1021/la000467n
(29)Zhang, Y.; Han, Y.; Chu, Z.; He, S.; Zhang, J.; Feng, Y. J. Colloid Interface Sci. 2013, 394, 319. doi: 10.1016/j. jcis.2012.11.032
(30)Berret, J. F.; Appell, J.; Porte, G. Langmuir 1993, 9, 2851. doi: 10.1021/la00035a021
(31)Candau, S. J.; Hirsch, E.; Zana, R.; Delsanti, M. Langmuir 1989, 5, 1225. doi: 10.1021/la00089a018
(32)Lin, B.; McCormick, A. V.; Davis, H. T.; Strey, R. J. Colloid Interface Sci. 2005, 291, 543. doi: 10.1016/j.jcis.2005.05.036
(33)Chu, Z.; Feng, Y. Chem. Commun. 2010, 46, 9028. doi: 10.1039/c0cc02415e
(34)Kalur, G. C.; Frounfelker, B. D.; Cipriano, B. H.; Norman, A. I.; Raghavan, S. R. Langmuir 2005, 21, 10998. doi: 10.1021/la052069w
(35)Mackintosh, F. C.; Safran, S. A.; Pincus, P. A. Europhys. Lett. 1990, 12, 697. doi: 10.1209/0295-5075/12/8/005
(36)Kusano, T.; Iwase, H.; Yoshimura, T.; Shibayama, M. Langmuir 2012, 28, 16798. doi: 10.1021/la304275h
Effect of TBAB/KCl on Constructing Anionic Wormlike Micelles
HAN Yi-Xiu ZHOU Hong WEI Yong-Qiang MEI Yong-Jun*WANG Hang
(The Second Research Institute of Civil Aviation Administration of China, Chengdu 610041, P. R. China)
Using rheological measurements, we investigated the wormlike micelles formed by anionic surfactants, sodium oleate (NaOA), and sodium erucate (NaOEr) in the presence of KCl and tetrabutyl ammonium bromide (TBAB). The viscosity of the NaOA solution increased with KCl concentration, but adding TBAB decreased viscosity. In contrast, the apparent viscosity of NaOEr-KCl solution enhances with increasing TBAB concentration. In addition, NaOEr is better than NaOA at encouraging the construction of viscoelastic wormlike micelles, needing less surfactant and a lower salt concentration. We prepared a wormlike micelle system with strong viscoelasticity by using NaOEr, cooperatively induced by KCl and TBAB. Based on these studies, we discussed the complex influence of TBA+on constructing wormlike micelles.
Anionic surfactant; Sodium erucate; Tetrabutyl ammonium bromide; Wormlike micelles; Rheology
O648
10.3866/PKU.WHXB201509112
Received: June 17, 2015; Revised: September 11, 2015; Published on Web: September 11, 2015.
*Corresponding author. Email: yongjun.mei@outlook.com; Tel: +86-28-82909883.
The project was supported by the National Natural Science Foundation of China and Civil Aviation Administration of China (U1233122).
國家自然科學基金-民航聯合研究基金(U1233122)資助項目
?Editorial office of Acta Physico-Chimica Sinica

