非小細胞肺癌患者血漿EGFR突變表達檢測及其臨床意義
朱美琴,夏俊賢,徐 敏,陳亦欣,申維璽
(暨南大學第二臨床醫學院、深圳市人民醫院腫瘤內科,廣東 深圳518020)
肺癌是當今世界最常見的惡性腫瘤,其中非小細胞肺癌占肺癌總病例數的75% ~85%,由于其缺乏明顯的早期臨床癥狀,確診時患者往往已經處于進展期,總手術切除率低,且對放療、化療不敏感,生存時間短、死亡率高[1]。表皮生長因子受體(epidermal growth factor receptor,EGFR)靶向治療的出現為非小細胞肺癌患者帶來了一線希望,以吉非替尼、厄洛替尼為代表的EGFR 酪氨酸激酶抑制劑對部分非小細胞肺癌患者有著快速、顯著的療效[2]。但部分復發轉移患者無法獲得病理組織進行檢測。我們用熒光定量PCR 法檢測了2012年10月至2014年6月在深圳市人民醫院住院的90 例非小細胞肺癌患者腫瘤組織和血漿EGFR 表達,并分析兩者的一致性,同時觀察了血漿EGFR 水平對非小細胞肺癌患者預后的預測價值。
1 資料與方法
1.1 研究對象 收集2012年10月至2014年6月在深圳市人民醫院腫瘤內科住院經組織病理確診的初治晚期非小細胞肺癌患者90 例,其中男58 例,女32 例;年齡44 ~79 歲,中位年齡50 歲。其中用于EGFR 基因突變檢測的標本包括:肺癌手術切除標本(肺癌組織、轉移淋巴結、轉移組織)25 例、組織學小活檢標本(肺穿刺活檢、氣管鏡活檢等)65 例。同時取得該90例患者的外周血標本。
1.2 檢測方法
1.2.1 DNA 的提取 使用德國QIAGEN 公司的DNA提取試劑盒,嚴格按照試劑盒說明書要求來提取人類基因組DNA。
腫瘤組織基因組DNA 的提取:將新鮮的腫瘤組織在液氮中研磨成粉,稱取50 mg 置于115 mL 離心管中提取基因組DNA,-20 ℃保存備用。
外周血游離DNA 的提取:抽取10 mL 靜脈血,靜置于EDTA 抗凝管6 h,析出血漿,吸取上層血漿,以12 000 r·min-1離心10 min,連續3 次,吸取上清液200 μL,提取血漿游離DNA,-20 ℃保存備用。
1.2.2 EGFR 突變檢測 采用人類EGFR 基因突變熒光PCR 檢測試劑盒(廈門艾德生物醫藥有限公司)檢測EGFR 的突變,嚴格按照試劑盒說明進行操作。
1.2.3 質量控制 控制PCR 和測序反應假陽性的質量控制體系:1)DNA 提取過程中增加無樣品空白對照;2)PCR 擴增過程中分別增加一個陽性質控品和一個陰性對照(自制純化水)。
1.3 結果判定 人類EGFR 基因突變熒光PCR 檢測試劑盒反應結束后,確定樣品各個反應管的突變Ct值,并確定該樣品的外控Ct 值。Ct 值=突變Ct 值-外控Ct 值。Ct 值低于26 為陽性,高于26 為陰性。
1.4 隨訪和療效評價 隨訪內容:患者年齡、性別、吸煙史、腫瘤分期、治療方案、轉移器官數目、內臟侵犯情況、無疾病進展時間、生存時間等。所有患者治療前后均行CT 或超聲檢查,然后按照WHO(1981年)制定的實體瘤客觀療效評定標準進行療效評價。
1.5 統計學處理 采用SPSS 17.0 進行統計學分析,率的比較采用χ2檢驗,生存分析采用Kaplan-Meier 法,比較采用log rank 檢驗,檢驗水準α=0.05。
2 結果
2.1 血漿與腫瘤組織EGFR 突變表達的一致性 90例非小細胞肺癌患者的腫瘤組織中共檢測到29 例EGFR 突變,其中25 例患者血漿EGFR 可檢測到突變。分析血漿與腫瘤組織中EGFR 突變表達的關系發現,非小細胞肺癌患者的血漿與腫瘤組織中EGFR 突變是一致的。見表1。
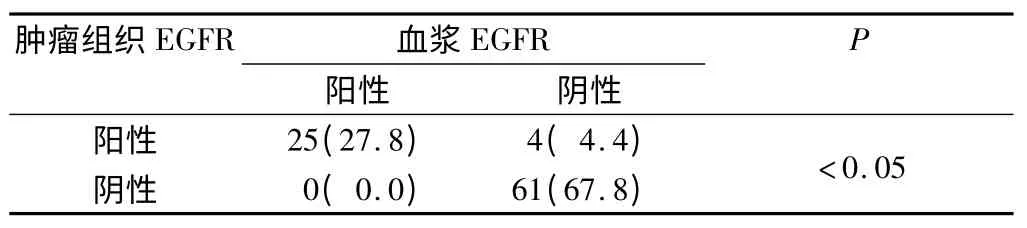
表1 非小細胞肺癌患者血漿與腫瘤組織EGFR 突變表達的關系 n(%)
2.2 血漿EGFR 突變表達與非小細胞肺癌臨床病理特征的關系 血漿EGFR 突變表達與非小細胞肺癌的病理類型、腫瘤大小、淋巴結轉移有關。見表2。
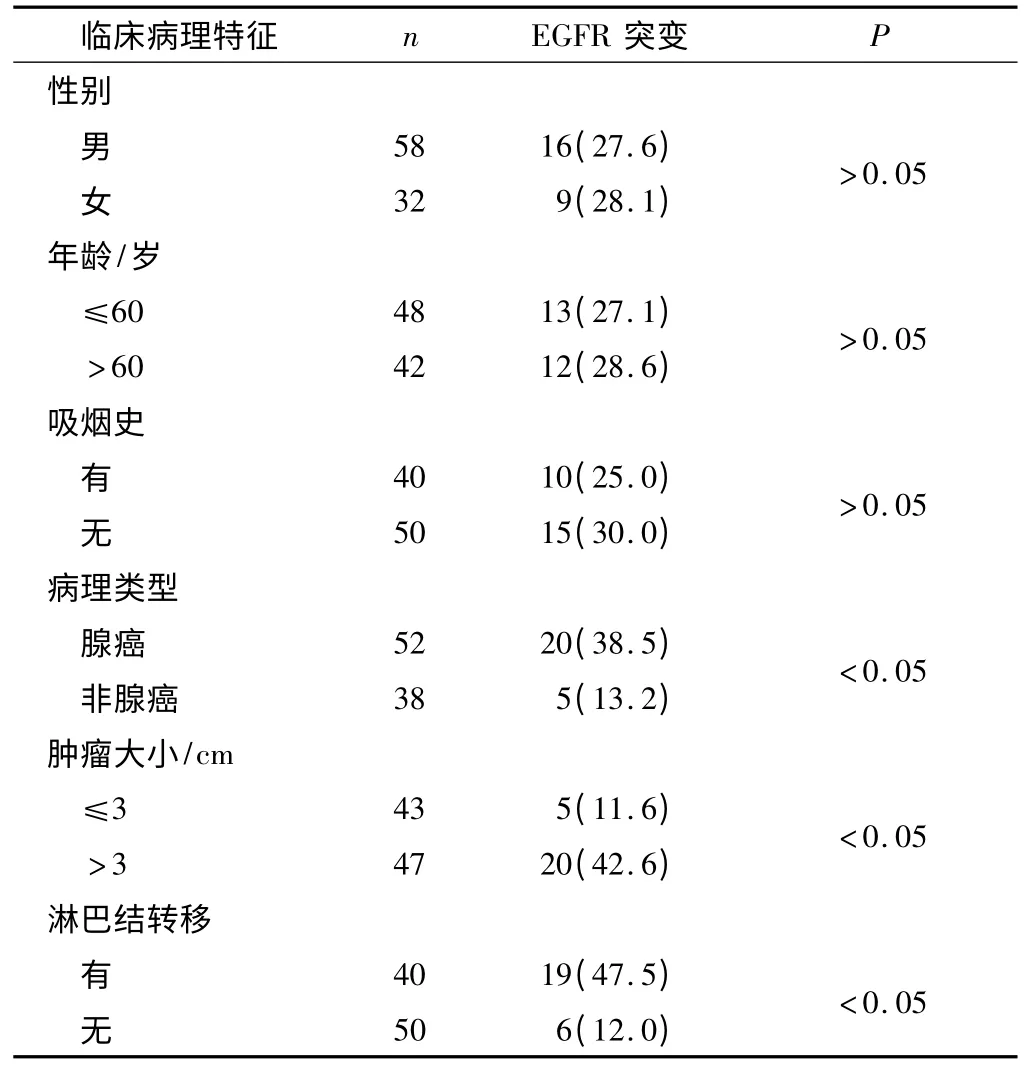
表2 血漿EGFR 突變表達與非小細胞肺癌臨床病理特征的關系 n(%)
2.3 生存情況 全組90 例非小細胞肺癌患者均獲全程隨訪,隨訪時間6 ~24 個月,中位隨訪期12.5 個月。隨訪截止時間為2015年1月。隨訪期內,全組生存21 例,死亡69 例,均死于腫瘤進展。中位無疾病進展時間為5.2(0 ~13)個月,中位生存時間11(3 ~24)個月。
按血漿EGFR 突變表達情況分為2 組,突變組的中位無疾病進展時間4.3(0 ~10)個月,無突變組6.2(0 ~13)個月。無突變組中位無疾病進展時間高于突變組,但比較差異無統計學意義(P >0.05)。
突變組的中位生存時間為10.2 個月,無突變組為11.5 個月。經log rank 檢驗分析發現,突變組與無突變組的總生存時間差異無統計學意義(P >0.05)。
3 討論
EGFR 靶向治療的出現為非小細胞肺癌患者帶來了一線希望,以吉非替尼、厄洛替尼為代表的EGFR 酪氨酸激酶抑制劑對部分非小細胞肺癌患者有著快速、顯著的療效,這些患者的無疾病進展生存時間和總生存時間得到顯著延長[3]。EGFR 是一種蛋白酪氨酸激酶受體,人類的EGFR 基因位于7 號染色體的p13 ~q22 區,全長200 kb,包括28 個外顯子,其中外顯子19的缺失突變與外顯子21 的點突變占所有EGFR 突變的85% ~90%[4]。
進展期肺癌患者一般通過支氣管鏡下活檢、CT 定位下肺穿刺、胸腔鏡下活檢獲取組織標本進行病理診斷,但是這些操作創傷大且獲取的腫瘤組織標本量少,很難有足夠量的腫瘤組織標本進行EGFR 基因突變的檢測。而實體腫瘤(包括肺癌)患者的血液循環中存在游離的腫瘤DNA,其來源主要是腫瘤組織中腫瘤細胞凋亡后,腫瘤細胞內的DNA 釋放入人體外周血,經腫瘤組織來源的循環DNA 中基因變異與循環血中DNA 相一致,且腫瘤患者外周血游離DNA 含量比正常健康人增高10 倍[5],其遺傳特性與腫瘤基因組DNA 相同,可以作為組織檢測EGFR 突變困難的晚期肺癌患者的補充標本采用。
董強剛等[6]曾對國內文獻進行了綜合分析,揭示我國非小細胞肺癌中EGFR 基因突變的發生率為34.0%(134/394)。而近年來大量研究[7]亦證明了可以從肺癌患者的外周血中檢測到EGFR 突變,且與腫瘤組織的突變情況基本一致。本研究的90 例晚期非小細胞肺癌患者中,腫瘤組織EGFR 突變患者為29例,約占全部患者的32. 2%,與文獻報道基本相符。本研究從患者的外周血中檢測到的EGFR 突變亦與腫瘤組織的突變情況基本一致。
目前我國臨床醫生選擇應用EGFR 酪氨酸激酶抑制劑一般遵循腺癌、非吸煙、女性等臨床指征,然而實踐證明單憑臨床特點進行篩選還是存在一定的盲目性。郭琛等[8]認為腫瘤組織和外周血中EGFR 突變表達與淋巴結轉移有關,但與性別、年齡、腫瘤大小、分化程度、病理類型無關。而孫曉軍等[9]則認為血漿EGFR 突變多發生于肺腺癌患者中。本研究采用熒光定量PCR 法分析了90 例非小細胞肺癌患者血漿EGFR,發現EGFR 突變表達與病理類型、腫瘤大小、淋巴結轉移有關,結果與之前的報道類似。外周血EGFR 是肺癌患者腫瘤組織中腫瘤細胞凋亡后,腫瘤細胞內的DNA 釋放入人體外周血,而腫瘤負荷大的患者更容易釋放出游離腫瘤DNA。
在本研究中,我們并沒有發現血漿EGFR 突變與無疾病進展時間、生存時間的長短相關,這個結論跟Ciledag 等[10]的結果是一致的。而王勇等[11]分析了術前外周血EGFR 與生存情況的關系,發現術前EGFR 高表達組的生存時間較低表達組顯著縮短。
綜上所述,本研究通過對90 例非小細胞肺癌患者血漿EGFR 和腫瘤組織EGFR 突變表達情況的檢測,發現兩者之間有較好的一致性。并且血漿EGFR 突變表達與病理類型、腫瘤大小、淋巴結轉移有關。但本研究的結果不支持以血漿EGFR 突變表達作為非小細胞肺癌患者獨立的預后指標。因此仍需加大樣本量進一步的研究。
[1]陳萬青,張思維,鄒小農,等. 中國肺癌發病死亡的估計和流行趨勢研究[J].中國肺癌雜志,2010 ,13 (5):283-285.
[2]Pakkala S,Ramalingam SS. Combined inhibition of vascular endothelial growth factor and epidermal growth factor signaling in nonsmall-cell lung cancer therapy[J]. Clin Lung Cancer,2009,10 Suppl 1:S17-S23.
[3]Fukuoka M,Wu YL,Thongprasert S,et al. Biomarker analyses and final overall survival results from a phase Ⅲ,randomized,open-label,first-line study of gefitinib versus carboplatin / paclitaxel in clini-cally selected patients with advanced non-small-cell lung cancer in A-sia (IPASS)[J]. J Clin Oncol,2011,29(21):2866-2874.
[4]Tanaka T,Matsuoka M,Sutani A,et al. Frequency of and variables associated with the EGFR mutation and its subtypes[J]. Int J Cancer,2010,126(3):651-655.
[5]BREMNES RM,SIRERA R,CAMPS C. Circulating tumor derived DNA andRNA markers in blood:a tool for early detection,diagnostics,and follow up[J].Lung Cancer,2005,49(1):1-12.
[6]董強剛,黃進肅,黃建,等. 肺癌靶向治療研究進展和我國肺癌的EGFR 基因突變概況[J].腫瘤,2005,25 (6):625-634.
[7]Jiang B,Liu F,Yang L,et al. Serum detection of epidermal growth factor receptor gene mutations using metant-enriched sequencing in Chinese patients with advanced non-small cell lung cancer[J]. J Int Med Res,2011,39(4):1392-1401.
[8]郭琛,郭其森,曾洪生,等. 非小細胞肺癌患者腫瘤組織與外周血中EGFR 表達相關性研究[J].中國肺癌雜志,2010,13(12):1107-1112.
[9]孫曉軍,李杰.非小細胞肺癌患者血漿表皮生長因子受體基因突變檢測及其臨床意義[J].中華臨床醫師雜志:電子版,2013,7(7 ):2833-2837.
[10]Ciledag A,Kaya A,Yetkin O,et al. The prognostic value of serum epidermal growth factor receptor level in patients with non-small cell lung cancer[J].Tuberk Toraks,2008,56(4):390-395.
[11]王勇,李俊杰,王小平.非小細胞肺癌患者手術前后血清EGFR水平變化在預后判斷中的應用價值[J]. 解放軍醫藥雜志,2014,26(4):55-67.

